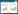文章信息
- 孟艳举, 王路, 王献清, 等.
- MENG Yanju, WANG Lu, WANG Xianqing, et al.
- 基于Raf-MEK-ERK信号通路探究梓醇对蛛网膜下腔出血大鼠脑组织损伤的影响
- Study on the impact of catalpol on brain tissue damage in rats with subarachnoid hemorrhage based on Raf-MEK-ERK signal pathway
- 天津中医药, 2023, 40(8): 1059-1064
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(8): 1059-1064
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.08.19
-
文章历史
- 收稿日期: 2023-04-17
2. 濮阳市人民医院麻醉科, 濮阳 457005
蛛网膜下腔出血(SAH)是一种破坏性的脑卒中,病死率和致残率较高,并伴有脑组织损伤和神经功能障碍,SAH后发生的早期脑损伤(EBI)被认为是导致SAH患者预后不良的关键因素[1]。在EBI的各种病理过程中,自噬、细胞凋亡、神经元直接死亡和坏死性凋亡是主要参与过程,其中自噬作为维持细胞和组织稳态的一个重要分解代谢过程,是缺血性细胞损伤中防止细胞凋亡的重要保护机制[2]。已有研究证明,SAH后激活自噬可抑制EBI中的神经元凋亡,具有神经保护作用[3]。梓醇具有抗炎、抗肿瘤、抗氧化和抗细胞凋亡等多种药理作用,在神经系统疾病方面具有较好的治疗作用[4]。研究发现,梓醇对创伤性脑损伤后大鼠的氧化应激和神经炎症具有改善作用[5],且梓醇可以改善炎症并促进自噬[6],但梓醇对SAH脑组织损伤的改善作用与自噬是否有关尚不完全明确。丝裂原活化激酶(MAPK)通过调节丝/苏氨酸蛋白激酶(Raf)-丝裂原活化蛋白激酶(MEK)-细胞外调节蛋白激酶(ERK)级联信号通路,激活ERK磷酸化,在细胞增殖、凋亡和自噬中起关键作用[7]。由于自噬受Ras/Raf/MEK/ERK信号通路调节,且Raf-MEK-ERK信号通路参与创伤性脑损伤后海马神经发生[8-9],由此推测Ras/Raf/MEK/ERK信号通路可能通过调节自噬改善SAH后脑组织损伤。而梓醇对SAH大鼠脑组织损伤的影响与Raf-MEK-ERK信号通路是否有关尚未有相关报道,研究通过建立SAH大鼠模型,对其进行探讨。
1 材料与方法 1.1 实验动物SPF级SD雄性大鼠60只,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2022-0004,饲养环境温度22 ℃左右,湿度55 %,12 h光暗循环,不禁水食。
1.2 主要试剂与仪器梓醇(纯度≥98%,成都瑞芬思生物科技有限公司);二抗辣根酶标记山羊抗兔IgG、伊文思蓝(EB,北京索莱宝公司);原位末端标(TUNEL)试剂盒、U0126(美国Sigma公司);苏木素-伊红(HE)染色液、Triton X-100(上海源叶生物公司);牛血清白蛋白(BSA)、DAPI(上海爱必信生物公司);一抗Raf、MEK、磷酸化MEK(p-MEK)、ERK1/2、p-ERK1/2、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、自噬基因Beclin-1、微管连接蛋白轻链3-Ⅱ(LC3-Ⅱ)和β-actin抗体(美国赛默飞公司)。光学显微镜,德国徕卡公司;分光光度计,奥地利TECAN公司。
1.3 模型分组、制备和给药将大鼠随机分为假手术组、SAH组、梓醇组、梓醇+U0126组(梓醇+Raf-MEK-ERK信号通路抑制剂U0126),每组15只。采用血管内穿孔法[10]构建大鼠SAH模型:麻醉大鼠,从颈外动脉残端将锋利的4-0单丝尼龙缝合线插入右内动脉,刺穿大脑前、中动脉分叉。造模大鼠出现呼吸急促、心率加快等症状,且剥离脑组织可见血性液体散在分布在脑底基底池部位,即为造模成功。假手术组与SAH大鼠接受相同的手术,但未对血管进行穿孔。造模术后1 h,对各组大鼠进行干预,梓醇组大鼠静脉注射10 mg/kg的梓醇[5],梓醇+U0126组在梓醇组的基础上注射0.05 mg/kg U0126[11],假手术组和SAH组注射相同剂量的生理盐水。每天1次,直至实验结束。
1.4 检测指标 1.4.1 神经功能评估造模后24 h采用改良Garcia法对大鼠进行神经学评分,评估自发活动、四肢运动的对称性、攀爬能力、触觉反应、前爪伸展和身体本体感觉,评分范围3~18分,评分越高神经功能越好。
1.4.2 SAH分级将大鼠脑基底池分为6部分,其中每部分分级标准如下:0级:无SAH;1级:少量SAH;2级:中度血凝,可见动脉;3级:血凝块阻塞节段内的所有动脉。等级范围从0~18。SAH分级评分小于7分的大鼠,没有明显的脑损伤。
1.4.3 脑组织含水量测定SAH后48 h麻醉处死大鼠,每组取5只大鼠采用标准干湿法测定脑含水量,取出造模侧大脑称质量以获得湿质量。然后将脑组织在100 ℃干燥24 h以获得干质量。脑水含量根据公式计算:(湿质量-干质量)/湿质量×100%。
1.4.4 血脑屏障通透性检测麻醉大鼠,处死前1 h每组取5只尾静脉注射2% EB溶液,体内循环1 h后开胸,心脏灌注生理盐水,分离取脑并称质量,脑组织以10 mL/kg的比例浸入甲酰胺溶液中后匀浆,60 ℃孵育24 h,用分光光度计在620 nm处测量渗出的EB染料。
1.4.5 HE染色观察脑组织病理变化取大鼠脑组织CA1区,每组5只,部分固定于4%多聚甲醛中(剩余冻存至-80 ℃),石蜡包埋,切片(5 μm)后用HE染色,在光学显微镜下观察。
1.4.6 免疫荧光染色取上述部分脑组织CA1区切片,用Triton X-100处理后BSA封闭,将样品与TUNEL试剂盒、一抗p-ERK1/2、LC3-Ⅱ(1∶1 000)在4 ℃孵育过夜,洗涤后与荧光二抗在37 ℃下孵育1 h。并用DAPI进行核染,在显微镜下观察拍照,使用Imagepro Plus 6.0分析结果,并计算平均光密度(AOD)值。
1.4.7 蛋白免疫印迹(Western blot)检测蛋白表达取上述冻存至-80 ℃的CA1区脑组织,裂解后提取总蛋白,定量后按步骤将蛋白SDS-PAGE电泳、转膜,5 %脱脂奶粉封闭2 h,在4 ℃下加入一抗Raf、MEK、p-MEK、ERK1/2、p-ERK1/2、Bcl-2、Bax、Beclin-1、LC3-Ⅱ(1∶1 000)和内参β-actin过夜孵育,清洗,在4 ℃下加入二抗山羊抗兔IgG(1∶2 000),孵育2 h。用ECL发光显影,观察拍照,各条带灰度值用Image J软件处理分析。
1.5 统计学方法采用SPSS 26.0软件进行统计分析,数据采用均数±标准差(x±s),多组间比较用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
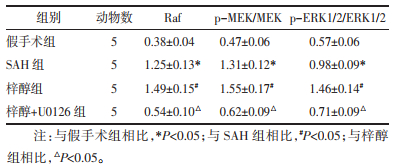
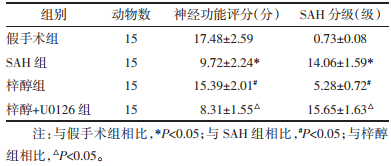
2 结果 2.1 大鼠神经功能评分和SAH分级比较与假手术组相比,SAH组大鼠神经功能评分减少,SAH分级显著增加(P<0.05);与SAH组相比,梓醇组大鼠神经功能评分增加,SAH分级显著减少(P<0.05);与梓醇组相比,梓醇+U0126组大鼠神经功能评分减少,SAH分级显著下降增加(P<0.05)。见表 1。
|
与假手术组相比,SAH组大鼠脑组织含水量、EB渗出量显著增加(P<0.05);与SAH组相比,梓醇组大鼠脑组织含水量、EB渗出量显著减少(P<0.05);与梓醇组相比,梓醇+U0126组大鼠脑组织含水量、EB渗出量显著增加(P<0.05)。见表 2。
|
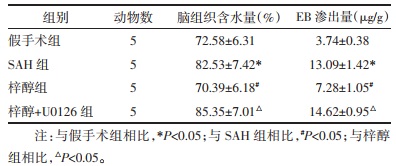
假手术组海马CA1区神经元细胞形态正常,排列整齐,未观察到明显变性或坏死;SAH组神经元细胞排列相对松散,许多核固缩和核仁消失体积较小,染色较深,细胞数目减少;梓醇组神经元损伤明显减轻,结构相对整齐,细胞死亡较少;梓醇+U0126组相比于梓醇组神经元损伤加重。见图 1。
|
| 注:A.假手术组;B.SAH组;C.梓醇组;D.梓醇+U0126组。 图 1 大鼠海马CA1区HE染色图(×400) Fig. 1 HE staining of rat hippocampal CA1 region (×400) |
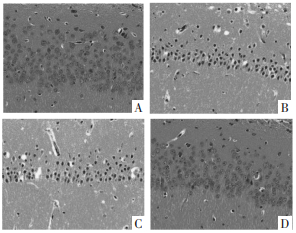
与假手术组相比,SAH组TUNEL阳性细胞数目增加,凋亡率升高(P<0.05);与SAH组相比,梓醇组TUNEL阳性细胞数目减少,凋亡率降低(P<0.05);与梓醇组相比,梓醇+U0126组TUNEL阳性细胞数目增加,凋亡率升高(P<0.05)。见图 2和表 3。
|
| 注:A.假手术组;B.SAH组;C.梓醇组;D.梓醇+U0126组 图 2 大鼠神经细胞凋亡情况(×400) Fig. 2 Neuronal apoptosis in rats (×400) |
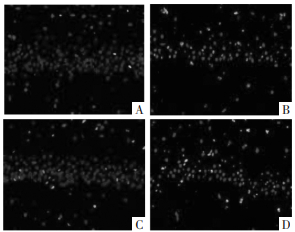
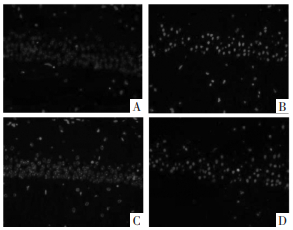
与假手术组相比,SAH组的LC3-Ⅱ、p-ERK神经元阳性表达显著增强;与SAH组相比,梓醇组LC3-Ⅱ、p-ERK神经元阳性表达进一步增强;与梓醇组相比,梓醇+U0126组LC3-Ⅱ、p-ERK神经元阳性表达减弱(P < 0.05)。见图 3、图 4和表 4。
|
| 注:A.假手术组;B.SAH组;C.梓醇组;D.梓醇+U0126组 图 3 大鼠脑组织CA1区LC3-Ⅱ表达(×400) Fig. 3 Expression of LC3-Ⅱ in CA1 region of rat brain tissue (×400) |
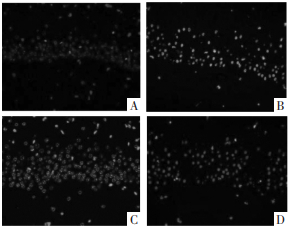
|
| 注:A.假手术组;B.SAH组;C.梓醇组;D.梓醇+U0126组 图 4 大鼠脑组织CA1区p-ERK表达(×400) Fig. 4 Expression of p-ERK in CA1 region of rat brain (×400) |
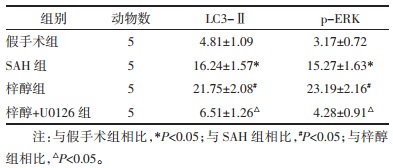
|
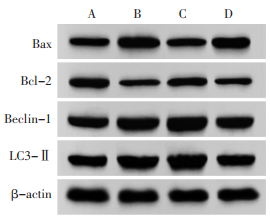
与假手术组相比,SAH组Bax、Beclin-1、LC3-Ⅱ蛋白表达升高,Bcl-2表达降低(P<0.05);与SAH组相比,梓醇组Bax蛋白表达降低,Bcl-2、Beclin-1、LC3-Ⅱ表达升高(P<0.05);与梓醇组相比,梓醇+U0126组Bax蛋白表达升高,Bcl-2、Beclin-1、LC3-Ⅱ表达降低(P<0.05)。见图 5和表 5。
|
| 注:A.假手术组;B.SAH组;C.梓醇组;D.梓醇+U0126组。 图 5 大鼠自噬和凋亡蛋白表达变化 Fig. 5 Changes of autophagy and apoptosis protein expression in rats |
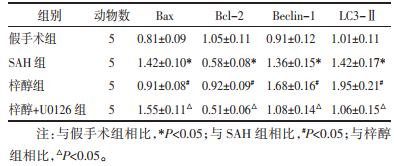
|
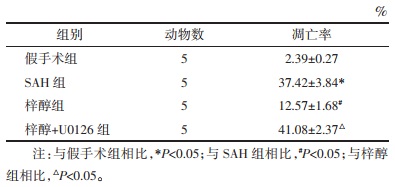
与假手术组相比,SAH组Raf、p-MEK/MEK、p-ERK1/2/ERK1/2蛋白表达升高(P<0.05);与SAH组相比,梓醇组Raf、p-MEK/MEK、p-ERK1/2/ERK1/2蛋白表达进一步升高(P<0.05);与梓醇组相比,梓醇+U0126组Raf、p-MEK/MEK、p-ERK1/2/ERK1/2蛋白表达降低(P<0.05)。见图 6和表 6。
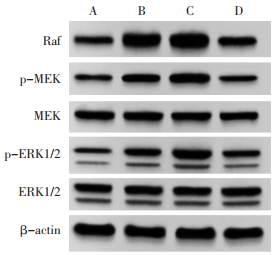
|
| 注:A.假手术组;B.SAH组;C.梓醇组;D.梓醇+U0126组 图 6 大鼠Raf-MEK-ERK通路蛋白表达变化 Fig. 6 Changes of Raf-MEK-ERK pathway protein expression in rats |
EBI是SAH患者急性脑损伤和神经功能障碍的最重要原因[12]。神经元死亡被认为是EBI的主要原因,可引发细胞毒性水肿和血脑屏障破坏。因此,减少神经元死亡的数量可改善SAH患者预后。研究发现,SAH大鼠神经元细胞数目减少,神经功能评分下降,SAH分级、脑组织含水量、血脑屏障通透性升高,表明SAH后发生脑水肿,出现神经功能障碍和脑损伤。梓醇具有神经保护作用,能有效改善急性脑缺血大鼠神经功能障碍和脑水肿,减少脑细胞凋亡[13]。研究SAH大鼠经梓醇干预后,神经元细胞数目增加,神经功能评分升高,SAH分级、脑组织含水量、血脑屏障通透性下降,表明梓醇能改善SAH后脑水肿,改善神经功能障碍和脑损伤。
神经元凋亡是SAH后血肿的机械压迫,血红蛋白的毒性损伤和氧化应激导致的,可引发EBI各种过程,是SAH患者预后不良的关键因素。研究表明,抑制细胞凋亡,可改善SAH后的EBI[14]。研究发现,SAH大鼠神经元细胞凋亡增加,促凋亡蛋白Bax表达增加,抗凋亡蛋白Bcl-2表达降低,而梓醇干预后神经元细胞凋亡减少,表明梓醇能减少SAH大鼠神经元凋亡。自噬是一种高度调控的细胞内成分的降解方式,在多种中枢神经系统疾病中发挥重要作用,在SAH中发现自噬激活可以减少神经元凋亡,而抑制自噬会加重神经元凋亡[15]。研究发现,SAH大鼠自噬标志物Beclin-1、LC3-Ⅱ表达增加,而梓醇干预后Beclin-1、LC3-Ⅱ表达进一步增加。且有研究发现梓醇可通过增强自噬来改善糖尿病肾病足细胞损伤[16],表明梓醇可能通过促进SAH大鼠自噬,减少神经元凋亡。
MAPK是一类广泛存在于哺乳动物细胞中的激酶参与细胞生长、发育、分化、凋亡和细胞间功能同步等多种过程[17]。Raf/MEK/ERK信号通路通过磷酸化上游Raf分子激活下游分子ERK,将信号从膜传递到细胞内参与调节生理和病理过程中的细胞分裂、增殖、自噬和凋亡等[7]。ERK在SAH引发的脑损伤中发挥重要作用,通过激活MEK/ERK通路并上调其蛋白表达增强突触可塑性,改善SAH后脑损伤[18]。Raf/MEK/ERK通路在细胞凋亡和自噬中都起关键作用,Li等[19]发现通过激活Raf/MEK/ERK介导的细胞自噬可减轻脂多糖引起的鼠肾足细胞凋亡。此外,Sun等[20]发现骨桥蛋白通过黏着斑激酶(FAK)-ERK途径增强自噬改善大鼠SAH后的EBI。研究中SAH组Raf、p-MEK/MEK、p-ERK1/2/ERK1/2表达升高,Raf/MEK/ERK通路激活,梓醇进一步促进Raf/MEK/ERK通路的激活,与自噬蛋白表达趋势一致。且ERK抑制剂U0126逆转了梓醇对SAH大鼠脑损伤的改善作用,表明梓醇可能是通过激活Raf/MEK/ERK信号通路发挥对SAH后脑损伤的改善作用。
综上所述,梓醇能改善大鼠SAH后脑损伤,减少细胞凋亡和神经功能障碍,其作用机制可能与激活Raf/MEK/ERK信号通路而增强自噬有关。该研究为改善SAH后脑损伤提供了新思路,但梓醇对大鼠SAH后脑损伤的其他分子机制仍有待阐明。
| [1] |
CHOU S H. Subarachnoid Hemorrhage[J]. Continuum (Minneap Minn), 2021, 27(5): 1201-1245. |
| [2] |
ZHENG B, ZHOU X W, PANG L J, et al. Baicalin suppresses autophagy-dependent ferroptosis in early brain injury after subarachnoid hemorrhage[J]. Bioengineered, 2021, 12(1): 7794-7804. DOI:10.1080/21655979.2021.1975999 |
| [3] |
SUN C M, ENKHJARGAL B, REIS C, et al. Osteopontin attenuates early brain injury through regulating autophagy-apoptosis interaction after subarachnoid hemorrhage in rats[J]. CNS Neuroscience & Therapeutics, 2019, 25(10): 1162-1172. |
| [4] |
WANG J H, ZHANG Y H, ZHANG M F, et al. Feasibility of catalpol intranasal administration and its protective effect on acute cerebral ischemia in rats via anti-oxidative and anti-apoptotic mechanisms[J]. Drug Design, Development and Therapy, 2022, 16(2): 279-296. |
| [5] |
NI H B, RUI Q, KAN X G, et al. Catalpol ameliorates oxidative stress and neuroinflammation after traumatic brain injury in rats[J]. Neurochemical Research, 2023, 48(2): 681-695. DOI:10.1007/s11064-022-03796-6 |
| [6] |
LIU Z G, ZHU P T, ZHANG L, et al. Autophagy inhibition attenuates the induction of anti-inflammatory effect of catalpol in liver fibrosis[J]. Biomedicine & Pharmacotherapy, 2018, 103(21): 1262-1271. |
| [7] |
WU P K, BECKER A, PARK J I. Growth inhibitory signaling of the raf/MEK/ERK pathway[J]. International Journal of Molecular Sciences, 2020, 21(15): 5436. DOI:10.3390/ijms21155436 |
| [8] |
HE K S, SUN H L, ZHANG J J, et al. Rab7-mediated autophagy regulates phenotypic transformation and behavior of smooth muscle cells via the Ras/Raf/MEK/ERK signaling pathway in human aortic dissection[J]. Molecular Medicine Reports, 2019, 19(4): 3105-3113. |
| [9] |
LU K T, SUN C L, WO P Y Y, et al. Hippocampal neurogenesis after traumatic brain injury is mediated by vascular endothelial growth factor receptor-2 and the Raf/MEK/ERK cascade[J]. Journal of Neurotrauma, 2011, 28(3): 441-450. DOI:10.1089/neu.2010.1473 |
| [10] |
韩雨薇, 王晨辰, 李晓明. 烟酰胺在大鼠蛛网膜下腔出血后早期脑损伤中作用的研究[J]. 中华神经外科杂志, 2022, 38(5): 500-505. HAN Y W, WANG C C, LI X M. The role of nicotinamide in early brain injury after subarachnoid hemorrhage in rats[J]. Chinese Journal of Neurosurgery, 2022, 38(5): 500-505. |
| [11] |
LIU J J, LIANG W J, WANG J Y, et al. Moderate hypothermia protects increased neuronal autophagy via activation of extracellular signal-regulated kinase signaling pathway in a rat model of early brain injury in subarachnoid hemorrhage[J]. Biochemical and Biophysical Research Communications, 2018, 502(3): 338-344. DOI:10.1016/j.bbrc.2018.05.158 |
| [12] |
LAUZIER D C, JAYARAMAN K, YUAN J Y, et al. Early brain injury after subarachnoid hemorrhage: incidence and mechanisms[J]. Stroke, 2023, 54(5): 1426-1440. DOI:10.1161/STROKEAHA.122.040072 |
| [13] |
WANG H J, XU X G, YIN Y, et al. Catalpol protects vascular structure and promotes angiogenesis in cerebral ischemic rats by targeting HIF-1α/VEGF[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2020, 78(13): 153300. |
| [14] |
LIU M, ZHONG W Y, LI C, et al. Fluoxetine attenuates apoptosis in early brain injury after subarachnoid hemorrhage through Notch1/ASK1/p38 MAPK signaling pathway[J]. Bioengineered, 2022, 13(4): 8396-8411. |
| [15] |
ZENG H H, CHEN H J, LI M, et al. Autophagy protein NRBF2 attenuates endoplasmic reticulum stress-associated neuroinflammation and oxidative stress via promoting autophagosome maturation by interacting with Rab7 after SAH[J]. Journal of Neuroinflammation, 2021, 18(1): 210. DOI:10.1186/s12974-021-02270-4 |
| [16] |
CHEN Y, LIU Q P, SHAN Z F, et al. Catalpol ameliorates podocyte injury by stabilizing cytoskeleton and enhancing autophagy in diabetic nephropathy[J]. Frontiers in Pharmacology, 2019, 10(1): 1477. |
| [17] |
HEPWORTH E M W, HINTON S D. Pseudophosphatases as regulators of MAPK signaling[J]. International Journal of Molecular Sciences, 2021, 22(22): 12595. DOI:10.3390/ijms222212595 |
| [18] |
WANG Y, XU J G, YOU W C, et al. Roles of Rufy3 in experimental subarachnoid hemorrhage-induced early brain injury via accelerating neuronal axon repair and synaptic plasticity[J]. Molecular Brain, 2022, 15(1): 35. DOI:10.1186/s13041-022-00919-6 |
| [19] |
LI X, MA A J, LIU K. Geniposide alleviates lipopolysaccharide-caused apoptosis of murine kidney podocytes by activating Ras/Raf/MEK/ERK-mediated cell autophagy[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1): 1524-1532. DOI:10.1080/21691401.2019.1601630 |
| [20] |
SUN C M, ENKHJARGAL B, REIS C, et al. Osteopontin-enhanced autophagy attenuates early brain injury via FAK-ERK pathway and improves long-term outcome after subarachnoid hemorrhage in rats[J]. Cells, 2019, 8(9): 980. DOI:10.3390/cells8090980 |
2. Department of Anesthesiology, Puyang People's Hospital, Puyang 457005, China
 2023, Vol. 40
2023, Vol. 40