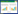文章信息
- 李思雨, 郝阳, 刘纳文.
- LI Siyu, HAO Yang, LIU Nawen.
- 基于少阴枢机理论组方对膜性肾病小鼠肾组织HO-1蛋白表达的影响
- Effect of prescription based on shaoyin pivot theory on HO-1 protein expression in renal tissue of mice with membranous nephropathy
- 天津中医药, 2023, 40(9): 1168-1174
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(9): 1168-1174
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.09.14
-
文章历史
- 收稿日期: 2023-06-16
2. 天津市第一中心医院中医科, 天津 300192
膜性肾病(MN)的病理组织学特征是肾小球基底膜上皮细胞下的免疫复合物沉积伴基底膜弥漫增厚,是成人肾病综合征(NS)中常见病理类型之一[1]。随着病程的进展,最终发展成终末期肾病(ESRD)。这也是肾移植术后常复发的主要肾小球疾病之一,约占患者病例的40%[2]。研究表明,氧化应激参与MN形成,免疫复合物引起补体的异常激活,形成补体膜攻击复合物(C5b-9),亚溶解量的C5b-9刺激足细胞产生炎症因子、活性氧(ROS)及蛋白分子,从而导致肾小球过滤屏障损伤出现蛋白尿[3-4]。ROS可能通过启动脂质过氧化和肾小球基底膜(GBM)胶原Ⅳ型蛋白降解诱发肾组织损伤[5]。研究发现,Nrf2作为氧化应激重要信号通路影响着肾病的疾病进程[6-8],血红素氧合酶(HO-1)作为该通路的下游因子,在抑制细胞炎症与抗氧化应激中发挥重要作用。HO-1通过催化血红素,分解产生胆绿素[9]。胆绿素通过还原酶作用下转换为胆红素,胆绿素与胆红素均有较强抗氧化作用,胆红素还可以调节机体免疫,调控脂质代谢[10]。
随着MN发病率及其并发症病死率的逐年升高,对于社会和国家造成的公共负担日益加重,探索新的治疗靶点及治疗方式有着重大意义。目前,西医治疗上主要采用糖皮质激素或联合免疫抑制剂,具有不良反应明显、治疗效果不稳定、患者依从性差等局限性。近年来研究发现中医在治疗MN上取得了良好成效,具有治疗效果明显、疗效稳定、不良反应小等优势特点。课题组通过前期临床工作实践及相关参考文献,提出从少阴枢机论治MN的学术观点,临床上常选用麻黄附子细辛汤合防己黄芪汤加减进行治疗并取得了良好的疗效[11]。本研究探索基于少阴枢机理论组方麻黄附子细辛汤合防己黄芪汤对MN小鼠的肾保护作用以及对HO-1蛋白表达水平的影响。
1 实验材料 1.1 实验动物50只BALB/c小鼠,6~8周,健康雄性,SPF级,体质量(20±25)g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008。
1.2 实验药品中药:麻黄附子细辛汤合防己黄芪汤由防己10 g,黄芪20 g,白术10 g,麻黄10 g,制附子10 g(先煎),细辛3 g,炙甘草3 g组成,天津市第一中心医院中医科统一制备。西药:环磷酰胺片,规格:50 mg/片,通化茂祥制药有限公司生产,批准文号:国药准字H22022673。
1.3 主要实验试剂阳离子化牛血清白蛋白(C-BSA,美国Chondrex公司,货号:9058);弗氏完全佐剂(美国Sigma公司,货号:F5581);丙二醛(MDA)测定试剂盒(南京建成生物工程研究所,货号:A003-1);HO-1抗体(Proteintech,货号:66743-1-lg);Mouse Anti-β-tubulin(中杉金桥,货号TA-10);Goat Anti-Mouse IgG(二抗,中杉金桥,货号:ZB-2305);BCA定量试剂盒(Biosharp,货号:BL521A);Goat anti-Mouse IgG-FITC(Absin,货号:abs20012);含DAPI抗荧光衰减封片剂(上海Beyotime,货号:P0131);苏木素染色液、伊红染色液(中杉金桥,货号:ZLI-9613、ZLI-9610);中性树胶(北京索莱宝科技有限公司,货号:G8590);基底膜六胺银染色试剂盒(北京索莱宝科技有限公司,货号:G1790);OCT包埋剂(日本Sakura)。
1.4 主要实验仪器全自动化学/荧光/凝胶成像分析系统(北京赛智);低温高速离心机(北京北利);高速低温组织研磨仪(武汉塞维尔生物科技有限公司);正置光学显微镜(OLYMPUS CKX43-LP);正置荧光显微镜(Nikon);载玻片及盖玻片(江苏世泰实验器材有限公司);病理脱水机、切片机(上海徕卡显微系统有限公司);冻台(金华市华速科技有限公司);电泳仪、电泳槽、转膜槽(北京六一生物科技有限公司)。
2 实验方法 2.1 造模与分组参照文献方法[12]制备MN小鼠模型,50只,BALB/c雄性小鼠,适应性喂养2周后,随机分为正常组10只,其余40只进行造模。预免疫,将C-BSA,规格:2 mg/mL,10 mL磷酸盐缓冲溶液(PBS)与等体积的弗氏完全佐剂混匀,制备成乳白色悬浊液,在每只小鼠尾根部、腹股沟多点皮下注射乳浊液0.2 mL。正常组小鼠给予等体积弗氏完全佐剂注射。2周后,正式免疫,造模组每只小鼠第1次尾静脉注射0.1 mg(C-BSA:0.1 mg/mL,体积1 mL),隔日注射,注射剂量增加至0.4 mg(C-BSA:0.4 mg/mL,体积1 mL),连续4周。正常组注射等体积的生理盐水。造模结束后,3只造模小鼠死亡。随机抽取2只造模小鼠予肾小球免疫荧光IgG检测,验证MN小鼠模型是否成功,结果显示,均出现IgG沿肾小球毛细血管壁呈绿色颗粒样沉积,证明造模成功。将剩余的造模小鼠按照随机数字表法分为4组,模型组8只、中药组9只、西药组9只、中药加西药组9只。
2.2 给药方法根据小鼠灌胃容积为10 mL/kg,正常组与模型组分别给予蒸馏水10 mL/(kg·d),每日1次,连续6周。中药组给予中药汤剂9.83 g/(kg·d)(成人每日所需生药总计量为65 g,按照成人60 kg体质量计算,约1.08 g生药/kg,小鼠等效用量大约为成人用量的9.1倍,得出小鼠的等效用量为9.83 g生药/kg)。将药物配制为0.983 g/mL的浓度,无菌瓶密封。西药组:给予环磷酰胺片0.64 mg/(kg·d)(参照说明书用量方法,成人每日剂量4 mg,按上述方法折算小鼠用量)。将环磷酰胺片碾成细末溶于蒸馏水,按小鼠灌胃容积为10 mL/kg计算,制备成浓度为0.064 mg/mL的环磷酰胺混悬液备用,无菌瓶密封。连续灌胃2周后,停2周,再连续灌胃2周。中药加西药组:给予上述同等剂量的中药联合西药,给药时间同上。
2.3 标本采集给药6周后,麻醉小鼠,摘眼球取血,待静置30 min后离心取血清,分别装于微型离心管内,标号,置于-80 ℃冰箱保存。留待行血清总蛋白(TP)、三酰甘油(TG)、血肌酐(SCr)等生化指标检测。采血结束后剖腹,取下一侧肾脏组织,剥离包膜及非肾组织,生理盐水反复冲洗,切大米粒样肾皮质放入瓶内(为防止肾组织干燥,使用生理盐水浸湿的纱布将组织轻轻包裹住),即刻行直接免疫荧光检测,观察小鼠肾组织免疫球蛋白G(IgG)沉积情况。剩余肾脏组织放入10%中性福尔马林固定液中固定,行苏木素-伊红(HE)染色,过碘酸-六胺银(PASM)染色;取另一侧肾脏组织,放入冻存管中,置于-80 ℃冰箱保存,进行MDA含量及蛋白免疫印迹法(Western blot)检测。
2.4 检测方法 2.4.1 血清生化检测全自动生化分析仪测定小鼠血清TP、TG、SCr等水平。
2.4.2 小鼠肾脏组织的病理形态检测 2.4.2.1 HE染色、PASM染色小鼠肾脏组织经10%中性福尔马林固定后,不同浓度乙醇溶液进行梯度脱水,二甲苯透明,浸蜡,包埋,切片4 μm厚度,分别进行HE染色、PASM染色,在光镜下观察肾小球组织形态变化情况。
2.4.2.2 免疫荧光检测小鼠肾脏IgG沉积采取直接免疫荧光法检测肾小球IgG沉积,取新鲜肾皮质,用OCT包埋剂包埋,冷冻切片机切片,经冷丙酮固定10 min;PBS浸洗3次,每次5 min;滴加5%BSA封闭非特异性染色,室温1 h;滴加FITC-山羊抗小鼠IgG,置湿盒内孵育,4 ℃过夜。次日复温30 min,避光操作,PBS清洗3次,每次5 min;用含DAPI的封片剂封片;荧光显微镜观察,拍照记录。
2.4.3 检测小鼠肾组织丙二醛(MDA)含量根据MDA试剂盒说明,检测小鼠肾组织MDA含量。
2.4.4 Western blot检测小鼠肾组织HO-1蛋白表达水平取出小鼠肾组织,剪取50 mg,放入离心管中,加入500 μ RIPA裂解液,冰上操作,裂解20 min后,设置12 000 r/min,离心20 min,离心半径8 cm。BCA法检测组织上清液中蛋白浓度。加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液,混匀,进行95 ℃变性处理10 min,放置于2~8 ℃备用。制备10%分离胶,4%浓缩胶,上样,将蛋白maker及各组蛋白分别注入相应泳道,电泳,采用湿转膜,封闭,4 ℃孵育一抗(稀释比例为1∶1 000)过夜,1×TBST洗膜3次,每次10 min,滴加二抗(稀释比例为1∶5 000),室温、避光缓慢摇动作用1 h,1×TBST洗膜3次,每次10 min,使用特超敏ECL发光液,避光,显影,采集并保存图像。
2.5 统计学方法采用SPSS21.0软件对数据进行统计学分析,应用Graph Pad Prism9作图,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),TP、TG、SCr及MDA检测结果选用Scheffe检验,HO-1结果选用组间两两比较LSD检验,P<0.05表示差异有统计学意义。
3 实验结果 3.1 小鼠血清TP、TG、SCr水平与正常组比较,模型组及各给药组小鼠血清TP水平均显著降低,TG水平均显著升高(P<0.01);与模型组比较,TP水平均升高,TG水平均降低(P<0.01,P<0.05)。各给药组之间,中药组与西药组比较,TP、TG水平差异无统计学意义(P>0.05),与中药组及西药组比较,中药加西药组TP水平升高(P<0.01,P<0.05),TG水平降低(P<0.05)。与正常组比较,模型组小鼠血清SCr水平显著升高(P< 0.01);与模型组比较,中药组及西药组差异无统计学意义(P>0.05),中药加西药组SCr水平降低(P<0.05)。见表 1。
|
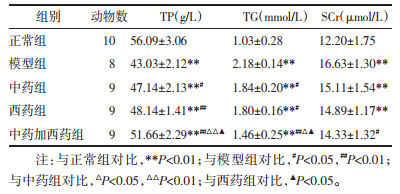
光镜下观察发现正常组小鼠肾小球体积正常,肾小球毛细血管基底膜及系膜区未见增厚,肾小球结构完整,肾小管及肾间质未见明显异常;HE染色显示模型组小鼠肾小球体积增大,细胞核增多,肾小球毛细血管腔狭窄,充血。PASM染色显示肾小球毛细血管基底膜增厚,系膜增厚。与模型组比较,各给药组治疗后上述情况均有改善。见图 1。
|
| 注:A.正常组B.模型组C.中药组D.西药组E.中药加西药组。 图 1 各组小鼠肾组织HE染色(正置光学显微镜,×400)和PASM染色(正置光学显微镜,×200) Fig. 1 Renal tissue of mice in each group stained with HE(orthomicroscope, ×400)and PASM(orthomicroscope, ×200) |
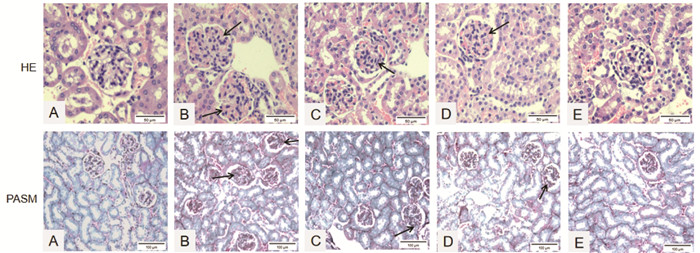
荧光显微镜下观察,IgG沿肾小球毛细血管壁呈绿色荧光沉积,正常组小鼠肾小球几乎未见绿色荧光沉积;模型组小鼠肾小球荧光表达较强;与模型组比较,各给药组治疗后,荧光强度呈不同程度减弱。中药组与西药组对比,荧光表达未见明显差异,中药加西药组荧光表达最弱。见图 2。
|
| 注:A.正常组B.模型组C.中药组D.西药组E.中药加西药组。 图 2 各组小鼠肾组织IgG沉积结果(正置荧光显微镜,×400) Fig. 2 Results of IgG deposition in renal tissue of mice in each group(positive fluorescence microscope, ×400) |
与正常组比较,模型组及各给药组小鼠肾组织MDA含量显著升高(P<0.01);与模型组比较,各给药组小鼠肾组织MDA含量均降低(P<0.01,P<0.05);各给药组之间,中药组与西药组比较,小鼠肾组织MDA含量差异不具有统计学意义(P>0.05),与中药组及西药组比较,中药加西药组小鼠肾组织MDA含量降低(P<0.05)。见表 2。
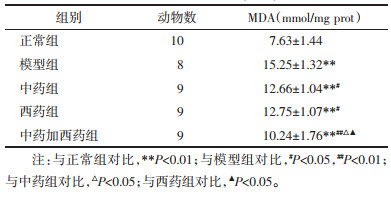
|
与正常组比较,模型组小鼠肾组织HO-1蛋白表达量有升高(P<0.05);与模型组比较,各给药组小鼠肾组织HO-1蛋白表达量均升高(P<0.05,P<0.01);各给药组之间,中药组与西药组比较,小鼠肾组织HO-1蛋白表达量差异无统计学意义(P>0.05),与中药组比较,中药加西药组小鼠肾组织中HO-1蛋白表达量升高(P<0.05)。见图 3。

|
|
注:与正常组对比,*P<0.05,**P<0.01;与模型组对比, #P<0.05, ##P<0.01;与中药组对比,△P<0.05。 图 3 各组小鼠肾组织HO-1蛋白表达条带图及柱状图(x±s) Fig. 3 Bands and bars of HO-1 protein expression in renal tissue of mice in each group(x±s) |
中医典籍中没有与“膜性肾病”相对应的名称,根据其临床表现及特点,多将其归属于中医学“水肿”“尿浊”“膏淋”“虚劳”等范畴。《素问·至真要大论》中“诸湿肿满,皆属于脾”,《灵枢·口问》中言“中气不足,溲便为之变”,《黄帝内经》认为水肿的病机与脾土相关,脾气运化无力,水湿停聚体内,则发为水肿,脾气虚,运化升清失司,且无力统摄,谷气下流,精微下注则发为尿浊。张从正《儒门事亲》中提到:“夫湿者,为太阴湿土之主也。”“肾以水为之主”,充分肯定了脾肾二脏在水肿病发病中的重要地位。《景岳全书·肿胀》指出:“凡水肿等证,乃肺脾肾三脏相干之病,盖水为至阴,故其本在肾;水化于气,故其标在肺;水唯畏土,故其制在脾。”认为水肿与肺脾肾三脏密切联系。肾为人体先天之本,主水,司开阖,与膀胱相表里,调控身体水液代谢,若肾阳不足,温煦气化功能降低,则致体内水液潴留。肺主宣发肃降,推动体内气机运行,水液代谢有赖于气的推动作用,肺气失司则水液停滞体内易发为水肿;肾水依靠脾土制约,若脾弱运化无力,则肾水泛溢。
综合历代医家观点及前期临床工作实践,笔者认为少阴枢机不利是MN发病的病机关键,阴阳失调,寒热失衡,气机升降失常,水道不利是MN发病的基本病理变化[11],邪越三阳入少阴,阳气已虚,治则上当以温阳散邪。麻黄附子细辛汤中,君用附子以温脾肾阳气,祛风散寒除湿;麻黄味辛微苦性温,归肺和膀胱经,解表宣肺,使邪从表路出;以细辛辛温发散之性,通达表里,内可佐附子以温经,外可助麻黄以解表,全方共建开太阳散邪、守脾阳健运、固肾阳气化之功。在临床发现MN的患者多因病程漫长,邪实而正虚,卫阳不振,水湿留滞,因此合用防己黄芪汤,防己祛风除湿,给邪以出路,黄芪振卫表之阳,两方合用,以少阴为枢,卫阳得健,脾土得温,水湿得散,共奏阴阳和调,寒热均衡,水道通利之功。
现代药理学研究发现,麻黄水提物有抗氧化作用,通过清除氧自由基,减轻脂质过氧化等方面减轻肾脏损伤[13-14]。附子含有100多种化学成分,具有生物活性的成分主要为二萜生物碱类、黄酮类、甾体皂苷类等,药理研究发现其具有抗炎、抗氧化作用[15]。细辛具有抗炎,解热镇痛作用[16]。研究表明防己生物碱化合物具有抗炎镇痛、解热、利尿、抑制肿瘤细胞生长等作用[17]。黄芪中富含黄芪多糖类、黄芪皂苷、黄酮类、蛋白质等多种有效成分,研究表明,黄芪具有抗氧化应激、抗炎、抑制足细胞凋亡、调节血脂及减少蛋白尿等作用,减少肾小球肥大、肾小球硬化、肾小球基底膜及系膜增厚等病理变化,具有肾脏保护作用[18-19]。白术主要化学成分是挥发油、白术内酯及内酯类化合物等,现代药理学发现具有抗炎、抗肿瘤、利尿及增强免疫等作用[20]。甘草属于豆科植物,18β-甘草次酸(GA)是甘草中的主要有效成分,具有抗炎、抗氧化、降血脂、祛痰、抗肿瘤、抗病毒及免疫调节等作用。研究发现GA可以通过促进尿肌酐的排泄、减少尿蛋白、抑制肾脏细胞的凋亡以及抑制ERK信号通路发挥肾脏保护作用,从而延缓糖尿病肾病的进展[21]。
MN临床表现为大量蛋白尿、水肿、高脂血症、低蛋白血症等,发病时由于肾小球过滤屏障受损,血清中蛋白质从尿中大量丢失,TP水平下降,导致蛋白尿,进而引发低蛋白血症。同时,由于血清中蛋白流失会刺激肝脏发挥蛋白合成代偿性机制,但合成的蛋白质不能完全弥补丢失的蛋白质,导致胶体渗透压下降,引发液体从血管内向组织间隙移动,产生水肿。同时影响血液的黏稠度,TG水平升高,引发高脂、高黏血症。血肌酐SCr是检测肾功能的重要指标,当MN伴有肾功能受损时会出现相应下降。本研究结果发现,中药干预后,MN小鼠血清TP升高,TG降低,肾组织病理形态改善,说明麻黄附子细辛汤联合防己黄芪汤有利于改善MN小鼠临床表现,减轻肾脏病理损害,对MN小鼠具有肾保护作用。有研究表明,氧化应激在MN的发病中有着重要作用。在机体的氧化应激过程中,过量的ROS会攻击脂质分子,导致脂质过氧化反应,产生大量的MDA,MDA含量通常被用来评估氧化应激程度的严重程度。本研究结果显示,MN小鼠肾组织MDA含量较正常组升高,提示MN小鼠有氧化应激损伤,各给药组治疗后MDA含量不同程度下降。HO-1蛋白表达量结果显示,正常组处于低水平状态,模型组有所升高,考虑可能是MN小鼠处于氧化应激状态下机体启动的自我保护反应。各给药组治疗后HO-1蛋白表达量均升高,由此笔者推测基于少阴枢机理论组方麻黄附子细辛汤合防己黄芪汤可能通过提高HO-1蛋白表达,增强机体抗氧化应激能力来改善肾脏组织损伤,保护肾组织,延缓MN进展。
综上所述,从中医宏观思维分析,两方联用治疗MN可以共奏和畅少阴枢机,调和阴阳,扶正固本,温阳散邪之功,缓解MN临床表现。从西医微观思维角度分析,推测两方联用缓解MN的内在分子作用机制可能与其降低氧化应激反应和炎症反应,激活HO-1通路有关。笔者认识到本课题研究存在的不足之处,仅对麻黄附子细辛汤合防己黄芪汤的整体治疗作用进行了探讨,仍需对方中各种药物单体化学成分、药理活性及其作用机制进行更深入研究,同时未来将进一步研究其量效关系、延长干预时间等,以期为中医治疗MN提供科学依据和新思路。
| [1] |
RONCO P, PLAISIER E, DEBIEC H. Advances in membranous nephropathy[J]. Journal of Clinical Medicine, 2021, 10(4): 607. DOI:10.3390/jcm10040607 |
| [2] |
RONCO P, DEBIEC H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care[J]. The Lancet, 2015, 385(9981): 1983-1992. DOI:10.1016/S0140-6736(15)60731-0 |
| [3] |
KOOPMAN J J E, VAN ESSEN M F, RENNKE H G, et al. Deposition of the membrane attack complex in healthy and diseased human kidneys[J]. Frontiers in Immunology, 2020, 11: 599974. |
| [4] |
KRATA N, FORONCEWICZ B, R, et al. Peroxiredoxins as markers of oxidative stress in IgA nephropathy, membranous nephropathy and lupus nephritis[J]. Archivum Immunologiae et Therapiae Experimentalis, 2021, 70(1): 3. |
| [5] |
ZHANG J X, WANG X L, VIKASH V, et al. ROS and ROS-mediated cellular signaling[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 4350965. |
| [6] |
彭福梅, 尹青桥, 李相友. 基于Nrf2/Keap1信号通路研究黄芩甲苷对糖尿病肾病模型小鼠肾损伤的作用[J]. 中医学报, 2022, 37(12): 2657-2663. PENG F M, YIN Q Q, LI X Y. Effects of baicalin Ⅳ on renal injury in diabetic nephropathy mice based on Nrf2/Keap1 signaling pathway[J]. Acta Chinese Medicine, 2022, 37(12): 2657-2663. |
| [7] |
周吉, 王子晨, 阴永辉. 基于Keap1-Nrf2-ARE信号通路探讨益气活血法防治糖尿病肾病[J]. 中医学报, 2022, 37(4): 742-750. ZHOU J, WANG Z C, YIN Y H. Discussion on prevention and treatment of diabetic nephropathy with Yiqi Huoxue method based on KEAP1-NRF2-ARE signaling pathway[J]. Acta Chinese Medicine, 2022, 37(4): 742-750. |
| [8] |
孔畅, 陈东峰, 阴永辉, 等. 基于Nrf2/HO-1通路探讨黄芪-当归药对改善糖尿病小鼠肾脏氧化损伤的机制[J]. 中华中医药杂志, 2022, 37(6): 3165-3170. KONG C, CHEN D F, YIN Y H, et al. Mechanism research of astragalus-angelica medicine pairs on improving renal oxidative damage in diabetic mice based on Nrf2/HO-1 pathway[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2022, 37(6): 3165-3170. |
| [9] |
CAMPBELL N K, FITZGERALD H K, DUNNE A. Regulation of inflammation by the antioxidant haem oxygenase 1[J]. Nature Reviews Immunology, 2021, 21(7): 411-425. DOI:10.1038/s41577-020-00491-x |
| [10] |
KUNUTSOR S K, BAKKER S J L, GANSEVOORT R T, et al. Circulating total bilirubin and risk of incident cardiovascular disease in the general population[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2015, 35(3): 716-724. DOI:10.1161/ATVBAHA.114.304929 |
| [11] |
郝阳, 刘纳文. 从少阴枢机论治膜性肾病[J]. 天津中医药, 2021, 38(8): 1022-1027. HAO Y, LIU N W. Treatment of membranous nephropathy from shaoyin pivot[J]. Tianjin Journal of Traditional Chinese Medicine, 2021, 38(8): 1022-1027. |
| [12] |
薛丕良, 李丽琦, 徐梅秀, 等. 参芪蛭龙汤通过ERK/cPLA2信号通路对膜性肾病小鼠的治疗作用及机制研究[J]. 海南医学院学报, 2022, 28(15): 1127-1134. XUE P L, LI L Q, XU M X, et al. Therapeutic effect and mechanism of Shenqi Zhilong Decoction on mice with membranous nephropathy through ERK/cPLA2 signaling pathway[J]. Journal of Hainan Medical University, 2022, 28(15): 1127-1134. |
| [13] |
张连茹, 邹国林, 杨天鸣. 麻黄水溶性多糖的提取及其清除氧自由基作用的研究[J]. 氨基酸和生物资源, 2000, 22(3): 24-26. ZHANG L R, ZOU G L, YANG T M. Studies on extraction of water-soluble polysaccharides and the function of cleaning oxygen free-radical function of ephedra[J]. Amino Acids & Biotic Resources, 2000, 22(3): 24-26. |
| [14] |
王雪, 刘海洋, 刘佳丽, 等. 麻黄水提物对顺铂所致大鼠肾损伤的影响[J]. 中国药师, 2019, 22(1): 1-3, 9. WANG X, LIU H Y, LIU J L, et al. Effects of ephedra water extract on renal injury induced by cisplatin in rats[J]. China Pharmacist, 2019, 22(1): 1-3, 9. |
| [15] |
许欣, 李刚敏, 孙晨, 等. 附子水溶性生物碱及其药理作用研究进展[J]. 中药药理与临床, 2021, 37(5): 213-219. XU X, LI G M, SUN C, et al. Research progress on water-soluble alkaloids from Fuzi and their pharmacological effects[J]. Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(5): 213-219. |
| [16] |
刘美婷, 王连嵋, 孟晶, 等. 细辛的化学成分、药理及毒理研究进展[J]. 中国实验方剂学杂志, 2023, 29(10): 224-234. LIU M T, WANG L M, MENG J, et al. Chemical constituents, pharmacology, and toxicology of asari radix et rhizoma: a review[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(10): 224-234. |
| [17] |
赖信宏, 谢孟姣, 陈海燕, 等. 防己化学成分和药理活性研究进展及质量标志物预测分析[J]. 中华中医药学刊, 2023, 42(3): 244-252, 281. LAI X H, XIE M J, CHEN H Y, et al. Research progress on chemical composition and pharmacological activities of Fangji(stephaniae tetrandrae radix) and predictive analysis on Q-marker[J]. Chinese Archives of Traditional Chinese Medicine, 2023, 42(3): 244-252, 281. |
| [18] |
龚建光, 詹慧芳, 金娟, 等. 黄芪甲苷保护嘌呤霉素氨基核苷诱导的足细胞损伤及机制探讨[J]. 临床肾脏病杂志, 2020, 20(4): 303-309. GONG J G, ZHAN H F, JIN J, et al. The protective effect of astragaloside Ⅳ on puromycin aminonucleoside induced podocyte injury and its potential mechanism[J]. Journal of Clinical Nephrology, 2020, 20(4): 303-309. |
| [19] |
李冀, 王田, 付强, 等. 黄芪甲苷对肾脏的保护作用研究进展[J]. 吉林中医药, 2022, 42(10): 1214-1218. LI J, WANG T, FU Q, et al. Research progress of the protective effects of astragaloside Ⅳ on kidney[J]. Jilin Journal of Chinese Medicine, 2022, 42(10): 1214-1218. |
| [20] |
柳威, 邓林华, 赵英强. 白术及其有效成分药理作用概述[J]. 中医药学报, 2021, 49(10): 116-119. LIU W, DENG L H, ZHAO Y Q. Summary of pharmacological effects of atractylodes macrocephala and its active ingredients[J]. Acta Chinese Medicine and Pharmacology, 2021, 49(10): 116-119. |
| [21] |
李小琴, 沈莹, 石珺. 甘草次酸对糖尿病肾病动物模型的疗效观察[J]. 临床肾脏病杂志, 2018, 18(7): 434-439. LI X Q, SHEN Y, SHI J. Curative effect of glycyrrhetinicacid for diabetic nephropathy animal model[J]. Journal of Clinical Nephrology, 2018, 18(7): 434-439. |
2. Department of Traditional Chinese Medicine, Tianjin First Central Hospital, Tianjin 300192, China
 2023, Vol. 40
2023, Vol. 40