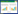文章信息
- 杨芳, 马静芬, 郑聪聪, 等.
- YANG Fang, MA Jingfen, ZHENG Congcong, et al.
- 苦参素对2型糖尿病雄性大鼠生殖损伤及Nrf2/HO-1信号通路的影响
- Effects of oxymatrine on reproductive injury and Nrf2/HO-1 signaling pathway in type 2 diabetic male rats
- 天津中医药, 2023, 40(9): 1175-1182
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(9): 1175-1182
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.09.15
-
文章历史
- 收稿日期: 2023-05-24
2. 邯郸市第一医院, 邯郸 056002
糖尿病是一种以高血糖为主要特征的慢性代谢性疾病,根据国际糖尿病联合会(IDF)报告,2021年全球糖尿病患者约5.37亿,预计2045年将上升至7.83亿,其中2型糖尿病(T2DM)患者占90%以上[1]。糖尿病会导致包括男性生殖损伤在内的多种系统性健康问题,有研究报道糖尿病男性精子浓度与活力均明显低于正常男性,损伤男性生殖功能,与空腹血糖呈负相关[2]。病理学研究发现,高血糖引起线粒体活性氧(ROS)过度生成导致氧化应激,是糖尿病并发症发生发展的重要机制之一[3]。E2相关因子2(Nrf2)/血红素加氧酶1(HO-1)是参与调控氧化应激的重要信号通路,研究证实,通过调控Nrf2/HO-1信号通路抑制氧化应激能够改善糖尿病雄性大鼠生殖损伤[4]。
苦参素(OMT)又名氧化苦参碱,是由苦参根茎中提取的一类活性生物碱,具有较好的抗氧化、抗炎作用[5]。有文献报道OMT能够通过激活Nrf2/HO-1信号通路减轻急性肝衰竭小鼠和肝硬化大鼠氧化应激损伤[6-7],并且能够减轻糖尿病所致心肌组织损伤[8]。但OMT能否通过抑制氧化应激减轻糖尿病雄性大鼠生殖损伤尚未见文献报道,本实验通过OMT干预T2DM雄性大鼠模型,探讨OMT对T2DM雄性大鼠生殖损伤及Nrf2/HO-1信号通路的影响,以期为临床防治T2DM男性患者生殖损伤提供新的思路。
1 材料与方法 1.1 实验动物53只清洁级雄性SD大鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0011,6周龄,体质量200~220 g。饲养于河北省中西医结合医药研究院,控制室温23~25 ℃、相对湿度50%~70 %、光暗各12 h循环。本实验通过邯郸市中心医院伦理委员会审批[HDZXYY(K)字2022-006],所有实验动物操作严格遵循3R原则。
1.2 药物与试剂OMT片(规格:0.1 g/片)购自山东齐都药业有限公司(批号:202203019);二甲双胍(Met,规格:0.25 g/片)购自北京中新药业股份有限公司(批号:202204B03005);链脲佐菌素(STZ)和比色法检测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒购自上海碧云天生物技术有限公司(货号:ST1668、S0109、S0051、S0131S);酶联免疫吸附(ELISA)法检测睾酮(T)、黄体生成素(LH)、卵泡刺激素(FSH)试剂盒购自泉州市睿信生物科技有限公司(货号:RXJ302700R、RX303076R、RX302805R);ELISA法检测促性腺激素释放激素(GnRH)试剂盒、苏木精-伊红(HE)染色试剂盒、ECL发光液购自南京建成生物工程研究所(货号:H297、D006-1-1、W028-2-1);总RNA提取试剂TRIzol购自北京索莱宝生物科技有限公司(批号:R1100);逆转录试剂盒购自美国Thermo Fisher公司(批号:013071205);实时荧光定量聚合酶链式反应(RT-PCR)试剂盒购自日本Takara公司(批号:RR651A);RIPA裂解液和Nrf2抗体、p-Nrf2抗体、HO-1抗体、β-actin抗体购自北京博奥森生物技术有限公司(货号:C5028、bs-1074R、bs-2013R、bs-2075R、bs-0061R);IgG二抗和BCA法蛋白定量试剂盒购自美国SantaCruz公司(货号:sc-2357、sc-14036)。
1.3 实验方法 1.3.1 模型制备与给药53只实验用大鼠适应性饲养1周后,随机8只设为正常(Normal)组,Normal组大鼠继续常规饲养。剩余45只参照Rahimiyan-Heravan等[9]报道的方法,通过高脂饮食(58%脂肪+17%蛋白质+25%碳水化合物)喂养4周,禁食12 h后35 mg/kg腹腔注射STZ制备T2DM大鼠模型,注射STZ 1周后检测空腹血糖(FBG)水平>16.7 mmol/L即可判断造模成功。共造模成功42只大鼠,去除FBG水平最低的2只后,将剩余40只成模大鼠随机分为模型(Model)组、Met组和OMT低、中、高剂量组,每组8只。Met组每日1次灌胃给药200 mg/kg[10],OMT低、中、高剂量组分别每日1次灌胃给药25、50、100 mg/kg(参照人临床使用剂量,根据大鼠与人剂量换算公式计算,OMT低、中、高剂量组分别相当于人临床剂量的1/2倍、1倍、2倍),Normal组和Model组每日1次灌胃给予生理盐水,疗程4周。
1.3.2 FBG水平和血清T、GnRH、LH、FSH含量检测治疗完成后,禁食禁水12 h,经尾静脉取血并通过动物血糖仪(JPS-5型,北京怡成生物科技公司)检测FBG水平。麻醉后开腹、经腹主动脉取血5 mL,室温静置30 min后2 000 r/min离心(24D型台式离心机,深圳市赛泰克生物科技有限公司,离心半径10 cm)5 min取血清,遵照ELISA试剂盒说明,通过酶标仪(MB-530型,深圳汇松科技公司)检测血清T、GnRH、LH、FSH含量。
1.3.3 睾丸质量和睾丸体积测量取左侧睾丸,生理盐水冲洗并拭干后称其质量;测量睾丸上下径(L1)、前后径(L2)和左右径(L3),睾丸体积=π×L1×L2×L3/6。
1.3.4 HE染色法观察睾丸病理学改变及输精管直径(STD)和输精管上皮厚度(TSE)测量将测量后左侧睾丸置于10%中性甲醛溶液中固定48 h,脱水、石蜡埋机(TEC®5型组织包埋机,日本樱花公司)、4 μm厚度连续切片(RM-2135型石蜡切片机,德国Leica公司)、展片、烤片、脱蜡处理后,按照试剂盒操作说明进行HE染色,在光学显微镜(CX41型,日本Olympus公司)下观察睾丸病理学改变。在显微镜下,应用目镜测微计测量STD和TSE,每只大鼠随机取15个输精管进行测量,取平均值。
1.3.5 精子数量、精子存活率和精子活力检测取大鼠右侧附睾,加入37 ℃平衡盐溶液1 mL后剪碎,反复吹打使精子充分游离,取10 μL上层液体加入37 ℃平衡盐溶液稀释至1 mL,通过精液分析仪(AS-CASA型,俄罗斯ASL公司)检测精子数量和精子存活率。取1滴新鲜精液和2滴生理盐水置于37 ℃载玻片上,在400倍光学显微镜(CX41型,日本Olympus公司)下选取200个以上精子进行精子活力分级,参照文献[11]报道的精子活力分级标准:沿直线快速前进为a级,沿直线或曲线缓慢前进为b级,摇尾但不向前移动为c级,不摇尾且不移动为d级。
1.3.6 睾丸组织抗氧化酶(SOD、GSH-Px)活性和MDA含量检测取右侧睾丸部分组织,加入9倍量(质量比)4 ℃生理盐水后研磨匀浆,4 ℃、3 500 r/min离心(24D型台式离心机,深圳市赛泰克生物科技有限公司,离心半径10 cm)10 min取上清,采用比色法,通过分光光度计(ND2000C型,美国Thermo公司)检测SOD、GSH-Px活性和MDA含量。
1.3.7 睾丸组织Nrf2、HO-1 mRNA表达检测取部分右侧睾丸组织,TRIzol法提取睾丸组织总RNA并逆转录成cDNA,以cDNA作为模板进行PCR(Quant Studio 5型PCR仪,美国ABI公司)扩增,扩增程序设置为:95 ℃ 10 min行预变性;95 ℃ 30 s、60 ℃ 30 s,重复40个循环。以GAPDH为内参基因,运用公式2-ΔΔCt计算Nrf2、HO-1 mRNA相对表达量。引物序列由北京擎科新业生物公司设计并合成,引物序列见表 1。
取100 mg右侧睾丸组织,加入1 mL 4 ℃ RIPA裂解液,组织剪碎后研磨匀浆,冰上静置30 min,4 ℃ 12000 r/min离心(CR22N型高速低温离心机,日本Hitachi公司,离心半径8 cm)30 min取上清,BCA法测定总蛋白浓度,各组均以30 μg总蛋白量上样行10% SDS-PAGE凝胶电泳(1659001型电泳仪,美国Bio-Rad公司)、半干法转至PVDF膜(Turbo型转膜仪,美国Bio-Rad公司)、5%蛋白封闭液37 ℃封闭2 h,洗膜后加一抗稀释液Nrf2(1∶1 000)、p-Nrf2(1∶1 000)、HO-1(1∶1 000)、β-actin(1∶2 000)4 ℃孵育过夜,洗膜后加二抗IgG稀释液(1∶2 000)37 ℃孵育1.5 h,洗膜后ECL显影,通过化学发光成像分析仪(Image Quant LAS4000型,美国GE Healthcare公司)拍照,通过Image J软件分析蛋白条带灰度值。
1.4 统计学方法运用SPSS 20.0软件进行统计分析,计量资料符合正态分布以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间多重比较行LSD-t检验(方差齐时)或Dunnett’T3检验(方差不齐时),P<0.05表示差异有统计学意义。
2 结果 2.1 OMT对T2DM雄性大鼠FBG水平的影响与Normal组比较,Model组大鼠FBG水平明显升高(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组FBG水平明显降低(P<0.05);OMT低、中、高剂量组该作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低、中剂量组FBG水平明显升高(P<0.05),OMT高剂量组FBG水平差异无统计学意义(P>0.05)。见表 2。

|
与Normal组比较,Model组大鼠血清T、GnRH、LH、FSH水平明显降低(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组T、GnRH、LH水平明显升高,Met组和OMT中、高剂量组FSH水平明显升高(P<0.05);OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低剂量组T、GnRH、LH、FSH水平明显降低(P<0.05);OMT中剂量组T、LH水平明显升高(P<0.05),GnRH、FSH水平差异无统计学意义(P>0.05);OMT高剂量组T、GnRH、LH、FSH水平明显升高(P<0.05)。见表 2。
2.3 OMT对T2DM雄性大鼠睾丸质量和睾丸体积的影响与Normal组比较,Model组大鼠睾丸质量和睾丸体积明显降低(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组睾丸质量和睾丸体积明显升高(P<0.05);OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低、中剂量组睾丸质量和睾丸体积差异无统计学意义(P>0.05);OMT高剂量组睾丸质量和睾丸体积明显升高(P<0.05)。见表 3。
|
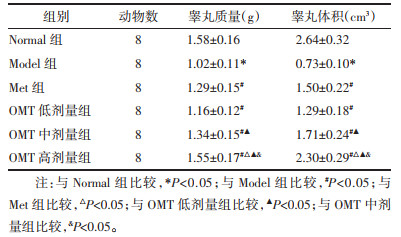
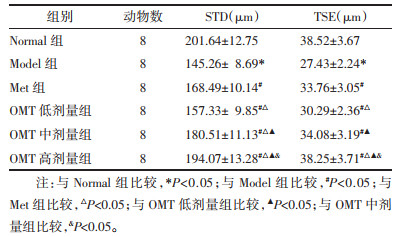
Normal组大鼠睾丸组织输精管排列整齐、结构完整,精子发生正常。Model组睾丸组织呈现输精管萎缩、管腔直径变窄、上皮厚度变薄,生精上皮结构紊乱,精原细胞退化、脱落、数量减少等病理学改变。与Model组比较,Met组和OMT低、中、高剂量组睾丸组织病理学改变不同程度改善,OMT低、中、高剂量组改善效果呈现剂量依赖性,OMT高剂量组改善效果优于Met组。与Normal组比较,Model组大鼠睾丸组织STD、TSE明显降低(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组STD、TSE明显升高(P<0.05),OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低剂量组STD、TSE明显降低(P<0.05);OMT中剂量组STD明显升高(P<0.05),TSE差异无统计学意义(P>0.05);OMT高剂量组STD、TSE明显升高(P<0.05)。见图 1、表 4。

|
| 图 1 OMT 对 T2DM 雄性大鼠睾丸组织病理学改变的影响(HE 染色,×400) Fig. 1 Effect of OMT on histopathological changes of testicular tissue in male rats with T2DM(HE staining, ×400) |
|
与Normal组比较,Model组大鼠精子数量、精子存活率和(a+b)级活力精子明显降低(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组精子数量、精子存活率、(a+b)级活力精子明显升高(P<0.05);OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低剂量组精子数量明显降低(P<0.05),精子存活率和(a+b)级活力精子差异无统计学意义(P>0.05);OMT中剂量组精子数量和精子存活率明显升高(P<0.05),(a+b)级活力精子差异无统计学意义(P>0.05);OMT高剂量组精子数量、精子存活率和(a+b)级活力精子明显升高(P<0.05)。见表 5。

|
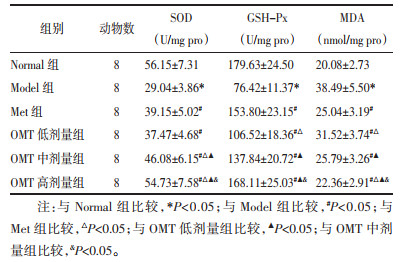
与Normal组比较,Model组大鼠睾丸组织SOD、GSH-Px活性明显降低,MDA含量明显升高(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组SOD、GSH-Px活性明显升高,MDA含量明显降低(P<0.05);OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低剂量组GSH-Px活性明显降低、MDA含量明显升高(P<0.05),SOD活性差异无统计学意义(P>0.05);OMT中剂量组SOD活性明显升高(P<0.05),GSH-Px活性和MDA含量差异无统计学意义(P>0.05);OMT高剂量组SOD活性明显升高、MDA含量明显降低(P<0.05),GSH-Px活性差异无统计学意义(P>0.05)。见表 6。
|
与Normal组比较,Model组大鼠睾丸组织Nrf2、HO-1 mRNA表达量明显降低(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组Nrf2、HO-1 mRNA表达量明显升高(P<0.05);OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低剂量组Nrf2、HO-1 mRNA表达量明显降低(P<0.05),OMT中剂量组Nrf2、HO-1 mRNA表达量差异无统计学意义(P>0.05);OMT高剂量组Nrf2、HO-1 mRNA表达量明显升高(P<0.05)。见表 7。
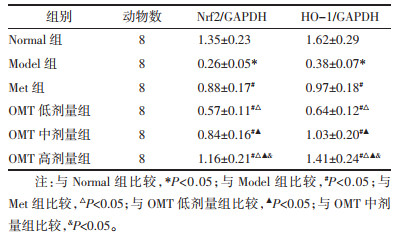
|
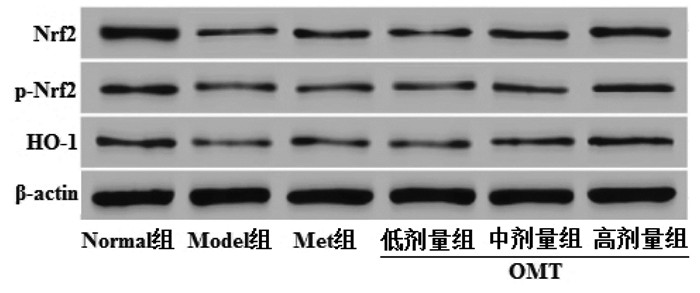
与Normal组比较,Model组大鼠睾丸组织Nrf2、p-Nrf2、HO-1表达量明显降低(P<0.05)。与Model组比较,Met组和OMT低、中、高剂量组Nrf2、p-Nrf2、HO-1表达量明显升高(P<0.05);OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT低剂量组Nrf2、p-Nrf2表达量明显降低,HO-1表达量差异无统计学意义(P>0.05);OMT中、高剂量组Nrf2、p-Nrf2、HO-1表达量明显升高(P<0.05)。见图 2、表 8。
|
| 图 2 OMT对T2DM雄性大鼠睾丸组织Nrf2、p-Nrf2、HO-1蛋白表达的影响 Fig. 2 Effects of OMT on the protein expression of Nrf2, pNrf2, HO-1 of testicular tissue in male rats with T2DM |
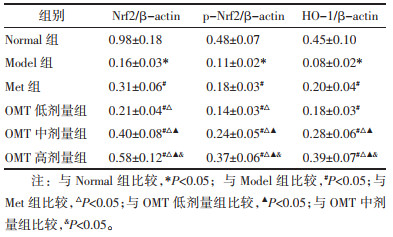
|
糖尿病患者生殖损伤发病率是非糖尿病患者的5~10倍,男性发病率高于女性[12]。随着国家鼓励生育政策相继出台,民众生育欲望升高,糖尿病所致男性生殖损伤甚至不育成为亟待解决的健康问题。
睾丸是男性生殖系统主要器官,是T分泌和精子生成的场所,其生理功能受下丘脑-垂体-性腺轴调控。糖尿病可引发多器官并发症,持续高血糖可导致睾丸萎缩、T分泌减少、精子质量降低,最终导致男性生殖功能受损甚至不育[13]。糖尿病患者中超过90%为T2DM,而T2DM男性患者普遍存在生殖损伤。本研究采用高脂饮食结合注射STZ损伤胰岛β细胞的方法构建T2DM雄性大鼠模型,该方法操作简便、成功率高、重复性好,并且成模过程与人类T2DM发病机制及病理特点相似,是国内外普遍认可的T2DM动物模型制备方法[14]。结果显示,与正常组比较,T2DM雄性大鼠FBG水平明显升高,血清T、GnRH、LH、FSH含量水平明显降低,睾丸质量和睾丸体积明显降低,睾丸组织呈现输精管萎缩、生精上皮结构紊乱、精原细胞退化、脱落、数量减少等病理学改变,STD和TSE均明显降低,与Sudirman等[10, 15]报道一致;精子数量、精子存活率、(a+b)级活力精子明显降低,与Heidari等[16]报道一致;说明T2DM雄性模型大鼠睾丸组织出现明显的结构和功能损伤,下丘脑-垂体-性腺轴功能受损。OMT能够剂量依赖性降低T2DM雄性大鼠FBG水平,提高血清T、GnRH、LH、FSH含量水平,减轻睾丸萎缩和睾丸组织病变,提高精子质量,并且OMT高剂量组对除FBG外其他指标的作用均优于Met组,提示OMT对T2DM雄性大鼠生殖损伤及下丘脑-垂体-性腺轴功能具有保护作用。
氧化应激是糖尿病所致生殖损伤等发生发展的重要机制。高血糖引发线粒体过度生成ROS,致使SOD、GSH-Px等内源性抗氧化酶被过度消耗,破坏“ROS生成-还原清除”平衡,ROS蓄积而攻击生物膜脂质双分子层结构并生成具有生物毒性的MDA,并且ROS可破坏蛋白质、DNA等生物大分子结构,造成氧化应激损伤[17]。Nrf2是一种核转录因子,在机体抗氧化系统中发挥着重要作用。正常状态下存在于细胞质的Nrf2通过Neh2结构域与其抑制剂Keap-1结合而无生理活性[18]。ROS可诱导Nrf2磷酸化并促使“Nrf2-Keap-1”复合体解离,p-Nrf2核转位后能够诱导SOD、GSH-Px等抗氧化酶转录与表达,提高ROS还原清除能力,降低氧化应激损伤[19]。Nrf2下游靶蛋白HO-1为血红素降解限速酶,可促使血红素降解生成胆绿素IX、CO、Fe2+等内源性抗氧化剂[20-21]。本研究发现,OMT能够剂量依赖性提高T2DM雄性大鼠睾丸组织SOD、GSH-Px活性并降低MDA含量,提高Nrf2、HO-1 mRNA表达和Nrf2、p-Nrf2、HO-1蛋白表达,并且OMT高剂量组对除GSH-Px外其他指标的作用均优于Met组,提示OMT对T2DM雄性大鼠睾丸组织氧化应激损伤具有保护作用,可能与激活Nrf2/HO-1信号通路有关。
综上所述,OMT对T2DM雄性大鼠生殖损伤具有保护作用,其机制可能与激活Nrf2/HO-1信号通路,抑制氧化应激,改善下丘脑-垂体-性腺轴功能有关。本研究为OMT用于防治T2DM男性生殖损伤提供了理论依据。氧化应激也是T2DM雌性大鼠生殖损伤的重要机制[22-23],因此OMT可能对T2DM雌性大鼠生殖损伤也具有保护作用,但尚需进行实验验证。
| [1] |
SUN H, SAEEDI P, KARURANGA S, et al. IDF Diabetes Atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2022, 183: 109119. DOI:10.1016/j.diabres.2021.109119 |
| [2] |
吴霞, 刘雯, 杨斯桀, 等. 高血糖对不育男性精液质量的影响及相关性分析[J]. 检验医学与临床, 2023, 20(3): 324-327. WU X, LIU W, YANG S J, et al. Influencing and correlation analysis of hyperglycemia on semen quality of infertile men[J]. Laboratory Medicine and Clinic, 2023, 20(3): 324-327. DOI:10.3969/j.issn.1672-9455.2023.03.009 |
| [3] |
DARENSKAYA M A, KOLESNIKOVA L I, KOLESNIKOV S I. Oxidative stress: pathogenetic role in diabetes mellitus and its complications and therapeutic approaches to correction[J]. Bulletin of Experimental Biology and Medicine, 2021, 171(2): 179-189. DOI:10.1007/s10517-021-05191-7 |
| [4] |
陆包伟, 刘露梅, 王能, 等. 龟鹿二仙胶对糖尿病大鼠生殖损伤的保护作用及机制[J]. 中国实验方剂学杂志, 2022, 28(19): 1-8. LU B W, LIU L M, WANG N, et al. Protective effect of Guilu Erxianjiao on reproductive injury in diabetic rats and its mechanism[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(19): 1-8. |
| [5] |
GUAN B G, CHEN R C, ZHONG M L, et al. Protective effect of oxymatrine against acute spinal cord injury in rats via modulating oxidative stress, inflammation and apoptosis[J]. Metabolic Brain Disease, 2020, 35(1): 149-157. DOI:10.1007/s11011-019-00528-8 |
| [6] |
XU J, LI C M, LI Z W, et al. Protective effects of oxymatrine against lipopolysaccharide/D-galactosamine-induced acute liver failure through oxidative damage, via activation of Nrf2/HO-1 and modulation of inflammatory TLR4-signaling pathways[J]. Molecular Medicine Reports, 2018, 17(1): 1907-1912. |
| [7] |
文志勇, 刘伟华, 谭松龄, 等. 氧化苦参碱通过激活Nrf2/HO-1通路减轻肝硬化大鼠肠道氧化应激损伤[J]. 赣南医学院学报, 2021, 41(6): 557-563, 575. WEN Z Y, LIU W H, TAN S L, et al. Study of oxymatrine in reducing intestinal oxidative stress injury by activating Nrf2/HO-1 pathway in cirrhosis rats[J]. Journal of Gannan Medical University, 2021, 41(6): 557-563, 575. DOI:10.3969/j.issn.1001-5779.2021.06.003 |
| [8] |
HUANG Y P, HE B, SONG C, et al. Oxymatrine ameliorates myocardial injury by inhibiting oxidative stress and apoptosis via the Nrf2/HO-1 and JAK/STAT pathways in type 2 diabetic rats[J]. BMC Complementary Medicine and Therapies, 2023, 23(1): 2. DOI:10.1186/s12906-022-03818-4 |
| [9] |
RAHIMIYAN-HERAVAN M, ROSHANGAR L, KARIMI P, et al. The potential therapeutic effects of lactobacillus plantarum and inulin on serum and testicular reproductive markers in diabetic male rats[J]. Diabetology & Metabolic Syndrome, 2020, 12: 53. |
| [10] |
SUDIRMAN S, SU C Y, TSOU D, et al. Hippocampus kuda protein hydrolysate improves male reproductive dysfunction in diabetic rats[J]. Biomedicine & Pharmacotherapy, 2021, 140: 111760. |
| [11] |
郭茂, 陈琰, 李兴元, 等. 雌激素及其受体ERβ在氰戊菊酯所致雄性大鼠生殖毒性中的作用[J]. 西南大学学报(自然科学版), 2021, 43(10): 66-76. GUO M, CHEN Y, LI X Y, et al. Effects of estrogen and ERβ on reproductive toxicity induced by fenvalerate in male rats[J]. Journal of Southwest University(Natural Science Edition), 2021, 43(10): 66-76. |
| [12] |
朱怡睿, 张莹. 糖尿病对生殖功能的影响[J]. 医学综述, 2021, 27(4): 771-777. ZHU Y R, ZHANG Y. Effects of diabetes mellitus on reproductive functions[J]. Medical Recapitulate, 2021, 27(4): 771-777. |
| [13] |
李晓明, 张滨, 齐涛, 等. 糖尿病对雄性大鼠生殖功能的影响[J]. 广东医学, 2011, 32(22): 2940-2942. LI X M, ZHANG B, QI T, et al. Effect of diabetes on reproductive function of male rats[J]. Guangdong Medical Journal, 2011, 32(22): 2940-2942. DOI:10.3969/j.issn.1001-9448.2011.22.024 |
| [14] |
裴天仙, 郭景玥, 王春雨, 等. 6种2型糖尿病动物模型中生化和病理改变的比较[J]. 药物评价研究, 2020, 43(9): 1740-1746. PEI T X, GUO J Y, WANG C Y, et al. Comparison of biochemical and pathological changes in six type 2 diabetic animal models[J]. Drug Evaluation Research, 2020, 43(9): 1740-1746. |
| [15] |
ÖZTAŞ E, YILMAZ T E, GÜZEL E, et al. Gliclazide alone or in combination with atorvastatin ameliorated reproductive damage in streptozotocin-induced type 2 diabetic male rats[J]. Saudi Pharmaceutical Journal, 2019, 27(3): 422-431. DOI:10.1016/j.jsps.2019.01.003 |
| [16] |
HEIDARI H, ABDOLLAHI M, KHANI S, et al. Effect of alpinia officinarum extract on reproductive damages in streptozotocin induced diabetic male rats[J]. Journal of Diabetes and Metabolic Disorders, 2021, 20(1): 77-85. DOI:10.1007/s40200-020-00711-0 |
| [17] |
魏书瑶, 冯珊珊, 马菲菲, 等. 氧化应激在2型糖尿病发生发展中的作用机制[J]. 西北国防医学杂志, 2021, 42(6): 557-562. WEI S Y, FENG S S, MA F F, et al. Mechanism of oxidative stress in the occurrence and development of type 2 diabetes mellitus[J]. Medical Journal of National Defending Forces in Northwest China, 2021, 42(6): 557-562. |
| [18] |
刘文娜, 甘玉金, 张璐, 等. Keap1-Nrf2信号通路在急性肾损伤中作用的研究进展[J]. 中华实用诊断与治疗杂志, 2022, 36(5): 537-540. LIU W N, GAN Y J, ZHANG L, et al. Keap1-Nrf2 signaling pathway in acute kidney injury[J]. Journal of Chinese Practical Diagnosis and Therapy, 2022, 36(5): 537-540. |
| [19] |
刘尧, 张建军, 李振皓, 等. 基于对衰老大鼠心脏抗氧化保护作用及Keap1-Nrf2-HO-1通路探讨川芎临床"久服"用药策略[J]. 环球中医药, 2022, 15(12): 2321-2328. LIU Y, ZHANG J J, LI Z H, et al. Based on the antioxidant protective effect of ligusticum chuanxiong hort on aging rats and the mechanism of Keap1-Nrf2-HO-1 pathway to discuss the clinical "long-term use" drug strategy of ligusticum chuanxiong hort[J]. Global Traditional Chinese Medicine, 2022, 15(12): 2321-2328. |
| [20] |
孔凯文, 孟岩, 邓小明. Nrf2/HO-1信号通路在急性肺损伤中的研究进展[J]. 东南国防医药, 2022, 24(6): 646-651. KONG K W, MENG Y, DENG X M. Research progress of Nrf2/HO-1 signaling pathway in acute lung injury[J]. Military Medical Journal of Southeast China, 2022, 24(6): 646-651. |
| [21] |
LIU X T, LIN X, ZHANG S Y, et al. Lycopene ameliorates oxidative stress in the aging chicken ovary via activation of Nrf2/HO-1 pathway[J]. Aging, 2018, 10(8): 2016-2036. |
| [22] |
OLAWALE F, ANINYE I I, AJAJA U I, et al. Long-term hyperglycemia impairs hormonal balance and induces oxidative damage in ovaries of streptozotocin-induced diabetic wistar rat[J]. Nigerian Journal of Physiological Sciences: Official Publication of the Physiological Society of Nigeria, 2020, 35(1): 46-51. |
| [23] |
AZEMI M E, NAMJOYAN F, KHODAYAR M J, et al. The antioxidant capacity and anti-diabetic effect of boswellia serrata triana and planch aqueous extract in fertile female diabetic rats and the possible effects on reproduction and histological changes in the liver and kidneys[J]. Jundishapur Journal of Natural Pharmaceutical Products, 2012, 7(4): 168-175. |
2. Handan First Hospital, Handan 056002, China
 2023, Vol. 40
2023, Vol. 40