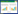文章信息
- 冯燕枝, 牛冰, 叶贝贝.
- FENG Yanzhi, NIU Bing, YE Beibei.
- 雪松醇调节miR-503-5p/TCF3轴对乳腺癌细胞增殖、迁移和侵袭的影响
- Effect of cedarol on proliferation, migration and invasion of breast cancer cells by regulating miR-503-5p/TCF3 axis
- 天津中医药, 2023, 40(9): 1183-1189
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(9): 1183-1189
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.09.16
-
文章历史
- 收稿日期: 2023-04-18
乳腺癌(BC)是最常见的恶性肿瘤之一,也是全球女性癌症死亡的主要原因[1]。尽管通过手术、化疗和放疗、内分泌治疗等对BC进行系统治疗有一定的效果,但因存在着不良反应、高成本和耐药性等局限性,因此仍需要开发更有效、毒性更低的新型药物,优化现有的治疗方法,以改善BC的预后,提高BC患者的生活质量[2-4]。雪松醇是一种天然倍半萜烯醇,已被证明具有广泛的生物活性,如抗菌、抗炎、镇痛、抗焦虑和抗癌作用[5]。研究发现,雪松醇可抑制胶质母细胞瘤[6]、肺癌[7]、结直肠癌[8]的发生发展。微小RNA(miRNA)表达失调与BC增殖、迁移和侵袭密切相关,多项报道显示,多种miRNA已成为BC药物干预的新靶点[9-10]。miR-503-5p作为重要的miRNA之一,在胃癌、结肠癌中下调表达,促进其表达可抑制肿瘤细胞增殖、迁移、侵袭和上皮间质转化[11-12]。miR-503-5p在BC中的作用尚不清楚。T细胞因子3(TCF3/TCF7L1)在BC中高表达,并能促进三阴性BC细胞的增殖、迁移和侵袭[13]。经生物信息学分析显示,miR-503-5p与TCF3之间存在结合位点,推测miR-503-5p可能通过调节TCF3影响BC的增殖、迁移和侵袭。但雪松醇通过调节miR-503-5p/TCF3轴对BC细胞增殖、迁移和侵袭的影响还不甚清楚,因此本实验旨在探讨雪松醇对BC细胞增殖、迁移和侵袭的影响及其作用机制,以期为临床治疗BC提供一定的参考价值。
1 材料与方法 1.1 材料 1.1.1 标本收集、细胞来源和实验动物2021年3月—2022年12月期间收集在本院首次确诊为BC患者的癌组织以及距离癌组织3 cm处的癌旁组织,共36对。所有患者均未接受化疗或放疗等形式的治疗,且签署了知情同意书,本研究获得本院伦理委员会的批准(批件号20210018)。人正常乳腺上皮细胞系MCF-10A及人BC细胞MCF7、MDA-MB-231、SKBR3购于美国ATCC。4周龄SPF级BALB/c裸鼠购自郑州大学(河南省实验动物中心),许可证号:SCXK(豫)2022-0001,体质量15~20 g。
1.1.2 主要试剂与仪器雪松醇(货号J14535),上海金穗生物科技有限公司;噻唑蓝比色法(MTT)试剂盒(货号:MH1001),江苏麦格生物科技有限公司;细胞转染试剂盒(货号:SY0944),北京伊塔生物科技有限公司;DMEM培养基(货号:M0108B),上海盈湾生物科技有限公司;细胞蛋白提取试剂盒(货号:SH-2473),北京凯诗源生物科技有限公司;RNA提取试剂盒(货号:R1200-100)、反转录试剂盒(货号:RP1105)、胸腺嘧啶核苷类似物(Edu)apollo 488 in vitro试剂盒(货号:CA1172),北京索莱宝科技有限公司;实时荧光定量PCR试剂盒(货号:IBIO-C583),江西艾博因生物科技有限公司;双荧光素酶报告基因检测试剂盒(货号:RG029S),上海碧云天生物技术有限公司;兔源一抗增殖细胞核抗原(PCNA,货号:ab15498-PCNA)、基质金属蛋白酶-2(MMP-2,货号:ab37150)、TCF3(货号:ab229605)、3-磷酸甘油醛脱氢酶(GAPDH,货号:ab9485)一抗抗体,美国Abcam公司;辣根酶标记羊抗兔二抗(货号:XY0650),上海信裕生物科技有限公司;miR-503-5p引物购自广州RiboBio;miR-503-5p抑制剂(miR-503-5p inhibitor)及对照(inhibitor-NC)、miR-503-5p模拟物(miR-503-5p mimic)及其对照(mimic-NC)购自上海吉玛生物公司;多功能酶标仪(型号:LD-96A),山东莱恩德智能科技有限公司;离心机(型号:5424),艾本德中国有限公司;实时荧光定量PCR仪(型号:CFX96 Touch),上海艾研生物科技有限公司;光学显微镜(型号:CX31),日本奥林巴斯公司。
1.2 实验方法 1.2.1 细胞培养将人正常乳腺上皮细胞MCF-10A及人BC细胞MCF7、MDA-MB-231、SKBR3置入DMEM的培养基中,在恒温培养箱中常规培养。定期观察,及时更换新的培养基。用0.25 %胰蛋白酶消化传代,收集对数生长期的细胞进行实验。
1.2.2 实时荧光定量聚合酶链式反应(qRT-PCR)法检测miR-503-5p表达组织和细胞的总RNA用TRIzol试剂提取。以RNA为模板合成cDNA后,再以cDNA为模板配置qRT-PCR反应体系。miR-503-5p上游引物:5′-CCTATTTCCCATGATTCCTTC ATA-3′和下游引物:5′-GTAATACGGTTATCCACGC G-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′和下游引物:5′-AACGCTTCACGAATTTGCGT-3′;以2-ΔΔCT法计算组织和细胞中miR-503-5p的相对表达量。
1.2.3 MTT实验检测细胞增殖将对数生长期细胞以1×104/孔,接种到96孔板中常规培养,设6个复孔,培养24 h后吸去原培养液,加入含0、14、28、56、112、225 μmol/L雪松醇[5]的培养液48 h后加入MTT溶液20 μL/孔,再培养4 h后,加入二甲基亚砜150 μL/孔,充分震荡后,在酶标仪上于490 nm波长处检测各孔的吸光度(A490)值,细胞增殖抑制率(%)=[(A对照-A实验)/(A对照-A空白)]×100%。
1.2.4 细胞转染及干预将细胞分为control组(正常培养)、雪松醇组(112 μmol/L干预)、inhibitor-NC(转染inhibitor-NC)、miR-503-5p inhibitor组(转染miR-503-5p inhibitor),对各组转染组细胞进行转染24 h,除control组外,再用雪松醇进行干预48 h,随后按照1.2.2中qRT-PCR法方法检测各组miR-503-5p的表达。
1.2.5 细胞增殖实验各组MCF7细胞在96孔板上接种,浓度为1×104/孔,设6个复孔。随后进行常规培养24、48、72 h后每孔加入20 μL MTT溶液。继续培养4 h每孔再加入150 μL的二甲基亚砜,在酶标仪上于490 nm波长处检测各孔的OD值。另取MCF7细胞接种至96孔板中,培养24 h后,每孔加入50 μM Edu孵育2 h,弃去培养液,加入50 μL的4 %多聚甲醛固定30 min,洗去固定液,每个孔加入100 μL的1×Apollo染色反应液,避光孵育30 min后,细胞核用DAPI溶液复染,荧光显微镜下观察,计算Edu阳性细胞比例。
1.2.6 Transwell小室检测细胞迁移与侵袭将各组MCF7细胞使用无血清培养基稀释,接种至不含有Matrigel基质胶(迁移实验)或含有Matrigel基质胶(侵袭实验)的Transwell上室,下室加入完全培养基,24 h后,用4 %多聚甲醛固定30 min,并用0.5 %结晶紫染色20 min,显微镜下随机选择6个视野细胞计算迁移与侵袭细胞数。
1.2.7 蛋白免疫印迹法(Western blot)检测PCNA、MMP-2、TCF3蛋白表达采用试剂盒提取组织和细胞总蛋白,对蛋白进行定量、电泳分离。转PVDF膜后室温封闭2 h,最后再分别加入PCNA(1∶1 000)、MMP-2(1∶2 000)、TCF3(1∶2 000)、GAPDH(1∶1 000)一抗在4℃条件下孵育过夜,加入二抗(1∶2 000)在37 ℃条件下孵育90 min。Image J软件分析蛋白条带的灰度值,计算蛋白的相对表达水平。
1.2.8 双荧光素酶报告基因实验构建TCF3野生型质粒和突变型质粒(TCF3-WT,TCF3-MUT),将TCF3-WT和TCF3-MUT分别与mimic-NC或miR-503-5p mimic共转染于MCF7细胞,48 h后用荧光酶标仪检测荧光素酶活性,并计算萤火虫荧光素酶和海肾荧光素酶活性比值。
1.2.9 体内肿瘤形成实验4周龄BALB/c裸鼠适应性饲养1周后,皮下注射200 μL(5×106)MCF7细胞悬液,每天观察肿瘤生长情况,待肿瘤体积达到50 mm3后,将裸鼠分成两组(10只/组):对照组、雪松醇组,雪松醇组皮下注射150 mg/kg雪松醇,2 d/1次,共给药10次。给药结束后测量小鼠质量,颈椎脱臼处死小鼠并分离肿瘤,测量肿瘤质量与体积,qRT-PCR检测移植瘤组织中miR-503-5p表达,免疫组化法检测TCF3、MMP-2蛋白表达。
1.3 统计学方法Graphpad Prism 7.0软件用于分析数据。数据采用均数±标准差(x±s)表示。两组间比较采用独立样本t检验。多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05表示差异具有统计学意义。
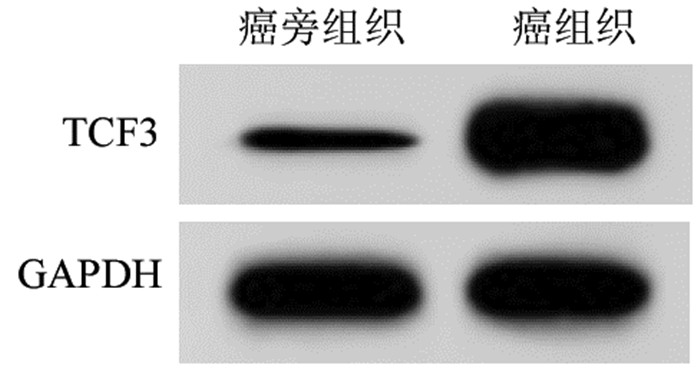
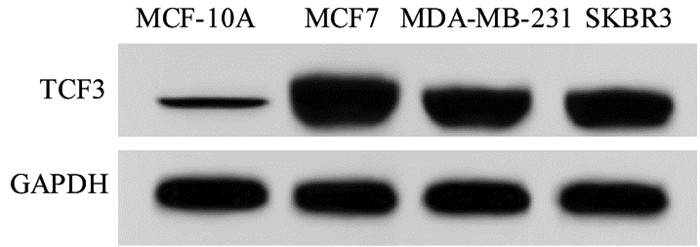
2 结果 2.1 miR-503-5p与TCF3在组织和细胞中的表达与癌旁组织比较,BC组织中miR-503-5p表达水平降低(1.00±0.02 vs. 0.25±0.02),TCF3蛋白表达水平(0.31±0.04 vs. 1.57±0.11)升高(P<0.05),见图 1。与MCF-10A细胞比较,MCF7、MDA-MB-231、SKBR3细胞中miR-503-5p表达水平降低,TCF3蛋白表达水平升高,且MCF7细胞中miR-503-5p表达水平最低,TCF3蛋白表达水平最高,因此,选择MCF7细胞进行转染实验,见图 2和表 1。
|
| 图 1 Western blot检测组织中TCF3蛋白表达 Fig. 1 Western blot detection of TCF3 protein expression in tissues |
|
| 图 2 Western blot检测细胞中TCF3蛋白表达 Fig. 2 Western blot analysis of TCF3 protein expression in cells |
与0 μmol/L比较,MCF7细胞增殖抑制率在14、28、56、112、225 μmol/L雪松醇处理下以剂量依赖性的方式(6.14±1.15)%、(12.78±2.10)%、(25.58±2.47)%、(43.64±3.12)%、(56.84±3.28)%显著增加(P<0.05),本研究选取112 μmol/L雪松醇进行后续实验。
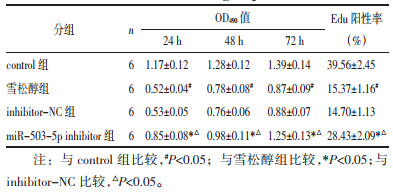
2.3 雪松醇对MCF7细胞中miR-503-5p表达的影响与control组(1.00±0.01)比较,雪松醇组MCF7细胞中miR-503-5p表达水平(1.87±0.15)显著升高(P<0.05);与雪松醇组、inhibitor-NC(1.85±0.12)比较,miR-503-5p inhibitor组MCF7细胞中miR-503-5p表达水平(0.15±0.01)显著降低(n=6,P<0.05)。
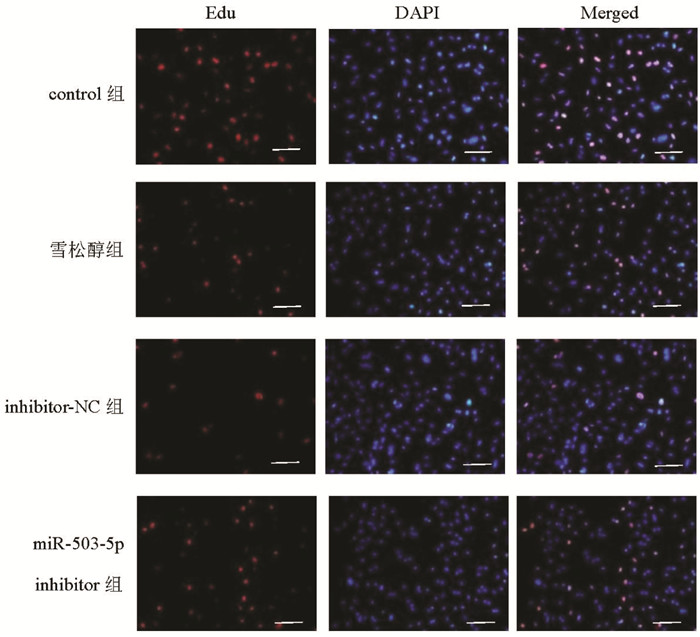
2.4 雪松醇对各组MCF7细胞增殖的影响与control组比较,雪松醇组MCF7细胞在24、48、72 h的OD490值和Edu阳性细胞率显著降低(P<0.05);与雪松醇组、inhibitor-NC比较,miR-503-5p inhibitor组MCF7细胞在24、48、72 h的OD490值和Edu阳性细胞率显著升高(P<0.05),见图 3和表 2。
|
| 图 3 Edu染色观察各组细胞增殖(比例尺=50 μm) Fig. 3 Observation of cell proliferation by Edu staining in each group(bar=50 μm) |
|
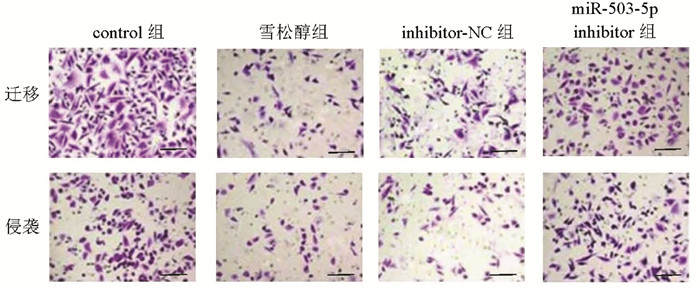
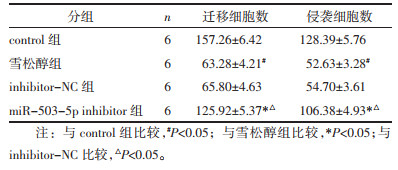
与control组比较,雪松醇组MCF7细胞迁移与侵袭数显著降低(P<0.05);与雪松醇组、inhibitor-NC比较,miR-503-5p inhibitor组MCF7细胞迁移与侵袭数显著升高(P<0.05),见图 4和表 3。
|
| 图 4 Transwell检测各组MCF7细胞迁移与侵袭(比例尺=100 μm) Fig. 4 Migration and invasion of MCF7 cells detected by Transwell in each group(bar=100 μm) |
| 个 | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
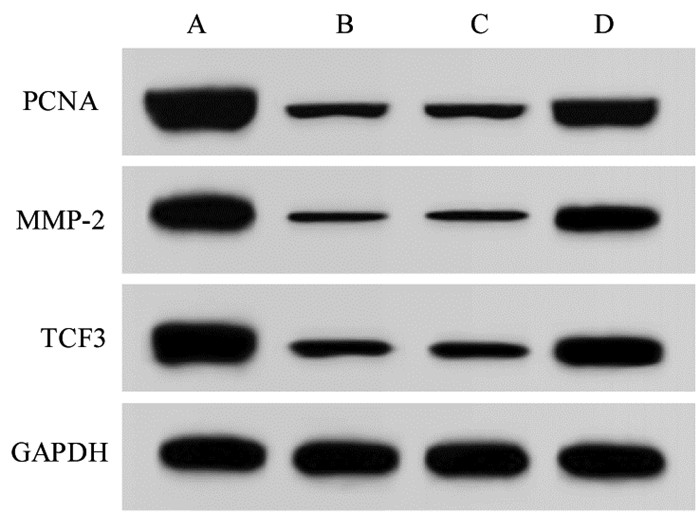
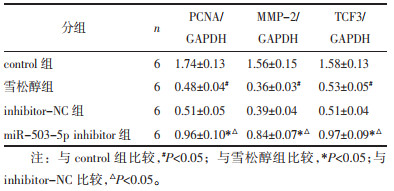
与control组比较,雪松醇组MCF7细胞中PCNA、MMP-2、TCF3蛋白表达水平显著降低(P<0.05);与雪松醇组、inhibitor-NC比较,miR-503-5p inhibitor组MCF7细胞中PCNA、MMP-2、TCF3蛋白表达水平显著升高(P<0.05),见图 5和表 4。
|
|
注:A. control组;B. 雪松醇组;C. inhibitor-NC组;D. miR-503-5p inhibitor组。 图 5 Western blot检测MCF7细胞中PCNA、MMP-2、TCF3蛋白表达 Fig. 5 Expression of the PCNA, MMP-2 and TCF3 in MCF7 cells detected by Western blot |
|
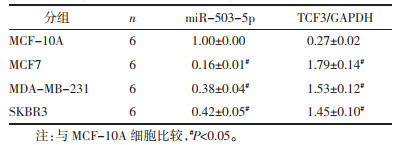
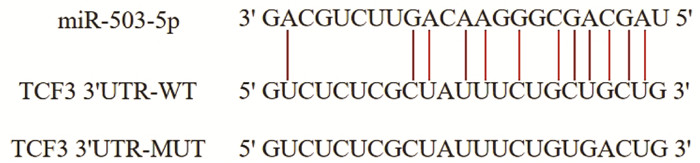
经starbase在线预测显示,miR-503-5p与TCF3基因有靶向结合位点,见图 6。与mimic-NC和TCF3-WT共转染组比较,miR-503-5p mimic和TCF3-WT共转染组的荧光素酶活性降低(P<0.05);与mimic-NC和TCF3-MUT共转染组比较,miR-503-5p mimic和TCF3-MUT共转染组荧光素酶活性变化无统计学意义(P>0.05),见表 5。
|
| 图 6 miR-503-5p与TCF3的结合位点与突变位点 Fig. 6 Binding sites and mutation sites of miR-503-5p and TCF3 |
小鼠荷瘤实验结果表明,与对照组比较,雪松醇组小鼠移植瘤质量与体积明显下降(P<0.05);qRT-PCR结果显示,雪松醇组移植瘤中miR-503-5p水平升高(P<0.05);免疫组化检测结果显示,雪松醇组移植瘤中,TCF3、MMP-2蛋白表达水平显著降低(P<0.05),见图 7、8和表 6。

|
| 图 7 各组小鼠剥离的移植瘤 Fig. 7 Transplanted tumors of mice in each group |

|
| 图 8 免疫组化检测移植瘤组织中TCF3、MMP-2蛋白表达(比例尺=100 μm) Fig. 8 Immunohistochemical detection of TCF3 and MMP-2 protein expression in transplanted tumor tissues (bar=100 μm) |

|
BC因其高病死率和发病率而成为女性的主要健康问题,即使使用辅助化疗,转移性BC的30年生存率也低于1%[14]。因此,揭示BC发生的关键分子机制,对于提高BC患者的诊断和治疗水平具有重要意义。
雪松醇因具有良好的抗肿瘤活性而备受关注。雪松醇通过诱导细胞周期停滞和细胞凋亡抑制体内体外结直肠癌、肺癌的生长,被认为是治疗结直肠癌、肺癌的有效药物[5, 7]。Chang等[6]研究发现,雪松醇通过诱导细胞内活性氧(ROS)生成、触发DNA损伤和阻断雄激素受体的核易位,有效抑制胶质母细胞瘤细胞生长。此外研究发现,雪松醇通过阻断丝苏氨酸蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)途径降低胶质母细胞瘤对替莫唑胺的耐药性,通过质膜脂质筏的失稳增强癌细胞化疗的敏感性[6, 15]。本研究发现,雪松醇降低MCF-7细胞OD490值、Edu阳性细胞率、迁移与侵袭数、PCNA、MMP-2蛋白表达水平和移植瘤质量。提示,雪松醇可抑制MCF7细胞增殖、迁移和侵袭,具有抗BC的作用。
越来越多的证据表明miRNAs可作为癌症的诊断标志物和治疗靶点[16]。miR-503-5p在多数肿瘤中呈低表达,发挥抗癌基因的作用,如在胃癌、结肠癌、卵巢癌、胰腺癌中低表达,过表达miR-503-5p后可抑制肿瘤细胞的生长、迁移和侵袭等恶性行为。本研究发现,miR-503-5p在BC组织和细胞中低表达,雪松醇可促进miR-503-5p在MCF7细胞和移植瘤中的表达,并且抑制miR-503-5p表达后,可逆转抑制雪松醇对MCF7细胞增殖、迁移和侵袭的抑制作用。推测雪松醇可能通过上调miR-503-5p表达,从而抑制BC细胞增殖、迁移和侵袭。
miRNA通过与靶mRNA内的互补序列进行碱基配对,在基因表达的转录后调控中发挥作用。经生物信息学分析显示,miR-503-5p与TCF3之间存在结合位点,双荧光素酶报告基因实验证实了miR-503-5p与TCF3之间存在靶向关系。TCF3是Wnt通路相关T细胞特异性转录因子/淋巴增强因子(TCF/LEF)转录因子家族的成员。研究表明,TCF3在包括BC在内的多种肿瘤中发挥促癌作用[13]。然而,致癌驱动因素TCF3如何影响BC进展的分子机制尚未完全阐明。本研究发现,TCF3蛋白在BC组织中和细胞中高表达,雪松醇可下调TCF3在MCF7细胞和移植瘤中的表达,而抑制miR-503-5p表达后,TCF3蛋白表达水平升高,减弱了雪松醇对TCF3蛋白表达的抑制作用,证实了雪松醇可能通过上调miR-503-5p表达来下调TCF3蛋白表达,进而抑制BC细胞增殖、迁移和侵袭。
综上所述,雪松醇能抑制BC细胞增殖、迁移和侵袭,其机制可能与调控miR-503-5p/TCF3轴有关,miR-503-5p/TCF3轴可能成为治疗BC的新靶点,然而本研究尚存在不足之处,仅验证了雪松醇调控miR-503-5p/TCF3轴对BC细胞增殖、迁移和侵袭的作用,而未对其他靶点和通路进行验证,后续需要进一步开展研究。
| [1] |
THORAT M A, BALASUBRAMANIAN R. Breast cancer prevention in high-risk women[J]. Best Practice & Research Clinical Obstetrics & Gynaecology, 2020, 65: 18-31. |
| [2] |
TABOR S, SZOSTAKOWSKA-RODZOS M, FABISIEWICZ A, et al. How to predict metastasis in luminal breast cancer? current solutions and future prospects[J]. International Journal of Molecular Sciences, 2020, 21(21): 8415. DOI:10.3390/ijms21218415 |
| [3] |
ABOTALEB M, KUBATKA P, CAPRNDA M, et al. Chemotherapeutic agents for the treatment of metastatic breast cancer: an update[J]. Biomedicine & Pharmacotherapy, 2018, 101: 458-477. |
| [4] |
GARCÍA-ARANDA M, REDONDO M. Immunotherapy: a challenge of breast cancer treatment[J]. Cancers, 2019, 11(12): 1822. DOI:10.3390/cancers11121822 |
| [5] |
CHIEN J H, CHANG K F, LEE S C, et al. Cedrol restricts the growth of colorectal cancer in vitro and in vivo by inducing cell cycle arrest and caspase-dependent apoptotic cell death[J]. International Journal of Medical Sciences, 2022, 19(13): 1953-1964. DOI:10.7150/ijms.77719 |
| [6] |
CHANG K F, HUANG X F, CHANG J T, et al. Cedrol suppresses glioblastoma progression by triggering DNA damage and blocking nuclear translocation of the androgen receptor[J]. Cancer Letters, 2020, 495: 180-190. DOI:10.1016/j.canlet.2020.09.007 |
| [7] |
YUN H J, JEOUNG D J, JIN S, et al. Induction of cell cycle arrest, apoptosis, and reducing the expression of MCM proteins in human lung carcinoma A549 cells by cedrol, isolated from Juniperus chinensis[J]. Journal of Microbiology and Biotechnology, 2022, 32(7): 918-926. DOI:10.4014/jmb.2205.05012 |
| [8] |
JIN S, PARK J H, YUN H J, et al. Cedrol, a sesquiterpene isolated from Juniperus chinensis, inhibits human colorectal tumor growth associated through downregulation of minichromosome maintenance proteins[J]. Journal of Cancer Prevention, 2022, 27(4): 221-228. DOI:10.15430/JCP.2022.27.4.221 |
| [9] |
LIU Z H, ZHOU Y, LIANG G H, et al. Circular RNA hsa_circ_ 001783 regulates breast cancer progression via sponging miR-200c-3p[J]. Cell Death & Disease, 2019, 10: 55. |
| [10] |
SHEN S J, SONG Y, ZHAO B, et al. Cancer-derived exosomal miR-7641 promotes breast cancer progression and metastasis[J]. Cell Communication and Signaling: CCS, 2021, 19(1): 20. DOI:10.1186/s12964-020-00700-z |
| [11] |
CAI X P, NIE J Y, CHEN L D, et al. Circ_0000267 promotes gastric cancer progression via sponging miR-503-5p and regulating HMGA2 expression[J]. Molecular Genetics & Genomic Medicine, 2020, 8(2): e1093. |
| [12] |
WEI L L, SUN C N, ZHANG Y T, et al. miR-503-5p inhibits colon cancer tumorigenesis, angiogenesis, and lymphangiogenesis by directly downregulating VEGF-A[J]. Gene Therapy, 2022, 29(1/2): 28-40. |
| [13] |
JIA H Y, WU D, ZHANG Z R, et al. TCF3-activated FAM201A enhances cell proliferation and invasion via miR-186-5p/TNKS1BP1 axis in triple-negative breast cancer[J]. Bioorganic Chemistry, 2020, 104: 104301. DOI:10.1016/j.bioorg.2020.104301 |
| [14] |
RIGGIO A I, VARLEY K E, WELM A L. The lingering mysteries of metastatic recurrence in breast cancer[J]. British Journal of Cancer, 2021, 124(1): 13-26. |
| [15] |
MISHRA S K, BAE Y S, LEE Y M, et al. Sesquiterpene alcohol cedrol chemosensitizes human cancer cells and suppresses cell proliferation by destabilizing plasma membrane lipid rafts[J]. Frontiers in Cell and Developmental Biology, 2021, 8: 571676. |
| [16] |
UZUNER E, ULU G T, GÜRLER S B, et al. The role of MiRNA in cancer: pathogenesis, diagnosis, and treatment[J]. Methods in Molecular Biology, 2022, 2257: 375-422. |
 2023, Vol. 40
2023, Vol. 40