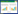文章信息
- 席加秋, 邵玉泽, 王中琳.
- XI Jiaqiu, SHAO Yuze, WANG Zhonglin.
- 基于网络药理学探讨化浊行血汤抗高脂血症的作用机制
- Exploration of the mechanism of Huazhuo Xingxue Decoction against hyperlipidemia based on network pharmacology
- 天津中医药, 2023, 40(9): 1190-1199
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(9): 1190-1199
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.09.17
-
文章历史
- 收稿日期: 2023-05-24
2. 山东中医药大学附属医院,济南 250355
高脂血症以总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)升高,和/或高密度脂蛋白胆固醇(HDL-C)降低为特征[1]。高脂血症能够引发复杂的血管病变。在经过血管内皮损伤、脂质沉积、平滑肌细胞增生等病理环节后,血管壁逐渐增厚、狭窄,失去其应有弹性,引发高血压、冠心病、心肌梗死、脑梗死等多种心脑血管疾病。心脑血管疾病造成了沉重的社会经济负担,成为人类主要死亡原因之一[2-3]。因此,对高脂血症进行有效干预是防治心脑血管疾病的重要举措。目前,他汀类药物被推荐为一线降脂药[4]。但不容忽视的是,越来越多的证据表明,他汀药物在降脂的同时能够引发肌痛、横纹肌溶解、肝肾毒性等严重不良反应[5-6]。鉴于目前治疗方法的局限性,寻找天然、有效的补充或替代策略逐渐成为治疗高脂血症的关注重点。
王新陆教授在《脑血辨证》一书中首次提出了“血浊”的概念。血浊指血液受各种因素影响,失去其清纯状态,或丧失其循行规律,影响脏腑气机的病理现象,与高脂血症的特点相契合[7-8]。王新陆教授认为,运气不同,古今异轨,现代疾病谱的构成已由过去感染、营养不良等单因素疾病为主转变为以机体自身代谢和调控失常导致的慢性非传染性疾病为主。后者也被称为“现代生活方式病”,由精神压力增加,过食肥甘厚味,劳逸失度等因素诱发,与当今物质文明飞速发展息息相关。“血浊”正是在这一新的时代背景下应运而生的概念。对血浊状态的干预能够将心脑血管疾病的治疗方向前移到“治未病”层面,若及渴而穿井,斗而铸锥,则治疗难度增大,且易出现后遗症状。因此,在血浊学术理论的指导下,王新陆教授创制了治疗高脂血症的化浊行血汤。化浊行血汤由荷叶、焦山楂、决明子、赤芍、酒大黄、路路通、虎杖、何首乌、水蛭粉9味中药组成。方中荷叶、决明子、焦山楂功善清化浊邪而无耗血伤阴之弊,共为君药。水蛭粉、酒大黄、赤芍通行血脉,善消坚积,助君药清化血浊,共为臣药。路路通利水除浊,兼通经活络,虎杖活血化浊,兼清血浊内郁之热,何首乌消脂通便,兼补浊邪内耗之阴血,共为佐药。诸药合用,共奏化浊消脂,行血畅血之功。前期临床研究已证明,化浊行血汤能够有效降低高脂血症患者的血脂水平,且未出现明显的毒副作用[9]。目前,化浊行血汤抗高脂血症的作用机制尚未阐明,故本研究拟借助网络药理学方法对其潜在机制进行科学预测,并对预测结果进行实验验证,以期为深入探究化浊行血汤抗高脂血症的作用机制提供基础实验依据。
1 材料与方法 1.1 实验动物SPF级健康雄性SD大鼠60只,6周龄,体质量(180±20)g,购于济南朋悦实验动物有限公司,实验动物合格证号:SCXK(鲁)20190003。SD大鼠饲养于山东中医药大学附属医院动物实验中心,室内保持12 h昼夜节律,温度(25±2)℃,自由摄食饮水。本研究通过山东中医药大学附属医院伦理委员会审批,审查编号:AWE-2019-042。
1.2 药物及试剂化浊行血汤:荷叶15 g,焦山楂10 g,决明子15 g,赤芍10 g,酒大黄10 g,路路通10 g,虎杖10 g,何首乌10 g,水蛭粉3 g,以上药物浸泡30 min,武火煮沸,文火煎煮20 min后取滤液,加水继煮15 min后再取滤液,两次滤液合并,浓缩成质量浓度为4 g/mL的化浊行血汤水煎液,存于4 ℃冰箱备用(山东省中医院药剂科),辛伐他汀片20 mg/片(杭州默沙东制药有限公司),高脂饲料:猪油10%,蛋黄粉10%,胆固醇1%,胆酸盐0.2%,基础饲料78.8%(山东百朋生物科技有限公司),TG、TC、LDL-C、HDL-C试剂盒(山东赛恩斯生物科技有限公司),苏木精-伊红(HE)染色试剂盒(山东思科捷生物技术有限公司),TaKaRa MiniBEST Universal RNA Extraction Kit(TaKaRa,No.9767),Evo M-MLV RT Kit with gDNA Clean for qPCRⅡ(ACCURATE,No.AG11711),SYBR Green Premix Pro TaqHS qPCR Kit(ACCURATE,No.AG11701)。
1.3 实验仪器轮转式切片机(Leica,德国),荧光倒置显微镜(Leica,德国),PRONTO EVOLUTION全自动生化分析仪(BPC Bio Sed,意大利),Nano Drop 2000分光光度计(Thermo Fisher Scientific,美国),Light Cycler 480Ⅱ Real-time PCR仪(Roche,瑞士)。
1.4 动物分组与给药适应性喂养1周后,按体质量随机分为对照组、模型组、化浊行血汤高剂量组、化浊行血汤中剂量组、化浊行血汤低剂量组、辛伐他汀组,每组10只。对照组予普通饲料喂养,其余组给予高脂饲料喂养。8周后目内眦静脉丛取血,测得受试动物血中TC、TG、LDL-C显著升高,确定高脂血症模型复制成功。根据《药理实验方法学》中的不同种类受试对象剂量换算方法,查询人与大鼠间剂量换算系数及校正系数,计算得出180 g大鼠每日用药剂量是标准体质量成人每日用药剂量的5.8倍[10],故化浊行血汤高、中、低剂量组每日给药剂量分别为18、9、4.5 g/kg,辛伐他汀组每日给药剂量为4 mg/kg,对照组和模型组予等体积生理盐水5 mL/kg。连续灌胃8周,每日1次。
1.5 体质量、肝湿质量、肝指数测定每两周测定1次大鼠体质量。末次给药后,禁食不禁水12 h,予40 mg/kg戊巴比妥钠腹腔注射麻醉。腹主动脉取血8 mL,并在冰上迅速分离肝组织,使用预冷磷酸盐缓冲溶液(PBS)冲洗,滤纸吸取多余水分,称取肝脏湿质量。称量完毕后分装速冻,存于-80 ℃冰箱备用。肝指数=肝湿质量/体质量×100%。
1.6 HE染色取部分分离的肝组织于4%多聚甲醛中固定,脱水包埋后将组织切片,厚度为5 μm,对切片进行脱蜡水化处理,进行HE染色,脱水封片,光镜下观察肝脏的组织学变化。
1.7 血清生化指标检测采用全自动生化分析仪,严格按试剂盒说明检测血清TC、TG、LDL-C和HDL-C含量。
1.8 化浊行血汤成分筛选及靶点预测应用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)及中药分子机制生物信息分析工具数据库(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm)预测荷叶、山楂、决明子、赤芍、大黄、水蛭、路路通、虎杖、何首乌九味药物的化学成分及潜在靶点。TCMSP数据库筛选条件设置为口服生物利用度OB≥30%,且类药性DL≥0.18;BATMAN-TCM数据库筛选条件设置为截断值≥20,P < 0.05。应用通用蛋白质资源库(UniProt,https://www.uniprot.org)对靶点蛋白名进行规范化处理。
1.9 高脂血症靶点预测以“高脂血症”为检索词,应用药物银行(Drugbank,https://www.drugbank.ca)、疾病相关基因与突变位点数据库(DisGeNET,https://www.disgenet.org)、比较毒理基因组数据库(CTD,http://ctdbase.org)、人类孟德尔遗传数据库(OMIM,https://omim.org)及遗传关联数据库(GAD,https://geneticassociationdb.nih.gov)查找高脂血症相关靶点。应用UniProt数据库对靶点蛋白名进行规范化处理。
1.10 化浊行血汤抗高脂血症的成分-靶点网络及蛋白互作(PPI)网络构建首先,借助TBtools v0.5确定化浊行血汤与高脂血症的交集靶点,交集靶点即为化浊行血汤抗高脂血症的潜在靶点。查找交集靶点所对应化浊行血汤的活性成分,构建化浊行血汤抗高脂血症的成分-靶点网络。将交集靶点导入STRING数据库(https://string-db.org/)构建PPI网络,并借助Cytoscape3.7.2插件cytoHubba拓扑化浊行血汤抗高脂血症的关键靶点。
1.11 基因本体(GO)与京都基因与基因组百科全书(KEGG)富集分析将化浊行血汤抗高脂血症的交集靶点导入基因注释形象集成数据库(DAVID,https://david.ncifcrf.gov),设置背景基因为“Homo sapiens”,P < 0.05。利用R语言工具包绘制生物过程、细胞组分、分子功能条形图及通路高级气泡图。
1.12 RT-PCR检测对肝组织样本使用液氮研磨,使用Buffer RL进行裂解,按说明书要求提取总RNA,测定总RNA浓度及完整性。将总RNA按说明书要求,使用M-MLV RTase Enzyme MIX逆转录为cDNA。将cDNA按说明书要求,使用2×SYBR® Green Pro Taq HS Premix进行PCR扩增。反应条件:预变性95 ℃ 30 s(1个循环);定量分析95 ℃ 5 s,60 ℃ 30 s(40个循环);溶解曲线采集95 ℃ 5 s,60 ℃ 60 s,95 ℃酶瞬间灭活(1个循环);冷却40 ℃ 30 s(1个循环)。以GAPDH为内参基因,采用2-ΔΔCt法计算目的基因的相对表达量。引物由山东赛恩斯生物科技有限公司设计合成,引物序列见表 1。
应用SPSS 23.0进行统计分析。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 化浊行血汤对高脂血症大鼠体质量、肝湿质量、肝指数的影响各组大鼠间体质量差异无统计学意义(P > 0.05)。与对照组比较,模型组大鼠肝湿质量和肝指数升高(P < 0.01)。与模型组比较,辛伐他汀与化浊行血汤各剂量组均能降低高脂血症大鼠肝湿质量和肝指数(P < 0.05或P < 0.01)。见表 2。
|
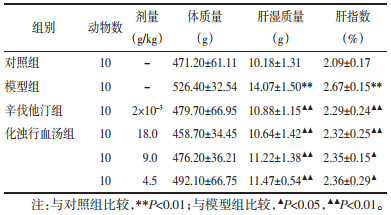
与对照组比较,模型组大鼠TC,TG及LDL-C水平升高(P < 0.01),HDL-C水平差异无统计学意义(P > 0.05)。与模型组比较,辛伐他汀与化浊行血汤各剂量组均能降低高脂血症大鼠TC,TG及LDL-C水平,高中剂量化浊行血汤能够升高大鼠HDL-C水平(P < 0.05或P < 0.01)。以上结果表明高中剂量化浊行血汤的降脂作用与辛伐他汀疗效相当(表 3)。
|
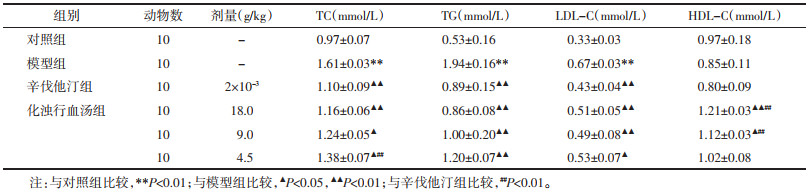
HE染色结果显示,与对照组相比,模型组大鼠肝小叶结构紊乱,肝窦缺失,肝细胞肿胀变性,内部可见脂肪滴沉积,部分细胞核因脂滴挤压而发生偏位。与模型组相比,化浊行血汤各剂量组和辛伐他汀组肝脏组织结构排列较整齐,脂肪变性明显减轻(图 1)。
|
| 注:A.对照组,B.模型组,C.化浊行血汤高剂量组,D.化浊行血汤中剂量组,E.化浊行血汤低剂量组,F.辛伐他汀组。 图 1 化浊行血汤对高脂血症大鼠肝脏病理形态学的影响(HE,×400) Fig. 1 Effect of Huazhuo Xingxue Decoction on pathological and morphological changes of liver in hyperlipidemia rats (HE, ×400) |
化浊行血汤各中药符合TCMSP数据库及BATMAN-TCM数据库筛选条件的化学成分及相关靶点数目如下:山楂2个化学成分涉及25个作用靶点,荷叶15个化学成分涉及430个作用靶点,决明子14个化学成分涉及231个作用靶点,赤芍29个化学成分涉及218个作用靶点,大黄16个化学成分涉及183个作用靶点,水蛭1个化学成分涉及171个作用靶点,虎杖10个化学成分涉及294个作用靶点,路路通4个化学成分涉及110个作用靶点,何首乌1个化学成分涉及14个作用靶点。经去重处理后,化浊行血汤全方共涉及56种化学成分,327个作用靶点。
2.5 高脂血症靶点预测在各疾病数据库分别检索得到高脂血症靶点数目如下:Drugbank29个、DisGeNET19个、CTD33个、OMIM50个、GAD72个。经去重处理后,共获取148个高脂血症作用靶点。
2.6 化浊行血汤抗高脂血症的成分-靶点网络构建构建韦恩图获取化浊行血汤与高脂血症的交集靶点37个(见OSID标识码),交集靶点即为化浊行血汤抗高脂血症的潜在治疗靶点。37个交集靶点涉及化浊行血汤37种生物活性成分。应用Cytoscape3.7.2构建化浊行血汤抗高脂血症的成分-靶点网络(见OSID标识码)。对该网络进行拓扑属性分析,菱形节点代表中药成分,degree值越大,菱形节点越大。根据degree值可知quercetin(槲皮素)的潜在靶点最多,其次为Crocetin(藏花酸)、kaempferol(山柰酚)、Stigmasterol(豆甾醇)、Physovenine(毒扁豆次碱)等(表 4)。说明上述化学成分为化浊行血汤抗高脂血症的关键成分。
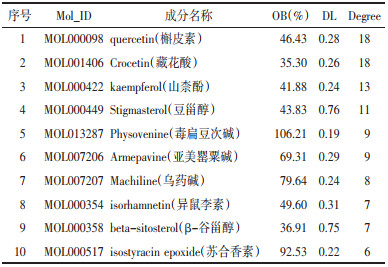
|
将37个交集靶点导入STRING数据库构建交集靶点的PPI网络(图 2),该网络包括36个节点和157条边。借助Cytoscape3.7.2插件cytoHubba获取排名前15的关键靶点,并构建关键靶点的PPI网络,该网络包括15个节点和77条边(图 2)。15个关键靶点如下:胰岛素(INS)、三磷酸腺苷结合盒转运蛋白A1(ABCA1)、肿瘤坏死因子(TNF)、血管细胞黏附因子1(VCAM1)、内皮型一氧化氮合酶(NOS3)、氧磷酶1(PON1)、三磷酸腺苷结合盒转运蛋白G1(ABCG1)、过氧化物酶体增殖物激活受体α(PPARA)、过氧化物酶体增殖物激活受体γ(PPARG)、脂联素(ADIPOQ)、肝X受体α(NR1H3)、微粒体甘油三酸酯转运蛋白(MTTP)、乙酰辅酶A羧化酶(ACACA)、E选择素(SELE)、载脂蛋白A2(APOA2)。
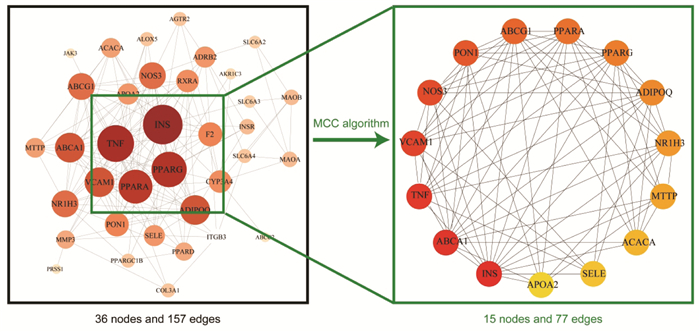
|
| 注:黑色方框内为化浊行血汤抗高脂血症交集靶点的PPI网络,绿色方框内为化浊行血汤抗高脂血症关键靶点的PPI网络。 图 2 化浊行血汤抗高脂血症靶点蛋白的PPI网络 Fig. 2 PPI network of Huazhuo Xingxue Decoction in the treatment of hyperlipidemia |
将37个交集靶点导入David数据库进行GO与KEGG富集分析,结果表明化浊行血汤抗高脂血症涉及152个生物过程、23个细胞组分、33种分子功能、22条作用通路。对P值排名前10的GO条目及全部KEGG通路进行可视化处理(图 3、图 4)。其中,排名前3的生物过程:GO:0010745 negative regulation of macrophage derived foam cell differentiation(对巨噬细胞来源的泡沫细胞分化的负调控)、GO:0010887 negative regulation of cholesterol storage(对胆固醇储存的负调控)、GO:0010875 positive regulation of cholesterol efflux(对胆固醇外流的正调控);细胞组分:GO:0043235 receptor complex(受体复合物)、GO:0045121 membrane raft(膜筏)、GO:0034366 spherical high-density lipoprotein particle(球形高密度脂蛋白颗粒);分子功能:GO:0004879 RNA polymeraseⅡtranscription factor activity,ligand-activated sequence-specific DNA binding(RNA聚合酶Ⅱ转录因子活性,配体激活的序列特异性DNA结合)、GO:0003707 steroid hormone receptor activity(类固醇激素受体活性)、GO:0008131 primary amine oxidase activity(初级胺氧化酶活性);作用通路为:hsa03320:PPAR signaling pathway(PPAR信号通路)、hsa04931:Insulin resistance(胰岛素抵抗)、hsa04932:Non-alcoholic fatty liver disease(非酒精性脂肪肝)。
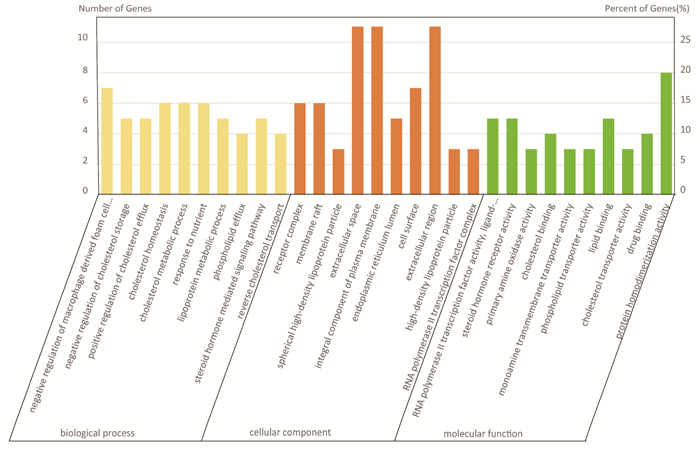
|
| 图 3 化浊行血汤抗高脂血症的GO功能富集分析 Fig. 3 GO functional annotation enrichment analyses of Huazhuo Xingxue Decoction in the treatment of hyperlipidemia |
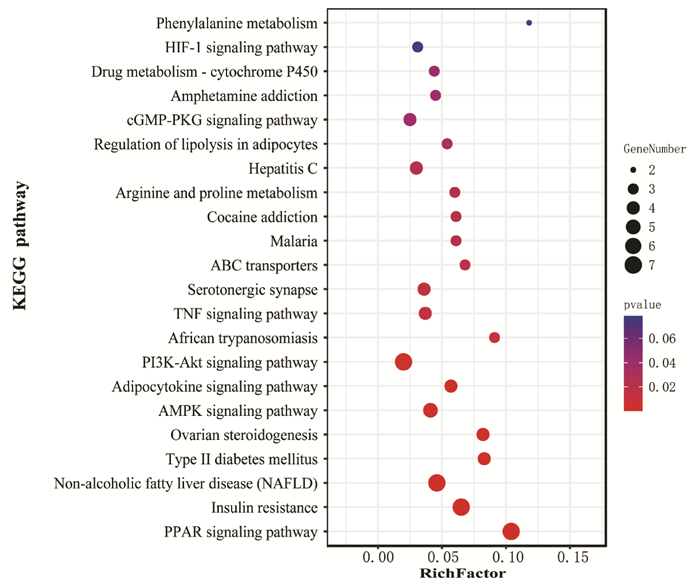
|
| 图 4 化浊行血汤抗高脂血症的KEGG通路富集分析 Fig. 4 KEGG pathway enrichment analyses of Huazhuo Xingxue Decoction in the treatment of hyperlipidemia |
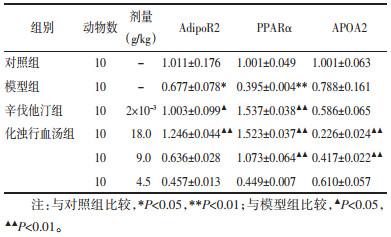
根据富集分析结果,PPAR信号通路是富集程度最高的通路,ADIPOQ、APOA2、PPARα、PPARγ、NR1H3、PPARD、RXRA是富集在该通路上的信号分子,其中ADIPOQ、APOA2、PPARα、PPARγ、NR1H3是“2.4化浊行血汤抗高脂血症的PPI网络构建”中鉴定出的关键靶点,因此,初步筛选出以上5个靶点为后续的研究指标。通过查阅相关文献,ADIPOQ发挥其生物学作用主要是通过与其受体结合而实现[11],而AdipoR2是肝脏中ADIPOQ的主要受体[12]。研究证实,AdipoR2为PPARα上游信号分子,APOA2为PPARα下游信号分子[12-13],故本研究最终选取AdipoR2、PPARα、APOA2进行实验验证。与对照组比较,模型组大鼠AdipoR2、PPARα mRNA表达下调(P < 0.05或P < 0.01),APOA2 mRNA与对照组间的表达差异无统计学意义(P > 0.05)。与模型组比较,化浊行血汤高剂量组及辛伐他汀组AdipoR2 mRNA表达上调(P < 0.05或P < 0.01),化浊行血汤高中剂量组及辛伐他汀组PPARα mRNA表达上调(P < 0.01),化浊行血汤高中剂量组APOA2 mRNA表达下调(P < 0.01),见表 5。表明化浊行血汤改善脂代谢紊乱,减轻脂质沉积的作用机制可能与干预AdipoR2/PPARα/APOA2信号通路相关。
|
化浊行血汤是王新陆教授诊病疏方五十余载,基于血浊学术理论创制的治疗高脂血症的经验方。方中荷叶清香升散,利湿化浊;决明子“利五脏,除肝家热”,通便祛浊;山楂入血分,善消肉食油腻之积,消积去浊,三药合用,化浊邪,行血脉,共为君药。赤芍清热凉血,活血化瘀;大黄善入血分,泄下攻积;水蛭“性迟缓善入,迟缓则生血不伤,善入则坚积易破”,三药寓“见血之浊,知血当滞,当先行血”之意,通行血脉助君化浊,共为臣药。虎杖清热利湿化浊,尤善血浊郁而生热者;路路通“通行十二经穴”,引君臣药直达病所;何首乌补肝肾、益精血,防泻浊之品耗伤营阴,3味药共为佐药。9味药相伍,共奏化浊行血之功。
本研究借助网络药理学方法,筛选得到槲皮素、藏花酸、山柰酚、豆甾醇等是化浊行血汤抗高脂血症的关键活性成分。作为一种天然的黄酮类化合物,槲皮素具有确切的降脂作用[14]。研究表明,槲皮素能够通过上调乙酰辅酶A氧化酶(ACO)、乙酰辅酶A酰基转移酶(ACAT)等脂肪酸氧化相关基因的表达而促进脂质分解代谢,并能通过抑制固醇调节元件结合蛋白1c(SREBP1c)、脂肪酸合酶(FAS)、羟甲基戊二酰辅酶A还原酶(HMGCR)等脂肪合成相关基因的表达而减少脂质的沉积[15-16]。藏花酸,又称西红花酸。有研究表明西红花酸能够降低高脂血症动物模型的TC及TG含量,其可能机制与选择性抑制胰脂肪酶活性有关[17]。目前,关于山奈酚抗炎的作用特性研究较多。近年来,研究者逐渐关注到了山奈酚在调节脂代谢方面的作用。Alkhalidy等[18]研究发现山奈酚能够促进葡萄糖转运蛋白4(Glut4)和腺苷酸活化蛋白激酶(AMPK)的表达,参与调节脂肪分解,改善胰岛素敏感性和防止胰腺β细胞功能障碍。豆甾醇则被证实能够抑制TC的吸收,减少内源性TC的合成[19-20]。
网络药理学结果显示,PPAR信号通路为富集程度最高的通路。因此,笔者选择富集在PPAR信号通路上的关键信号分子ADIPOQ、PPARα、APOA2进行实验验证。ADIPOQ是一种由脂肪细胞分泌的内源性生物多肽,能够参与脂肪酸氧化、葡萄糖摄取和糖异生等多种生物过程,调节机体能量代谢[21],而ADIPOQ发挥其生物效应主要是通过与ADIPOQ受体结合而实现[11]。因此,对ADIPOQ受体表达情况的研究有助于更好地了解高脂血症大鼠脂代谢紊乱的病理机制[22]。AdipoR2是ADIPOQ受体之一,主要表达于肝脏组织[12]。与经典的7层跨膜蛋白不同,AdipoR2的羧基端位于细胞膜外,可与ADIPOQ结合;氨基端位于细胞膜内,可与信号接收蛋白结合[23-24]。当AdipoR2与ADIPOQ结合,可以促进脂肪酸β氧化,改善脂代谢紊乱;同时,AdipoR2又能与膜内的PPARα信号分子结合,从而激活PPARα信号通路[12]。PPARs是受配体调节的转录因子,能够被内源性脂肪酸及其代谢衍生物激活[25],在细胞的信号转导过程中发挥至关重要的作用。PPARα是PPARs家族中的一员,在维持肝脏脂肪酸代谢稳态中扮演重要角色[26]。脂肪酸的氧化大部分发生在线粒体中,其他部分则是在过氧化物酶体中降解[27]。研究证明,激活的PPARα能够上调线粒体中电子传递链的组分,增加肝脏过氧化物酶体的丰度,从而能够促进脂肪酸的氧化利用[28-29]。此外,激活的PPARα能够与饱和及不饱和脂肪酸结合,增加其下游脂肪酸氧化基因的表达。APOA2是PPARα的下游靶基因之一,也是HDL的主要成分,在指导脂代谢方面发挥重要作用[13, 30]。HDL颗粒主要由载脂蛋白、胆固醇、磷脂和少量脂肪酸组成。其中,组成HDL颗粒的载脂蛋白主要是APOA1和APOA2,分别占HDL总蛋白成分的70%和20%[31-32]。APOA1能够与磷脂和非酯化游离胆固醇关联,在ABCA1的介导下形成前β-HDL,再经卵磷脂-胆固醇酰基转换酶(LCAT)的酯化,使游离胆固醇转化为胆固醇酯,形成成熟的HDL[33-34]。诱导表达的APOA1能够增加循环血液中HDL的水平,从而将外周组织中的TC转运到肝脏,最终以胆汁酸的形式排泄。这一过程又被称为“胆固醇逆向转运”(RCT)[35]。通过RCT过程能够实现机体多余TC的清除,减少TC在动脉壁的沉积,从而改善血脂紊乱,发挥心脑血管保护作用。HDL因此被称为“血管清道夫”[36]。APOA1空间构象的改变与HDL结构重塑和功能实现密切相关。目前虽然关于APOA2的研究较少,但是已有研究表明APOA2参与对APOA1空间构象的调节,导致APOA1依赖性eNOS磷酸化减弱,NO生成减少[37-38]。因此,APOA2含量变化将直接或间接影响HDL清除TC的能力,造成内皮功能紊乱[39]。
通过网络药理学预测,化浊行血汤抗高脂血症的作用机制可能为通过槲皮素、藏花酸、山柰酚、豆甾醇等生物活性成分对关键靶点INS、ABCA1、TNF、VCAM1、NOS3、PON1、ABCG1、PPARA、PPARG、ADIPOQ、NR1H3、MTTP、ACACA、SELE、APOA2等进行调节,通过RNA聚合酶Ⅱ转录因子活性、类固醇激素受体活性、初级胺氧化酶活性等分子功能,在受体复合物、膜筏、球形高密度脂蛋白颗粒等细胞组分中参与对巨噬细胞来源的泡沫细胞分化的负调控、对胆固醇储存的负调控、对胆固醇外流的正调控等生物过程,以对PPAR、AMPK、PI3K-Akt等信号通路进行干预,从而发挥改善脂代谢紊乱,减轻脂质沉积的作用。对网络药理学结果的体内实验验证表明,化浊行血汤能够降低高脂饮食诱导高脂血症大鼠的TC,TG,LDL-C的水平,升高HDL-C的水平,改善高脂血症大鼠的肝脏病理损伤。RT-PCR结果显示化浊行血汤能够上调AdipoR2及PPARα mRNA的表达水平,下调APOA2 mRNA的表达水平,表明化浊行血汤抗高脂血症的机制可能与干预AdipoR2/PPARα/APOA2信号通路相关。本研究借助网络药理学方法,从多成分-多靶点-多通路的角度对化浊行血汤抗高脂血症的机制进行预测和实验验证,为后续深入探究化浊行血汤抗高脂血症的作用机制提供了基础实验依据。
| [1] |
WU Q, ZHANG H, DONG X, et al. UPLC-Q-TOF/MS based metabolomic profiling of serum and urine of hyperlipidemic rats induced by high fat diet[J]. Journal of Pharmaceutical Analysis, 2014, 4(6): 360-367. DOI:10.1016/j.jpha.2014.04.002 |
| [2] |
YANG K L, ZENG L T, GE A Q, et al. Integrating systematic biological and proteomics strategies to explore the pharmacological mechanism of Danshen Yin modified on atherosclerosis[J]. Journal of Cellular and Molecular Medicine, 2020, 24(23): 13876-13898. DOI:10.1111/jcmm.15979 |
| [3] |
LIU H X, GUO W, XIANG S S, et al. The natural course of unruptured intracranial aneurysms in a Chinese cohort: protocol of a multi-center registration study in CIAP[J]. Journal of Translational Medicine, 2019, 17(1): 349. DOI:10.1186/s12967-019-2092-z |
| [4] |
POKHAREL Y, TANG F M, JONES P G, et al. Adoption of the 2013 American college of cardiology/american heart association cholesterol management guideline in cardiology practices nationwide[J]. JAMA Cardiology, 2017, 2(4): 361-369. DOI:10.1001/jamacardio.2016.5922 |
| [5] |
ROGULA S, BŁAŻEJOWSKA E, GĄSECKA A, et al. Inclisiran-silencing the cholesterol, speaking up the prognosis[J]. Journal of Clinical Medicine, 2021, 10(11): 2467. DOI:10.3390/jcm10112467 |
| [6] |
LI T, HU S M, PANG X Y, et al. The marine-derived furanone reduces intracellular lipid accumulation in vitro by targeting LXRα and PPARα[J]. Journal of Cellular and Molecular Medicine, 2020, 24(6): 3384-3398. DOI:10.1111/jcmm.15012 |
| [7] |
王新陆. 脑血辨证——中医理论发展的探索[M]. 北京: 中国医药科技出版社, 2002. WANG X L. Syndrome differentiation of cerebral blood—exploration on the development of TCM theory[M]. Beijing: China Medical Science Press, 2002. |
| [8] |
王新陆. 血浊论[M]. 北京: 中国医药科技出版社, 2016. WANG X L. Theory of blood turbidity[M]. Beijing: China Medical Science Press, 2016. |
| [9] |
席加秋, 王中琳. 化浊行血汤治疗高脂血症30例临床研究[J]. 山东中医药大学学报, 2017, 41(4): 338-340. XI J Q, WANG Z L. Clinical study on Huazhuo Xingxue Decoction in treatment of 30 patients with hyperlipidemia[J]. Journal of Shandong University of Traditional Chinese Medicine, 2017, 41(4): 338-340. DOI:10.16294/j.cnki.1007-659x.2017.04.013 |
| [10] |
魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010. WEI W, WU X M, LI Y J. Experimental methodology of pharmacology[M]. 4th edition. Beijing: People's Medical Publishing House, 2010. |
| [11] |
DE OLIVEIRA PEIXOTO J, SAVOLDI I R, IBELLI A M G, et al. Proximal femoral head transcriptome reveals novel candidate genes related to epiphysiolysis in broiler chickens[J]. BMC Genomics, 2019, 20(1): 1031. DOI:10.1186/s12864-019-6411-9 |
| [12] |
PARK H S, LIM J H, KIM M Y, et al. Resveratrol increases AdipoR1 and AdipoR2 expression in type 2 diabetic nephropathy[J]. Journal of Translational Medicine, 2016, 14(1): 176. DOI:10.1186/s12967-016-0922-9 |
| [13] |
HAN L, SHEN W J, BITTNER S, et al. PPARs: regulators of metabolism and as therapeutic targets in cardiovascular disease. Part Ⅱ: PPAR-β/δ and PPAR-Γ[J]. Future Cardiology, 2017, 13(3): 279-296. DOI:10.2217/fca-2017-0019 |
| [14] |
STROMSNES K, MAS-BARGUES C, GAMBINI J, et al. Protective effects of polyphenols present in Mediterranean diet on endothelial dysfunction[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 2097096. |
| [15] |
JUNG C H, CHO I, AHN J, et al. Quercetin reduces high-fat diet-induced fat accumulation in the liver by regulating lipid metabolism genes[J]. Phytotherapy Research: PTR, 2013, 27(1): 139-143. DOI:10.1002/ptr.4687 |
| [16] |
闫淑霞, 李鲜, 孙崇德, 等. 槲皮素及其糖苷衍生物降糖降脂活性研究进展[J]. 中国中药杂志, 2015, 40(23): 4560-4567. YAN S X, LI X, SUN C D, et al. Hypoglycemic and hypolipidemic effects of quercetin and its glycosides[J]. China Journal of Chinese Materia Medica, 2015, 40(23): 4560-4567. |
| [17] |
董婉茹, 刘洪毓, 丁雅光, 等. 栀子在治疗肝脏疾病中的研究进展[J]. 中国实验方剂学杂志, 2011, 17(23): 250-254. DONG W R, LIU H Y, DING Y G, et al. Advance about application of gardenia jasminoides ellis in treatment of heptic diseases[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(23): 250-254. DOI:10.13422/j.cnki.syfjx.2011.23.013 |
| [18] |
ALKHALIDY H, MOORE W, ZHANG Y L, et al. Small molecule kaempferol promotes insulin sensitivity and preserved pancreatic β-cell mass in middle-aged obese diabetic mice[J]. Journal of Diabetes Research, 2015, 2015: 532984. |
| [19] |
卢婧霞, 郑祖国, 徐志猛, 等. 植物甾醇降血脂机制研究进展[J]. 中国中药杂志, 2019, 44(21): 4552-4559. LU J X, ZHENG Z G, XU Z M, et al. Advances in research on hypolipidemic mechanism of phytosterols[J]. China Journal of Chinese Materia Medica, 2019, 44(21): 4552-4559. |
| [20] |
PARK Y, CARR T P. Unsaturated fatty acids and phytosterols regulate cholesterol transporter genes in Caco-2 and HepG2 cell lines[J]. Nutrition Research, 2013, 33(2): 154-161. DOI:10.1016/j.nutres.2012.11.014 |
| [21] |
SMOLINSKA N, SZESZKO K, DOBRZYN K, et al. Transcriptomic analysis of porcine endometrium during implantation after in vitro stimulation by adiponectin[J]. International Journal of Molecular Sciences, 2019, 20(6): 1335. DOI:10.3390/ijms20061335 |
| [22] |
段浩茹, 李瑞, 宋姗姗, 等. 电针调控骨骼肌AdipoR1/AMPK/PPARα通路改善糖尿病肥胖大鼠糖脂代谢紊乱的机制探讨[J]. 针刺研究, 2021, 46(11): 907-913. DUAN H R, LI R, SONG S S, et al. Electroacupuncture improves glucose and lipid metabolism by regulating APN/AMPK/PPARα signaling of skeletal muscle in Zucker diabetic obese rats[J]. Acupuncture Research, 2021, 46(11): 907-913. |
| [23] |
KAJIMURA D, LEE H W, RILEY K J, et al. Adiponectin regulates bone mass via opposite central and peripheral mechanisms through FoxO1[J]. Cell Metabolism, 2013, 17(6): 901-915. DOI:10.1016/j.cmet.2013.04.009 |
| [24] |
DEVKOTA R, SVENSK E, RUIZ M, et al. The adiponectin receptor AdipoR2 and its caenorhabditis elegans homolog PAQR-2 prevent membrane rigidification by exogenous saturated fatty acids[J]. PLoS Genetics, 2017, 13(9): e1007004. DOI:10.1371/journal.pgen.1007004 |
| [25] |
NISHIDA Y, IYADOMI M, TOMINAGA H, et al. Influence of single-nucleotide polymorphisms in PPAR-δ, PPAR-γ, and PRKAA2 on the changes in anthropometric indices and blood measurements through exercise-centered lifestyle intervention in Japanese middle-aged men[J]. International Journal of Molecular Sciences, 2018, 19(3): 703. DOI:10.3390/ijms19030703 |
| [26] |
JIN M Y, FENG H H, WANG Y, et al. Gentiopicroside ameliorates oxidative stress and lipid accumulation through nuclear factor erythroid 2-related factor 2 activation[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 2940746. |
| [27] |
MALVI P, JANOSTIAK R, NAGARAJAN A, et al. N-acylsphingosine amidohydrolase 1 promotes melanoma growth and metastasis by suppressing peroxisome biogenesis-induced ROS production[J]. Molecular Metabolism, 2021, 48: 101217. |
| [28] |
LODHI I J, SEMENKOVICH C F. Peroxisomes: a nexus for lipid metabolism and cellular signaling[J]. Cell Metabolism, 2014, 19(3): 380-392. |
| [29] |
CHEN W, GAO R, XIE X N, et al. A metabolomic study of the PPARδ agonist GW501516 for enhancing running endurance in Kunming mice[J]. Scientific Reports, 2015, 5: 9884. |
| [30] |
SATO Y, KOBAYASHI T, NISHIUMI S, et al. Prospective study using plasma apolipoprotein A2-isoforms to screen for high-risk status of pancreatic cancer[J]. Cancers, 2020, 12(9): 2625. |
| [31] |
钟华, 仇静文, 吴鸿飞, 等. 基于网络药理学研究瓜蒌-薤白药对抗高脂血症作用机制[J]. 中国实验方剂学杂志, 2020, 26(18): 154-165. ZHONG H, QIU J W, WU H F, et al. Mechanism of action of trichosanthis fructus-allii macrostemonis Bulbus herb pairs against hyperlipidemia based on network pharmacology[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(18): 154-165. |
| [32] |
李光飞, 陶玲, 王伟. 利用气相二氧化硅从人血浆中制备载脂蛋白A1方法的建立[J]. 中国生物制品学杂志, 2018, 31(2): 195-199. LI G F, TAO L, WANG W. Development of a method for preparation of apolipoprotein A1 from human plasma by fumed silicon dioxide[J]. Chinese Journal of Biologicals, 2018, 31(2): 195-199. |
| [33] |
MA X, WANG T, ZHAO Z L, et al. Propofol suppresses proinflammatory cytokine production by increasing ABCA1 expression via mediation by the long noncoding RNA LOC286367[J]. Mediators of Inflammation, 2018, 2018: 8907143. |
| [34] |
SAMINO S, VINAIXA M, DÍAZ M, et al. Metabolomics reveals impaired maturation of HDL particles in adolescents with hyperinsulinaemic androgen excess[J]. Scientific Reports, 2015, 5: 11496. |
| [35] |
CHAKRABARTI R S, INGHAM S A, KOZLITINA J, et al. Variability of cholesterol accessibility in human red blood cells measured using a bacterial cholesterol-binding toxin[J]. eLife, 2017, 6: e23355. |
| [36] |
刘玉琳, 李国泰. 不同强度跑步运动与二甲双胍联用对2型糖尿病并发骨质疏松大鼠的骨密度、骨吸收、胰岛素敏感性的影响效果研究[J]. 中国骨质疏松杂志, 2020, 26(2): 240-246. LIU Y L, LI G T. Effects of different intensity of running exercises combined with metformin on bone mineral density, bone metabolism, and insulin sensitivity in type 2 diabetic patients with osteoporosis[J]. Chinese Journal of Osteoporosis, 2020, 26(2): 240-246. |
| [37] |
GOMARASCHI M, OSSOLI A, CASTELNUOVO S, et al. Depletion in LpA-Ⅰ: A-Ⅱ particles enhances HDL-mediated endothelial protection in familial LCAT deficiency[J]. Journal of Lipid Research, 2017, 58(5): 994-1001. |
| [38] |
王斯琦, 唐朝克. 高密度脂蛋白组成成分对心血管疾病的影响[J]. 生理科学进展, 2017, 48(5): 365-369. WANG S Q, TANG Z K. Effects of high density lipoprotein components on cardiovascular diseases[J]. Progress in Physiological Sciences, 2017, 48(5): 365-369. |
| [39] |
BANDARIAN F, DANESHPOUR M S, HEDAYATI M, et al. Identification of sequence variation in the apolipoprotein A2 gene and their relationship with serum high-density lipoprotein cholesterol levels[J]. Iranian Biomedical Journal, 2016, 20(2): 84-90. |
2. Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jian 250355, China
 2023, Vol. 40
2023, Vol. 40