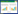文章信息
- 刘洋, 郭璐萱, 郝娜.
- LIU Yang, GUO Luxuan, HAO Na.
- 槐杞黄颗粒干预狼疮性肾炎的物质基础与作用机制:网络药理学和分子对接技术
- Material basis and mechanism of Huaiqihuang Granule in intervention of lupus nephritis: network pharmacology and molecular docking technology
- 天津中医药, 2023, 40(9): 1200-1207
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(9): 1200-1207
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.09.18
-
文章历史
- 收稿日期: 2023-05-18
2. 国家中医针灸临床医学研究中心,天津 300381;
3. 天津中医药大学,天津 301617
系统性红斑狼疮(SLE)是一种典型的系统性自身免疫性疾病,主要特征表现为自身免疫耐受的丧失以及针对自身抗原产生高水平的自身反应性抗体,从而累及全身系统,导致多器官损伤[1]。狼疮性肾炎(LN)是SLE最常见的严重表现之一,约50%~70%的SLE患者可发展为LN[2],其中大约22%的LN患者在15年内可进展至终末期肾病[3]。目前LN仍然是SLE患者发病和死亡的重要原因[4],积极地改善治疗LN,对于延缓肾脏病的进展,降低病死率,提升生活质量具有积极的意义。目前现代医学对于LN的治疗仍以激素类药物和免疫抑制剂治疗为主,虽然具有一定的疗效,但仍然不可避免地出现药物毒性以及可能引发的继发性感染,且治疗过程中易出现疾病的反复发作,治疗不彻底。虽然目前出现了一些新型药物用于LN的治疗,比如B细胞靶向治疗、利妥昔单抗、奥瑞珠单抗等药物,但是其具体的疗效仍然需要大规模临床试验进一步去证实[5]。迫切地去寻找一种副作用更小,疗效更佳的药物成为临床治疗LN的热点所在。槐杞黄颗粒(HQH)是一种以真菌为主要组成的中成药,近年来,HQH在慢性肾脏病(CKD),如儿童肾病综合征、糖尿病肾病、过敏性紫癜性肾炎、慢性肾衰竭等的治疗中疗效突出,可通过保护肾小球足细胞、抑制肾小球系膜细胞增殖、抗肾间质纤维化等多方面来实现干预CKD的进展[6]。根据中国最新的1项临床随机对照研究发现[7],相比于单纯应用常规药物(泼尼松联合环磷酰胺)治疗,联合HQH治疗后可显著地降低LN患者的24 h尿蛋白定量,降低白细胞介素(IL)-4和IL-10等炎症因子,还可降低血清铁蛋白水平,具有突出的疗效且安全性良好。虽然目前临床证实HQH可明显改善LN,改善相关症状,但是其作用机制还有待进一步明确,且中药具有多成分、多靶点、多通路协同治疗的效果,为了明确HQH干预LN的具体物质基础和作用机制,因此文章借助网络药理学和分子对接的方法去探究HQH的核心成分、靶点以及关键通路,以期为今后临床中HQH在治疗LN的深入研究与应用方面提供有益的参考。
1 材料与方法 1.1 HQH的有效成分及作用靶点的整理借助中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php/)并根据生物利用度(OB)≥30%,类药性(DL)≥0.18相关条件筛选HQH的有效成分及对应靶点,对于TCMSP未收录的药物槐耳,在中药分子机制的生物信息学分析工具平台(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm/)获取其活性成分,同样在TCMSP数据库筛选符合条件的有效成分及对应靶点。最后通过UniProt平台(https://www.uniprot.org/)规范靶点名称。
1.2 狼疮性肾炎的疾病靶点整理以“Lupus Nephritis”“Lupus Glomerulonephritis”“Lupus Nephritides”“Lupus Glomerulonephritides”为检索词在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、Therapeutic Target Database(TTD,http://db.idrblab.net/ttd/)数据库获取LN的疾病靶点并整理汇总。
1.3 中药与疾病共同靶点的整理借助Venny 2.1.0平台(https://bioinfogp.cnb.csic.es/tools/venny/)对HQH的作用靶点与LN的靶点取交集,获取两者的共同靶点。
1.4 中药-有效成分-共同靶点-疾病网络图的构建借助Cytoscape 3.9.1软件导入中药、有效成分、共同靶点及疾病等信息,构建中药-有效成分-共同靶点-疾病网络图,运用软件中“CytoNCA”插件计算节点度值(DC),获取HQH干预LN的核心关键成分。
1.5 蛋白互作网络图的构建将成分与疾病的共同靶点导入STRING 11.5数据库(https://cn.string-db.org/),物种设置为“Homo sapiens”,最低要求交互得分设置为0.4,获得蛋白质互作网络关系,将数据输出为tsv格式并导入Cytoscape 3.9.1软件中建立蛋白互作网络图。
1.6 GO功能富集分析及KEGG通路富集分析借助Metascape平台(https://metascape.org/gp/index.html#/main/step1)对中药与疾病的共同靶点进行GO功能富集分析及KEGG通路富集分析,运用微生信平台(http://www.bioinformatics.com.cn/)对数据结果可视化分析。
1.7 分子对接为进一步探究HQH的核心关键成分与关键靶点的稳定性作用关系。选择1.4中中药-有效成分-共同靶点-疾病网络图中DC值排名前5的核心成分与1.5蛋白互作网络图中DC值排名前3的核心蛋白靶点进行分子对接操作。方法如下:首先,在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索并下载核心关键成分的SDF结构文件,同时借助Open Babel 2.3.1软件将SDF结构文件转化为PDB格式文件;通过Protein Data Bank(PDB)数据库(https://www.rcsb.org//)下载关键蛋白靶点的PDB格式文件。其次,将关键蛋白靶点导入至AutoDock Tools软件中进行去水、加全氢、设置为受体等操作,以pdbqt文件格式导出;对小分子进行加全氢、设置为配体、检测扭转键等操作,同样以pdbqt文件格式导出。再次,将输出的配体和受体的pdbqt文件依次进行分子对接的操作,若结合能 < 0 kcal/mol,说明配体与受体可自发结合,若结合能 < -5 kcal/mol表示具有较好的结合活性,若结合能 < -7 kcal/mol表示具有强烈的结合活性;结合能的绝对值越大,表示结合活性越强,分子构象越稳定。最后,利用Pymol软件对分子对接结果进行可视化分析。
2 结果 2.1 HQH的有效成分及作用靶点的整理结果通过相应的数据库共计检索到56个HQH的有效成分和211个活性成分所对应的作用靶点,根据活性成分所对应的作用靶点的数量进行排序,对靶点数量≥10的活性成分具体信息进行展示,见表 1。
通过GeneCard、OMIM、TTD疾病数据库共计获取到1 822个LN疾病靶点。
2.3 交集靶点的筛选结果借助Venny 2.1.0平台对HQH的作用靶点与LN的疾病靶点取交集,得到117个交集靶点,见图 1。
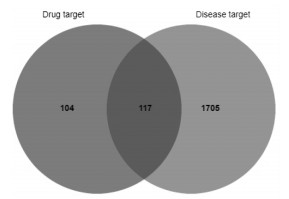
|
| 图 1 HQH与LN的交集靶点韦恩图 Fig. 1 Wayne diagram of the intersection target of HQH and LN |
借助Cytoscape 3.9.1软件构建HQH干预LN的中药-有效成分-共同靶点-疾病网络图见OSID标识码。网络图共计节点166个(3个中药节点,45个有效成分节点,117个共同靶点节点和1个疾病节点),436条边。利用“CytoNCA”插件计算节点DC值,DC值越大节点面积越大,取DC值排名前5的成分作为核心关键成分,见表 2。
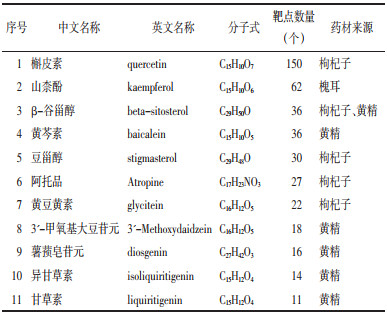
蛋白互作网络图共包含116个节点,2 359条边,见OSID标识码。借助插件“CytoNCA”进行网络拓扑分析,首先计算各节点DC值,筛选出DC值大于中位数的节点。其次,分别计算各节点介度(BC)和紧密度(CC)值,分别筛选出BC和CC值均大于中位数的节点。其中,各节点中位数的DC、BC、CC值分别为39、10.52、0.83,最终获取到27个核心靶点,按照DC值对核心靶点排序,排名前5的核心靶点见表 3。
GO功能富集分析共得到1 926条结果,包括1 702条BP信息,80条CC信息,144条MF信息。按照P值由小到大的顺序排列,BP、CC和MF的前10条富集分析结果见图 2。
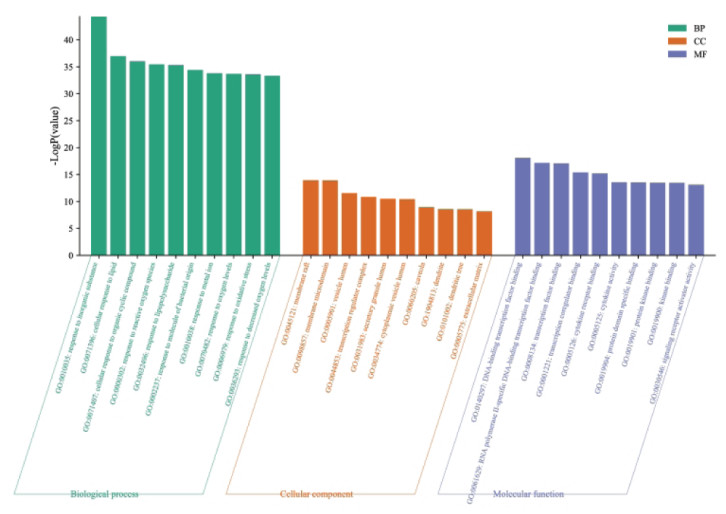
|
| 图 2 GO功能富集分析 Fig. 2 GO functional enrichment analysis |
KEGG通路富集分析得到195条结果,主要包括糖尿病并发症中的糖基化终末产物(AGE)-糖基化终末产物受体(RAGE)信号通路、肿瘤坏死因子(TNF)信号通路、白细胞介素(IL)-17信号通路、辅助性T细胞17(Th17)细胞分化信号通路、低氧诱导因子(HIF-1)信号通路、磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(Akt)信号通路等。同样按照P值由小到大排序,前20条富集通路信息见图 3。
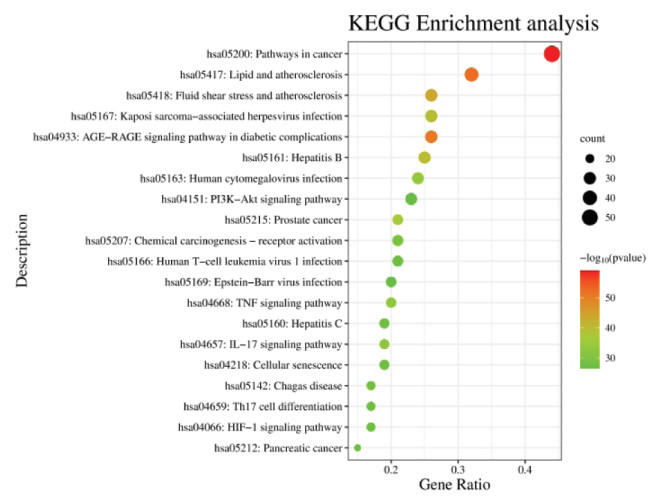
|
| 图 3 KEGG通路富集分析 Fig. 3 KEGG pathway enrichment analysis |
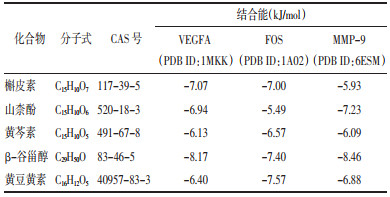
将HQH中槲皮素、山柰酚、黄芩素、β-谷甾醇、黄豆黄素等核心成分分别与VEGFA(PDB ID:1MKK)、c-fos原癌基因蛋白(FOS,PDB ID:1A02)、MMP-9(PDB ID:6ESM)等核心靶点进行分子对接,计算核心成分和核心靶点之间的结合能以便预测成分与靶点之间的结合活性。结合能低于0表明成分与靶点能够自发结合,结合能负值越高提示构象越稳定。结合能的具体数值见表 4。结果显示15次对接结果均小于0,结合能的范围在-5.49~8.46 kJ/mol之间,提示核心成分与核心靶点对接良好。其中β-谷甾醇与MMP-9、VEGFA、FOS,槲皮素与VEGFA、FOS,黄豆黄素与FOS,山奈酚与MMP-9等对接后结合能相对较小,提示HQH干预LN的科学性及有效性,利用Pymol软件对上述结合能较高的分子对接的结果进行可视化分析,见图 4。
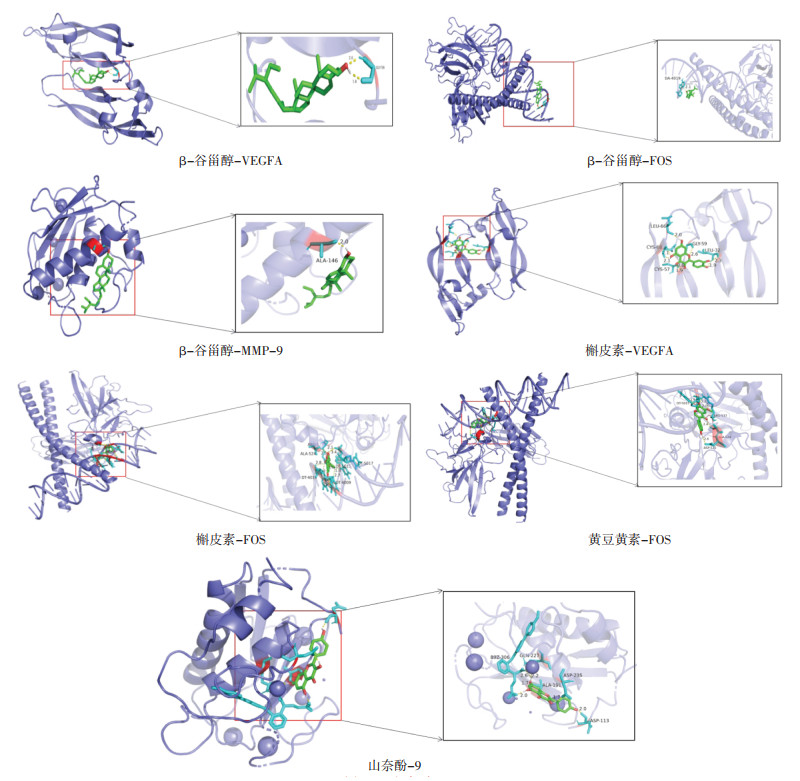
|
| 图 4 分子对接结果 Fig. 4 Macromolecular docking results |
文章借助网络药理学和分子对接技术探究了HQH干预LN的物质基础及潜在作用机制。研究发现,HQH干预LN的核心成分以槲皮素、山柰酚、黄芩素、β-谷甾醇、黄豆黄素等为主。槲皮素具有抗炎、抗氧化应激、抗病毒、抗癌以及免疫调节等多种药理作用[8]。MRL/lpr小鼠作为研究LN的常用动物模型之一[9],研究发现[10],槲皮素能够明显减少MRL/lpr模型小鼠肿大的脾脏,降低异常的免疫功能和炎症反应。系膜细胞的过度增殖是LN最严重的病理表现之一,研究证实,槲皮素通过抑制核转录因子(NF-κB)信号通路的活化,降低长正五聚蛋白3的表达来抑制系膜细胞的过度增殖,改善LN[11]。山柰酚则能通过降低高迁移率蛋白1、Toll样受体4和ATP门控离子通道嘌呤7等炎性蛋白的表达从而有效改善脂多糖诱导的小鼠急性肾损伤和炎症反应[12]。黄芩素具有抗炎和抗氧化的作用,而炎症、氧化应激和肾脏中的髓源性抑制细胞(MDSC)的浸润是加速LN进展的主要原因之一。研究发现[13],黄芩素能明显下调LN模型小鼠的Nod样受体蛋白3(NLRP3)炎症小体的活化和活性氧(ROS)及NF-κB磷酸化水平,抑制MDSC的扩增等,进而保护肾脏。β-谷甾醇具有抗氧化、抗炎、抑菌和类激素功能等多种生物活性[14]。Koc等[15]研究发现,针对肾缺血/再灌注损伤的模型大鼠,应用β-谷甾醇干预后能够有效降低其机体丙二醛水平,升高SOD和谷胱甘肽的活性,改善氧化应激,此外β-谷甾醇还能够降低大鼠机体TNF-α和IL-6水平,降低炎症反应。然而目前,在β-谷甾醇干预LN的应用中,仍缺少相关的基础实验证实其潜在机制。
网络拓扑分析发现,VEGFA、FOS、MMP-9、PTGS2、NFKBIA为HQH干预LN的核心靶点。VEGFA属于血小板源性生长因子超家族的一种分泌型糖蛋白,对于维持肾小球滤过屏障至关重要[16]。在肾组织中,VEGFA主要由足细胞产生并穿过肾小球基底膜,到达肾小球内皮细胞,进而对于肾小球内皮细胞的增殖和分化发挥重要作用[17],足细胞中VEGFA的表达增多或减少均可导致肾小球结构和功能的异常[18]。FOS家族由FOS,FOSB,FOSL1和FOSL2等成员组成,其中FOSL1和FOSL2在IgAN、LN和局灶性肾小球硬化症等各种肾脏疾病中均呈现出高表达状态[19]。IgA肾病的诊断目前仅局限于肾活检,缺乏有效的血清和尿液相关的生物标志物[20]。但是最新的1项研究发现[21],FOS在健康人群和IgA肾病人群中具有较高的特异性和敏感性,这提示FOS有望成为诊断IgA肾病的生物标志物之一。MMP属于基质金属蛋白酶家族[22],包括间质胶原酶(MMP-1、MMP-8、MMP-13)、明胶酶(MMP-9、MMP-2)、基质溶素(MMP-3、MMP-7、MMP-10)等[23]。相关的研究发现[22],MMP的过度表达可能会导致炎症反应及肾间质成纤维细胞的活化,加速肾纤维化的进展。
通过KEGG通路富集分析及结合本专业和文献知识,发现HQH可通过调控多种信号通路来干预LN的进程。AGE-RAGE信号通路的活化可介导CKD的炎症与肾纤维化的进程,AGEs受体,即RAGE,其激活能够刺激烟酰胺腺嘌呤二核苷酸磷酸氧化酶介导的ROS的产生,导致内质网应激、炎症、肾小球肥大、足细胞损伤和肾纤维化[24]。此外,AGE-RAGE信号通路又能够通过调控MAPK信号通路进而诱导NF-κB的表达,促使其下游的TNF-α、IL-6过度表达,从而促进炎症反应和引发肾组织损伤[25]。TNF信号通路作为经典的炎症信号通路之一,在炎症反应的早期其过度活化即可导致大量的TNF-α释放,一方面其可直接导致足细胞的损伤[26],另一方面可诱导IL-1和IL-6等炎症因子的产生,参与LN的进展[27-28]。IL-17信号通路在CKD领域具有重要的研究意义,通过抑制IL-17信号通路的过度活化,可以减轻炎症因子对肾脏带来的损伤。研究发现[29],白花蛇舌草能够通过调控IL-17信号通路进而明显下调MRL/lpr模型小鼠的肾脏中炎症因子的表达,减少中性粒细胞浸润。而黄芪甲苷则能够抑制血清IL-1β和IL-17的表达从而明显抑制肾小球系膜细胞的增殖和细胞外基质的增加,减轻肾脏损伤[30]。
分子对接的结果显示,HQH中的核心成分(槲皮素、山柰酚、黄芩素、β-谷甾醇、黄豆黄素等)与LN的关键靶点(VEGFA、FOS、MMP-9)结合较为稳定。其中,β-谷甾醇与MMP-9、VEGFA、FOS,槲皮素与VEGFA、FOS,黄豆黄素与FOS,山奈酚与MMP-9等对接后结合能相对较小,提示这极有可能是HQH干预LN的关键作用机制,为后续实验提供一定的有价值的参考。
综上所述,本研究运用网络药理学结合分子对接的方法,对HQH干预LN的物质基础和潜在作用机制提供了初步的预测。通过分子对接验证了核心成分及靶点结合的可行性,最终证实了HQH能够通过多成分、多靶点、多通路来干预LN的进程,为临床运用HQH干预LN的治疗提供重要的参考依据,但其确切的作用机制仍需后续的基础实验研究予以验证。
| [1] |
YU C, LI P, DANG X, et al. Lupus nephritis: new progress in diagnosis and treatment[J]. Journal of Autoimmunity, 2022, 132: 102871. DOI:10.1016/j.jaut.2022.102871 |
| [2] |
REPPE MOE S E, MOLBERG Ø, STRØM E H, et al. Assessing the relative impact of lupus nephritis on mortality in a population-based systemic lupus erythematosus cohort[J]. Lupus, 2019, 28(7): 818-825. DOI:10.1177/0961203319847275 |
| [3] |
TSELIOS K, GLADMAN D D, TAHERI C, et al. Factors associated with rapid progression to endstage kidney disease in lupus nephritis[J]. The Journal of Rheumatology, 2021, 48(2): 228-231. DOI:10.3899/jrheum.200161 |
| [4] |
ANDERS H J, SAXENA R, ZHAO M H, et al. Lupus nephritis[J]. Nature Reviews Disease Primers, 2020, 6: 7. DOI:10.1038/s41572-019-0141-9 |
| [5] |
陈浩涛, 梁东, 许勇芝, 等. 狼疮性肾炎新型药物治疗进展[J]. 海南医学, 2022, 33(22): 2973-2977. CHEN H T, LIANG D, XU Y Z, et al. Progress in new drug therapy for lupus nephritis[J]. Hainan Medical Journal, 2022, 33(22): 2973-2977. DOI:10.3969/j.issn.1003-6350.2022.22.031 |
| [6] |
郝娜, 刘洋, 郭璐萱, 等. 槐杞黄颗粒干预慢性肾脏病的机制与临床研究进展[J/OL]. 中国实验方剂学杂志, (2022-08-17)[2022-12-01]. https://kns.cnki.net/kcms2/article/abstract?v=y08Y1my-xOdLBdyhlRBmwpG08WUZ46yjw8fpgoeWCO33g45rKG0FvAUAlKfrCn6c11Zm2R7iCIoObdS20ukg-0IqZFcXWg8bmkzv1q63zAp5L-ShpvmRJQ==&uniplatform=NZKPT. HAO N, LIU Y, GUO L X, et al. Mechanism and clinical research progress of Huaiqihuang Granule in chronic kidney disease[J/OL]. Chinese Journal of Experimental Traditional Medical Formulae, (2022-08-17)[2022-12-01]. https://kns.cnki.net/kcms2/article/abstract?v=y08Y1my-xOdLBdyhlRBmwpG08WUZ46yjw8fpgoeW-CO33g45rKG0FvAUAlKfrCn6c11Zm2R7iCIoObdS20ukg-0IqZFcXWg8bmkzv1q63zAp5L-ShpvmRJQ==&uniplatform=NZKPT. |
| [7] |
王洁, 李源, 姚硕, 等. 槐杞黄颗粒辅助治疗狼疮性肾炎的疗效及对患者血清铁蛋白的影响[J]. 中国医院用药评价与分析, 2022, 22(9): 1060-1063. WANG J, LI YUAN, YAO S, et al. Efficacy of huaiqihuang Granules in the adjuvant treatment of lupus nephritis and its effects on serum ferritin[J]. Evaluation and Analysis of Drug-Use in Hospitals of China, 2022, 22(9): 1060-1063. |
| [8] |
蒋海旭, 许杰, 陆清怡. 槲皮素治疗类风湿关节炎的研究进展[J]. 中国实验方剂学杂志, 2021, 27(5): 243-250. JIANG H X, XU J, LU Q Y. Research progress of quercetin in treatment of rheumatoid arthritis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(5): 243-250. DOI:10.13422/j.cnki.syfjx.20210105 |
| [9] |
LI W, TITOV A A, MOREL L. An update on lupus animal models[J]. Current Opinion in Rheumatology, 2017, 29(5): 434-441. DOI:10.1097/BOR.0000000000000412 |
| [10] |
CHEN H Y, CHIANG Y F, HONG Y H, et al. Quercetin ameliorates renal injury and pyroptosis in lupus nephritis through inhibiting IL-33/ST2 pathway in vitro and in vivo[J]. Antioxidants, 2022, 11(11): 2238. DOI:10.3390/antiox11112238 |
| [11] |
LIU Y, YU C, JI K, et al. Quercetin reduces TNF-α-induced mesangial cell proliferation and inhibits PTX3 production: involvement of NF-κB signaling pathway[J]. Phytotherapy Research: PTR, 2019, 33(9): 2401-2408. DOI:10.1002/ptr.6430 |
| [12] |
程笑, 杨滢霖, 李伟瀚, 等. 山柰酚对LPS诱导小鼠急性肾损伤作用及机制探讨[J]. 中国药学杂志, 2020, 55(17): 1439-1443. CHENG X, YANG Y L, LI W H, et al. Effect and possible mechanism of kaempferol on acute kidney injury in LPS-stimulated mice[J]. Chinese Pharmaceutical Journal, 2020, 55(17): 1439-1443. |
| [13] |
LI D, SHI G P, WANG J L, et al. Baicalein ameliorates pristane-induced lupus nephritis via activating Nrf2/HO-1 in myeloid-derived suppressor cells[J]. Arthritis Research & Therapy, 2019, 21(1): 105. |
| [14] |
陈跃平, 谢婷, 张昊, 等. β-谷甾醇的生理功能及其在动物生产中的应用研究进展[J]. 动物营养学报, 2022, 34(5): 2721-2731. CHEN Y P, XIE T, ZHANG H, et al. Physiological functions of β-sitosterol and advances of its application in animal production[J]. Chinese Journal of Animal Nutrition, 2022, 34(5): 2721-2731. DOI:10.3969/j.issn.1006-267x.2022.05.001 |
| [15] |
KOC K, GEYIKOGLU F, CAKMAK O, et al. The targets of β-sitosterol as a novel therapeutic against cardio-renal complications in acute renal ischemia/reperfusion damage[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2021, 394(3): 469-479. DOI:10.1007/s00210-020-01984-1 |
| [16] |
TURNER R J, EIKMANS M, BAJEMA I M, et al. Stability and species specificity of renal VEGF-A splicing patterns in kidney disease[J]. PLoS One, 2016, 11(9): e0162166. DOI:10.1371/journal.pone.0162166 |
| [17] |
FERRARA N. Role of vascular endothelial growth factor in regulation of physiological angiogenesis[J]. American Journal of Physiology Cell Physiology, 2001, 280(6): C1358-C1366. DOI:10.1152/ajpcell.2001.280.6.C1358 |
| [18] |
CARRANZA K, VERON D, CERCADO A, et al. Cellular and molecular aspects of diabetic nephropathy; the role of VEGF-A[J]. Nefrología(English Edition), 2015, 35(2): 131-138. |
| [19] |
WANG Q, WANG X Y, YE Z. Screening and bioinformatics analysis of IgA nephropathy gene based on GEO databases[J]. BioMed Research International, 2019, 2019: 8794013. |
| [20] |
KIDNEY DISEASE: IMPROVING GLOBAL OUTCOMES(KDIGO) GLOMERULAR DISEASES WORK GROUP. KDIGO 2021 clinical practice guideline for the management of glomerular diseases[J]. Kidney International, 2021, 100(4S): S1-S276. |
| [21] |
ZHOU X, WANG N, ZHANG Y F, et al. Expression of CCL2, FOS, and JUN may help to distinguish patients with IgA nephropathy from healthy controls[J]. Frontiers in Physiology, 2022, 13: 840890. DOI:10.3389/fphys.2022.840890 |
| [22] |
TAN R J, LIU Y H. Matrix metalloproteinases in kidney homeostasis and diseases[J]. American Journal of Physiology Renal Physiology, 2012, 302(11): F1351-F1361. DOI:10.1152/ajprenal.00037.2012 |
| [23] |
ADAMIDIS K N, KOPAKA M E, PETRAKI C, et al. Glomerular expression of matrix metalloproteinases in systemic lupus erythematosus in association with activity index and renal function[J]. Renal Failure, 2019, 41(1): 229-237. DOI:10.1080/0886022X.2019.1591998 |
| [24] |
PATHOMTHONGTAWEECHAI N, CHUTIPONGTANATE S. AGE/RAGE signaling-mediated endoplasmic reticulum stress and future prospects in non-coding RNA therapeutics for diabetic nephropathy[J]. Biomedicine & Pharmacotherapy, 2020, 131: 110655. |
| [25] |
YAN S D, SCHMIDT A M, ANDERSON G M, et al. Enhanced cellular oxidant stress by the interaction of advanced glycation end products with their receptors/binding proteins[J]. The Journal of Biological Chemistry, 1994, 269(13): 9889-9897. |
| [26] |
QING X P, CHINENOV Y, REDECHA P, et al. iRhom2 promotes lupus nephritis through TNF-α and EGFR signaling[J]. The Journal of Clinical Investigation, 2018, 128(4): 1397-1412. |
| [27] |
DIAZ-RICART M, TORRAMADE-MOIX S, PASCUAL G, et al. Endothelial damage, inflammation and immunity in chronic kidney disease[J]. Toxins, 2020, 12(6): 361. |
| [28] |
蒋志明, 魏小桐, 赵丽娜, 等. 不同浓度艾烟环境对大鼠鼻黏膜损伤及血清IL-1、IL-6和TNF-α表达的影响[J]. 中国针灸, 2021, 41(7): 781-786. JIANG Z M, WEI X T, ZHAO L N, et al. Effect of different concentrations of moxa smoke exposure on nasal mucosal injury and expression of serum IL-1, IL-6 and TNF-α in rats[J]. Chinese Acupuncture & Moxibustion, 2021, 41(7): 781-786. |
| [29] |
LI Y, DING T, CHEN J, et al. The protective capability of hedyotis diffusa willd on lupus nephritis by attenuating the IL-17 expression in MRL/lpr mice[J]. Frontiers in Immunology, 2022, 13: 943827. |
| [30] |
梁文林, 李军, 金光明, 等. 黄芪甲苷对系膜增生性肾小球肾炎小鼠肾功能及血清IL-1β和IL-17的影响[J]. 基础医学与临床, 2020, 40(12): 1666-1670. LIANG W L, LI J, JIN G M, et al. Effect of astragaloside on renal function and serum IL-1β and IL-17 in mice with mesangial proliferative glomerulonephritis[J]. Basic & Clinical Medicine, 2020, 40(12): 1666-1670. |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40