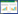文章信息
- 周诗远, 杨永可, 熊飞然, 等.
- ZHOU Shiyuan, YANG Yongke, XIONG Feiran, et al.
- 针刺人迎穴调控RhoA/ROCK1通路改善自发性高血压大鼠血压及血管损伤的机制研究
- Study on the mechanism of regulating RhoA/ROCK1 pathway by acupuncture at Renying Point to improve blood pressure and vascular injury in spontaneously hypertensive rats
- 天津中医药, 2024, 41(1): 67-72
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 67-72
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.14
-
文章历史
- 收稿日期: 2023-09-26
2. 国家中医针灸临床医学研究中心, 天津 300193;
3. 宁波市北仑区人民医院康复科, 宁波 315800;
4. 河北省三河市中医院中医科, 廊坊 065200;
5. 天津市北辰区双环邨街社区卫生服务中心中医科, 天津 300134;
6. 天津中医药大学, 天津 300193;
7. 天津市西青区中北镇社区卫生服务中心针灸科, 天津 300111
高血压病是最常见的慢性病,常被称为“无声的杀手”,大多数临床患者可在没有任何症状的情况下发病,并且血管壁长期承受着高于正常的压力会导致冠心病、脑卒中等严重的心脑血管疾病。心脑血管疾病现已成为中国人口死亡的主要原因,高血压病正是其首要的危险因素[1]。流行病学调查研究显示,2015年中国18岁以上人群中已有2.45亿的高血压病患者[2],2017年中国有254万人死于收缩压升高,伤残调整寿命年超过5%[3]。高血压病的病理过程为复杂的血管生物学改变,主要以血管重构为突出表现,这也是高血压导致靶器官损伤的结构基础。目前高血压病的治疗目标不再仅仅是以血压降低为标准,更重要的是对靶器官的保护,以降低致残率和病死率[4]。
“活血散风”针刺法是石学敏院士针对高血压病的治疗而创立,此法以人迎穴为主穴,具有明确手法量学标准,是治疗高血压病的一套规范、成熟的方法[5]。石院士认为由气海失司导致气逆而上引发的高血压直接输出于人迎穴,因此针刺此处能直接调节气海,使上逆之气归于平和,起到稳定血压的作用。但对其机制尚不清楚。高血压导致的靶器官损害其早期常表现为颈动脉内中膜的增厚,研究表明RhoA/ROCK信号通路与高血压以及血管损伤的发病机制密切相关[6]。前期诸多临床研究证实针刺人迎穴在降低血压及改善血管损伤发挥靶器官保护方面显示出了一定的优势[7-8],因此推测针刺人迎穴可能通过调控RhoA/ROCK信号通路介导的血管损伤发挥降压及靶器官保护的作用。本实验采用自发性高血压大鼠模型,通过观察针刺人迎穴对大鼠平均动脉压及血管损伤相关调控因子内皮素-1(ET-1)、血管紧张素Ⅱ(AngⅡ)、人血小板衍化生长因子-AA(PDGF-AA)、基质金属蛋白酶2(MMP2)和RhoA、ROCK1表达的影响,揭示人迎穴降压及改善血管损伤的作用机制,从而为针刺降压及针刺保护靶器官提供科学依据。
1 材料与方法 1.1 动物及分组SPF级11周龄雄性自发性高血压大鼠27只,体质量(350±50)g,随机分为模型组(SHR)、西药组(Medicine)、针刺组(Acup),每组各9只,同周龄雄性Wistar大鼠9只,体质量(300±50)g作为正常组(Wistar)。以上动物均购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006,每5只一笼饲养,适应性饲养1周后进行实验。
1.2 主要仪器与试剂 1.2.1 主要仪器中研太和牌一次性无菌针灸针(0.25 mm×40 mm);鼠尾无创血压仪(北京软隆生物技术有限公司BP98A);PCR扩增仪(德国,Eppendorf公司);荧光定量PCR仪Rotor Gene 6000(美国,Corbett公司);BioPhotometer plus(德国,Eppendorf公司);多功能酶标仪(美国Thermo公司,Varioskan LUX);伯乐基础电泳仪(美国,BIORAD公司);伯乐垂直电泳槽(美国,BIORAD公司);伯乐转移电泳槽(美国,BIORAD公司);Chemstudio多功能成像仪(德国耶拿,G119717)。
1.2.2 主要试剂大鼠ANG-Ⅱ酶联免疫吸附实验(ELISA)Kit武汉华美生物CSB-E04494r;大鼠ROCK1 ELISA Kit武汉华美生物CSB-el020058ra;Anti- ET-1 antibody [TR.ET.48.5] ab2786;Anti- PDGF-AA antibody [EPR19924] ab203911;Anti-MMP2 antibody ab37150;Anti-Rho antibody[EP487Y] ab40673;Alexa Fluor® 594标记山羊抗鼠免疫球蛋白G(IgG,H+L)中杉金桥ZF-0513;Alexa Fluor® 594标记山羊抗兔IgG(H+L)中杉金桥ZF-0516;BCA protein assaykit CWBIO CW0014S;Trizol Reagent(Invitrogen life technologies公司,15596-018);Oligo(dT)18 primer(Thermo公司,MAN0013109);HiFi-MMLV逆转录酶(CWBIO公司,CW0744M);高纯dNTP(10 mmol/L,each,CWBIO公司)。
1.3 治疗及检测方法 1.3.1 穴位选取人迎穴:参照中国针灸学会实验针灸研究会制定的“动物针灸穴位图谱”[9],根据人和大鼠解剖特点和人迎穴定位特点,确定大鼠人迎穴定位:颈部三角区内,当胸骨舌骨肌与胸锁乳突肌上缘交点,约当颈总动脉分叉处,体表可触及搏动。
1.3.2 治疗方法人迎组:直刺5 mm,可见针柄随颈动脉搏动而上下振动。西药组:厄贝沙坦[安博维,30 mg/(kg·d)],溶解于2 mL水中,灌胃。SHR组和Wistar组不治疗但给予相同的抓取。针刺采用管针垂直进针约5 mm,以保证刺入深度的一致性。针刺入穴位后行捻转补法30 s(向前用力为补),然后留针1 min。治疗为5次/周,连续6周。
1.3.3 血压测量将大鼠装入测血压固定器中,待大鼠平静波形稳定后,给尾套充气加压测量大鼠血压,测量3次取平均值作为大鼠本次血压值。各组大鼠共针刺6周,并于干预前,治疗3周,治疗6周测量3次平均动脉血压值。
1.4 取材及检测指标和方法 1.4.1 取材用10%水合氯醛对大鼠进行麻醉后取颈动脉组织,组织经磷酸盐缓冲溶液(PBS)及4%多聚甲醛灌注取材后保存于多聚甲醛溶液的标本瓶或冻存管中,放于-80 ℃冰箱中保存备用。
1.4.2 ELISA测定AngⅡ、ROCK1的浓度取颈动脉组织100 mg加入1 mL PBS进行匀浆,3 000 r/min,离心15 min,离心半径8 cm,离心后取上清液进行检测;或取血液离心取血清进行检测。依照试剂盒说明书加样、孵育、显色,用酶标仪测定每孔OD值(吸光度设为450 nm波长);用公式计算颈动脉组织AngⅡ和血清中ROCK1的浓度。
1.4.3 实时荧光定量PCR法检测ET-1和PDGF-AA基因表达取颈动脉组织100 mg剪碎液氮研磨,加入Trizol裂解液提取总RNA,将mRNA反转cDNA后,将体系进行扩增,反应条件为94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火1 min,72 ℃延伸2 min,共33个循环,总反应体系20 μL。扩增PCR引物序列见表 1。
取颈动脉组织100 mg剪碎加入裂解液裂解30 min,离心后取上清液,BCA法计算样本蛋白浓度。加入蛋白缓冲液,在100度沸水浴中反应10 min使蛋白变性,制备分离胶和浓缩胶上样后进行电泳,采用半干转法进行转膜、封闭、洗膜,加入一抗,4 ℃孵育过夜;室温平衡30 min后洗膜,加入二抗,37 ℃孵育1 h后,进行ECL反应成像出图,用Image J软件对条带灰度值进行分析。
1.4.5 免疫荧光检测MMP2、RhoA蛋白定位及表达取颈动脉组织于4%甲醛溶液固定,石蜡包埋后切成4 μm的组织切片,将石蜡切片脱蜡至水,滴加一抗工作液(1%BSA稀释):MMP2 1∶150或RhoA 1∶100 4 ℃过夜;结合二抗工作液Alexa Fluor® 594标记山羊抗鼠IgG滴度为1∶80或Alexa Fluor® 594标记山羊抗兔IgG滴度为1∶80,洗涤后封片,在显微镜下观察并拍片。
1.5 统计学方法采用SPSS 25.0软件进行统计分析,计量资料采用均数±标准差(x±s)表示。多组间比较采用单因素方差分析,进一步进行组间两两比较时,若方差齐采用LSD法;若方差不齐采用Games-Howell法;多时点采用重复测量方差分析。P<0.05表示差异具有统计学意义。
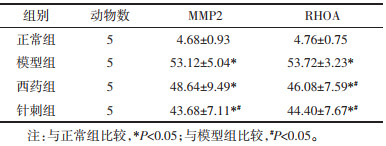
2 结果 2.1 不同组别大鼠平均动脉压结果与正常组比较,模型组、西药组、针刺组在治疗前,治疗3周,治疗6周时的平均动脉压均显著升高(P<0.05),与模型组比较,西药组和针刺组在治疗3周,治疗6周时的平均动脉压显著降低(P<0.05),与西药组比较,针刺组在治疗3周,治疗6周时的平均动脉压差异无统计学意义(P>0.05),与治疗前比较,西药组和针刺组在治疗3周,治疗6周时的平均动脉压显著降低(P<0.05)。见表 2。
|
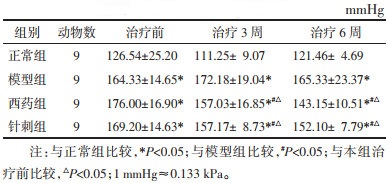
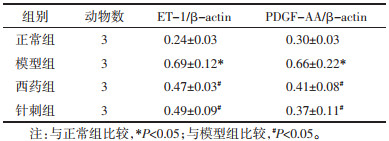
与正常组比较,模型组在治疗6周时的ET-1和PDGF-AA的mRNA表达显著升高(P<0.05);与模型组比较,西药组和针刺组在治疗6周时ET-1和PDGF-AA的mRNA表达显著降低(P<0.05)。见表 3。
|
与正常组比较,模型组在治疗6周时的ET-1和PDGF-AA的蛋白表达显著升高(P<0.05);与模型组比较,西药组和针刺组在治疗6周时ET-1和PDGF-AA的蛋白表达显著降低(P<0.05)。见图 1,表 4。
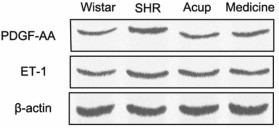
|
| 图 1 干预后各组大鼠PDGF-AA,ET-1的蛋白表达 Fig. 1 Protein expression of PDGF-AA and ET-1 in each group of rats after intervention |
|
与正常组比较,模型组、西药组和针刺组在治疗6周时的MMP2和RhoA的蛋白表达显著升高(P<0.05);与模型组比较,西药组在治疗6周时RhoA的蛋白表达显著降低(P<0.05),针刺组在治疗6周时MMP2和RhoA的蛋白表达均显著降低(P<0.05)。见表 5,免疫荧光染色图见OSID二维码。
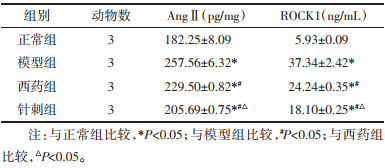
与正常组比较,模型组,西药组和针刺组在治疗6周时的AngⅡ和ROCK1的蛋白表达均显著升高(P<0.05);与模型组比较,西药组和针刺组在治疗6周时AngⅡ和ROCK1的蛋白表达均显著降低(P<0.05);与西药组比较,针刺组在治疗6周时AngⅡ和ROCK1的蛋白表达均显著降低(P<0.05)。见表 6。
|
高血压病的发生发展与血管结构和功能的异常有着密切的关系,高血压通过各种因素引发血管损伤,同时血压的升高也加剧了血管损伤最终造成心,脑,肾等靶器官损害,压力水平与血管损伤之间是一个逐渐加剧的过程,两者相互关联,并相互促进[10-11]。高血压病造成的血管损伤是一个复杂的病变过程,涉及到血管的内膜、中膜、外膜及细胞外基质的参与。内皮素-1(ET-1)是由血管内皮细胞合成的一种缩血管多肽,血管内皮细胞损伤后释放活性物质破坏自身调节体系平衡,导致ET-1合成增多,血管张力调节功能紊乱,内皮依赖性舒张力下降,血管壁结构发生改变,继而导致血压升高[12-13]。有研究表明肾素血管紧张素醛固酮系统(RAAS)与高血压有着密切的关系,血管紧张素Ⅱ(AngⅡ)作为RAAS中最重要的效应分子之一,是一种缩血管因子,可促进外周血管收缩和醛固酮分泌导致血压升高[14-15]。血小板源生长因子(PDGF)是血小板、内皮细胞、平滑肌细胞肌细胞和滋养层细胞等细胞产生的一类细胞因子,PDGF有3个二聚体(AA、BB、AB),PDGF-AA是其亚型之一。研究显示[16-18],PDGF-AA能促进多种细胞的增殖和分裂,PDGF-AA正常分泌能诱导血管的生成,异常升高能够引起血管的强烈收缩及粥样硬化性病变[19]。另有研究发现,血管内膜损伤后,它周围的内皮细胞会释放出一些促生长因子,如PDGF和ET-1等,启动平滑肌细胞增殖引发血管重构[20]。基质金属蛋白酶2(MMP2)是一种锌依赖性酶,能切割细胞外基质成分,研究表明MMP2在多种因素所致血管损伤过程中均发挥重要作用,其在内皮细胞、平滑肌细胞、纤维细胞和巨噬细胞等多种不同类型的细胞中都可分泌,MMP2作为血管重构调节的重要信号通路之一,其激活可引发细胞炎症反应、氧化应激反应,造成血管损伤[21-22]。本实验结果显示,针刺人迎穴能明显降低SHR大鼠的平均动脉压,且能达到与西药相似的降压疗效,并随着针刺时间的增加,治疗6周比3周能达到更好的降压效果。表明针刺发挥效应的方式是随时间而蓄积的,与药物相比,针刺发挥作用的方式相对较缓,这样可避免血压大幅度波动对血管造成的损伤。同时针刺人迎穴后颈动脉组织中ET-1、PDGF-AA、AngⅡ、MMP2的表达水平明显下降。表明针刺可能通过调节血管释放出的相关活性因子来改善血压并抑制血管损伤。
Rho蛋白是小G结合蛋白Ras超家族成员之一,其通过激活下游蛋白激酶ROCK而产生多种生物学效应,如介导内皮功能异常、血管平滑肌的收缩、肌动蛋白细胞骨架形成、细胞黏附与迁移、细胞增殖与凋亡等,因此RhoA/ROCK通路在如高血压病、动脉粥样硬化、心力衰竭等心血管疾病的病理过程中发挥了重要作用是治疗的新靶点[23-24]。研究表明ET-1作为内皮细胞分泌的一种强烈的可收缩血管的活性物质,是调控RhoA/ROCK通路重要的因子,并可通过RhoA/ROCK通路影响血管的收缩和内皮的功能[25]。AngⅡ作为RAAS系统的主要生物活性肽通过G蛋白偶联受体AT1受体刺激血管平滑肌细胞的肥大、增殖和迁移,有研究表明AT1受体的激活可引起HEK293和A10细胞形态的改变,这种改变是依赖RhoA/ROCK通路所介导[26-27]。PDGF作为重要的生长因子,可促进血管平滑肌细胞的有丝分裂和趋化效应,参与血管损伤重构过程中新生内膜的形成,并能通过Rho/ROCK通路影响血管平滑肌细胞的增殖与迁移[28]。血管平滑肌细胞从中膜向内膜迁移需要克服许多屏障,主要是其周围的细胞外基质,MMPs是降解细胞外基质的主要酶类,在血管平滑肌细胞的迁移过程中发挥了重要作用。有研究利用siRNA干扰技术使血管平滑肌细胞中ROCK1的表达下调,结果显示在ROCK1表达下调的同时MMP2的表达和活性也随之降低,表明MMP2可能是ROCK1的下游分子并影响血管平滑肌细胞的迁移[29-30]。本实验结果显示,针刺人迎穴在调节ET-1、PDGF-AA、AngⅡ、MMP2因子同时能明显降低RhoA、ROCK1表达水平。表明针刺可能通RhoA/ROCK1通路来改善血压并抑制血管损伤。
综上所述,针刺人迎穴不仅可以降低血压,还可抑制血管损伤进而保护靶器官,其机制可能与调节血管释放出的相关活性因子有关,且可能通过调控RhoA/ROCK1信号通路发挥作用。本研究从基础实验方面为针刺降压及靶器官的保护提供了实验证据,为高血压病的治疗提供了新的手段,可提前预防和控制由高血压病引发的血管损伤进而导致靶器官损害而引发的一系列心脑血管疾病。
| [1] |
WANG Z W, CHEN Z, ZHANG L F, et al. Status of hypertension in China: Results from the China hypertension survey, 2012-2015[J]. Circulation, 2018, 137(22): 2344-2356. DOI:10.1161/CIRCULATIONAHA.117.032380 |
| [2] |
GBD 2017 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years(DALYs)for 359 diseases and injuries and healthy life expectancy(HALE)for 195 countries and territories, 1990-2017:A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1859-1922. DOI:10.1016/S0140-6736(18)32335-3 |
| [3] |
CZURIGA-KOVÁCS K R, CZURIGA D, CSIBA L. Influence of hypertension, alone and in combination with other vascular risk factors on cognition[J]. CNS & Neurological Disorders Drug Targets, 2016, 15(6): 690-698. |
| [4] |
国家心血管病中心, 中国医师协会, 中国医师协会高血压专业委员会, 等. 中国高血压临床实践指南[J]. 中华心血管病杂志, 2022, 50(11): 1050-1095. |
| [5] |
DU Y Z. The application of acupuncture technique metrology in hypertension by academician SHI Xuemin, a Master of Traditional Chinese Medicine[J]. Chinese Journal of Acupuncture and Moxibustion, 2017, 6(1): 1-2. |
| [6] |
王琦, 艾常虹, 商庆辉. 靶向Rho通路的抗高血压治疗策略研究进展[J]. 国际药学研究杂志, 2019, 46(2): 81-88. |
| [7] |
冯闪闪, 孙朝军, 郭蕴萍, 等. 针刺人迎穴对缺血性脑卒中伴原发性高血压患者血压的影响[J]. 中国针灸, 2019, 39(11): 1160-1163, 1190. |
| [8] |
卫彦, 寇吉友, 陈军. 针刺人迎穴对高血压患者血清中血管活性物质影响的研究[J]. 针灸临床杂志, 2010, 26(2): 12-14. DOI:10.3969/j.issn.1005-0779.2010.02.004 |
| [9] |
王永, 王舒. 大鼠"人迎"穴定位标准及针刺降压效应[A]//中国中医药研究促进会针灸康复分会第二届学术年会暨山东针灸学会第九届学术年会论文集[C]. 济南, 2017: 496-499.
|
| [10] |
马静, 方红薇, 谢晓林, 等. 中老年体位性高血压与尿微量白蛋白排泄率及左心室质量指数的相关性研究[J]. 中华全科医学, 2020, 18(10): 1685-1687, 1694. |
| [11] |
JONES D W, CLARK D C. Hypertension(blood pressure)and lifetime risk of target organ damage[J]. Current Hypertension Reports, 2020, 22(10): 75. DOI:10.1007/s11906-020-01086-6 |
| [12] |
MOORHOUSE R C, WEBB D J, KLUTH D C, et al. Endothelin antagonism and its role in the treatment of hypertension[J]. Current Hypertension Reports, 2013, 15(5): 489-496. DOI:10.1007/s11906-013-0380-1 |
| [13] |
马登飞, 郭艳平, 李学仲, 等. 高血压脑出血患者术后并发肺部感染的危险因素及PCT、NO、ET-1的早期预测价值[J]. 实验与检验医学, 2021, 39(1): 100-104. |
| [14] |
CHASZCZEWSKA-MARKOWSKA M, SAGAN M, BOGUNIA-KUBIK K. The renin-angiotensin-aldosterone system(RAAS)-physiology and molecular mechanisms of functioning[J]. Adances in Hygience and Experimental Medicine, 2016, 70(0): 917-927. |
| [15] |
马全萍, 杨金龙, 杨震. Ang(1-7)对高血压心脏重构的作用机制研究进展[J]. 临床心血管病杂志, 2021, 37(1): 84-87. |
| [16] |
晋军, 祝善俊, 黄岚, 等. PDGF-AA对血管平滑肌细胞c-myc、c-myb mRNA及PCNA表达的影响[J]. 中国微循环, 2004, 8(4): 218-220. |
| [17] |
PELLET-MANY C, FRANKEL P, EVANS I M, et al. Neuropilin-1mediates PDGF stimulation of vascular smooth muscle cell migration and signalling via p130 Cas[J]. The Biochemical Journal, 2011, 435(3): 609-618. |
| [18] |
JONES R, CAPEN D E, JACOBSON M, et al. PDGF and microvessel wall remodeling in adult rat lung: Imaging PDGF-AA and PDGFRalpha molecules in progenitor smooth muscle cells developing in experimental pulmonary hypertension[J]. Cell and Tissue Research, 2006, 326(3): 759-769. |
| [19] |
MORITA H, MIZUTORI M, TAKEUCHI K, et al. Abundant expression of platelet-derived growth factor in spiral arteries in decidua associated with pregnancy-induced hypertension and its relevance to atherosis[J]. European Journal of Endocrinology, 2001, 144(3): 271-276. |
| [20] |
YU K, ZHENG B, HAN M, et al. ATRA activates and PDGF-BB represses the SM22α promoter through KLF4 binding to, or dissociating from, its cis-DNA elements[J]. Cardiovascular Research, 2011, 90(3): 464-474. |
| [21] |
BAI P Y, LYU L H, YU T T, et al. Macrophage-derived legumain promotes pulmonary hypertension by activating the MMP(matrix metalloproteinase)-2/TGF(transforming growth factor)-β1 signaling[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2019, 39(4): e130-e145. |
| [22] |
REN Z L, CUI N, ZHU M L, et al. Placental growth factor reverses decreased vascular and uteroplacental MMP-2 and MMP-9 and increased MMP-1 and MMP-7 and collagen typesⅠandⅣin hypertensive pregnancy[J]. American Journal of Physiology Heart and Circulatory Physiology, 2018, 315(1): H33-H47. |
| [23] |
ZHOU Q, LIAO J K. Rho kinase: An important mediator of atherosclerosis and vascular disease[J]. Current Pharmaceutical Design, 2009, 15(27): 3108-3115. |
| [24] |
SHIMOKAWA H, SUNAMURA S, SATOH K. RhoA/rho-kinase in the cardiovascular system[J]. Circulation Research, 2016, 118(2): 352-366. |
| [25] |
皇甫海全. 基于RhoA/Rock1信号通路探讨养心汤对大鼠血管内皮损伤的影响[D]. 哈尔滨: 黑龙江中医药大学, 2018.
|
| [26] |
SUZUKI H, KIMURA K, SHIRAI H, et al. Endothelial nitric oxide synthase inhibits G12/13 and rho-kinase activated bythe angiotensinⅡtype-1 receptor: implication in vascular migration[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2009, 29(2): 217-224. |
| [27] |
GODIN C M, FERGUSON S S G. The angiotensinⅡtype 1 receptor induces membrane blebbing by coupling to Rho A, Rho kinase, and myosin light chain kinase[J]. Molecular Pharmacology, 2010, 77(6): 903-911. |
| [28] |
AI S, KUZUYA M, KOIKE T, et al. Rho-Rho kinase is involved in smooth muscle cell migration through myosin light chain phosphorylation-dependent and independent pathways[J]. Atherosclerosis, 2001, 155(2): 321-327. |
| [29] |
洪艳, 郭艳, 赵莹, 等. PDGF介导ROCK对血管平滑肌细胞基质金属蛋白酶-2的表达及活性的影响[J]. 现代生物医学进展, 2009, 9(20): 3855-3857. |
| [30] |
LEE T, ESEMUEDE N, SUMPIO B E, et al. Thrombospondin-1induces matrix metalloproteinase-2 activation in vascular smooth muscle cells[J]. Journal of Vascular Surgery, 2003, 38(1): 147-154. |
2. National Clinical Research Center of Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China;
3. Department of Psychiatry, Ningbo Beilun District People's Hospital, Ningbo 315800, China;
4. Department of Traditional Chinese Medicine, Hebei Sanhe Traditional Chinese Medicine Hospital, Langfang 065200, China;
5. Department of Traditional Chinese Medicine, Beichen District Shuanghuantun Street Community Health Service Center, Tianjin 300134, China;
6. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
7. Department of Acupuncture, Xiqing District Zhongbei Community Health Service Center, Tianjin 300111, China
 2024, Vol. 41
2024, Vol. 41