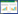文章信息
- 康花民, 李淑红, 边玉玺, 等.
- KANG Huamin, LI Shuhong, BIAN Yuxi, et al.
- 通窍活血汤调节Nrf2通路对新生大鼠缺血缺氧性脑损伤血管保护及神经功能改善作用研究
- Effects of Tongqiao Huoxue Decoction regulating Nrf2 pathway on vascular protection and neurological improvement of newborn rats with ischemic hypoxic brain injury
- 天津中医药, 2024, 41(1): 80-86
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 80-86
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.16
-
文章历史
- 收稿日期: 2023-09-08
缺血缺氧性脑损伤是目前临床中常见的新生儿中枢神经系统疾病,其发病机制主要为母体和胎儿间血液循环及气体交换障碍,进而导致新生儿发生脑神经元坏死、基底神经节变性等病理改变,同时,缺血缺氧性脑损伤也是导致新生儿智力缺陷甚至终身残障的重要原因之一[1]。然而,目前临床中对于新生儿缺血缺氧性脑损伤的治疗药物有限且预后较差,给患儿家庭和社会带来巨大的经济负担,因此对于新生儿缺血缺氧性脑损伤治疗药物的研发仍是当前工作重点。核转录因子2(Nrf2)通路是近年来发现的与缺血缺氧性脑损伤密切相关的重要信号通路,Nrf2通路及相关蛋白水平的异常是导致缺血缺氧性脑损伤发生发展的关键因素[2],且研究证实调节Nrf2通路可能是治疗缺血缺氧性脑损伤有效方法[3]。通窍活血汤由麝香、川芎、赤芍等多种中药材组成,具有活血通络,清瘀散结等多种功效。有研究认为通窍活血汤在脑损伤及神经损伤的修复中存在较大潜力[4],因此,本实验通过研究通窍活血汤对于新生大鼠缺血缺氧性脑损伤的改善作用及机制,为通窍活血汤的药理研究提供参考。
1 材料与方法 1.1 药品及试剂通窍活血汤由麝香(批号210806)0.15 g、川芎(批号210601)3 g、赤芍(批号210423)3 g,桃仁(批号210816)9 g,红花(批号210718)9 g,生姜(批号210919)9 g,大枣(批号210521)6 g,葱白(批号210811)6 g,黄酒(批号190819)250 mL组成(中药饮片购自北京同仁堂药业有限公司),将川芎、赤芍、桃仁、红花、生姜、大枣、葱白置于黄酒中煎煮至150 mL,加入麝香继续煎煮,沸腾两次并浓缩至生药含量为1 g/mL的制剂;神经节苷脂(批号2106231)购自齐鲁制药有限公司;苏木精-伊红(HE)试剂盒(批号G1120)、超氧化物歧化酶(SOD)酶联免疫吸附法(ELISA)试剂盒(批号BC0170)、丙二醛(MDA)ELISA试剂盒(批号BC0025)及肿瘤坏死因子(TNF)-α ELISA试剂盒(批号SEKR-0009)、BCA试剂盒(批号PC0020)、白介素(IL)-1β ELISA试剂盒(批号SEKR-0002)及IL-6 ELISA试剂盒(批号SEKR-0005)购自北京索莱宝科技有限公司;化学发光试剂盒(批号P0018)、组织裂解液(批号P0013)、PCR试剂盒(批号D7260)购自碧云天生物科技有限公司;RNA提取试剂盒(批号WLA088)购自沈阳万类生物科技有限公司;GAPDH(批号ab181602)、核转录因子2(Nrf2,批号ab92946、血红素氧合酶-1(HO-1,批号ab68477)、Janus激酶2(JAK2,批号ab108596)、信号转导和转录激活因子3(STAT3,批号ab68153)一抗、辣根过氧化物酶标记山羊抗兔免疫球蛋白G(IgG,批号ab6721)购自艾博抗贸易有限公司;血清可溶性内皮细胞蛋白C受体(sEPCR)ELISA试剂盒(批号EK-R38890)购自上海酶研生物科技有限公司;可溶性血栓调节蛋白(sTM)ELISA试剂盒(批号YE02629)购自上海远慕生物科技有限公司、内皮素(ET)-1 ELISA试剂盒(批号CSB-E06979r-1)购自上海恒斐生物科技有限公司;PCR引物设计及合成由赛默飞世尔科技有限公司完成。
1.2 实验动物1周龄SD雄性大鼠,体质量10~12 g,健康清洁级,购自河北省实验动物中心,实验动物生产许可证号SCXK(冀)2022-001,动物房温度22~25 ℃,相对湿度40%~70%,每12 h明暗交替光照。
1.3 实验仪器DB001型Morris水迷宫购自北京智鼠多宝生物科技有限责任公司;Ⅸ83荧光倒置显微镜购自日本奥林巴斯;Gel Doc EZ凝胶成像仪购自美国Bio-Rad公司;himac CR22N高速冷冻离心机购自Eppendorf艾本德中国有限公司;RM2235石蜡切片机购自德国Leica公司;Spark多功能酶标仪帝肯实验器材有限公司。
1.4 方法 1.4.1 缺血缺氧性脑损伤大鼠模型的建立大鼠采用随机数字表法分为正常对照组(12只)及造模组(63只),造模组参照文献[5]方法建立缺血缺氧性脑损伤大鼠模型,采用吸入乙醚法进行麻醉,麻醉后置于操作台上分离颈总动脉,并进行结扎,缝合伤口,大鼠恢复1 h后,置于37 ℃恒温低氧箱中,低氧箱气体构成为8%氧气及92%氮气,气流速度为5 L/min,2 h后取出放回饲养笼。随机取3只大鼠进行脑组织病理学检查以验证造模是否成功,如镜下可见脑组织炎症细胞浸润,细胞排列不整齐,脑组织细胞通透性改变或空泡样坏死视为脑组织炎症损伤,每张切片炎症损伤面积超过切片的10%视为造模成功。正常对照组仅切开皮肤后分离颈总动脉,缝合,不进行颈总动脉结扎。造模完成后大鼠随机分为脑损伤组、通窍活血汤低剂量组、通窍活血汤中剂量组、通窍活血汤高剂量组及神经节苷脂组,每组12只。
1.4.2 给药通窍活血汤低、中、高剂量组分别按照4、8、16 g/kg(以生药含量计)[6]的剂量灌胃给予通窍活血汤,神经节苷脂组按照10 mg/kg[7]的剂量腹腔注射神经节苷脂,每日1次,连续14 d[6],正常对照组及脑损伤组灌胃给予生理盐水。
1.4.3 Morris水迷宫实验Morris水迷宫中设置低于水面1 cm的平台,将大鼠置于Morris水迷宫中,第1~5 d训练大鼠,引导大鼠到达平台且停留10 s,第6天撤除平台,将平台所在象限记为靶象限,将大鼠置于Morris水迷宫,记录90 s内大鼠在靶象限停留时间及穿越平台次数。
1.4.4 大鼠血清sEPCR、sTM、ET-1含量的测定按照35 mg/kg的剂量腹腔注射给予大鼠戊巴比妥钠将大鼠麻醉,大鼠断头处死并取血至离心管,室温静置30 min,8 000 r/min,4 ℃离心(离心半径13 cm)10 min,取血清,按照sEPCR、sTM、ET-1 ELISA试剂盒方法测定sEPCR、sTM、ET-1含量。
1.4.5 大鼠血管组织SOD、MDA及TNF-α水平测定大鼠处死后取颈总动脉血管,组织研磨匀浆后,4 ℃条件下,8 000 r/min,离心(离心半径13 cm)10 min,取上清液,按照SOD、MDA、TNF-α ELISA试剂盒方法测定SOD、MDA及TNF-α水平。
1.4.6 大鼠脑组织TNF-α、IL-1β及IL-6水平测定取大鼠脑组织,按照TNF-α、IL-1β及IL-6 ELISA试剂盒方法测定脑组织研磨匀浆液中TNF-α、IL-1β及IL-6水平。
1.4.7 大鼠海马组织病理学检查颈椎脱臼法处死大鼠,分离海马组织,常规HE染色并在显微镜下进行病理学检查。
1.4.8 大鼠海马组织Nrf2、HO-1、JAK2、STAT3 mRNA水平测定大鼠颈椎脱臼处死并分离海马组织,提取总RNA后逆转录为cDNA,使用PCR试剂盒检测海马组织GAPDH、Nrf2、HO-1、JAK2、STAT3 mRNA水平,结果按照2-ΔΔct法,以GAPDH为内参,计算各基因相对表达量。引物序列见表 1。采用20 μL反应体系:qPCR Mix 10 μL,正反向引物各1 μL,模板DNA 2 μL,蒸馏水补充至20 μL。反应程序为:95 ℃预变性2 min,95 ℃变性15 s,60 ℃延伸30 s,共计40个循环,60 ℃退火30 s。
大鼠颈椎脱臼法处死,分离海马组织,研磨匀浆后,4 ℃,12 000 r/min,离心(离心半径13 cm)10 min,取上清液,BCA法对总蛋白定量,分别经电泳分离、转膜、封闭后,使用Nrf2、HO-1、JAK2、STAT3及GAPDH兔抗体(1∶500)4 ℃孵育过夜,TBST清洗后,山羊抗兔二抗(1∶2 000)室温孵育1 h,TBST再次清洗后,使用化学发光液在凝胶成像仪中成像,用ImageJ 1.8.0软件,检测各蛋白灰度值,以GAPDH为内参,计算Nrf2、HO-1、JAK2、STAT3相对水平。
1.5 统计学处理所有数据使用SPSS26.0软件进行处理分析,数据均符合正态分布且方差齐,数据采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD检验,P<0.05表示差异有统计学意义。
2 结果 2.1 通窍活血汤对缺血缺氧性脑损伤新生大鼠靶象限停留时间及穿越平台次数的影响与正常对照组比较,脑损伤组大鼠靶象限停留时间及穿越平台次数显著减少(P<0.05);与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组大鼠靶象限停留时间及穿越平台次数明显增加(P<0.05),且随着通窍活血汤剂量的增加,大鼠靶象限停留时间及穿越平台次数逐渐增加。见表 2。
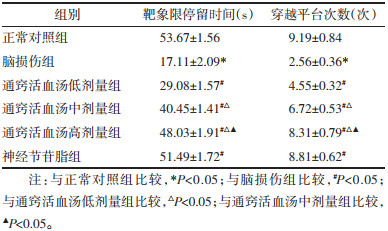
|
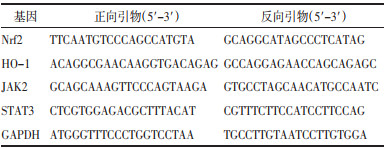
与正常对照组比较,脑损伤组大鼠血清sEPCR、sTM、ET-1含量显著升高(P<0.05);与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组大鼠血清sEPCR、sTM、ET-1含量显著降低(P<0.05),且随着通窍活血汤剂量的增加,大鼠血清sEPCR、sTM、ET-1含量逐渐降低。见表 3。
与正常对照组比较,脑损伤组大鼠血管组织SOD显著降低(P<0.05),MDA及TNF-α显著升高(P<0.05);与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组大鼠血管组织SOD显著升高(P<0.05),MDA及TNF-α显著降低(P<0.05),且随着通窍活血汤剂量的增加,大鼠血管组织SOD逐渐升高,MDA及TNF-α逐渐降低。见表 4。
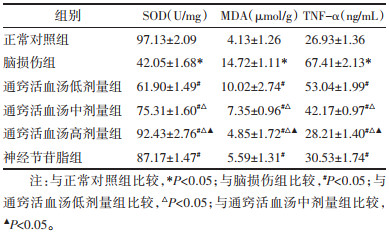
|
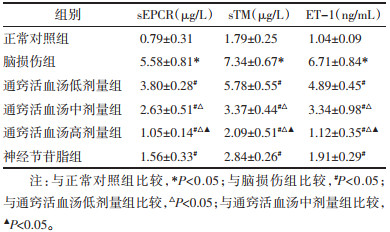
与正常对照组比较,脑损伤组大鼠脑组织TNF-α、IL-1β及IL-6显著升高(P<0.05);与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组大鼠脑组织TNF-α、IL-1β及IL-6显著降低(P<0.05),且随着通窍活血汤剂量的增加,大鼠脑组织TNF-α、IL-1β及IL-6逐渐降低。见表 5。
正常对照组海马组织无病理性改变,与正常对照组比较,脑损伤组海马组织炎症损伤及细胞脱落,与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组海马组织炎症浸润明显减轻,病理性改变明显减轻。见图 1。
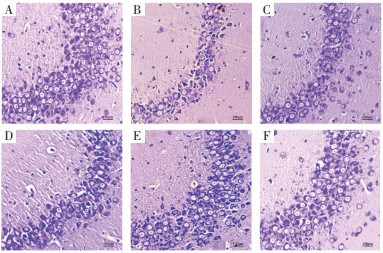
|
| 注:A,正常对照组;B,脑损伤组;C,通窍活血汤低剂量组;D,通窍活血汤中剂量组;E,通窍活血汤高剂量组;F,神经节苷脂组。 图 1 大鼠海马组织病理学检查结果(HE,×200) Fig. 1 Histopathological examination results in hippocampus tissue of rats(HE, ×200) |
与正常对照组比较,脑损伤组大鼠海马组织Nrf2、HO-1 mRNA水平显著降低(P<0.05),JAK2、STAT3 mRNA水平显著升高(P<0.05);与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组大鼠海马组织Nrf2、HO-1 mRNA水平显著升高(P<0.05),JAK2、STAT3 mRNA水平显著降低(P<0.05),且随着通窍活血汤剂量的增加,大鼠海马组织Nrf2、HO-1 mRNA水平逐渐升高,JAK2、STAT3 mRNA水平逐渐降低。见表 6。
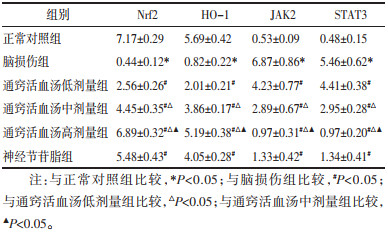
|
与正常对照组比较,脑损伤组大鼠海马组织Nrf2、HO-1蛋白水平显著降低(P<0.05),JAK2、STAT3蛋白水平显著升高(P<0.05);与脑损伤组比较,通窍活血汤低、中、高剂量组及神经节苷脂组大鼠海马组织Nrf2、HO-1蛋白水平显著升高(P<0.05),JAK2、STAT3蛋白水平显著降低(P<0.05),且随着通窍活血汤剂量的增加,大鼠海马组织Nrf2、HO-1蛋白水平逐渐升高,JAK2、STAT3蛋白水平逐渐降低。见图 2。
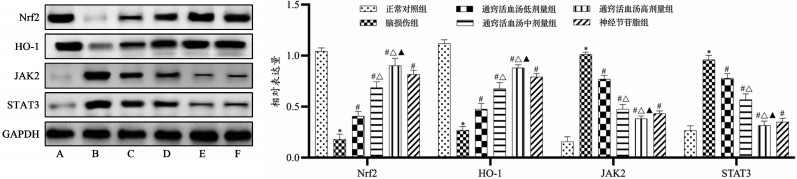
|
| 注:A,正常对照组;B,脑损伤组;C,通窍活血汤低剂量组;D,通窍活血汤中剂量组;E,通窍活血汤高剂量组;F,神经节苷脂组;与正常对照组比较,*P<0.05;与脑损伤组比较,#P<0.05;与通窍活血汤低剂量组比较,△P<0.05;与通窍活血汤中剂量组比较,▲P<0.05。 图 2 大鼠海马组织Nrf2、HO-1、JAK2、STAT3蛋白水平(x±s) Fig. 2 Levels of Nrf2, HO-1, JAK2 and STAT3 protein in hippocampal tissue of rats(x±s) |
新生儿脑损伤是临床中常见的中枢神经功能障碍性疾病,常见于先天性脑发育不全、脑性瘫痪及婴儿期创伤或严重疾病所遗留的并发症,其中缺血缺氧性脑损伤是临床中常见的新生儿脑损伤疾病,主要由胎儿宫内窘迫或胎儿出生时窒息等因素引起,严重时表现出新生儿发育迟缓、智力低下,甚至诱发癫痫及患儿死亡,严重影响患儿的生活生存质量,给患儿家庭带来巨大的经济和精神负担[8]。目前,临床对于新生儿缺血缺氧性脑损伤的治疗方法和药物有限,且现有药物均只能在一定程度上缓解症状,表现出有效性低及预后差的特点[9],所以,目前对于新生儿缺血缺氧性脑损伤治疗药物的研发越来越受关注。
通窍活血汤由麝香、川芎等中药材组成,方中麝香,活血祛瘀,散瘀止痛,为君药;桃仁、红花、赤芍及川芎活血解郁,通达止痛,为臣药;佐以大枣及生姜,通络化瘀,温中补脾,葱白通阳利窍,调和营卫,为使药,诸药合用,共奏通窍活血,散瘀利结之功。现代研究发现,通窍活血汤对于脑损伤及神经损伤均具有显著的改善作用,贺冠军[11]研究发现通窍活血汤能够显著抑制脑出血患者血肿体积及水肿体积,并能够促进神经功能的恢复;安聪等[12]研究证实通窍活血汤对于重型颅脑损伤大鼠具有显著的炎症抑制作用;杜勇等[13]研究表明,通窍活血汤能够通过抑制线粒体自噬进而抑制颅脑损伤小鼠脑组织细胞凋亡;练志明等[14]临床研究证实通窍活血汤能够显著促进重型颅脑损伤患者脑血管循环及神经恢复。由此可见通窍活血汤对于缺血缺氧性脑损伤的治疗具有较大潜力。
认知障碍是新生儿缺血缺氧性脑损伤的典型临床表现与并发症,在临床药物治疗与药物研发中成为关键考察指标[15],其中,Morris水迷宫实验中靶象限停留时间及穿越平台次数是反映认知功能的常用指标[16],本实验结果发现,通窍活血汤能够呈剂量依赖性地提高缺血缺氧性脑损伤新生大鼠靶象限停留时间及穿越平台次数,显著提高缺血缺氧性脑损伤新生大鼠认知能力及神经功能。脑组织TNF-α、IL-1β及IL-6水平是反映脑组织炎症反应程度的指标,其水平的升高提示脑组织炎症损伤加重[17],本实验表明,通窍活血汤能够呈剂量依赖性明显降低缺血缺氧性脑损伤新生大鼠脑组织TNF-α、IL-1β及IL-6水平,抑制脑组织炎症水平,改善脑组织损伤。
血清sEPCR、sTM、ET-1水平提示血管内皮功能受损,马磊等[18]研究证实血清sEPCR水平升高与大血管病变的发生及进展有关;徐向辉等[19]研究表明降低sTM水平与改善大鼠血管内皮细胞损伤有关;刘志浩等[20]研究表明降低脑缺血患者ET-1水平能够有效改善患者血管内皮功能,促进神经恢复;抑制ET-1水平能够显著抑制血管炎症损伤,本实验结果表明,与正常对照组比较,脑损伤组大鼠血清sEPCR、sTM、ET-1水平明显升高,而给予不同剂量的通窍活血汤后,大鼠血清sEPCR、sTM、ET-1水平明显降低,提示通窍活血汤能够呈剂量依赖性地降低缺血缺氧性脑损伤大鼠血清sEPCR、sTM、ET-1水平,抑制血管炎症反应。同时,血管组织SOD、MDA及TNF-α水平反映血管炎症损伤及应激水平,SOD水平降低,MDA及TNF-α水平升高提示血管炎症损伤加重,自我修复能力降低及应激损伤加重[21],因此,提高血管组织SOD水平,降低MDA及TNF-α水平可能是改善脑血管损伤的重要途径之一。本实验结果表明,通窍活血汤能够呈剂量依赖性地抑制血管MDA及TNF-α水平,提高SOD水平,进而抑制血管组织氧化及应激损伤,发挥血管保护作用。
研究证实Nrf2通路与缺血缺氧性脑损伤的发生及进展密切相关。Shu等[22]研究发现,Nrf2、HO-1能够有效抑制氧化应激损伤,进而修复脑损伤后神经功能障碍;马竞等[23]研究表明,升高缺血缺氧性脑损伤大鼠脑组织Nrf2、HO-1水平能够显著促进神经功能恢复,并增强抗氧化作用;魏小于等[24]研究证实JAK2、STAT3蛋白参与脑组织损伤的发生,而抑制JAK2、STAT3蛋白水平则能够显著抑制脑组织损伤及炎症反应;刘庆等[25]研究表明Nrf2能够通过抑制JAK2、STAT3蛋白水平,进而抑制炎症反应及脑神经损伤,抑制和改善脑组织缺血缺氧性脑损伤。由此可见,调节Nrf2通路及相关蛋白水平可能是治疗缺血缺氧性脑损伤的有效途径和方法。本实验结果表明,与脑损伤组比较,通窍活血汤能够剂量依赖性低升高海马组织Nrf2、HO-1水平,并抑制JAK2、STAT3水平,进而促进神经功能改善,抑制脑组织炎症损伤,促进缺血缺氧性脑损伤大鼠的恢复。
综上所述,通窍活血汤能够显著抑制缺血缺氧性脑损伤大鼠神经损伤及脑组织炎症反应,抑制血管氧化应激损伤,发挥脑组织及血管保护作用,其机制可能与调节Nrf2通路有关。
| [1] |
CREE B A C, NIU J Q, HOI K K, et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury[J]. Brain: a Journal of Neurology, 2018, 141(1): 85-98. DOI:10.1093/brain/awx312 |
| [2] |
FU C C, ZHENG Y H, LIN K, et al. Neuroprotective effect of apigenin against hypoxic-ischemic brain injury in neonatal rats via activation of the PI3K/Akt/Nrf2 signaling pathway[J]. Food & Function, 2021, 12(5): 2270-2281. |
| [3] |
ZHANG W, DONG X J, DOU S M, et al. Neuroprotective role of Nrf2 on hypoxic-ischemic brain injury in neonatal mice[J]. Synapse, 2020, 74(11): e22174. DOI:10.1002/syn.22174 |
| [4] |
李俊霖, 雷昆, 李文刚, 等. 通窍活血汤联合康复训练对颅脑损伤患者血清炎症介质的影响[J]. 世界中医药, 2022, 17(10): 1440-1443. DOI:10.3969/j.issn.1673-7202.2022.10.016 |
| [5] |
李娜, 穆亚平, 刘春英, 等. 黄芪甲苷对新生大鼠缺氧缺血性脑损伤NLRP3炎性小体表达的影响[J]. 中国当代儿科杂志, 2021, 23(4): 402-409. |
| [6] |
江颖, 王凯华, 方兴, 等. 中药通窍活血汤对脑缺血再灌注大鼠神经营养因子及氧自由基的影响[J]. 基因组学与应用生物学, 2018, 37(7): 3085-3093. |
| [7] |
张波, 戚利坤, 李立新. 神经节苷脂GM1对大鼠急性脑损伤的保护作用及相关机制研究[J]. 中国生化药物杂志, 2015, 35(9): 48-50. |
| [8] |
JINNOU H. Regeneration using endogenous neural stem cells following neonatal brain injury[J]. Pediatrics International: Official Journal of the Japan Pediatric Society, 2021, 63(1): 13-21. DOI:10.1111/ped.14368 |
| [9] |
MORTON S, KUA J, MULLINGTON C J. Epidural analgesia, intrapartum hyperthermia, and neonatal brain injury: a systematic review and meta-analysis[J]. British Journal of Anaesthesia, 2021, 126(2): 500-515. DOI:10.1016/j.bja.2020.09.046 |
| [10] |
韩海玲, 张蕾. 神经节苷脂治疗新生儿缺氧缺血性脑病的疗效观察[J]. 中国妇幼保健, 2017, 32(15): 3526-3528. |
| [11] |
贺冠军. 通窍活血汤治疗脑出血急性脑损伤的临床疗效[J]. 临床医学研究与实践, 2018, 3(16): 135-136. |
| [12] |
安聪, 王学敏, 黄宗轩, 等. 通窍活血汤水提取物对重型颅脑损伤大鼠血清白介素-6、白介素-10水平的影响[J]. 广西医学, 2017, 39(4): 501-503. |
| [13] |
杜勇, 王革生, 张淑敏, 等. 通窍活血汤灌胃对小鼠颅脑损伤的改善作用及其机制[J]. 山东医药, 2020, 60(9): 48-52. DOI:10.3969/j.issn.1002-266X.2020.09.012 |
| [14] |
练志明, 简林养, 谢伟坚. 通窍活血汤对重型颅脑损伤的疗效及部分机制研究[J]. 世界中医药, 2020, 15(13): 1958-1961, 1966. |
| [15] |
RESITOGLU B, YALCIN C, KOMUR M, et al. Relationship of ozone application and time in rats with hypoxic-ischemic brain injury[J]. Hippokratia, 2021, 25(2): 56-62. |
| [16] |
SIFAT A E, NOZOHOURI S, VILLALBA H, et al. Prenatal electronic cigarette exposure decreases brain glucose utilization and worsens outcome in offspring hypoxic-ischemic brain injury[J]. Journal of Neurochemistry, 2020, 153(1): 63-79. DOI:10.1111/jnc.14947 |
| [17] |
胡晓芳, 郑少锐, 聂群, 等. 英夫利昔单抗对创伤性脑损伤后神经功能的保护作用及机制研究[J]. 中华神经医学杂志, 2022, 21(6): 563-572. DOI:10.3760/cma.j.cn115354-20220216-00087 |
| [18] |
马磊, 王述进, 崔琳. sEPCR、hs-CRP、TNF-α及IL-18水平与2型糖尿病患者大血管病变的相关性分析[J]. 中国医学前沿杂志(电子版), 2017, 9(10): 188-191. |
| [19] |
徐向辉, 常业恬, 李李, 等. 依达拉奉预处理对大鼠脑缺血再灌注后血管内皮功能的影响[J]. 实用医学杂志, 2008, 24(24): 4205-4207. DOI:10.3969/j.issn.1006-5725.2008.24.019 |
| [20] |
刘志浩, 余波, 黄馨凝, 等. 肌肉起止点针刺联合常规针刺对早期缺血性卒中患者神经功能及血管内皮细胞功能的影响[J]. 河北中医, 2019, 41(8): 1241-1245. |
| [21] |
赵辉, 杨晓静, 程芳, 等. 针药结合对脑梗死大鼠氧化应激、炎症反应及血管生成的影响[J]. 广州中医药大学学报, 2022, 39(5): 1116-1122. |
| [22] |
SHU L F, WANG C L, WANG J B, et al. The neuroprotection of hypoxic preconditioning on rat brain against traumatic brain injury by up-regulated transcription factor Nrf2 and HO-1 expression[J]. Neuroscience Letters, 2016, 611: 74-80. DOI:10.1016/j.neulet.2015.11.012 |
| [23] |
马竞, 何文龙, 高重阳, 等. 党参多糖介导Nrf2通路对缺氧缺血性脑损伤的抗氧化和神经保护作用[J]. 中国临床解剖学杂志, 2019, 37(4): 403-408. |
| [24] |
魏小于, 郑威楠, 楚亚楠, 等. 白及多糖调节JAK2/STAT3通路对脑缺血再灌注大鼠脑损伤和炎症反应的影响[J]. 中国临床药理学杂志, 2020, 36(13): 1825-1829. |
| [25] |
刘庆, 卢蓉, 郝莉霞. Nrf2基因对缺氧缺血性脑损伤新生大鼠脑组织氧化应激和JAK2/STAT3信号通路的影响[J]. 局解手术学杂志, 2020, 29(8): 604-609. |
 2024, Vol. 41
2024, Vol. 41