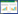文章信息
- 王素亭, 彭琰琰, 韩雪, 等.
- WANG Suting, PENG Yanyan, HAN Xue, et al.
- 基于JAK2/STAT3信号通路探讨升清降浊制动颗粒对多发性抽动症模型大鼠的作用及机制
- Exploring the effect and mechanism of Shengqing Jiangzhuo Zhidong Granule on Tourette's syndrome model rats based on JAK2/STAT3 signal pathway
- 天津中医药, 2024, 41(1): 87-92
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 87-92
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.17
-
文章历史
- 收稿日期: 2023-09-11
2. 郑州大学附属儿童医院中医科, 郑州 450000
多发性抽动症(TS)是儿童中最常见的精神和运动障碍疾病。其临床表现为多发性运动和语音抽动,常伴有注意缺陷多动障碍、情绪障碍和强迫症,部分症状可持续至成年[1]。TS的病因和发病机制仍不清楚。既往研究表明,TS的病因与遗传因素、环境因素、神经炎症、多巴胺系统、神经元凋亡等因素密切相关[2-4]。虽然近年来TS的治疗范围不断扩大,但目前的治疗策略往往不尽如人意,且不良反应较多[5]。因此,有必要寻求新的治疗方法和药物。升清降浊制动颗粒是由酒大黄、生白芍、生甘草、僵蚕、蝉蜕、片姜黄组成的中药颗粒,已有研究报道,升清降浊制动颗粒可明显提高TS患儿临床症状及体征的改善效果,且药物不良反应明显减少[6]。以上研究表明,升清降浊制动颗粒可用于治疗TS。但具体机制尚不完全明确。相关研究显示,抑制Janus激酶2(JAK2)/信号转导和转录激活子3(STAT3)通路可减轻TS大鼠的神经炎症[7]。而升清降浊制动颗粒对TS大鼠的保护作用是否与调控JAK2/STAT3信号通路有关尚不可知。因此,本研究主要探究升清降浊制动颗粒对TS大鼠神经炎症、多巴胺系统相关因子及神经元凋亡的影响以及其作用机制。
1 材料与方法 1.1 实验动物84只,6周龄体质量为200~210 g的雄性SD大鼠购自广东莱迪生物医药研究院有限公司,生产许可证号为SCXK(粤)2022-0064。所有动物实验获得本院动物伦理委员会的批准。
1.2 主要试剂升清降浊制动颗粒由僵蚕、蝉蜕、片姜黄、酒大黄、全蝎、生白芍、生甘草。按照7种药物30∶12∶9∶6∶6∶30∶15的比例配制而成。亚氨基二丙腈(货号:111-94-4)购自上海阿拉丁生化科技股份有限公司;氟哌啶醇(货号:14202011317)购自宁波大红鹰药业股份有限公司;JAK2通路激活剂Coumermycin A1(货号:C9451)购自翌圣生物科技(上海)股份有限公司;大鼠白细胞介素(IL)-1β(货号:E-UNEL-R0028)、肿瘤坏死因子-α(TNF-α,货号:E-EL-M3063)、IL-6(货号:E-EL-M0044c)、大鼠多巴胺(DA,货号:E-EL-0046c)、多巴胺转运蛋白(DAT,货号:E-EL-0052c)酶联免疫吸附试验(ELISA)试剂盒及DNA缺口末端标记法(TUNEL)细胞凋亡检测试剂盒(货号:E-CK-A320)购自武汉伊莱瑞特生物科技股份有限公司;多巴胺D2受体(DRD2)ELISA试剂盒(货号:SEA673Ra)购自武汉云克隆科技股份有限公司;兔源一抗p-JAK2(货号:ab32101)、p-STAT3(货号:ab267373)、JAK2(货号:ab108596)、STAT3(货号:ab68153)、GAPDH(货号:ab9485)及辣根过氧化物酶(HRP)标记的羊抗兔二抗(货号:ab172730)均购自英国Abcam公司。
1.3 实验方法 1.3.1 TS大鼠模型的构建及分组采用连续7 d腹腔注射150 mg/(kg·d)亚氨基二丙腈的方式构建TS大鼠模型[8],对照组大鼠则连续7 d腹腔注射等量的生理盐水。从造模开始第4天起,若大鼠出现头动、急速旋转、跳跃、挖洞等刻板行为,则视为造模成功。按照随机数字表法将SD大鼠随机分为对照组、TS组、升清降浊制动颗粒低剂量组(SQJZZD-L组)、升清降浊制动颗粒高剂量组(SQJZZD-H组)、氟哌啶醇组、Coumermycin A1(JAK2通路激活剂)组、升清降浊制动颗粒高剂量+Coumermycin A1组(SQJZZD-H+Coumermycin A1组),每组12只。除对照组外,其他组大鼠均需构建TS模型。建模成功后,升清降浊制动颗粒低剂量组、升清降浊制动颗粒高剂量组[9]、氟哌啶醇组[10]大鼠分别需灌胃0.645 mg/kg升清降浊制动颗粒、2.58 mg/kg升清降浊制动颗粒、200 μg/kg氟哌啶醇,且均需尾静脉注射等量的生理盐水;Coumermycin A1组[11]大鼠需尾静脉注射4 mg/kg Coumermycin A1且需灌胃等量的生理盐水;升清降浊制动颗粒高剂量+Coumermycin A1组大鼠需灌胃2.58 mg/kg升清降浊制动颗粒且尾静脉注射4 mg/kg Coumermycin A1;对照组、TS组大鼠均需灌胃等量的生理盐水和尾静脉注射等体积的生理盐水,给药每日1次,持续21 d。
1.3.2 标本收集末次处理24 h后,每组选取所有大鼠进行运动行为评分、刻板行为评分;行为评分结束后,2%戊巴比妥钠麻醉大鼠,腹主动脉取血,3 000 r/min离心15 min(离心半径10 cm),收集血清,用于IL-1β、TNF-α、IL-6水平的检测;血清收集后,解剖大鼠分离纹状体,将纹状体分为2部分(每部分包含每组6只大鼠的纹状体),一部分固定于4%多聚甲醛中用于TUNEL染色,另一部分冻存于-80 ℃中用于DA、DAT、DRD2含量及p-JAK2、p-STAT3蛋白水平的检测。
1.3.3 大鼠运动行为评分检测运动行为评分标准为:0分表示正常活动;1分表示过度兴奋;2分表示存在探究行为和不连续的吸鼻声;3分表示跑动不间断;4分表示不间断跑动且伴有惊跳。
1.3.4 大鼠刻板行为评分检测刻板行为评分标准为:0分表示无刻板运动;1分表示躯体存在旋转行为;2分表示头颈部运动过多;3分表示头颈部运动过多且伴有旋转行为;4分表示头向侧摆,并伴有头颈部运动过多。
1.3.5 ELISA检测血清中IL-1β、TNF-α、IL-6水平及纹状体中DA、DAT、DRD2含量严格按照试剂盒说明书检测大鼠血清中IL-1β、TNF-α、IL-6水平及纹状体中DA、DAT、DRD2含量。
1.3.6 TUNEL染色检测大鼠纹状体中神经元凋亡取4%多聚甲醛固定纹状体进行包埋,切片,切片脱蜡,水化,蛋白酶K消化,末端脱氧核苷酸转移酶(TdT酶)孵育,4',6-二脒基-2-苯基吲哚(DAPI)染核,封片后,用荧光显微镜观察神经元凋亡情况并拍照。
1.3.7 蛋白免疫印迹法(Western Blot)检测大鼠纹状体中p-JAK2、p-STAT3蛋白表达取纹状体,加入RIPA裂解液经组织研磨仪匀浆研磨纹状体提取总蛋白。采用2,2-联喹啉-4,4-二甲酸二钠法测定总蛋白浓度,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭液封闭,一抗p-JAK2(1∶2 000)、p-STAT3(1∶2 000)、JAK2(1∶1 000)、STAT3(1∶2 000)、GAPDH(1∶1 000)在4 ℃下孵育过夜。然后与二抗(1∶2 000)在室温下孵育1 h后PBST缓冲液洗膜3次。加入ECL发光试剂后在化学发光成像系统中成像拍照,使用Image Lab 5.0软件分析蛋白质条带灰度值,以目的蛋白与GAPDH的比值表示蛋白相对表达量。
1.4 统计学方法使用SPSS 22.0软件进行统计学分析,以符合正态分布的数据以均数±标准差(x±s)表示。多组间的差异比较采用单因素方差分析,进一步两两差异比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结果 2.1 升清降浊制动颗粒对各组大鼠运动行为评分、刻板行为评分的影响与对照组比较,TS组大鼠运动行为评分、刻板行为评分升高(P<0.05);与TS组比较,升清降浊制动颗粒低剂量组、升清降浊制动颗粒高剂量组、氟哌啶醇组大鼠运动行为评分、刻板行为评分降低(P<0.05);与TS组比较,Coumermycin A1组大鼠运动行为评分、刻板行为评分升高(P<0.05);与升清降浊制动颗粒高剂量组比较,升清降浊制动颗粒高剂量+Coumermycin A1组大鼠运动行为评分、刻板行为评分升高(P<0.05)。见表 1。
|
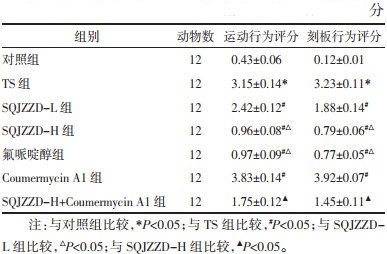
与对照组比较,TS组大鼠血清中IL-1β、TNF-α、IL-6水平升高(P<0.05);与TS组比较,升清降浊制动颗粒低剂量组、升清降浊制动颗粒高剂量组、氟哌啶醇组大鼠血清中IL-1β、TNF-α、IL-6水平降低(P<0.05);与TS组比较,Coumermycin A1组大鼠血清中IL-1β、TNF-α、IL-6水平升高(P<0.05);与升清降浊制动颗粒高剂量组比较,升清降浊制动颗粒高剂量+Coumermycin A1组大鼠血清中IL-1β、TNF-α、IL-6水平升高(P<0.05)。见表 2。
|
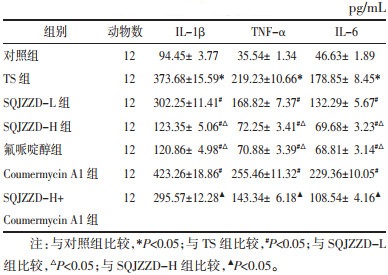
与对照组比较,TS组大鼠纹状体中DA、DAT含量降低,DRD2含量升高(P<0.05);与TS组比较,升清降浊制动颗粒低剂量组、升清降浊制动颗粒高剂量组、氟哌啶醇组大鼠纹状体中DA、DAT含量升高,DRD2含量降低(P<0.05);与TS组比较,Coumermycin A1组大鼠纹状体中DA、DAT含量降低,DRD2含量升高(P<0.05);与升清降浊制动颗粒高剂量组比较,升清降浊制动颗粒高剂量+Coumermycin A1组大鼠纹状体中DA、DAT含量降低,DRD2含量升高(P<0.05)。见表 3。
|
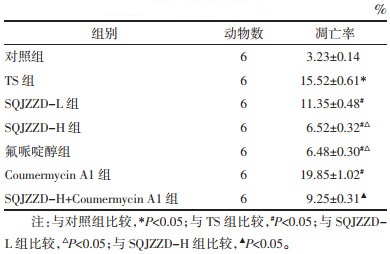
与对照组比较,TS组大鼠纹状体中神经元凋亡率升高(P<0.05);与TS组比较,升清降浊制动颗粒低剂量组、升清降浊制动颗粒高剂量组、氟哌啶醇组大鼠纹状体中神经元凋亡率降低(P<0.05);与TS组比较,Coumermycin A1组大鼠纹状体中神经元凋亡率升高(P<0.05);与升清降浊制动颗粒高剂量组比较,升清降浊制动颗粒高剂量+Coumermycin A1组大鼠纹状体中神经元凋亡率升高(P<0.05)。见表 4。TUNEL染色图见OSID二维码。
|
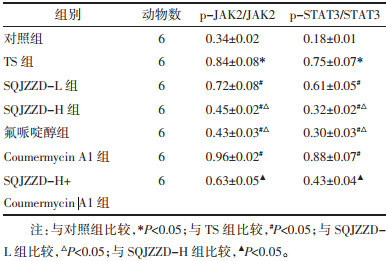
与对照组比较,TS组大鼠纹状体中p-JAK2、p-STAT3蛋白表达升高(P<0.05);与TS组比较,升清降浊制动颗粒低剂量组、升清降浊制动颗粒高剂量组、氟哌啶醇组大鼠纹状体中p-JAK2、p-STAT3蛋白表达降低(P<0.05);与TS组比较,Coumermycin A1组大鼠纹状体中p-JAK2、p-STAT3蛋白表达升高(P<0.05);与升清降浊制动颗粒高剂量组比较,升清降浊制动颗粒高剂量+Coumermycin A1组大鼠纹状体中p-JAK2、p-STAT3蛋白表达升高(P<0.05)。见图 1和表 5。

|
| 注:A,对照组;B,TS组;C,SQJZZD-L组;D,SQJZZD-H组;E,氟哌啶醇组;F,Coumermycin A1 group;G,SQJZZD-H+Coumermycin A1组。 图 1 Western blot检测大鼠纹状体中p-JAK2、p-STAT3蛋白表达 Fig. 1 Western blot detection of p-JAK2 and p-STAT3 protein expression in rat striatum |
|
细胞因子是细胞通讯的重要介质,在神经炎症中起着重要作用。在TS大鼠中观察到脑组织中TNF-α、IL-6水平明显高于正常大鼠[12]。亚氨基二丙腈会导致DA浓度持续下降,导致生长发育过程中的DRD2超敏反应,这可能导致动物的刻板行为[13];DAT作为一种专门定位于DA神经元突触前膜的传递糖蛋白,其负责通过神经元再摄取调节突触外DA的浓度。因此,DAT在维持DA释放的阶段性平衡中起着重要作用[14]。先前的研究表明,与健康对照相比,TS大鼠中DAT的表达较低[15]。亚氨基二丙腈模型是TS的标准动物模型,能够全面再现TS的行为特征[16]。本研究利用亚氨基二丙腈成功诱导了TS大鼠模型,结果显示,与对照组比较,TS组大鼠运动行为评分、刻板行为评分、IL-1β、TNF-α、IL-6水平、DRD2含量、神经元凋亡率升高,DA、DAT含量降低,表明神经炎症可诱导TS大鼠神经元凋亡,进而引起DA代谢紊乱。提示抑制神经炎症、神经元凋亡进而促进DA平衡可能是开发新药治疗TS的有效途径之一。
中医学理论认为TS主要病机是脾虚痰聚、气血阴虚。因此,应坚持健脾补肝、益气活血、化痰祛风等原则来治疗TS。升清降浊制动颗粒中,僵蚕有化痰熄风之功效;蝉蜕有祛风止痉之功效;片姜黄有理气之等功效;酒大黄有荡涤瘀浊之功效。4种药物联用,可降阴中之浊阴,可升阳中之清阳,阴阳相配,调畅气机,内外通和,契合TS的病机。全蝎、生白芍、生甘草配合使用,共奏升清降浊、通络止痉等功效[6]。此外,升清降浊制动颗粒的核心在升降散,其升清降浊,调畅气机,为控制抽动之关键[9]。据报道,升清降浊制动颗粒可明显改善TS患儿的抽动症状[17]。本研究结果与其是一致的,本研究显示,升清降浊制动颗粒可抑制TS大鼠神经炎症、神经元凋亡,促进DA表达,且升清降浊制动颗粒剂量越高,对应指标的变化趋势越明显。氟哌啶醇是DRD2的阻断剂,可有效改善抽动症状[18]。本研究选取该药物作为阳性药物,结果显示,升清降浊制动颗粒高剂量组与氟哌啶醇组对应指标变化趋势差异无统计学意义。提示升清降浊制动颗粒可能是治疗TS的潜在有效药物。
JAK2/STAT3是多种细胞因子和生长因子介导的重要转导通路,可参与细胞增殖、分化、凋亡、迁移等过程[19]。目前关于JAK2/STAT3通路在TS中的研究较少,仅仅有研究显示,抑制JAK2/STAT3通路可改善TS大鼠神经炎症[7]。本研究结果显示,与TS组比较,Coumermycin A1组大鼠纹状体中p-JAK2、p-STAT3蛋白表达升高,TS大鼠神经炎症、神经元凋亡及DA代谢紊乱现象明显,提示JAK2/STAT3通路确实参与了TS大鼠神经炎症、神经元凋亡及DA代谢紊乱过程。此外,本研究还发现,升清降浊制动颗粒可抑制TS大鼠纹状体中p-JAK2、p-STAT3蛋白表达,且升清降浊制动颗粒剂量越高,对应的蛋白表达水平越低,推测升清降浊制动颗粒可能通过抑制JAK2/STAT3通路对TS大鼠发挥保护作用。为了验证该推测,本研究在高剂量升清降浊制动颗粒作用的基础上给予JAK2通路激活剂Coumermycin A1干预TS大鼠,结果显示,Coumermycin A1减弱了高剂量升清降浊制动颗粒对TS大鼠神经炎症、神经元凋亡的抑制作用以及对DA表达水平的促进作用。证实了猜想的正确性,即升清降浊制动颗粒可能通过抑制JAK2/STAT3通路对TS大鼠发挥保护作用。
综上所述,升清降浊制动颗粒可抑制TS大鼠神经炎症、神经元凋亡及促进DA平衡,该机制可能与抑制JAK2/STAT3信号通路有关。升清清降浊制动颗粒对TS大鼠保护作用的机制可能还涉及其他通路,这将是本研究下一步研究的重点内容之一。
| [1] |
SZEJKO N, LOMBROSO A, BLOCH M H, et al. Refractory gilles de la tourette syndrome-many pieces that define the puzzle[J]. Frontiers in Neurology, 2020, 11: 589511. DOI:10.3389/fneur.2020.589511 |
| [2] |
SUN X R, ZHANG X, JIANG K Y, et al. Gastrodin attenuates tourette syndrome by regulating EAATs and NMDA receptors in the Striatum of rats[J]. Neuropsychiatric Disease and Treatment, 2021, 17: 2243-2255. DOI:10.2147/NDT.S305925 |
| [3] |
杨德爽, 孟州令, 国文文, 等. 柴胡加龙骨牡蛎汤对多发性抽动症模型大鼠行为学和多巴胺系统的影响[J]. 中国中西医结合杂志, 2018, 38(1): 76-79. |
| [4] |
伍俊伊, 曾晓云. IGF-1对多发性抽动症模型大鼠纹状体神经元氨基酸递质水平及细胞凋亡的影响[J]. 东南大学学报(医学版), 2018, 37(3): 463-467. DOI:10.3969/j.issn.1671-6264.2018.03.021 |
| [5] |
XI L Y, JI X X, JI W X, et al. Jing-an oral liquid alleviates Tourette syndrome via the NMDAR/MAPK/CREB pathway in vivo and in vitro[J]. Pharmaceutical Biology, 2022, 60(1): 1790-1800. DOI:10.1080/13880209.2022.2116056 |
| [6] |
王小艳, 王芳, 赵保玲, 等. 升清降浊制动颗粒治疗儿童多发性抽动症的临床观察[J]. 医药论坛杂志, 2021, 42(19): 20-23. |
| [7] |
LONG H Y, ZHANG M J, WANG C Y, et al. Rhynchophyllin attenuates neuroinflammation in Tourette syndrome rats via JAK2/STAT3and NF-κB pathways[J]. Environmental Toxicology, 2019, 34(10): 1114-1120. DOI:10.1002/tox.22813 |
| [8] |
郑宏, 高国财, 梁瑞星, 等. 升清降浊制动颗粒对多发性抽动症模型大鼠纹状体内DA水平及DAT、DRD2mRNA表达的影响[J]. 中医学报, 2018, 33(12): 2374-2378. |
| [9] |
高国财, 郑宏, 卢婷婷, 等. 升清降浊制动颗粒对多发性抽动症模型大鼠脑组织内GABA、Glu、ASP含量影响[J]. 中药药理与临床, 2018, 34(5): 105-108. |
| [10] |
张如意, 张丽, 艾厚喜, 等. 金童颗粒治疗拟抽动秽语综合征模型大鼠的药理机制研究[J]. 中国康复理论与实践, 2010, 16(10): 910-912. DOI:10.3969/j.issn.1006-9771.2010.10.004 |
| [11] |
陈菲, 陈霞, 黄财城. 星形胶质细胞外泌体对癫痫大鼠小胶质细胞活化及JAK2/STAT3通路的影响[J]. 卒中与神经疾病, 2022, 29(3): 267-273, 280. DOI:10.3969/j.issn.1007-0478.2022.03.015 |
| [12] |
KE Z L, CHEN Y H, CHEN G F, et al. Neuroinflammation in a rat model of tourette syndrome[J]. Frontiers in Behavioral Neuroscience, 2022, 16: 710116. DOI:10.3389/fnbeh.2022.710116 |
| [13] |
单麒元, 刘琳, 孙竺, 等. 定志散对抽动症小鼠多巴胺和刻板行为的影响[J]. 哈尔滨商业大学学报(自然科学版), 2020, 36(2): 142-146. DOI:10.3969/j.issn.1672-0946.2020.02.003 |
| [14] |
LI J J, GUO Y, ZHAO L, et al. Ningdong Granule upregulates the striatal DA transporter and attenuates stereotyped behavior of tourette syndrome in rats[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2020, 2020: 2980705. |
| [15] |
LI J J, LI Z W, LI A Y, et al. Abnormal expression of dopamine and serotonin transporters associated with the pathophysiologic mechanism of Tourette syndrome[J]. Neurology India, 2010, 58(4): 523-529. DOI:10.4103/0028-3886.68663 |
| [16] |
LIU X M, WANG X M, CAO A H, et al. Immune function changes of the IDPN-induced Tourette syndrome rat model[J]. International Journal of Developmental Neuroscience, 2021, 81(2): 159-166. DOI:10.1002/jdn.10085 |
| [17] |
郑宏, 高国财, 郑攀, 等. 升清降浊制动颗粒治疗多发性抽动症痰热动风证临床研究[J]. 中医学报, 2015, 30(11): 1650-1652. |
| [18] |
WANG Y, ZHAO L, LI A Y. Gastrodin-a potential drug used for the treatment of Tourette syndrome[J]. Journal of Pharmacological Sciences, 2021, 145(3): 289-295. DOI:10.1016/j.jphs.2021.01.005 |
| [19] |
WANG Y, NIE X B, LIU S J, et al. Curcumol attenuates endometriosis by inhibiting the JAK2/STAT3 signaling pathway[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2022, 28: e934914. |
2. Department of Traditional Chinese Medicine, Children's Hospital Affiliated to Zhengzhou University, Zhengzhou 450000, China
 2024, Vol. 41
2024, Vol. 41