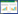文章信息
- 解锦香, 史斌琦, 马占强.
- XIE Jinxiang, SHI Binqi, MA Zhanqiang.
- 坤宁颗粒对痛经模型大鼠的抗炎镇痛作用研究
- Study on anti-inflammatory and analgesic effects of Kunning Granules on dysmenorrhea model rats
- 天津中医药, 2024, 41(1): 93-98
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 93-98
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.18
-
文章历史
- 收稿日期: 2023-08-30
坤宁颗粒源于24代中医世家峏山杨妇科圣方,处方由益母草、当归、赤芍、丹参、郁金、牛膝、枳壳、木香、荆芥炭、干姜炭、茜草等11种药材组成。本课题组前期研究发现坤宁颗粒具有良好的活血化瘀功效,可以显著降低气滞血瘀模型大鼠的全血黏度、血浆黏度[1],气滞血瘀是引起痛经的主要证型,临床研究表明坤宁口服液可以显著改善气滞血瘀型痛经[2],坤宁颗粒方中益母草、当归去瘀生新为君,赤芍、丹参、郁金、牛膝为臣,活血化瘀,调理冲任,活血化瘀中药能改善血液流变学、改善微循环,还能抑制炎症和镇痛[3]。然而坤宁颗粒对痛经模型大鼠的药理作用尚未研究,本实验初步研究坤宁颗粒对痛经模型大鼠血清中内分泌激素、炎症因子、氧化应激水平和子宫组织中相关蛋白表达的影响,探讨其抗炎镇痛的作用及机制,为坤宁颗粒的充分开发和应用提供实验参考依据。
1 材料 1.1 实验动物SPF级雌性未孕SD大鼠,体质量200~220 g,购自上海市计划生育科学研究所实验动物经营部,许可证号:SCXK(沪)2018-0006。大鼠饲养于中国药科大学药学动物实验中心,许可证号:SYXK(苏)2018-0019,室内温度为23~26 ℃,相对湿度为40%~70%,12 h明暗交替,自由摄食和饮水,适应性喂养1周后进行实验。该实验研究获得中国药科大学实验动物伦理委员会的批准(批准号2021-11-012)。
1.2 药品与试剂坤宁颗粒(生产批号:210501,宿州亿帆制药有限公司);戊酸雌二醇片(批号:627A,拜尔医药保健有限公司);缩宫素注射液(批号:210803,宁波第二雌激素厂);益母草颗粒[批号:20110165,北京同仁堂天然药物(唐山)有限公司];前列腺素F2α(PGF2α)试剂盒(E-EL-R0795c)、前列腺素E2(PGE2)试剂盒(E-EL-0034c)、β-内啡肽(β-EP)试剂盒(E-EL-R0105c)、雌二醇(E2)试剂盒(E-OSEL-R0001)、孕酮(PROG)试剂盒(E-EL-0154c)、白介素-1β(IL-1β)试剂盒(E-EL-R0012c)、白介素-6(IL-6)试剂盒(E-EL-R0015c)、肿瘤坏死因子-α(TNF-α)试剂盒(E-EL-R2856c)、超敏化学发光(ECL)试剂盒均为Elabscience公司产品;超氧化物歧化酶(SOD)试剂盒(批号20220314)、MDA试剂盒(批号20220314)、GSH-Px试剂盒(批号20220311)均为南京建成生物工程研究所产品;COX-2抗体(66351-1-lg)、GAPDH抗体(10494-1-AP)为Proteintech公司产品;PTGER2抗体(ab167171)、ERα抗体(ab32063)为abcam公司产品;HRP标记的山羊抗兔lgG抗体(货号BS13278)为Bioworlde公司产品;BCA蛋白浓度测定试剂盒(货号P0010)、PMSF(货号ST506)、RIPA裂解液(货号P0013B)均为碧云天生物技术有限公司产品;其余试剂均为国产分析纯试剂。
1.3 仪器5810R台式高速冷冻离心机(德国Eppendorf公司);全波长酶标仪(美国Thermo公司);ESP300电泳仪(上海天能科技有限公司);蛋白免疫印迹法(Western Blot)转膜系统(美国Bio-Rad公司);全自动化学发光成像系统(上海天能科技有限公司);BSA124S电子分析天平(北京赛多利斯科学仪器有限公司);切片扫描仪(Hamamatsu公司);-80 ℃超低温冰箱(中科美菱低温科技股份有限公司)。
2 方法 2.1 造模、分组及给药将雌性SD大鼠随机平均分为6组,正常对照组、模型组、益母草颗粒组(3.5 g/kg)、坤宁颗粒低剂量组(1.4 g/kg)、坤宁颗粒中剂量组(2.8 g/kg)、坤宁颗粒高剂量组(5.6 g/kg),每组10只,其中坤宁颗粒中剂量和阳性对照药益母草颗粒为临床用量,人与大鼠等效剂量换算比例按1∶7,药物用蒸馏水配制。除正常对照组外其余组大鼠进行造模:第1、10天灌胃给予戊酸雌二醇每只0.2 mg,第2~9天每只0.1 mg。从第5天开始灌胃给药,大鼠给药体积均为1 mL/10g,正常对照组和模型组灌胃给予等量蒸馏水,第10天末次给药1 h后,正常对照组腹腔注射生理盐水,其余各组每只大鼠腹腔注射缩宫素10 U。
2.2 扭体反应次数的检测注射缩宫素后将大鼠单独放在笼子里,立即观察30 min内大鼠的疼痛扭体反应,即为子宫强烈收缩的指标,计算扭体次数。扭体表现:腹部内凹,躯干与后肢伸展,臀部与一侧肢体内旋。扭体抑制率(%)=(模型组扭体数-给药组扭体数)/模型组扭体数×100%。
2.3 组织样本的采集扭体反应完成后,用10%水合氯醛麻醉大鼠后,腹主动脉取血,于室温静置1 h后,3 000 r/min离心15 min,离心半径9.6 cm,吸取上层血清。处死大鼠,取其子宫组织,用作苏木精-伊红(HE)染色和Western Blot检测。
2.4 ELISA检测大鼠血清中PGF2α、PGE2、β-EP、E2、PROG、IL-1β、IL-6、TNF-α水平按照酶联免疫吸附实验(ELISA)试剂盒说明分别测定各组大鼠血清中PGF2α、PGE2、β-EP、E2、PROG、IL-1β、IL-6、TNF-α水平,在450 nm下检测吸光度A值,用标准曲线算得其含量。
2.5 比色法检测大鼠血清中SOD、GSH-Px、MDA水平按照试剂盒说明书操作步骤要求,测定2.3中取得的大鼠血清中SOD、GSH-Px酶活力和MDA含量。
2.6 苏木精-伊红(HE)染色观察大鼠子宫组织病理形态将子宫组织置于4%多聚甲醛固定48 h,进行石蜡包埋、切片、HE染色观察子宫组织病理学变化,观察子宫内膜损伤程度及有无炎细胞浸润等现象。
2.7 Western Blot检测大鼠子宫组织COX-2、PTGER2、ERα蛋白表达从-80 ℃冰箱中取出保存的子宫组织,用含1% PMSF的RIPA裂解液匀浆提取蛋白,BCA法测定浓度,等量蛋白在SDS-PAGE凝胶经过电泳、转移到PVDF膜中,室温用5%脱脂奶粉封闭2 h,4 ℃过夜孵一抗,TBST室温洗涤3次,每次10 min,然后4 ℃孵二抗2 h,TBST室温洗涤3次,每次10 min,ECL曝光,仪器显影。用Image J软件分析灰度值以统计蛋白表达量。
2.8 统计学分析采用Graphpad Prism 7.00统计软件进行统计分析。所有实验数据符合正态分布且方差齐采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用Tukey检验,P<0.05为差异有统计学意义。
3 结果 3.1 坤宁颗粒对痛经模型大鼠扭体反应次数的影响结果如表 1所示,与正常对照组比较,模型组大鼠扭体反应次数显著升高(P<0.01)。与模型组比较,各给药组大鼠扭体反应次数显著降低(P<0.01)。扭体抑制率随剂量增加而递增,呈剂量相关性。
|
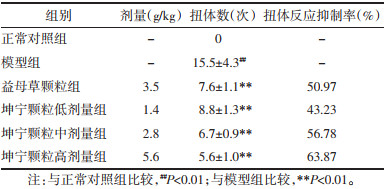
结果如表 2所示,与正常对照组比较,模型组大鼠血清中PGF2α含量明显升高(P<0.05),PGE2、β-EP含量显著下降(P<0.05或P<0.01)。与模型组相比,坤宁颗粒中、高剂量组PGF2α含量显著降低(P<0.01),PGE2、β-EP含量显著升高(P<0.05或P<0.01)。
|
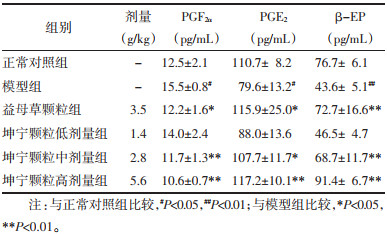
结果如表 3所示,与正常对照组比较,模型组大鼠血清中E2含量显著升高(P<0.01),PROG含量显著降低(P<0.01)。与模型组比较,坤宁颗粒中、高剂量组大鼠血清中E2含量显著降低(P<0.05或P<0.01),PROG含量显著升高(P<0.05或P<0.01)。
|
结果如表 4所示,与正常对照组比较,模型组大鼠血清炎症因子IL-1β、IL-6、TNF-α水平均显著升高(P<0.01)。与模型组比较,坤宁颗粒低、中、高剂量组IL-1β、TNF-α含量显著下降(P<0.01),坤宁颗粒中、高剂量组IL-6含量显著下降(P<0.05或P<0.01)。
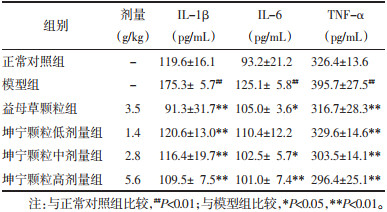
|
结果如表 5所示,与正常对照组比较,模型组大鼠血清中SOD和GSH-Px活性显著降低(P<0.05),MDA含量升高(P<0.01)。与模型组比较,坤宁颗粒中、高剂量组大鼠血清中SOD和GSH-Px活性显著升高(P<0.05或P<0.01),坤宁颗粒低、中、高剂量组大鼠血清中MDA含量显著降低(P<0.05或P<0.01)。
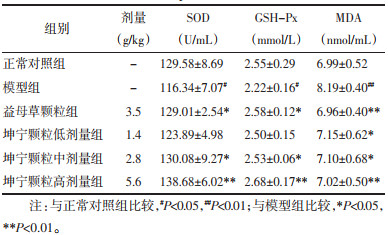
|
结果如图 1 HE染色显示,正常对照组子宫组织结构形态正常,未见明显改变,模型组大鼠子宫内膜和肌层充血、水肿严重,上皮细胞变性坏死等现象,与模型组比较,益母草颗粒组和坤宁颗粒各给药组大鼠子宫内膜和肌层充血水肿程度略减轻。
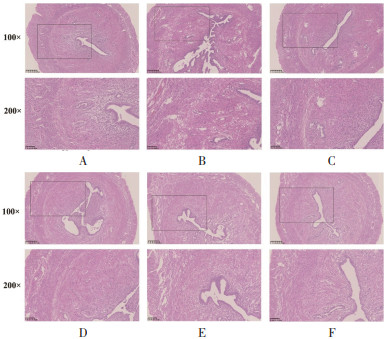
|
| 注:A,正常对照组;B,模型组;C,益母草颗粒组(3.5 g/kg);D,坤宁颗粒低剂量组(1.4 g/kg);E,坤宁颗粒中剂量组(2.8 g/kg);F,坤宁颗粒高剂量组(5.6 g/kg)。 图 1 坤宁颗粒对痛经模型大鼠子宫组织病理学的影响 Fig. 1 Effect of Kunning Granules on uterine histopathology in dysmenorrhea model rats |
结果如图 2所示,与正常对照组比较,模型组大鼠子宫组织COX-2蛋白相对表达量显著增加(P<0.05),PTGER2蛋白表达量显著降低(P<0.01)。与模型组比较,坤宁颗粒低、中、高剂量组大鼠子宫组织中COX-2蛋白相对表达量显著降低(P<0.01),坤宁颗粒高剂量组大鼠子宫组织中PTGER2蛋白相对表达量显著增加(P<0.01)。
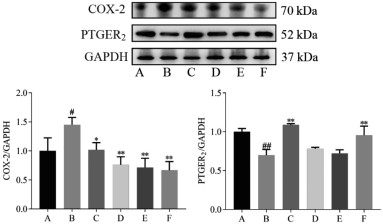
|
| 注:A,正常对照组;B,模型组;C,益母草颗粒组(3.5 g/kg);D,坤宁颗粒低剂量组(1.4 g/kg);E,坤宁颗粒中剂量组(2.8 g/kg);F,坤宁颗粒高剂量组(5.6 g/kg);与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 图 2 坤宁颗粒对痛经模型大鼠子宫组织COX-2、PTGER2蛋白表达的影响(x±s) Fig. 2 Effect of Kunning Granules on COX-2 and PTGER2 protein expression levels in uterine tissue of dysmenorrhea model rats(x±s) |
结果如图 3所示,与正常对照组比较,模型组大鼠子宫组织中ERα蛋白相对表达量显著增加(P<0.01)。与模型组相比,坤宁颗粒中、高剂量组大鼠子宫组织中ERα蛋白相对表达量显著降低(P<0.01)。
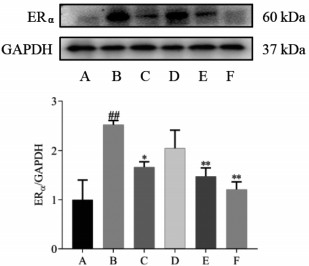
|
| 注:A,正常对照组;B,模型组;C,益母草颗粒组(3.5 g/kg);D,坤宁颗粒低剂量组(1.4 g/kg);E,坤宁颗粒中剂量组(2.8 g/kg);F,坤宁颗粒高剂量组(5.6 g/kg);与正常对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 图 3 坤宁颗粒对痛经模型大鼠子宫组织ERα蛋白表达的影响(x±s) Fig. 3 Effect of Kunning Granules on ERα protein expression levels in uterine tissue of dysmenorrhea model rats(x±s) |
本研究采用戊酸雌二醇致敏后再使用缩宫素致痛的方法制备PD大鼠模型,原因是雌二醇可增强子宫平滑肌细胞对缩宫素的敏感性,缩宫素可引起子宫强烈收缩,从而导致痛经的发生[4]。模型组大鼠扭体反应次数显著增加,表明模型建立成功。PGF2α是一种有效的血管收缩剂,PGF2α生成增加与子宫肌层强烈收缩引起血流受损有关,而PGE2活性取决于其受体激活的类型,PGE2与EP2型受体(PTGER2)结合通过升高细胞内环磷酸腺苷诱导子宫平滑肌松弛[5]。COX-2为诱导型酶,对花生四烯酸代谢产生的前列腺素负责炎症反应[6]。实验ELISA结果表明坤宁颗粒可以显著降低模型大鼠体内PGF2α含量,升高PGE2含量,并通过Western Blot对大鼠子宫组织COX-2、PTGER2蛋白表达水平进行测定,结果表明坤宁颗粒可以显著抑制COX-2蛋白表达水平,显著升高PTGER2表达水平,从而调节PGF2α和PGE2的合成和释放。β-EP是一种具有吗啡样活性的内源性镇痛多肽[7],其降低可引起疼痛,ELISA结果显示坤宁颗粒可以显著升高模型大鼠体内β-EP含量。这些结果表明坤宁颗粒有良好的调经止痛作用,可以显著减少戊酸雌二醇联合缩宫素诱发的大鼠扭体反应次数,抑制扭体反应的发生。
炎症反应过程中的各种介质,在痛经的发病过程中起到了重要作用[8]。IL-1β、IL-6、TNF-α等炎症因子可以刺激PGF2α的合成和释放,引起子宫平滑肌的过度收缩[9]。痛经模型大鼠血清中IL-1β、IL-6、TNF-α水平显著升高,坤宁颗粒各剂量组可以显著降低模型大鼠血清中炎症因子水平,并呈剂量依赖性关系,表明坤宁颗粒有显著的抗炎作用,且低、中、高剂量结果相差不明显,可能与坤宁颗粒的剂量设计偏大有关。病理学染色观察到模型组大鼠子宫组织充血、水肿等现象,坤宁颗粒给药组大鼠子宫组织形态逐渐改善。
炎症过程诱导氧化应激并降低细胞抗氧化能力,过度产生的活性氧与细胞膜脂肪酸和蛋白质反应,损害细胞功能[10]。正常情况下,机体的氧化与抗氧化处于一种动态平衡的状态,当机体抗氧化状态降低,抗氧化酶如SOD、GSH-Px活性降低,MDA水平升高[11]。实验结果表明坤宁颗粒能够显著提高痛经模型大鼠血清中SOD、GSH-Px活性,显著降低MDA含量,从而通过抗氧化损伤而发挥抗炎作用。
PROG也是一种重要的抗炎激素,研究表明PROG可以降低脂质过氧化,减轻氧化应激以及减少炎性细胞因子IL-1β、TNF-α的释放,并抑制COX-2的信号激活[12-13]。实验ELISA结果表明模型组大鼠体内PROG水平显著降低,而坤宁颗粒中、高剂量组大鼠体内PROG水平显著升高。过量的E2可以促进炎症反应,促进ERα的生成[14],较高的ERα表达可增加疼痛相关反应[15],ELISA结果和Western Blot结果表明模型组大鼠经过雌激素增敏后E2的含量和ERα的表达显著上升,而坤宁颗粒能显著降低痛经模型大鼠E2的含量和ERα的表达。研究表明活血化瘀药具有雌激素样作用[16],能与ERα结合介导血管舒张[17],因此可以增加血流量,改善子宫血液循环,缓解子宫局部缺血缺氧的状态,进而缓解疼痛,其具体作用机制有待进一步深入研究。
综上所述,痛经模型大鼠体内疼痛、炎症反应显著增加,坤宁颗粒可以显著通过下调COX-2/PGF2α水平,升高PTGER2受体介导的PGE2水平,改善子宫平滑肌收缩,提高镇痛效应,并显著降低炎症因子水平,改善氧化应激达到抗炎镇痛作用,还可以通过调节雌孕激素及ERα水平,起到抗炎、舒张血管作用,从而缓解气滞血瘀型痛经症状。
| [1] |
解锦香, 史斌琦, 马世平, 等. 坤宁颗粒治疗功能性子宫出血的实验研究[J]. 中南药学, 2023, 21(4): 940-944. |
| [2] |
李晋琼, 蔡春仙, 刘丽萍. 坤宁口服液治疗青少年气滞血瘀型痛经的临床疗效观察[J]. 转化医学电子杂志, 2016, 3(12): 25-26. |
| [3] |
高冲, 刘璐, 胡爱菊, 等. 活血化瘀中药的药理作用研究进展[J]. 药物评价研究, 2013, 36(1): 64-68. |
| [4] |
陈兆恒, 任奎羽, 李雪梅, 等. 不同中医证型原发性痛经动物模型制备及评价的研究进展[J]. 成都中医药大学学报, 2020, 43(3): 52-56. |
| [5] |
ROBELDO T, CANZI E F, DE ANDRADE P M, et al. Effect of Tahiti lime(Citrus latifolia)juice on the Production of the PGF2α/PGE2 and pro-inflammatory cytokines involved in Menstruation[J]. Scientific Reports, 2020, 10(1): 7063. DOI:10.1038/s41598-020-63477-8 |
| [6] |
HATA A N, BREYER R M. Pharmacology and signaling of prostaglandin receptors: multiple roles in inflammation and immune modulation[J]. Pharmacology & Therapeutics, 2004, 103(2): 147-166. |
| [7] |
PILOZZI A, CARRO C, HUANG X D. Roles of β-endorphin in stress, behavior, neuroinflammation, and brain energy metabolism[J]. International Journal of Molecular Sciences, 2020, 22(1): 338. DOI:10.3390/ijms22010338 |
| [8] |
谢丹, 居明乔, 曹鹏, 等. 炎症因子和原发性痛经相关性的研究进展[J]. 中国临床药理学与治疗学, 2014, 19(3): 346-350. |
| [9] |
BARCIKOWSKA Z, RAJKOWSKA-LABON E, GRZYBOWSKA M E, et al. Inflammatory markers in dysmenorrhea and therapeutic options[J]. International Journal of Environmental Research and Public Health, 2020, 17(4): 1191. |
| [10] |
KHANSARI N, SHAKIBA Y, MAHMOUDI M. Chronic inflammation and oxidative stress as a major cause of age-related diseases and cancer[J]. Recent Patents on Inflammation & Allergy Drug Discovery, 2009, 3(1): 73-80. |
| [11] |
SZMIDT M K, GRANDA D, SICINSKA E, et al. Primary dysmenorrhea in relation to oxidative stress and antioxidant status: a systematic review of case-control studies[J]. Antioxidants, 2020, 9(10): 994. |
| [12] |
AZEEZ J M, SUSMI T R, REMADEVI V, et al. New insights into the functions of progesterone receptor(PR)isoforms and progesterone signaling[J]. American Journal of Cancer Research, 2021, 11(11): 5214-5232. |
| [13] |
CRITCHLEY H O D, OSEI J, HENDERSON T A, et al. Hypoxiainducible factor-1alpha expression in human endometrium and its regulation by prostaglandin E-series prostanoid receptor 2(EP2)[J]. Endocrinology, 2006, 147(2): 744-753. |
| [14] |
HUANG Z X, MAO X M, WU R F, et al. RhoA/ROCK pathway mediates the effect of oestrogen on regulating epithelial-mesenchymal transition and proliferation in endometriosis[J]. Journal of Cellular and Molecular Medicine, 2020, 24(18): 10693-10704. |
| [15] |
PLUCHINO N, MAMILLAPALLI R, WENGER J M, et al. Estrogen receptor-α immunoreactivity predicts symptom severity and pain recurrence in deep endometriosis[J]. Fertility and Sterility, 2020, 113(6): 1224-1231. e1. |
| [16] |
张晓晓, 刘胜, 薛晓红. 具有雌激素类似作用的中药研究进展[J]. 中西医结合学报, 2005, 3(2): 149-153. |
| [17] |
FAN G W, ZHU Y, GUO H, et al. Direct vasorelaxation by a novel phytoestrogen tanshinoneⅡA is mediated by nongenomic action of estrogen receptor through endothelial nitric oxide synthase activation and calcium mobilization[J]. Journal of Cardiovascular Pharmacology, 2011, 57(3): 340-347. |
 2024, Vol. 41
2024, Vol. 41