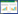文章信息
- 石明亮, 王晓磊, 申洋, 等.
- SHI Mingliang, WANG Xiaolei, SHEN Yang, et al.
- 茯苓酸调节Hippo信号通路对二乙基亚硝胺诱导的肝癌大鼠的治疗作用研究
- Therapeutic effect of pachymic acid on diethylnitrosamine induced hepatoma in rats by regulating Hippo signaling pathway
- 天津中医药, 2024, 41(1): 99-105
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 99-105
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.19
-
文章历史
- 收稿日期: 2023-09-19
2. 河南大学第一附属医院消化内科, 开封 475000
原发性肝癌是世界范围内最常见的恶性肿瘤之一,其发病隐匿且进展快,多数患者就诊时已进入中晚期或发生了转移,致使失去手术最佳治疗机会,而因严重的肝功能减退又无法耐受长期放化疗,故临床治疗难度大且效果差,患者生存率不高[1-2]。炎症因子作用于癌症细胞引发的炎症是癌症发生发展的易感条件,Hippo作为调控细胞再生和器官发育的保守信号,可通过调控炎症介导前列腺癌的发生发展[3],Yes相关蛋白(YAP)作为Hippo通路的主要关键效应物之一,促使YAP信号失活可通过调控免疫与抑制炎症而抑制肿瘤发生[4],Hippo信号是肝癌发生所必需的,阻止其激活可抑制肝癌进展并导致其肿瘤消退[5],由此靶向Hippo来控制炎症是肝癌的潜在防治策略。茯苓酸是自利水渗湿药茯苓中提取的一种蒽酮型三萜化合物,在茯苓中的含量为0.07%~0.09%,具有显著的抗氧化、抗衰老、抗炎和抗癌等生物学活性,可抑制不同类型癌症细胞的生长并诱导其凋亡,能有效降低肝癌细胞HepG2和Huh7的生长和转移潜力[6],并能抑制肾癌和结肠癌细胞增殖、迁移和侵袭[7-8],二乙基亚硝胺引发大鼠免疫异常激活,诱发肝脏严重炎症损伤是诱导大鼠肝脏发生癌变的重要原因,因而推测茯苓酸可能通过其抗炎功效对DEN诱导的肝癌发挥治疗作用,本文通过制备DEN诱导的肝癌大鼠模型,探究茯苓酸调节Hippo信号通路对其的治疗作用。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级SD雄性大鼠(7周龄,体质量220~250 g)采购于济南朋悦实验动物繁育有限公司,生产许可证号:SCXK(鲁)2019-0003,于本院维持屏障环境且温度为23~25 ℃的动物房中饲养,房内相对湿度为50%~60%,光照为黑暗交替进行(明暗各12 h)。
1.1.2 主要试剂与仪器二乙基亚硝胺(DEN)(批号N109570)采购于上海阿拉丁生化科技股份有限公司;茯苓酸[纯度98.1%,密度(1.1±0.1)g/cm3,沸点(612.2±55.0)℃,760 mmHg(1 mmHg≈0.133 kPa),可溶于甲醇、乙醇、二甲基亚砜(DMSO)等有机溶剂,批号10015]采购于上海诗丹德标准技术服务有限公司;氟尿嘧啶(批号100187-200602)采购于上海劲马实验设备有限公司;大鼠白细胞介素(IL)-6酶联免疫吸附实验(ELISA)试剂盒、大鼠IL-17 ELISA试剂盒、大鼠肿瘤坏死因子-α(TNF-α)ELISA试剂盒采购于江苏科惟生物技术有限公司;超氧化物歧化酶(SOD)活性检测试剂盒、过氧化氢酶(CAT)活性检测试剂盒、丙二醛(MDA)检测试剂盒采购于上海尚宝生物科技有限公司;苏木精-伊红(HE)染色试剂盒、兔抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)、LATS1、p-YAP1及YAP1一抗、辣根过氧化物酶标记的山羊抗兔二抗采购于美国Abcam公司等。
全自动生化分析仪(型号BK-200)采购于山东博浩生物科技有限公司;全自动冰冻切片机(型号HS-4080)采购于济南来宝医疗器械有限公司;倒置生物显微镜(型号AI-WSI3000)采购于广州微域光学仪器有限公司;酶标仪(型号Model 680)、小型垂直电泳套装(型号Mini-PROTEANTetra)采购于美国Bio-Rad公司等。
1.2 方法 1.2.1 肝癌大鼠模型的建立及分组给药以0.9%氯化钠溶液溶解DEN制为10 mg/mL的储备液备用,取SD大鼠随机分为对照组、模型组、茯苓酸低剂量组、茯苓酸中剂量组、茯苓酸高剂量组、氟尿嘧啶组,每组10只,模型组和给药组大鼠通过腹腔注射DEN诱导建立肝癌模型,具体方法参照文献[9]:按5 mL/kg进行腹腔注射,使DEN注射剂量达到50 mg/kg,每周注射2次,连续注射4周后改为每周注射1次,持续8周即完成造模,对照组大鼠腹腔注射等剂量0.9%氯化钠溶液,造模大鼠随机选出5只开腹检测成癌情况,发现大鼠肝脏形态肿大且质地变硬,表面粗糙并有大量大小不一、密集排布的白色颗粒状结节出现,即可表明肝癌造模成功,造模成瘤率为100%。
以0.9%氯化钠溶液溶解茯苓酸制为0.35、0.7、1.4 mg/mL的药液备用,以0.9%氯化钠溶液溶解氟尿嘧啶制为5 mg/mL的药液备用,各组大鼠均于造模4周后开始给药直至造模结束:茯苓酸低剂量组、茯苓酸中剂量组、茯苓酸高剂量组大鼠分别腹腔注射0.35、0.7、1.4 mg/mL的茯苓酸药液10 mL/kg(使茯苓酸剂量分别达到3.5、7、14 mg/kg,1次/d)[10];氟尿嘧啶组大鼠腹腔注射5 mg/mL的氟尿嘧啶药液10 mL/kg(使氟尿嘧啶剂量分别达到50 mg/kg,每周1次)[11];模型组和对照组大鼠腹腔注射0.9%氯化钠溶液10 mL/kg,各组大鼠均给药处理8周。
1.2.2 检测各组大鼠体质量、肝功能、肝脏指数、肝表面癌结节数、最大癌结节体积及采集标本首次给药后称量各组大鼠体质量,记为第0周,每隔1周测量1次体质量,直至第4周给药结束;末次给药后24 h以乙醚麻醉各组大鼠,采集其尾静脉血离心(4 ℃、1 000 r/min、10 min,离心半径20 cm)取血清,采用全自动生化分析仪检测其中肝功能指标谷丙转氨酶(ALT)、谷草转氨酶(AST)水平;再次采集尾静脉血离心(4 ℃、1 000 r/min、10 min,离心半径20 cm)取血清后将其存在-80℃冰箱保存;称量各组大鼠体质量后开腹取出肝脏,称出其质量后计算肝脏指数,公式为:肝脏指数=肝脏质量/体质量×100%,计数肝脏表面癌结节数量,测量出其中最大癌结节长径a、短径b后算出其体积,公式为:最大癌结节体积=ab2/2;剪下约0.4 g肝组织存在液氮内,剩余肝组织固定于10%甲醛内过夜,然后依次浸泡分级乙醇(70%、80%、90%、100%)脱水、二甲苯透明及浸蜡包埋,修成小方块后进行连续切片备用。
1.2.3 HE染色检测各组大鼠肝组织病理形态肝组织石蜡切片浸泡二甲苯脱蜡、分级乙醇(100%、90%、80%、70%)水化后用HE试剂盒内染色行HE染色,然后在倒置生物显微镜下观察各组大鼠肝组织病理形态,并采集切片任意6个视野图像,用Image J软件定量每个视野中浸润的炎性细胞数目,取平均值得到各组的炎性细胞浸润数。
1.2.4 测定各组大鼠血清炎症因子IL-6、IL-17、TNF-α与氧化应激因子SOD、CAT、MDA的水平各组大鼠血清取出放入冰水浴中提前解冻,采用试剂盒测量其中炎症因子IL-6、IL-17、TNF-α与氧化应激因子SOD、CAT、MDA水平,具体步骤参照各自试剂盒说明书进行操作。
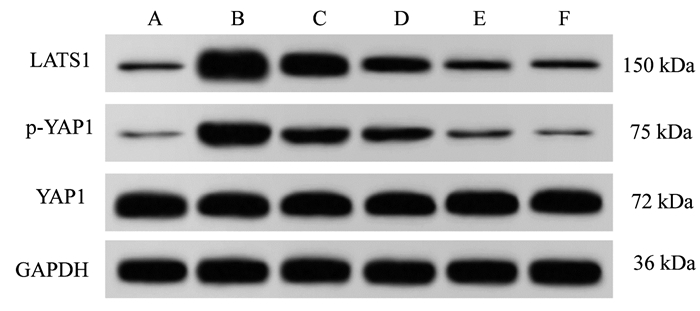
1.2.5 蛋白免疫印迹法检测各组大鼠肝组织Hippo信号通路相关蛋白表达各组大鼠肝组织剪碎加入预冷的RAPI裂解液内,于冰水浴中高速研磨成匀浆液,4 ℃离心(3 000 r/min、20 min,离心半径20 cm)取上清获得各组总蛋白样品液,以BCA法测出其中蛋白浓度,然后于沸水浴内加热致使蛋白变性,每组取出20 μg总蛋白样本通过跑SDS-PAGE电泳进行分离,然后通过湿转将其电转至PVDF膜上,将LATS1、p-YAP1、GAPDH、YAP1蛋白条带自膜上剪下,封闭其非特异位点后行抗原抗体反应(分别孵育相对应一抗和二抗),经化学发光显色后采集各组蛋白条带图像,用Quantity One软件定量其灰度值后算出各待测蛋白与内参GAPDH蛋白间比值,即得出各组待测蛋白相对表达水平。
1.3 统计学方法实验数据采用GraphPad Prism 8.0软件行多分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
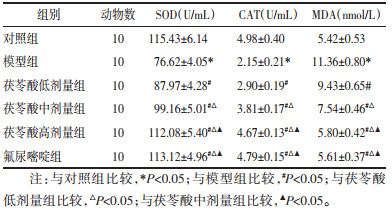
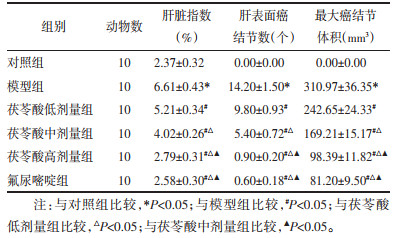
2 结果 2.1 茯苓酸对大鼠肝功能的影响与对照组比较,模型组大鼠给药结束后体质量显著降低(P<0.05),血清肝功能指标ALT、AST水平显著升高(P<0.05);与模型组比较,茯苓酸低、中、高剂量组、氟尿嘧啶组大鼠给药结束后体质量升高(P<0.05),血清肝功能指标ALT、AST水平降低,且茯苓酸各组呈剂量依赖性(P<0.05);茯苓酸高剂量组与氟尿嘧啶组大鼠比较,给药结束后体质量与血清肝功能指标ALT、AST水平差异无统计学意义(P>0.05)。见图 1、表 1。
|
| 注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与茯苓酸低剂量组比较,△P<0.05;与茯苓酸中剂量组比较,▲P<0.05。 图 1 各组大鼠在给药期间的体质量变化曲线 Fig. 1 Body weight change curves of rats in each group during administration |
与对照组比较,模型组大鼠肝脏指数、肝表面癌结节数、最大癌结节体积显著升高(P<0.05);与模型组比较,茯苓酸低、中、高剂量组、氟尿嘧啶组大鼠肝脏指数、肝表面癌结节数、最大癌结节体积降低,且茯苓酸各组呈剂量依赖性(P<0.05);茯苓酸高剂量组与氟尿嘧啶组大鼠比较,肝脏指数、肝表面癌结节数、最大癌结节体积差异无统计学意义(P>0.05)。见图 2、表 2。
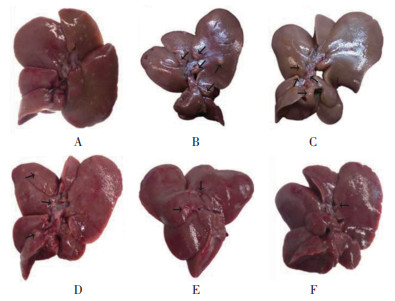
|
| 注:A,对照组;B,模型组;C,茯苓酸低剂量组;D,茯苓酸中剂量组;E,茯苓酸高剂量组;F,氟尿嘧啶组;黑色箭头指示癌结节。 图 2 各组大鼠肝脏及肿瘤大体观察 Fig. 2 Gross observation of liver and tumor of rats in each group |
|
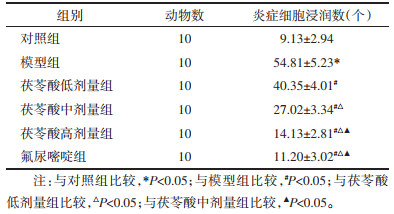
对照组大鼠肝小叶结构正常,肝组织无病理损伤;模型组大鼠肝组织发生癌变:肝小叶结构受损被分割,肝细胞大小不一且变性坏死,可见细胞核且呈双核、多核等病理性分裂象的肝癌细胞大量增加,并呈巢状、梁状或灶状排列,瘤灶内伴有炎症细胞浸润,模型组大鼠炎症细胞浸润数相比对照组显著升高(P<0.05);与模型组比较,茯苓酸低、中、高剂量组、氟尿嘧啶组大鼠肝组织上述癌变症状均减轻,且癌变减轻程度随茯苓酸剂量升高而增强,炎症细胞浸润数降低且茯苓酸各组呈剂量依赖性(P<0.05);茯苓酸高剂量组与氟尿嘧啶组大鼠比较,肝组织癌变减轻程度无明显差异,炎症细胞浸润数差异无统计学意义(P>0.05)。见图 3、表 3。

|
| 注:A,对照组;B,模型组;C,茯苓酸低剂量组;D,茯苓酸中剂量组;E,茯苓酸高剂量组;F,氟尿嘧啶组;黑色箭头指示炎性细胞浸润。 图 3 各组大鼠肝组织病理形态(×200) Fig. 3 Pathological morphology of liver tissue of rats in each group(×200) |
|
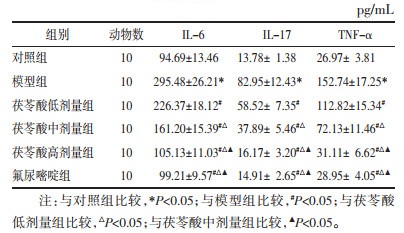
与对照组比较,模型组大鼠血清IL-6、IL-17、TNF-α水平显著升高(P<0.05);与模型组比较,茯苓酸低、中、高剂量组、氟尿嘧啶组大鼠血清IL-6、IL-17、TNF-α水平降低,且茯苓酸各组呈剂量依赖性(P<0.05);茯苓酸高剂量组与氟尿嘧啶组大鼠比较,血清IL-6、IL-17、TNF-α水平差异无统计学意义(P>0.05)。见表 4。
|
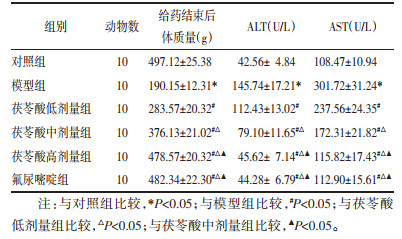
与对照组比较,模型组大鼠血清SOD、CAT水平显著降低(P<0.05),MDA水平显著升高(P<0.05);与模型组比较,茯苓酸低、中、高剂量组、氟尿嘧啶组大鼠血清SOD、CAT水平升高(P<0.05),MDA水平降低(P<0.05),且茯苓酸各组呈剂量依赖性(P<0.05);茯苓酸高剂量组与氟尿嘧啶组大鼠比较,血清SOD、CAT、MDA水平差异无统计学意义(P>0.05)。见表 5。
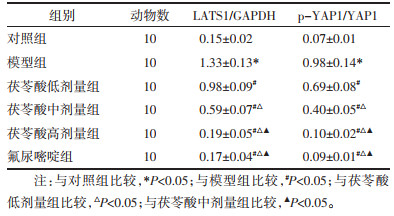
与对照组比较,模型组大鼠肝组织LATS1蛋白表达及p-YAP1/YAP1显著升高(P<0.05);与模型组比较,茯苓酸低、中、高剂量组、氟尿嘧啶组大鼠肝组织LATS1蛋白表达及p-YAP1/YAP1降低(P<0.05),且茯苓酸各组呈剂量依赖性(P<0.05);茯苓酸高剂量组与氟尿嘧啶组大鼠比较,LATS1蛋白表达及p-YAP1/YAP1差异无统计学意义(P>0.05)。见图 4、表 6。
|
| 注:A,对照组;B,模型组;C,茯苓酸低剂量组;D,茯苓酸中剂量组;E,茯苓酸高剂量组;F,氟尿嘧啶组。 图 4 各组大鼠肝组织Hippo信号通路相关蛋白表达 Fig. 4 Hippo signaling pathway related protein expression in liver tissue of rats in each group |
|
目前中国肝癌发病率年年上升,如今已成为排在第2位的造成癌症性死亡的恶性肿瘤,临床主要以化学药物进行治疗,但存在诸如不良反应大、易产生耐药性等局限性,因此要提高肝癌患者生存率和生活质量还需探寻更有效且安全的新型药物[12-13]。本文采用腹腔注射DEN诱导建立肝癌大鼠模型,实验结果发现模型组大鼠血清SOD、CAT水平显著降低,血清ALT、AST、IL-6、IL-17、TNF-α与MDA水平、肝组织炎症细胞浸润数显著升高,表明DEN引发大鼠体内严重炎症与氧化应激,揭示炎症及氧化应激引起的肝组织损伤是DEN诱导肝癌的重要病理基础。
茯苓是一种利水渗湿类中药,具有安神、宁心、健脾、利水、渗湿的功能,茯苓酸作为茯苓的主要活性成分之一,可发挥抗炎、抗氧化、免疫调节和抗肿瘤的药理作用,能呈剂量依赖性地降低宫颈癌细胞活力并抑制其在裸鼠体内生长[6, 14],还可用于肺癌的治疗,降低肺癌细胞活性及其耐药蛋白表达[15],并可显著抑制肝癌细胞生长、上皮-间质转化、侵袭、迁移和转移[6],因而推测茯苓酸可能用于治疗肝癌。本文以不同剂量茯苓酸处理DEN诱导的肝癌大鼠,可升高大鼠血清SOD、CAT水平并降低其血清ALT、AST、IL-6、IL-17、TNF-α与MDA水平、炎症细胞浸润数,与文献[10]研究结果相似,证实了茯苓酸具有抗炎功效,但本文还表明茯苓酸可增强抗氧化酶活性,对DEN诱发的炎症和氧化应激起到明显抑制作用;茯苓酸还可升高DEN诱导的肝癌大鼠体质量,减轻其肝组织癌变症状,降低其肝脏指数、肝表面癌结节数、肿瘤质量,且呈剂量依赖性,与文献[6, 14-15]研究结果相似,证实了茯苓酸具有抗癌活性,且表明了茯苓酸可减轻DEN诱导的大鼠肝组织癌变症状,减少其肝组织内肿瘤结节形成,改善大鼠肝功能,最终发挥明显的抗癌作用,且剂量越高,作用越强,揭示茯苓酸在肝癌的防治中具有很高的研发应用潜力。
Hippo是重要的致癌信号,在癌症发生发展过程中处于异常激活状态,抑制其激活可减轻结直肠癌的生长和肝转移[16],研究显示刺激Hippo信号激活可促进肝细胞癌细胞的干性和化疗耐药性的产生,抑制Hippo信号传导可显著降低肝细胞癌的干细胞特性和索拉非尼、乐伐替尼耐药性,增强化疗药物对体内肿瘤的消退作用,最终对肝癌发挥显著抗癌功效[5, 17]。本文结果显示,DEN诱导的肝癌大鼠肝组织Hippo信号通路相关蛋白LATS1表达及YAP1磷酸化显著升高,而不同剂量茯苓酸处理的大鼠肝组织LATS1蛋白表达及YAP1磷酸化相比肝癌模型大鼠降低,表明Hippo信号参与介导DEN诱导的肝癌发生发展过程,且茯苓酸延缓DEN诱导的大鼠肝癌发生时可抑制Hippo信号激活,揭示茯苓酸治疗DEN诱导的肝癌大鼠的分子机制可能是阻止Hippo信号激活,本文首次证实了Hippo信号参与茯苓酸对DEN诱导的肝癌大鼠的治疗过程,对于临床研发茯苓酸的肝癌治疗方案提供了新的理论依据,并可发挥一定积极作用。
综上所述,茯苓酸可降低Hippo信号通路相关蛋白LATS1表达及YAP1磷酸化,阻止DEN诱导的炎症和氧化应激反应发生发展,抑制大鼠肝组织癌变及肝组织内肿瘤结节形成,修复其肝功能,对DEN诱导的肝癌大鼠起到显著的治疗作用,抑制Hippo信号激活可能是药理机制之一,本文为临床治疗肝癌提供了新的治疗思路和药物候选,有助于患者预后的改善,但本文对茯苓酸治疗肝癌的药理机制只进行了初步研究,其证据效力存在一定不足,后续需要用Hippo信号激活剂和抑制剂进行实验来作对照验证。
| [1] |
RUMGAY H, ARNOLD M, FERLAY J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. Journal of Hepatology, 2022, 77(6): 1598-1606. DOI:10.1016/j.jhep.2022.08.021 |
| [2] |
MAKI H, HASEGAWA K. Advances in the surgical treatment of liver cancer[J]. Bioscience Trends, 2022, 16(3): 178-188. DOI:10.5582/bst.2022.01245 |
| [3] |
TANG Q F, FANG J, LAI W Q, et al. Hippo pathway monomerizes STAT3 to regulate prostate cancer growth[J]. Cancer Science, 2022, 113(8): 2753-2762. DOI:10.1111/cas.15463 |
| [4] |
HAO F. An overview of the crosstalk between YAP and cGAS-STING signaling in non-small cell lung cancer: It takes two to tango[J]. Clinical and Translational Oncology, 2022, 24(9): 1661-1672. DOI:10.1007/s12094-022-02826-7 |
| [5] |
LIANG B Y, WANG H C, QIAO Y, et al. Differential requirement of Hippo cascade during CTNNB1 or AXIN1 mutation-driven hepatocarcinogenesis[J]. Hepatology, 2023, 77(6): 1929-1942. DOI:10.1002/hep.32693 |
| [6] |
JIANG F, ZHU T M, YANG C F, et al. Pachymic acid inhibits growth and metastatic potential in liver cancer HepG2 and Huh7 cells[J]. Biological & Pharmaceutical Bulletin, 2023, 46(1): 35-41. |
| [7] |
罗园园, 冯心怡, 褚泽文, 等. 茯苓酸通过Smads调控MMP/TIMP平衡抑制肾癌细胞侵袭转移的机制[J]. 中国实验方剂学杂志, 2023, 29(7): 76-83. |
| [8] |
刘婉, 晋颖, 冯晓洁, 等. 茯苓酸对结肠癌细胞增殖凋亡、迁移侵袭及PERK/ATF4信号通路蛋白表达的影响[J]. 山东医药, 2023, 63(6): 38-42. |
| [9] |
杨芙蓉, 杜沙莉, 付传奎, 等. 大黄虫丸对肝癌大鼠糖脂代谢及免疫功能的影响[J]. 中华中医药杂志, 2022, 37(8): 4378-4382. |
| [10] |
陈云, 王婷婷, 郝明明, 等. 茯苓酸对LPS诱导的急性肺损伤小鼠的保护作用及机制[J]. 广东药科大学学报, 2022, 38(1): 83-89. |
| [11] |
朱晓燃, 杨振寰, 索菲娅, 等. 清肝化瘀颗粒对二乙基亚硝胺所致原发性肝癌大鼠的治疗作用[J]. 中国中西医结合消化杂志, 2021, 29(3): 161-165. DOI:10.3969/j.issn.1671-038X.2021.03.01 |
| [12] |
HUANG D Q, SINGAL A G, KONO Y, et al. Changing global epidemiology of liver cancer from 2010 to 2019: NASH is the fastest growing cause of liver cancer[J]. Cell Metabolism, 2022, 34(7): 969-977.e2. DOI:10.1016/j.cmet.2022.05.003 |
| [13] |
CHENG K, CAI N, ZHU J H, et al. Tumor-associated macrophages in liver cancer: from mechanisms to therapy[J]. Cancer Communications, 2022, 42(11): 1112-1140. DOI:10.1002/cac2.12345 |
| [14] |
YANG T, TIAN S J, WANG Y H, et al. Antitumor activity of pachymic acid in cervical cancer through inducing endoplasmic reticulum stress, mitochondrial dysfunction, and activating the AMPK pathway[J]. Environmental Toxicology, 2022, 37(9): 2121-2132. DOI:10.1002/tox.23555 |
| [15] |
ZHANG J, LIU L, LI H, et al. Pharmacokinetic study on the interaction between pachymic acid and bavachin and its potential mechanism[J]. Pharmaceutical Biology, 2021, 59(1): 1256-1259. |
| [16] |
LIU X, QUAN J, SHEN Z L, et al. Metallothionein 2A (MT2A) controls cell proliferation and liver metastasis by controlling the MST1/LATS2/YAP1 signaling pathway in colorectal cancer[J]. Cancer Cell International, 2022, 22(1): 205. DOI:10.1186/s12935-022-02623-w |
| [17] |
WANG J H, YU H M, DONG W, et al. N6-methyladenosine-mediated up-regulation of FZD10 regulates liver cancer stem cells' properties and lenvatinib resistance through WNT/β-catenin and hippo signaling pathways[J]. Gastroenterology, 2023, 164(6): 990-1005. DOI:10.1053/j.gastro.2023.01.041 |
2. Department of Gastroenterology, The First Affiliated Hospital of Henan University, Kaifeng 475000, China
 2024, Vol. 41
2024, Vol. 41