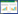文章信息
- 孔一晗, 刘信邦, 常柏, 等.
- KONG Yihan, LIU Xinbang, CHANG Bai, et al.
- 黄芪多糖减轻糖尿病性肌少症大鼠肌肉萎缩的作用机制研究
- Study on the mechanism of Astragalus polysaccharide alleviating muscle atrophy in diabetic sarcopenia rats
- 天津中医药, 2024, 41(1): 106-110
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 106-110
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.20
-
文章历史
- 收稿日期: 2023-08-05
近年来,糖尿病的发病率逐渐上升,预计到2045年,全球糖尿病患者将达到7亿[1],在中国,60岁以上人群的糖尿病患病率为14.7%[2],糖尿病常伴发各种并发症,除糖尿病肾病、糖尿病视网膜病变等常见的并发症之外,糖尿病合并肌少症也是值得关注的问题。骨骼肌约占人体总质量的40%,是人体重要组织和代谢器官,不仅能够维持身体姿势和参与运动,在糖代谢过程中也发挥着重要作用。肌少症是一种以骨骼肌肌力、耐力以及质量下降,影响生活质量,甚至造成残疾乃至死亡的退行性综合征[3-4]。
糖尿病患者因内分泌代谢紊乱、血管病变及神经病变等因素,易合并肌少症,造成肌肉萎缩等不良后果[5],同时,肌少症的发生又可通过影响血糖调节、机体代谢等途径加速糖尿病的发生发展[6]。在高糖状态下,骨骼肌中的micro RNA-106表达量上升,而自噬能力下降,加剧脂肪在骨骼肌中的沉积,导致肌萎缩的出现[7]。此外,发生肌萎缩的组织中卫星细胞数量减少,肌肉与周围肌腱韧带的连接减弱,关节生物力学发生改变,对生活质量造成影响[8]。现代医学研究发现,2型糖尿病患者合并肌少症的比例高达18%[9],因此对于糖尿病合并肌少症的研究刻不容缓。
目前,对于糖尿病合并肌少症的治疗尚不完善,除了营养支持、运动疗法等预防性的手段,西医药物治疗也存在一些局限性[10]。中医认为,“脾不散精”是糖尿病患者血糖异常升高的重要环节[11],而肌少症属于痿症,脾主肌肉[12],因此糖尿病合并肌少症的治疗多从补气健脾、益气养阴层面开展。黄芪多糖是黄芪的主要活性成分之一,近年来相关研究发现黄芪多糖具有抗炎、抗衰老、降低血糖、免疫调节等多种作用[13],其性味甘微温,归脾、肺两经,兼具补气健脾、敛疮生肌、利尿排脓之功效[14],其应用于糖尿病肾病、糖尿病视网膜病变等常见并发症已有相关报道,但对于治疗糖尿病合并肌少症的研究少之又少,因此本文将通过动物实验探究黄芪多糖对糖尿病相关性肌少症的治疗效果及其作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物SD大鼠(雄性,8月龄),许可证号:SCXK(京)2019-0010,来自北京斯贝福生物技术有限公司,SPF级,体质量(400±50)g,饲养于天津医科大学朱宪彝纪念医院实验动物中心,湿度60%~80%,温度18~23 ℃,给予充分光照,此次动物实验通过了天津医科大学朱宪彝纪念医院的动物实验伦理委员会批准(批号:DXBYY-IACUC-2021054)。
1.1.2 仪器与试剂仪器:荧光定量PCR仪(Applied Biosystems);离心机(Eppendorf);蛋白电泳仪(美国Bio-Rad公司)。试剂:PCR试剂盒购自北京全式金生物公司;Trizol总RNA提取试剂盒、RIPA裂解液、PMSF、链脲佐菌素(STZ)由索莱宝提供;预染蛋白Marker由Thermo提供;PAGE凝胶快速制备试剂盒购自雅酶生物;黄芪多糖来自罗恩公司;盐酸二甲双胍购于中美上海施贵宝制药有限公司(国药准字H20023370),抗体购自Sigma公司;引物来自擎科生物,引物序列见表 1。
SD大鼠分为4组,每组6只,分别为正常组、模型组、黄芪多糖组、二甲双胍组,除正常组以外,根据相关文献,其余3组于适应性喂养1个月后按55 mg/kg的剂量一次性腹腔注射STZ制备糖尿病大鼠模型,注射7 d后连续3 d血糖>16.7 mmol/L代表造模成功。之后进行分组灌胃给药,根据相关文献及前期实验总结,黄芪多糖组每日给予800 mg/kg的黄芪多糖灌胃[15]、西药二甲双胍组每日给予105 mg/kg的二甲双胍灌胃,正常及模型组给予同等剂量的生理盐水灌胃。
1.2.2 苏木精-伊红(HE)染色大鼠给药3个月后麻醉处死,取腓肠肌组织进行包埋、切片、HE染色,在全自动扫描仪上观察腓肠肌形态并留存图像。
1.2.3 蛋白免疫印迹法(Western Blot)检测将腓肠肌组织放于-80 ℃,提前配置好凝胶,取部分组织进行蛋白提取,上样电泳结束后进行转膜,牛奶封闭、TBST缓冲液摇动清洗,一抗4 ℃孵育过夜、二抗孵育,最后在暗箱进行条带曝光并保存。
1.2.4 PCR检测利用Trizol提取RNA,逆转录试剂盒进行c-DNA转录,并设置相应的反应条件。q-PCR体系配置,离心后放入PCR仪进行循环,记录CT值等数据进行下一步的分析。
1.2.5 血清检测大鼠麻醉处死后立即眼球取血,离心分离血清,采用院内检验科全自动生化分析仪进行三酰甘油(TG)检测。
1.3 统计学分析数据采用SPSS 22.0进行分析,所有计量资料以均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05表示差异具有统计学意义。
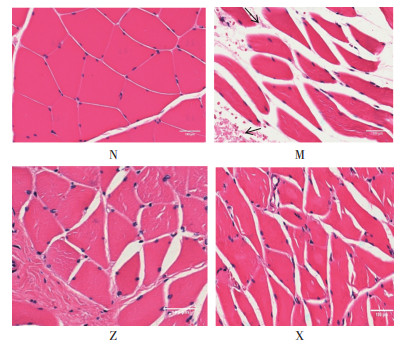
2 结果 2.1 腓肠肌HE染色如图 1所示,正常组肌肉细胞饱满、细胞间距较小、无异常形态;模型组发生明显萎缩、横截面积变小,细胞间距增大、稀疏,有部分渗出及炎性浸润表现,如箭头所示;黄芪多糖组较模型组有显著改善,肌肉细胞面积增大,炎性状态大大减轻;二甲双胍组也在模型组的基础上有一定程度的恢复,但改善程度不如黄芪多糖组。
|
| 注:N,正常组;M,模型组;Z,黄芪多糖组;X,二甲双胍组。 图 1 各组腓肠肌HE染色形态图(×40) Fig. 1 HE staining pattern of gastrocnemius muscle of each group (×40) |
由图 2、表 2所示,P-AKT与AKT蛋白分子量在模型组均较正常组有所降低,黄芪多糖组和二甲双胍组较模型组有所增加,且黄芪多糖组增加更为明显(P < 0.05)。模型组FOXO1的蛋白分子量较正常组显著下降(P < 0.05),黄芪多糖组和二甲双胍组比模型组明显增加(P < 0.05),且药物干预的两组比较差异没有统计学意义。

|
| 图 2 P-AKT/ AKT、FOXO1的蛋白表达 Fig. 2 Relative protein expression of P-AKT/AKT, FOXO1 in each group |
与正常组相比,模型组、热休克转录因子1(HSF1)、白细胞介素(IL-6)、基质金属蛋白酶-9(MMP-9)抑癌基因TP53 mRNA水平明显升高,差异具有统计学意义(P<0.01)。与模型组相比,黄芪多糖组的MMP-9、TP53水平显著降低(P<0.01),HSF1、IL-6水平明显降低(P<0.05);二甲双胍各个指标均较模型组有所下降,其中MMP-9下降水平最为明显,差异具有统计学意义(P<0.05或P<0.01)。见表 3。
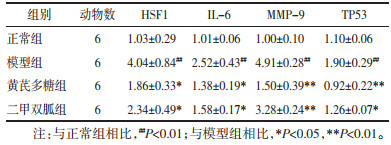
|
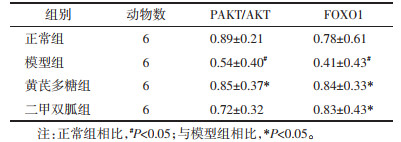
模型组TG水平明显高于正常组(P<0.01),黄芪多糖组与二甲双胍组相较于模型组血脂状态均有改善,TG水平有所降低,其中二甲双胍组TG水平改善较为显著,差异具有统计学意义(P<0.01)。见表 4。
糖尿病作为一种慢性消耗性疾病,常合并多种并发症,近年来有些研究指出,肌少症成为了糖尿病人群,尤其是老年糖尿病人群的新的并发症[16]。合并肌少症的患者会因肌力下降、肌肉萎缩等病理过程严重影响日常活动,造成意外伤害而致残乃至死亡,正日益成为糖尿病患者面临的又一项挑战。
本次实验选用了大月龄SD鼠作为研究对象,并进行一次性STZ注射造模,以符合老年糖尿病模型的设计初衷。腓肠肌作为人体进行站立、步行等活动的重要骨骼肌,受肌少症影响较为显著,对大鼠腓肠肌的HE染色发现,糖尿病组的肌细胞明显发生了萎缩、渗出,细胞间隙变大,说明高糖毒性对腓肠肌的消耗较为严重,这与张艳等[17]的实验结果相似。经黄芪多糖灌胃治疗3个月后的腓肠肌有所改善,可见肌细胞相比于模型组更加饱满,变性渗出也大面积减少,效果优于二甲双胍组。PI3K-AKT-FOXO1信号通路是糖尿病研究的重要通路机制之一[18],Western Blot结果表明,模型组P-AKT/AKT水平较正常组明显降低[19],AKT作为糖尿病的保护因子,高糖状态降低了其含量[20-21],经中药干预后含量显著增加。FOXO1是一种叉头框转录因子,O’Neill等[22]实验证明FOXO是糖尿病相关肌萎缩的关键调节因子,恰恰印证了模型组FOXO1含量的下降,而经过药物干预的两组均出现了FOXO1含量的上升,且相差不大,效果相当,考虑黄芪多糖和二甲双胍均可能通过调控FOXO转录因子减轻高糖毒性并改善肌萎缩状态[23]。聚合酶链PCR实验验证了黄芪多糖和二甲双胍对IL-6、TP53炎症因子的改善作用,相比之下,黄芪多糖减轻程度要优于西药,这与Giha等[24-26]文章不谋而合。相关实验表明HSF1参与糖尿病的相关进程[27],在本实验中糖尿病组HSF1 mRNA表达量明显提高,黄芪多糖组相较于模型组明显降低。MMP-9主要功能是降解和重塑细胞外基质之间的动态平衡,有研究发现糖尿病合并下肢病变的人群MMP-9水平明显提高[28],说明MMP-9可能通过影响下肢血液循环造成肌肉萎缩,与实验结果一致。糖尿病大鼠生化指标TG较正常组明显升高,二甲双胍的降脂作用要优于黄芪多糖组。
黄芪多糖是黄芪中的重要成分之一,近年来有不少致力于研究黄芪多糖对糖尿病及其并发症的治疗作用的文章。本次实验采用黄芪多糖对糖尿病性肌少症进行干预,通过肌肉形态的HE染色、Western Blot、PCR等实验验证了黄芪多糖对糖尿病及肌肉萎缩的改善作用。黄芪多糖由多种单糖及葡聚糖(Glu)构成,有研究指出,β-Glu可以作为生物反应调节剂增强免疫功能,从而改善高糖状态,减轻肌肉萎缩[29]。相关研究发现,黄芪多糖可以纠正因糖尿病导致的辅助性T淋巴细胞(Th)的失衡,保护胰腺的超微结构,减轻凋亡及炎症水平[30],这也可能是导致肌肉萎缩减轻的作用机制。此外,黄芪多糖能够上调抗氧化因子减轻氧化应激水平[31],并且显著增强抗氧化基因表达,降低了胰岛素样肽和长寿基因MTH的表达,从而延缓各组织器官的萎缩机体的衰老[32]。叶婷等[15]证明黄芪多糖通过调节自噬改善糖尿病心肌病;有研究发现黄芪多糖能降低空腹血糖、减轻胰岛素抵抗从而改善血管动脉粥样硬化[33]。黄芪多糖还可通过下调心肌p38丝裂原活化蛋白激酶(MAPK)和核因子-κB(NF-κB)/p65的磷酸化水平减轻心肌纤维化[25];另外有实验证明[34-36],黄芪多糖通过调节PI3K-AKT途径及炎性因子发挥作用,减轻高糖状态及各种糖尿病并发症,与本次实验部分结果相一致。
综上所述,实验结果表明黄芪多糖可能通过调节PI3K-AKT-FOXO1信号通路、降低IL-6、TP53炎性因子水平,影响HSF1和MMP-9的活性,从而改善糖尿病性肌少症大鼠的肌肉萎缩。
| [1] |
SAEEDI P, PETERSOHN I, SALPEA P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Research and Clinical Practice, 2019, 157: 107843. DOI:10.1016/j.diabres.2019.107843 |
| [2] |
闫彬源, 张维璐, 田敏, 等. 1996—2016年中国≥20岁成年人2型糖尿病患病率meta分析[J]. 中华老年多器官疾病杂志, 2018, 17(11): 814-819. |
| [3] |
TOURNADRE A, VIAL G, CAPEL F, et al. Sarcopenia[J]. Joint Bone Spine, 2019, 86(3): 309-314. DOI:10.1016/j.jbspin.2018.08.001 |
| [4] |
DHILLON R J S, HASNI S. Pathogenesis and management of sarcopenia[J]. Clinics in Geriatric Medicine, 2017, 33(1): 17-26. DOI:10.1016/j.cger.2016.08.002 |
| [5] |
SINCLAIR A J, ABDELHAFIZ A H, RODRÍGUEZ-MAÑAS L. Frailty and sarcopenia-newly emerging and high impact complications of diabetes[J]. Journal of Diabetes and Its Complications, 2017, 31(9): 1465-1473. DOI:10.1016/j.jdiacomp.2017.05.003 |
| [6] |
MESINOVIC J, ZENGIN A, DE COURTEN B, et al. Sarcopenia and type 2 diabetes mellitus: a bidirectional relationship[J]. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, 2019, 12: 1057-1072. DOI:10.2147/DMSO.S186600 |
| [7] |
杨翠萍, 郗光霞. 自噬与脂肪异位沉积[J]. 中华临床医师杂志(电子版), 2016, 10(18): 2776-2779. |
| [8] |
WELCH A A, HAYHOE R P G, CAMERON D. The relationships between sarcopenic skeletal muscle loss during ageing and macronutrient metabolism, obesity and onset of diabetes[J]. The Proceedings of the Nutrition Society, 2020, 79(1): 158-169. DOI:10.1017/S0029665119001150 |
| [9] |
AI Y Q, XU R X, LIU L P. The prevalence and risk factors of sarcopenia in patients with type 2 diabetes mellitus: a systematic review and meta-analysis[J]. Diabetology & Metabolic Syndrome, 2021, 13(1): 93. |
| [10] |
周晓宁, 许金海, 王国栋, 等. 肌少症治疗[J]. 中华骨质疏松和骨矿盐疾病杂志, 2020, 13(3): 272-279. |
| [11] |
富晓旭, 刘桠, 高泓, 等. "脾气散精"环节在机体糖调节中发挥核心作用的理论探讨[J]. 中国中医基础医学杂志, 2021, 27(3): 398-399, 426. |
| [12] |
田代华. 黄帝内经素问[M]. 北京: 人民卫生出版社, 2005: 87-88.
|
| [13] |
杨乾方, 王帆, 叶婷, 等. 黄芪多糖提取工艺、化学结构及药理作用的研究进展[J]. 中草药, 2023, 54(12): 4069-4081. |
| [14] |
国家药典委员会. 中华人民共和国药典: 一部[S]. 北京: 中国医药科技出版社, 2020: 315.
|
| [15] |
叶婷, 陈晶, 马国庆, 等. 黄芪多糖对糖尿病心肌病大鼠自噬的调控机制研究[J]. 时珍国医国药, 2022, 33(2): 312-316. |
| [16] |
TRIERWEILER H, KISIELEWICZ G, HOFFMANN JONASSON T, et al. Sarcopenia: a chronic complication of type 2 diabetes mellitus[J]. Diabetology & Metabolic Syndrome, 2018, 10: 25. |
| [17] |
张艳, 桑亚洲, 彭梦薇, 等. 六君子汤调控STAT3/泛素蛋白酶体途径防治肺癌恶病质小鼠肌肉萎缩的机制[J]. 中国实验方剂学杂志, 2022, 28(5): 8-15. |
| [18] |
王芳, 姚敏娜, 张雅, 等. 基于PI3K/Akt/FoxO1信号通路探索白虎加人参汤对2型糖尿病大鼠胰腺组织的保护作用[J]. 中成药, 2022, 44(10): 3315-3320. |
| [19] |
邓锦满, 胡润凯, 韩伟超, 等. 黄芪甲苷联合西格列汀对糖尿病大鼠糖脂代谢、氧化应激及TGF-β1/PI3K/Akt信号通路的影响[J]. 中国老年学杂志, 2022, 42(18): 4522-4526. |
| [20] |
解宏卿, 樊铠睿, 方蒡, 等. 谷氨酰胺对老年糖尿病肌少症大鼠肌保护的作用机制研究[J]. 中国临床药理学杂志, 2021, 37(14): 1859-1863. |
| [21] |
付茜茹, 范颖, 李新, 等. 基于析因设计探讨黄芪葛根有效组分配伍调节胰岛素分泌的机制研究[J]. 时珍国医国药, 2019, 30(2): 265-268. |
| [22] |
O'NEILL B T, BHARDWAJ G, PENNIMAN C M, et al. FoxO transcription factors are critical regulators of diabetes-related muscle atrophy[J]. Diabetes, 2019, 68(3): 556-570. DOI:10.2337/db18-0416 |
| [23] |
JIN J J, DU M M, WANG J, et al. Conservative analysis of Synaptopodin-2 intron sense-overlapping lncRNA reveals its novel function in promoting muscle atrophy[J]. Journal of Cachexia, Sarcopenia and Muscle, 2022, 13(4): 2017-2030. DOI:10.1002/jcsm.13012 |
| [24] |
GIHA H A, ALAMIN O A O, SATER M S. Diabetic sarcopenia: metabolic and molecular appraisal[J]. Acta Diabetologica, 2022, 59(8): 989-1000. DOI:10.1007/s00592-022-01883-2 |
| [25] |
孙奇林, 陈雯洁, 赵雪兰, 等. 黄芪多糖下调心肌p38和核因子κB的磷酸化改善老年糖尿病鼠心脏功能[J]. 老年医学与保健, 2021, 27(2): 399-404. |
| [26] |
刘翠明, 马学芹, 唐正和, 等. 糖尿病视网膜病变患者血清Metrnl和鸢尾素水平变化及其临床意义[J]. 眼科新进展, 2022, 42(6): 469-473. |
| [27] |
薛承斌, 詹继东, 谭文勇, 等. 热休克转录因子1对2型糖尿病发病促进作用[J]. 中国公共卫生, 2015, 31(11): 1427-1429. |
| [28] |
苏钢, 洪娟, 许继炜, 等. 血清抵抗素和基质金属蛋白酶9水平对老年糖尿病患者下肢血管病变的评估价值[J]. 血管与腔内血管外科杂志, 2022, 8(7): 877-880, 890. |
| [29] |
LEW D B, LEMESSURIER K S, PALIPANE M, et al. Saccharomyces cerevisiae-derived mannan does not alter immune responses to Aspergillus allergens[J]. BioMed Research International, 2018, 2018: 3298378. |
| [30] |
CHEN W, LI Y M, YU M H. Astragalus polysaccharides: an effective treatment for diabetes prevention in NOD mice[J]. Experimental and Clinical Endocrinology & Diabetes, 2008, 116(8): 468-474. |
| [31] |
SHAHZAD M, SHABBIR A, WOJCIKOWSKI K, et al. The antioxidant effects of Radix astragali (Astragalus membranaceus and related species) in protecting tissues from injury and disease[J]. Current Drug Targets, 2016, 17(12): 1331-1340. DOI:10.2174/1389450116666150907104742 |
| [32] |
YANG F J, XIU M H, YANG S P, et al. Extension of Drosophila lifespan by Astragalus polysaccharide through a mechanism dependent on antioxidant and insulin/IGF-1 signaling[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021: 6686748. |
| [33] |
禹博威, 潘晓琼, 陈君第霞, 等. 黄芪多糖对糖尿病动脉粥样硬化大鼠糖脂代谢的影响及血管内皮保护机制[J]. 浙江中医药大学学报, 2021, 45(5): 447-453. |
| [34] |
魏祎. 黄芪多糖对肥胖模型大鼠胰岛素抵抗的作用研究[J]. 河南中医, 2021, 41(4): 562-565. |
| [35] |
何佳, 邵继华, 王林园, 等. 黄芪多糖对溃疡性结肠炎大鼠的研究[J]. 中国临床药理学杂志, 2022, 38(14): 1678-1682. |
| [36] |
王瑜, 于瑞雪, 胡思博, 等. 黄芪多糖对糖尿病心肌病模型大鼠的保护作用[J]. 中国临床药理学杂志, 2019, 35(21): 2754-2758. |
 2024, Vol. 41
2024, Vol. 41