文章信息
- 吴清原, 郭思佳, 孙增涛, 等.
- WU Qingyuan, GUO Sijia, SUN Zengtao, et al.
- 基于线粒体功能探讨培宗气理论治疗慢性阻塞性肺疾病的机制研究
- Based on the function of mitochondria to explore the internal mechanism of zongqi theory in treating of chronic obstructive pulmonary disease
- 天津中医药, 2024, 41(1): 117-122
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 117-122
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.22
-
文章历史
- 收稿日期: 2023-08-28
2. 天津中医药大学第二附属医院, 天津 300250;
3. 天津中医药大学医院管理处, 天津 301617
慢性阻塞性肺部疾病(COPD)是以气道不可逆的持续性气流受限为主要临床特征,可预防和治疗的一种慢性肺部疾病。世界卫生组织预测,随着患病率逐渐上升,至2030年,COPD将成为世界第三大死因[1]。随着环境污染及人口老龄化的加重,中国COPD患病人数逐年增加。根据2018年王辰院士团队开展的中国成人肺部健康研究数据显示,中国20岁以上COPD患病率已达8.6%,40岁以上的患病率为13.7%,患病人数近1亿[2]。COPD患者反复急性加重严重影响着患者肺功能、运动功能及生存质量,给社会及家庭带来沉重的经济负担。目前西医对COPD的主要治疗手段为支持治疗及替代治疗,但仍缺乏满意的治疗方案[3]。中医药从整体观念出发,总结COPD临床症状,提出以“虚、痰、瘀”为其主要病机[4]。培土生金法为宗气学说的代表性治法,现已广泛应用于COPD的辨治,并取得了良好的治疗效果[5]。线粒体功能是近年来COPD基础研究的热点,随着研究不断进展,线粒体的作用已不仅仅体现在氧感应和能量产生,在香烟烟雾的刺激下,线粒体可感知上游炎症损伤,通过改变线粒体蛋白的表达、结构和生物学功能对刺激做出反应,导致炎症反应增加,起到黏液分泌增多和诱导细胞衰老和凋亡等功能[6]。因此线粒体功能的异常,可能是COPD病程中“虚、痰、瘀”的病理变化的内在机制,本文立足于“虚、痰、瘀”在COPD病程发生发展的过程,从线粒体功能异常的角度阐释培土生金法治疗COPD的内在机制,以期为宗气理论治疗COPD提供理论依据。
1 宗气的盛衰在COPD病程发展中的体现 1.1 宗气的生理功能宗气,又称为大气,是由肺脏呼吸自然界中清气,与脾胃化生之水谷精气合而生成,积于胸中。对宗气之功能早在《黄帝内经》中即有记载,《灵枢·邪客》言“宗气积于胸中,出于喉咙,以贯心肺,而行呼吸焉”,对其生理功能进行概括,包括“贯心肺”和“行呼吸”。张锡纯在《医学衷中参西录》描述:“肺司呼吸,人所共知也……始确知于肺气呼吸之外,别有气贮于胸中,以司肺脏之呼吸。宗气包举肺外,走于息道,司呼吸之枢机”说明人体肺脏主气司呼吸的功能,有赖于宗气的推动;《素问·平人气象论》云:“胃之大络名虚里,贯膈络肺出于左乳下,其动应手,脉宗气也”。说明心脏的节律波动有赖于宗气;宗气同时参与了人体防御功能,张锡纯在《医学衷中参西录》中提到:“一身之外表,卫气主之,卫气本于胸中大气,又因肺主皮毛,与肺脏亦有密切关系”宗气与营卫之气密切相关,宗气的强弱直接关系到营卫之气的强弱,直接影响着机体的卫外功能,同时也关系到血液对各个脏腑的濡养。宗气盛,营卫之气和谐,构筑机体牢固的卫外系统,各脏腑得以滋养。
1.2 宗气功能失调与COPD“虚、痰、瘀”的生成COPD患者因咳喘日久,久病必虚,损伤肺气,其气虚状态呈进行性加重。COPD初期主要表现为肺卫气阳虚,母病及子,导致脾气受损,进而影响到肾气。因此COPD病机概括为早期以气虚为主,主要包括肺、脾、肾三脏,至中后期可发展为脏腑阳虚。宗气的生成有赖于肺脾之气,COPD发生过程中肺脾之气日益虚衰,日久必然会出现宗气生成不足,宗气虚弱推动呼吸无力,则出现气少气短,呼吸乏力,少气懒言,四肢无力、疲乏、肢体欠温等症状。肾气为一身之元气,有赖于宗气的濡养,宗气虚弱,则一身之气也虚,不能滋养肾气,进而导致肾气虚弱。从脏腑生化来看,金不生水,肺伤及肾。肺为气之主,肾为气之根,肺不主气,则肾气摄纳无权,由咳致喘而见气短不续、动则益甚、日益加剧。
肺主一身之气,为相傅之官,自然界吸入之清气与脾胃化生之精微聚于胸中形成宗气以辅心生血行血。肺气充沛,宗气旺盛,气机调畅,则血运正常。若感受外邪,肺气不畅,失于宣降,辅心行血功能障碍,则可导致血液运行不畅,甚至血脉瘀滞,出现心悸胸闷,唇青舌紫等症。肺气受损,难行肺的生理功能,肺虚日久,子盗母气,致脾气虚弱,脾虚水谷不能化为精微,反为湿浊,水湿停积,聚而为痰,深伏于肺。“脾为生痰之源,肺为贮痰之器”,肺脾肾脏气化功能失调则致痰浊水湿内停,痰浊潴留于肺,渐而成瘀,终至痰浊、血瘀错杂而为患。
2 线粒体生物功能障碍与COPD“虚、痰、瘀”的关系 2.1 线粒体功能异常与正虚无力抗邪的关系目前已有研究显示,线粒体受损导致的功能障碍可以通过磷酸酯酶与张力蛋白同源物(PTEN)诱导假定激酶1(PINK1)/帕金森氏病蛋白2(PARK2)通路影响细胞衰老。香烟烟雾诱导的原代人气道上皮细胞线粒体损伤与活性氧(ROS)产生增加和细胞衰老有关,而PINK1和PARK2的敲低加重了线粒体活性氧(mtROS)的产生和细胞衰老的程度[7]。受损的线粒体吞噬会导致CS诱导的原代人类气道上皮细胞的衰老[8]。最近的1项研究表明,在C57小鼠和ACEII细胞中,激活雷帕霉素靶蛋白复合物1/转录辅助活化因子1(mTORC1/PGC1)轴打破线粒体稳态,增加了氧化磷酸化(OXPHOS)以及mtROS的表达会诱导细胞衰老的产生[9],这说明线粒体功能和CS暴露后的稳态反应的改变,可能有助于肺上皮细胞的细胞衰老,进一步说明了线粒体和细胞衰老之间的直接联系。这些研究表明在CS暴露后线粒体功能和形态的改变,可能起到加速肺上皮细胞的细胞衰老,从而加重COPD的机制。
气道上皮细胞之间的顶端连接复合物是黏膜免疫系统的组成部分,限制了病原体对上皮细胞的跨越,起到对机体的保护作用。气道上皮细胞之间的顶端连接复合物是黏膜免疫系统的重要组成部分。上皮的连接方式由紧密连接(TJs)和附着连接(AJs)组成[10-11]。TJs位于细胞表面的顶端部分,限制上皮的渗透性,由紧密连接蛋白(CLDN)、闭塞蛋白(OCLN)和连接黏附分子(JAM)[11-13]组成。此外,许多其他细胞质分子如封闭带(ZO)-1、ZO-2、ZO-3、扣带蛋白(Cingulin)和Afadin(AF6)也与TJs的形成有关[14-15]。这些分子通过与跨膜蛋白结合并将它们与肌动蛋白微丝和其他细胞质蛋白连接起来作为支架,从而保持TJs的稳定性。AJs位于顶端的TJs的基底外侧,连接相邻细胞并通过E-钙黏蛋白(E-cadherin)的同型钙依赖性黏附启动细胞-细胞接触的形成[16]。气道上皮的内衬由4种主要类型的细胞组成,即纤毛细胞、分泌杯状细胞、棒状细胞和基底细胞[17],上皮层的黏液纤毛清除由纤毛细胞和杯状细胞提供,它们主要存在于较大的气道中。杯状细胞和黏膜下腺体都会产生黏液,它在呼吸道的上皮表面形成凝胶层,捕获病原体和吸入的颗粒。被捕获的病原体和颗粒通过纤毛和咳嗽的协同作用被清除[18]。目前已有多项体内外研究中均指出吸烟会影响上皮屏障功能并有研究已经证明香烟烟雾可以损害上皮屏障功能,破坏OCLN和ZO-1连接表达[19-21]。上皮细胞暴露在香烟烟雾中,mtROS的表达增加,而过度的氧化负荷被认为是COPD上皮屏障破坏的潜在机制之一[22],已有研究表明CS诱导的mtROS可以通过Src介导的细胞外信号调节激酶(ERK)信号传导激活表皮生长因子受体(EGFR)。激活的ERK可以诱导TJs解离[23]。
COPD属于慢性呼吸系统疾病,患者多为老年,一旦发病,无力祛邪,则病情缠绵难愈,或者病情初愈,正气未复,再次感受外邪,病情复发。这与宗气不足,卫气不固存在密切关系。宗气的生成有赖于肺脾之气,COPD发生过程中肺脾之气日益虚衰,日久必然会出现宗气生成不足,宗气虚弱推动呼吸无力,则出现气少气短,呼吸乏力,少气懒言,四肢无力、疲乏、肢体欠温等症状。肾气为一身之元气,有赖于宗气的濡养,宗气虚弱,则一身之气也虚,不能滋养肾气,进而导致肾气虚弱。从脏腑生化来看,金不生水,肺伤及肾。肺为气之主,肾为气之根,肺不主气,则肾气摄纳无权,由咳致喘而见气短不续、动则益甚、日益加剧;正如张锡纯所言:“因大气下陷过甚,呼吸机关将停,遂勉强鼓舞肺脏,努力呼吸自救,其迫促之形,有似乎喘,而实与气逆之喘,有天渊之分。观此证假寐之时,肺脏不能努力呼吸,气息即无”,这段话很形象地描述了宗气虚衰引起呼吸过度的表现。
《灵枢·决气》言“上焦开发,宣五谷味,熏肤,充身,泽毛”“上焦出气,以温分肉而养骨节,通腠理”。即指人体精微之气是通过肺的宣发,充养全身,温煦肌腠,润泽皮毛,发挥卫外防御机能。说明肺气与卫气之间密切相关,卫阳的部分生理功能及病理变化当为肺阳所调动,只有肺阳调达,卫外有权,肺阳不足,即出现卫表不固,临床中也常可见到,COPD患者反复发生气道感染,导致急性加重。张介宾《类经》言:“营气卫气,无非资藉宗气,故宗气盛则营卫和,宗气衰则营卫弱矣。”说明营卫之气与宗气的盛衰密切相关。因此宗气统领一身之气,包括肺中清气,脾胃之水谷之气,肾之元气,营卫之气。宗气虚衰,元气自衰,肺脾气弱,不能正常运化水谷精微,供给不足,肌肤失养,又呼吸过度,耗气伤津,形体逐渐消瘦。先天元气无法再补,因此顾护脾胃之气是补益宗气重要内容之一,通过健脾胃,丰肌肉,增强营养,提高抗病能力。
2.2 线粒体功能异常与痰瘀之标肺上皮细胞表达多种促炎模式识别受体(PRRs),包括toll样受体(TLRs)、核苷酸结合寡聚化结构域类受体(NLRs)、维甲酸诱导基因-i样受体(RLRs)和晚期糖基化终末产物受体(RAGE),这些受体可被线粒体损伤相关的分子模式(mtDAMPs)激活,已经有研究表明,mtROS能够通过直接激活NF-κB通路和缺氧诱导因子-1α(HIF-1α)来诱导促炎反应[24],同时MtROS也可以通过激活炎症小体来调节炎症反应,目前研究较多的为NLR炎症小体NLRP3,它与线粒体功能障碍有很强的联系,可以直接被各种mtDAMPs激活[25-26];同时香烟等伤害性因素暴露于气道上皮细胞,可通过增加过氧化物酶增殖物激活受体(PPAR)-γ共激活因子1α(PGClα)转录水平增强线粒体的生物发生[27]。通过更多的线粒体膜分裂倾向诱导融合/分裂过程失衡导致肺上皮细胞线粒体断裂,增加上皮细胞中磷酸酶和张力蛋白同源物(PTEN)诱导激酶1(PINK1)mRNA和蛋白水平。最终会导致其线粒体肿胀和分支,并伴随着线粒体的功能改变,包括氧化磷酸化改变,活性氧(ROS)生成增加,三磷酸腺苷(ATP)生成减少,线粒体膜去极化线粒体吞噬功能受损导致气道上皮纤毛功能丧失和黏液分泌增加(MUC)[28]。
宗气为胸中之大气,主全身脏腑经络之气,宗气虚弱,一身之气虚弱,肺为水之上源,肺气虚或肺气壅塞,失于宜发和肃降,其通调水道功能失常而不能布津,聚津成痰;脾气虚,运化功能失调,津液不得输布,聚而成痰;肾气虚衰,无力气化水液,加重痰的生成。宗气虚衰,肺脾肾三脏气阳亦虚,气为血之帅,气虚无力推动血液运行而致瘀;阳虚则寒,失于温化,血得寒则凝。临床中常常可见到COPD患者痰瘀为特征的临床表现。痰的征象多为:痰量多,质稀,或咳吐泡沫,或喉中痰鸣,稳定期痰色多为白色,急性期多见黄痰或黄白相间,舌苔厚腻,脉弦而滑。瘀的表现多为胸闷、活动后气喘明显、面暗、唇暗、舌暗等证候特点。痰瘀皆属阴邪,为COPD的重要病理物,一旦形成,痰瘀相阻气道,又会影响宗气的输布,二者常相兼为病,因痰致瘀,因瘀生痰,循环往复,恶性循环,而使得本病迁延难愈。
综上所述,宗气为积于胸中之大气,主要功能为:一是走息道以行呼吸,即宗气的盛衰决定着语言、呼吸、声音的强弱;二是贯心脉以行气血,即肢体的寒温、气血的运行、视听等感觉、心脏的搏动等均与宗气的盛衰息息相关。宗气的功能推动着全身气血的生成和运行,维持脏腑及四肢百骸的正常功能。而线粒体的功能为全身细胞供能的“能量工厂”,同样推动细胞的正常运行。COPD患者久咳久喘,肺气虚弱,宗气生成不足,由此而见患者咳嗽喘促,少气不足以息,语言低微,身倦乏力,脉沉微等全身气虚症状,而同时研究证明COPD患者同样存在线粒体功能的障碍。在这一主要功能上与中医学宗气的功能高度相合。中西医病机互参示意图见图 1。
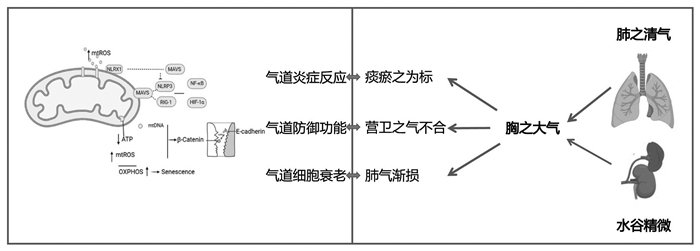
|
| 注:mtROS,线粒体活性氧;NLRX1,富含亮氨酸重复序列的家族蛋白X1;MAVS,线粒体抗病毒信号蛋白;NLRP3,核苷酸结合寡聚化结构域样受体蛋白3;RIG-I,视黄酸(维甲酸)诱导基因蛋白;NF-κB,核因子-κB;HIF-1α,缺氧诱导因子-1α;mtDNA,线粒体DNA;ATP,三磷酸腺苷;β-Catenin,β-连环蛋白;E-cadherin,E-钙黏蛋白;OXPHOS,氧化磷酸化;Senescence,衰老。 图 1 中西医病机互参示意图 Fig. 1 Schematic diagram of mutual reference between Chinese and Western medical pathogenesis |
宗气的生成全赖于脾胃之水谷精微与肺中之清气,因此通过调节肺脾二脏改善宗气功能的代表治法即为培土生金法。中医学通过观察COPD患者临床症状,总结出“虚、邪、瘀”为其主要病机。本病发病的根本即为肺脏感邪,失治误治,肺气渐损,子病及母,肺脾二脏正气亏虚,水液生成运行失职,痰饮内生,进而影响血液输布则内生痰瘀。培土生金法利用甘平、甘温、甘凉等药物,以脏腑传变为理论基础,调理脏腑机能,改善肺脾二脏的虚损,同时辅以活血祛湿的药物,以改善痰瘀内阻,起到标本兼治的治疗特色。在《黄帝内经》时即奠定了培土生金法的理论基础,阐明培土生金的含义为通过调补脾胃以达补益肺气;《石室秘录》所言:“治肺之法,正治甚难,当转治以脾,脾气有养,则土自生金,咳嗽自已。”通过以补脾为手段而达到治肺之目的,即所谓肺病不愈,求治于脾。温健脾益气之法治疗肺脾虚寒之证,创立健脾补肺名方“补中益气汤”,进一步充实了“甘温培土生金”的内涵[29]。
国医大师洪广祥教授即注重临床运用宗气理论治疗COPD,提出COPD患者反复感染导致反复的急性加重,其根本原因即为“邪之所凑,其气必虚”,而所虚之气,即为宗气,在分析临床COPD急性加重期患者常见临床证型的基础上,在对症解决标证的同时,往往需加入黄芪益气之药物,发现不仅能改善急性加重期的临床症状,并且能显著延缓急性加重的反复发生,并且认为COPD患者临床常见的痰、瘀之证型,其根本病机同样为宗气的虚衰[30-31]。对于补益宗气经典方补中益气汤也广泛应用于COPD的治疗。范艺龄等[32]进行了补中益气汤治疗COPD的系统评价研究,研究纳入18项临床随机对照试验(RCT),1 566例患者。结果显示补中益气汤单用或联合西医常规治疗均可延缓急性发作次数,改善COPD患者的临床症状、运动耐力及肺功能水平。研究显示运用补肺健脾颗粒(包括黄芪、党参、白术、茯苓、陈皮、炙甘草等)干预SD大鼠COPD模型,发现补肺健脾颗粒可以显著改善大鼠模型mPTP、mRNA、ATP的含量,改善线粒体数量、形态测量和功能,并且可以改善SD大鼠骨骼肌障碍的功效[33-34]。魏珊珊[35]建立COPD大鼠模型,发现模型组大鼠膈肌细胞线粒体高度肿胀、变性,膜模糊不清,伴部分破裂,同时线粒体NOX、CCO、SDH较空白组显著降低,使用黄芪建中汤干预后发现,黄芪建中汤可以修复大鼠膈肌线粒体的结构和功能,能提高NOX、SDH、CCO活性从而改善模型大鼠临床症状,减轻烟雾及LPS带来的影响。冯立志等[36]通过建立COPD模型大鼠,应用培土生金法(五指毛桃、茯苓、杏仁、白术等)进行干预,结果显示,中药组较模型组相比,线粒体、肺泡及膈肌结构更为完整,提示培土生金法可以显著改善线粒体功能以改善COPD模型大鼠呼吸功能。徐升等[37-39]进行多项研究,以观察黄芪建中汤(黄芪、白芍、饴糖、桂枝、生姜、大枣、甘草)对COPD模型大鼠线粒体功能的影响。结果显示,黄芪建中汤可以显著改善COPD模型大鼠肺组织线粒体膜电位(△·ψm),提高NADH氧化酶、CCO、SDH活性以及Cyta、Cytb、Cytc、Cytc1含量,以改善模型大鼠的线粒体形态、功能,起到增加COPD模型大鼠呼吸道防御功能、免疫调节能力及改善气道阻塞延缓COPD进程的作用。
4 小结COPD的根本病机以肺脾二脏渐损为本,痰瘀互结为标,而宗气的虚衰在这其中起到了关键的作用,临床运用培土生金法补益宗气治疗COPD也取得了一定的疗效,而其机制尚不清晰。本文试图从现代医学的角度阐明宗气学说在COPD病程发生发展中的作用体现并与线粒体功能相关联,有助于阐明中医药治疗COPD的理论内涵,以期为推动中医药防治COPD的临床应用与科学研究提供理论依据。
| [1] |
POLLOK J, VAN AGTEREN J E, ESTERMAN A J, et al. Psychological therapies for the treatment of depression in chronic obstructive pulmonary disease[J]. The Cochrane Database of Systematic Reviews, 2019, 3(3): CD012347. |
| [2] |
WANG C, XU J Y, YANG L, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China[the China Pulmonary Health(CPH)study]: A national cross-sectional study[J]. Lancet, 2018, 391(10131): 1706-1717. DOI:10.1016/S0140-6736(18)30841-9 |
| [3] |
中华医学会呼吸病学分会慢性阻塞性肺疾病学组, 中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会. 慢性阻塞性肺疾病诊治指南(2021年修订版)[J]. 中华结核和呼吸杂志, 2021, 44(3): 36. |
| [4] |
李建生, 李素云, 余学庆. 慢性阻塞性肺疾病中医诊疗指南(2011版)[J]. 中医杂志, 2012, 53(1): 80-84. |
| [5] |
杨燕, 胡镜清, 彭锦, 等. 宗气理论概述及现代研究进展[J]. 世界科学技术-中医药现代化, 2014, 16(11): 2435-2439. |
| [6] |
AGHAPOUR M, REMELS A H V, POUWELS S D, et al. Mitochondria: at the crossroads of regulating lung epithelial cell function in chronic obstructive pulmonary disease[J]. American Journal of Physiology- Lung Cellular and Molecular Physiology, 2020, 318(1): L149-L164. DOI:10.1152/ajplung.00329.2019 |
| [7] |
ITO S, ARAYA J, KURITA Y, et al. PARK2-mediated mitophagy is involved in regulation of HBEC senescence in COPD pathogenesis[J]. Autophagy, 2015, 11(3): 547-559. DOI:10.1080/15548627.2015.1017190 |
| [8] |
AHMAD T, SUNDAR I K, LERNER C A, et al. Impaired mitophagy leads to cigarette smoke stress-induced cellular senescence: implications for chronic obstructive pulmonary disease[J]. The FASEB Journal, 2015, 29(7): 2912-2929. DOI:10.1096/fj.14-268276 |
| [9] |
SUMMER R, SHAGHAGHI H, SCHRINER D, et al. Activation of the mTORC1/PGC-1 axis promotes mitochondrial biogenesis and induces cellular senescence in the lung epithelium[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2019, 316(6): L1049-L1060. DOI:10.1152/ajplung.00244.2018 |
| [10] |
NAWIJN M C, HACKETT T L, POSTMA D S, et al. E-cadherin: gatekeeper of airway mucosa and allergic sensitization[J]. Trends in Immunology, 2011, 32(6): 248-255. DOI:10.1016/j.it.2011.03.004 |
| [11] |
HEIJINK I H, NOORDHOEK J A, TIMENS W, et al. Abnormalities in airway epithelial junction formation in chronic obstructive pulmonary disease[J]. American Journal of Respiratory and Critical Care Medicine, 2014, 189(11): 1439-1442. DOI:10.1164/rccm.201311-1982LE |
| [12] |
KRAUSE G, WINKLER L, MUELLER S L, et al. Structure and function of claudins[J]. Biochimica et Biophysica Acta, 2008, 1778(3): 631-645. DOI:10.1016/j.bbamem.2007.10.018 |
| [13] |
MCCARTHY K M, SKARE I B, STANKEWICH M C, et al. Occludin is a functional component of the tight junction[J]. Journal of Cell Science, 1996, 109(9): 2287-2298. DOI:10.1242/jcs.109.9.2287 |
| [14] |
EBNET K, SUZUKI A, OHNO S, et al. Junctional adhesion molecules (JAMs): more molecules with dual functions?[J]. Journal of Cell Science, 2004, 117(1): 19-29. DOI:10.1242/jcs.00930 |
| [15] |
ANDERSON J M. Molecular structure of tight junctions and their role in epithelial transport[J]. News in Physiological Sciences, 2001, 16: 126-130. |
| [16] |
HARTSOCK A, NELSON W J. Adherens and tight junctions: structure, function and connections to the actin cytoskeleton[J]. Biochimica et Biophysica Acta, 2008, 1778(3): 660-669. DOI:10.1016/j.bbamem.2007.07.012 |
| [17] |
GANESAN S, COMSTOCK A T, SAJJAN U S. Barrier function of airway tract epithelium[J]. Tissue Barriers, 2013, 1(4): e24997. DOI:10.4161/tisb.24997 |
| [18] |
BALS R, HIEMSTRA P S. Innate immunity in the lung: how epithelial cells fight against respiratory pathogens[J]. The European Respiratory Journal, 2004, 23(2): 327-333. DOI:10.1183/09031936.03.00098803 |
| [19] |
HEIJINK I H, BRANDENBURG S M, POSTMA D S, et al. Cigarette smoke impairs airway epithelial barrier function and cell-cell contact recovery[J]. The European Respiratory Journal, 2012, 39(2): 419-428. DOI:10.1183/09031936.00193810 |
| [20] |
SCHAMBERGER A C, MISE N, JIA J, et al. Cigarette smoke-induced disruption of bronchial epithelial tight junctions is prevented by transforming growth factor-Β[J]. American Journal of Respiratory Cell and Molecular Biology, 2014, 50(6): 1040-1052. DOI:10.1165/rcmb.2013-0090OC |
| [21] |
MILARA J, PEIRÓ T, SERRANO A, et al. Epithelial to mesenchymal transition is increased in patients with COPD and induced by cigarette smoke[J]. Thorax, 2013, 68(5): 410-420. DOI:10.1136/thoraxjnl-2012-201761 |
| [22] |
WANG A, KEITA Å V, PHAN V, et al. Targeting mitochondria-derived reactive oxygen species to reduce epithelial barrier dysfunction and colitis[J]. The American Journal of Pathology, 2014, 184(9): 2516-2527. DOI:10.1016/j.ajpath.2014.05.019 |
| [23] |
AGHAPOUR M, RAEE P, MOGHADDAM S J, et al. Airway epithelial barrier dysfunction in chronic obstructive pulmonary disease: role of cigarette smoke exposure[J]. American Journal of Respiratory Cell and Molecular Biology, 2018, 58(2): 157-169. DOI:10.1165/rcmb.2017-0200TR |
| [24] |
BANOTH B, CASSEL S L. Mitochondria in innate immune signaling[J]. Translational Research: the Journal of Laboratory and Clinical Medicine, 2018, 202: 52-68. DOI:10.1016/j.trsl.2018.07.014 |
| [25] |
IYER S S, HE Q, JANCZY J R, et al. Mitochondrial cardiolipin is required for Nlrp3 inflammasome activation[J]. Immunity, 2013, 39(2): 311-323. DOI:10.1016/j.immuni.2013.08.001 |
| [26] |
SHIMADA K, CROTHER T R, KARLIN J, et al. Oxidized mitochondrial DNA activates the NLRP3 inflammasome during apoptosis[J]. Immunity, 2012, 36(3): 401-414. DOI:10.1016/j.immuni.2012.01.009 |
| [27] |
PLOUMI C, DASKALAKI I, TAVERNARAKIS N. Mitochondrial biogenesis and clearance: a balancing act[J]. The FEBS Journal, 2017, 284(2): 183-195. DOI:10.1111/febs.13820 |
| [28] |
ZHOU J S, ZHAO Y, ZHOU H B, et al. Autophagy plays an essential role in cigarette smoke-induced expression of MUC5AC in airway epithelium[J]. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2016, 310(11): L1042-L1052. DOI:10.1152/ajplung.00418.2015 |
| [29] |
胡涛, 林琳, 吴蕾. 宗气与慢性阻塞性肺疾病膈肌疲劳相关理论浅析[J]. 时珍国医国药, 2015, 26(5): 1183-1185. |
| [30] |
洪广祥. 论宗气与慢性阻塞性肺疾病[J]. 中医药通报, 2006, 5(1): 5-8. DOI:10.3969/j.issn.1671-2749.2006.01.003 |
| [31] |
王丽华. 洪广祥运用宗气理论治疗慢性阻塞性肺疾病稳定期的经验继承与临床研究[D]. 南京: 南京中医药大学, 2012.
|
| [32] |
范艺龄, 苗青, 廖星, 等. 补中益气汤治疗慢性阻塞性肺疾病稳定期有效性和安全性的系统评价与Meta分析[J]. 中国中药杂志, 2020, 45(22): 5344-5355. |
| [33] |
DONG Y Q, LI Y, SUN Y F, et al. Bufei Jianpi Granules improve skeletal muscle and mitochondrial dysfunction in rats with chronic obstructive pulmonary disease[J]. BMC Complementary and Alternative Medicine, 2015, 15(1): 1-9. DOI:10.1186/s12906-015-0520-z |
| [34] |
MAO J, LI Y, LI S Y, et al. Bufei Jianpi Granules reduce quadriceps muscular cell apoptosis by improving mitochondrial function in rats with chronic obstructive pulmonary disease[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2019, 2019: 1216305. |
| [35] |
魏姗姗. 培土生金法干预慢性阻塞性肺疾病动物模型作用机制的实验研究[D]. 合肥: 安徽中医药大学, 2014.
|
| [36] |
冯立志, 詹少锋. 培土生金法对慢性阻塞性肺疾病大鼠肺泡、膈肌及其线粒体病理形态的影响[J]. 广州中医药大学学报, 2022, 39(9): 2123-2128. |
| [37] |
徐升, 孙丽萍, 张念志. 培土生金法对COPD大鼠肺组织线粒体功能影响的实验研究[J]. 辽宁中医杂志, 2013, 40(6): 1239-1241. |
| [38] |
徐升, 魏姗姗, 张念志, 等. 培土生金法对慢性阻塞性肺疾病线粒体膜电位影响的实验研究[J]. 安徽医学, 2013, 34(8): 1059-1062. DOI:10.3969/j.issn.1000-0399.2013.08.001 |
| [39] |
徐升, 孙丽萍, 张念志. 培土生金法对COPD大鼠肺功能的影响实验研究[J]. 山东中医杂志, 2013, 32(2): 107-110. |
2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China;
3. Department of Hospital Management, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41