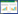文章信息
- 王薪淇, 方玉秋, 尚瑞鹏, 等.
- WANG Xinqi, FANG Yuqiu, SHANG Ruipeng, et al.
- 姜黄素及其与化疗药物的纳米递药系统协同抗肿瘤作用研究
- Synergistic anti-tumor effects of curcumin and its nanodrug delivery system with chemotherapeutic drugs
- 天津中医药, 2024, 41(1): 123-129
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(1): 123-129
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.01.23
-
文章历史
- 收稿日期: 2023-08-30
目前,全世界范围内癌症的发病率仍连年居高不下且呈增长态势,严重威胁人类的健康与发展,成为医学界面临的共同挑战[1]。临床上对于癌症的治疗主要是通过手术、放疗、化疗或将以上几种方法相结合以达到消灭肿瘤的目的,此外骨髓移植、激素疗法、干细胞疗法以及免疫治疗也是新兴的有效抗肿瘤治疗方式[2]。由于化疗药物可随血液循环遍布全身,治疗范围较广,使其成为癌症中晚期较为普遍的治疗手段。然而,肿瘤多药耐药(MDR)的发生早已成为化疗过程中的主要障碍[3]。MDR的特点是肿瘤细胞不仅对化疗药物产生耐药性,还会对一系列结构、作用机制不同的其他抗癌药物产生交叉耐药性[4]。因此,多药耐药逆转剂与化疗药物合用以提高治疗效果成为癌症治疗的重中之重[5]。
由于中药活性成分具有作用靶点多、副作用小、毒性低等优势,因此,近年来中药抗癌活性成分的研究备受瞩目[6]。姜黄素是中药姜黄属植物姜黄、郁金、莪术的主要有效成分,具有抗氧化、抗炎、抗病原微生物、抗肿瘤等广泛的药理活性[7]。研究发现,姜黄素可以作为肿瘤MDR有效的逆转剂,拥有极大的治疗潜力和应用前景[8]。其逆转耐药的机制包括:抑制肿瘤细胞DNA损伤修复,从而增强细胞对抗肿瘤药物的敏感性[9];抑制肿瘤部位P糖蛋白(P-gp)的高表达[10];抑制肿瘤细胞中核因子κB(NF-κB)的活性[11];提高抑癌基因P53的表达[12];下调B淋巴细胞瘤-2(Bcl-2)在肿瘤细胞中的表达[13];改变miRNA在癌组织中的表达[14]等几个方面。Wei等[15]研究表明,姜黄素通过抑制或激活一系列细胞通路,提高了癌细胞对5-氟尿嘧啶的敏感性,从而逆转MDR,两者联合使用可以增强结直肠癌、乳腺癌、胃癌等多种癌症的治疗作用。Firouzi等[16]研究发现,阿霉素、姜黄素、姜黄素与阿霉素联合使用均能降低胃癌模型的细胞存活率、减少肿瘤细胞的生成、抑制癌细胞的迁移和侵袭能力,且姜黄素与阿霉素联合使用对胃癌细胞AGS的凋亡和抗癌作用明显优于二者单独使用。由此可见,姜黄素与其他化疗药物联合使用在体内、外实验中展现出了独特的治疗优势。
然而,姜黄素由于水溶性低、稳定性差,一定程度上影响了其生物利用度和临床治疗效果[17]。因此,为了改善姜黄素水溶性、提高稳定性以及生物利用度,设计合理、能够高效传递的药物剂型成为药剂学领域研究的热点[18]。纳米生物技术的蓬勃发展,促使纳米药物递送系统的研发及成果转化取得了巨大进步[19]。与传统制剂相比,纳米药物递送系统不仅能够影响药物外排机制,也是应对MDR的优良载体[20];而且在进入体内后还能够增强难溶性药物的稳定性,提高药物在肿瘤部位的蓄积,延长药物的滞留时间,增强药物的治疗效果并降低毒性,具有其他药物输送体系不可比拟的给药优势[21]。
依托纳米系统达到协同载药治疗癌症主要分为3种形式:1)将所有药物一同包封于纳米载体中;2)先将其中一种药物包载进纳米载体中,再与其他药物联合使用;3)不同药物分别包载然后再联合用药[22]。目前,国内外研究者对于纳米药物递送系统联合载药的研究十分广泛,主要包括脂质体、纳米粒、微球、微乳、胶束等。
1 姜黄素对不同癌症的治疗作用癌症,即恶性肿瘤,经考证距今3 500多年前殷商时期出土的甲骨文中已有对“瘤”字的记载[23]。此外《黄帝内经》中的“肠覃”“石瘕”,《难经》中的“积聚”,《伤寒杂病论》中的“癥瘕”等都是对人体不同肿瘤部位的形容[24]。由此可见中医对癌症的认识历史悠久,古往今来,随着人们不断地对中医理论知识进行深入的了解和探索,近年来中医在癌症治疗中发挥的独特优势备受关注[25]。结合临床表现,中医学认为,气虚和血瘀两者互为因果,相辅相成,对肿瘤的发生与转移有着密不可分的关联。因此活血化瘀疗法成为现阶段中医治疗癌症的新思路,具有活血化瘀作用的中药对于肿瘤的治疗有积极意义[26],其中姜黄因具有破血行气,通经止痛的功效在中医临床上广泛用于癌症的治疗[27]。
随着对于姜黄的深入研究,其中具有二酮结构的酸性多酚类化合物姜黄素(图 1)因为具有广谱的抗肿瘤活性而备受瞩目[28]。姜黄素,化学式为C21H20O6[29],具有抗炎[30]、抗肿瘤[31]、抗病毒[32]、抗氧化[33]等广泛的药理作用,还可以控制糖尿病及其并发症[34]、改善心血管系统[35]、治疗神经系统[36]疾病。除此之外,姜黄素还可以通过抑制肿瘤增殖、侵袭、转移、抑制血管生成、调节肿瘤部位能量代谢、诱导肿瘤细胞自噬和凋亡、发挥免疫调节作用、逆转细胞多药耐药性等机制对结直肠癌[37]、乳腺癌[38]、肺癌[39]、肝癌[40]等一系列癌症发挥良好的治疗作用。
|
| 注:Curcumin,姜黄素;Nanopartiles,纳米粒;Liposome,脂质体;Micelle,聚合物胶束;Hydrogel,纳米凝胶。 图 1 姜黄素纳米递药系统 Fig. 1 Curcumin-loaded nano-drug delivery system |
Xiang等[41]研究发现,姜黄素以剂量和时间依赖性抑制结肠癌细胞HCT116地迁移、侵袭和增殖,可以通过旁分泌调节基因金属蛋白酶-9(MMP-9)和细胞紧密连接,抑制NF-κB信号通路,从而诱导Fas死亡受体信号通路的激活并抑制肿瘤上皮-间质转化(EMT)。Zhang等[42]发现姜黄素能够通过上调Wnt通路中抑制基因裸露角质蛋白同源物2(NKD2)的表达,进而抑制Wnt信号通路,最终抑制结肠癌细胞SW620的侵袭和转移。
雷鸣等[43]发现,姜黄素可以通过抑制雷帕霉素靶蛋白(m TOR)信号通路的表达,增强细胞内具有抑癌作用蛋白磷酸酯酶与张力蛋白同源物(PTEN)的表达,从而诱导乳腺癌细胞MCF-7的凋亡。Moghtaderi等[44]研究表明,阿拉伯半乳聚糖和姜黄素联合应用可显著提高三阴性乳腺癌细胞MDA-MB-231中BCL-2相关X蛋白(Bax)/Bcl-2比值和天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)裂解水平,通过增加活性氧(ROS)水平,改变线粒体膜结构并减少谷胱甘肽等途径促进细胞凋亡,还通过提高对P53的表达和降低Ki-67水平来抑制乳腺肿瘤的进展。
Wu等[45]研究发现,姜黄素可以抑制肺癌细胞NCI-H460中的非受体型酪氨酸蛋白激酶2(JAK2)/重组人信号转导与转录激活因子3(STAT3)信号通路,下调作为细胞周期进展调节因子cyclin D1和转录因子C-myc的表达,从而抑制肿瘤生长。Tang等[46]发现,姜黄素能调节STAT3信号通路,时间依赖性地增加叉头框蛋白A2(FOXA2)表达来抑制肺癌细胞NCI-H292的生长。郑爽等[47]证实,姜黄素能抑制lncRNA HOTAIR表达,实现有效抑制肺癌细胞A549中上皮细胞间质转型(EMT)的发生。
Han等[48]研究发现,姜黄素可显著抑制肝癌细胞SMMC-7721和HepG2的增殖,提高Caspase-3活性,通过下调DJ-1、上调PTEN的表达,抑制磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)通路的激活,从而发挥抗肝癌作用。Ren等[49]研究表明,姜黄素能通过降低HepG2细胞中HSP70水平抑制肿瘤细胞上TOLL样受体(TLR-4)的表达,从而抑制由TLR4信号传导启动的核因子-κB(NF-κB)通路。牟海军等[50]研究表明,姜黄素可以下调肝癌模型小鼠Keap1表达,激活转录因子NF-E2相关因子-2(Nrf2)/抗氧化反应元件(ARE)信号,改善肝功能和胆汁酸肝肠循环,降低癌变的可能。
2 姜黄素纳米递药系统虽然姜黄素在肿瘤治疗方面体现出了极高的利用价值和显著优势,但其存在稳定性差、溶解度低、代谢速度快、靶向性差等限制因素[51]。为了克服这些缺点,通过构建合适的纳米药物递送系统可以达到改善姜黄素的生物利用度,提高肿瘤治疗效果的目的[52]。常用于提高姜黄素稳定性和生物利用度的载药系统包括纳米粒、脂质体、聚合物胶束、纳米凝胶等(图 1)。
2.1 纳米粒固体脂质纳米粒以天然或合成的类脂材料为载体,药物被包裹在脂质材料内核,粒径保持在10~1 000 nm范围内的固态纳米颗粒[53],其具有良好的包封能力,毒性低且生物相容性好,还可以提高药物生物利用度[54]。Jourghanian等[55]利用胆固醇为载体采用高压匀质法制备了姜黄素固体脂质纳米粒,该纳米粒具有良好的缓释作用,48 h内释放92%的姜黄素。Yallapu等[56]将姜黄素封装在聚乳酸-羟基乙酸共聚物纳米粒中,通过抑制关键的抗凋亡蛋白Mcl-1、Bcl-x和诱导多聚ADP-核糖聚合酶(PARP)裂解,导致细胞凋亡,抑制前列腺癌细胞的生长。
2.2 纳米脂质体脂质体是将药物包封于类脂质双分子层内而形成的微小囊泡,由于其结构类似于生物膜,又被称为“人工生物膜”。因具有良好的生物相容性和靶向性,在医学领域备受关注,已有多种脂质体药物成功上市[57]。Basnet等[58]研究发现,与游离姜黄素相比,脂质体能显著增强姜黄素的抗氧化能力和抗炎活性。Chen等[59]研究表明,以大豆磷脂为原料制备的姜黄素脂质体展现出了显著的抗黑色素瘤活性,可以作为经皮给药载体用于皮肤癌的治疗。Zhao等[60]研究发现,脑靶向肽RDP修饰的姜黄素纳米脂质体可以进入脑部胶质瘤区域,并通过乙酰胆碱受体介导的内吞途径被胶质瘤细胞内化,能将荷瘤小鼠的生存期从23 d延长到33 d。
2.3 聚合物胶束聚合物胶束也是近年来备受关注的纳米药物载体之一,它是由一种两亲性高分子化合物在溶液中通过自组装形成的具有内核-外壳结构的球形高分子胶束[61]。因其能够起到增溶药物、在体内不易被代谢、结构易被修饰、能够输送药物至特定靶点等优势常被用于抗癌药物的递送[62]。Li等[63]制备的姜黄素胶束不但提高了其水溶性和缓释能力,而且更容易进入细胞内,可以显著抑制肿瘤生长。Sarika等[64]将姜黄素与阿拉伯胶偶联,通过自组装形成纳米胶束对肝癌细胞HepG2的抗癌活性更高,可能是阿拉伯胶中的半乳糖基团对肝癌细胞具有靶向作用,增强了其在HepG2细胞中的蓄积和毒性。
2.4 纳米凝胶纳米凝胶是一种由聚合物通过物理或化学手段交联形成的具有三维立体网状多孔结构的纳米颗粒,可以在水中溶胀,拥有良好的胶体稳定性和比表面积,兼顾了水凝胶和纳米粒的特性[65]。因其能够提高药物稳定性,延长药物的体内滞留时间,通过修饰靶头可以达到靶向治疗的目的,成为药物输送的优良载体[66]。另有研究采用反向微乳技术制备了姜黄素纳米凝胶,体外释放实验表明姜黄素可以在48 h内持续释放且在酸性条件下展现出了较高的释放率,并且对乳腺癌细胞MCF-7具有抗癌活性[67]。Niu等[68]制备了丝素肽-透明质酸负载姜黄素的纳米凝胶,结果表明纳米凝胶能够将姜黄素有效递送至皮肤深层且具有良好的抗炎和镇痛活性。
3 姜黄素与化疗药物的协同纳米递药系统随着对姜黄素各种剂型研究的不断深入,其可以作为肿瘤MDR有效逆转剂的报道得到了研究者的广泛关注,姜黄素与化疗药物协同使用的纳米递药系统的研究日新月异,已开发的纳米递药系统包括纳米粒、脂质体、聚合物胶束、聚合物-纳米载体等。
3.1 纳米粒Jiang等[69]采用溶剂注入法制备了负载依托泊苷和姜黄素的纳米粒,结果表明该纳米粒对胃癌细胞SGC7901具有更好的抑制效果,在荷瘤小鼠的肿瘤部位分布浓度最高,抗肿瘤效果更加显著。与两者单独给药相比,双载药纳米粒不仅减少两药用量且能更好的抑制肿瘤体积,说明依托泊苷和姜黄素具有协同作用。为了加强纳米粒的靶向性和稳定性,提高治疗效果,国内外学者不断对其表面进行功能化修饰,用来克服纳米载药系统对非特异性细胞靶向的局限性,从而达到主动靶向的治疗目的[70]。Hu等[71]制备了经叶酸(FT)修饰的共载多西他赛和姜黄素的纳米粒(FT-NPs),结果表明,肿瘤细胞膜表面的叶酸受体特异性识别FT-NPs,并且能够显著减少荷瘤小鼠的肿瘤体积,具有更好的抗肿瘤活性。为了进一步控制载药纳米粒在肿瘤部位的精准释放,Cui等[72]研制了一种具有负载姜黄素和阿霉素的pH敏感和转铁蛋白双重靶向作用的纳米粒,纳米粒能在肿瘤微酸性环境下断裂,实现药物的精准释放[73],而且纳米粒中的聚乙二醇(PEG)具有长循环效应,延长了药物在肿瘤部位的滞留时间,从而达到更好的癌症靶向治疗效果。
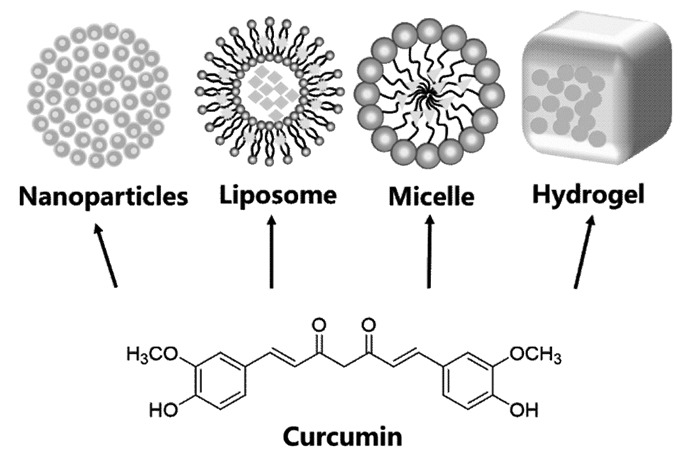
3.2 脂质体由于脂质体磷脂分子一端为亲水基,一端为亲油基,形成一个双层的中空囊泡,内部可以包裹水溶性药物,脂质层又可以包裹脂溶性药物[74],因此基于脂质体双载药系统的开发逐渐受到关注(图 2)。
|
| 图 2 脂质体的结构 Fig. 2 Structure of liposomes |
Cheng等[75]采用反向微乳-薄膜分散法制备含顺铂和姜黄素的共载脂质体,结果表明两药在24 h内可以保持同步释放,与单一药物相比,共载脂质体能明显提高肝癌细胞HepG2的活性氧(ROS)水平,能延长其在肿瘤部位的滞留时间并增强抗肿瘤效果。Ruttala等[76]研制了一种白蛋白结合紫杉醇纳米粒共载姜黄素的脂质体,在较低的给药剂量下仍表现出很好的细胞毒性,发挥良好的协同抗肿瘤作用。Jiang等[77]设计了一种共载紫杉醇和姜黄素的RGD肽修饰双载药脂质体用于肺癌的治疗,结果表明,与单独给药相比,经RGD修饰的双载药脂质体呈现出更好的体内抗肿瘤作用。Ye等[78]制备了共递送姜黄素和多西他赛的双载药脂质体用于乳腺癌的治疗,细胞活性和增殖检测(CCK-8)实验证明双载药脂质体能逆转MDR,增强多西他赛诱导的细胞毒性和细胞凋亡,而且与游离药物相比双载药脂质体的生物半衰期显著延长,生物利用度提高。
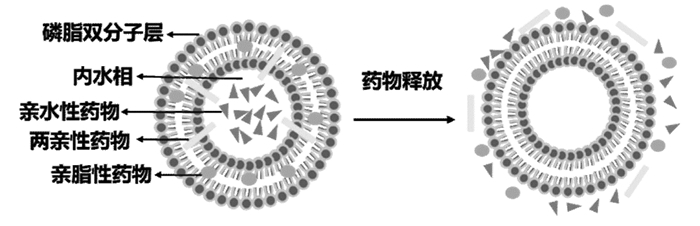
脂质体双载药的常规方式是将两种药物按一定比例共载进脂质体中,但由于脂质层空间限制使载药量受到影响。因此,可以将其中一种药物先制成环糊精包合物再包载进脂质体内水相中,另一种药物包封在脂质层中,形成一种新型的环糊精包合物脂质体(DCL)[79](图 3)。研究发现这种载体能够改善药物的治疗效果,延长药物释放时间[80]。
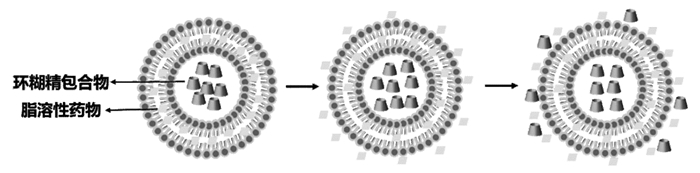
|
| 图 3 环糊精包合物脂质体 Fig. 3 Drug-in-CD-in-liposome |
陈仕红[81]制备了一种具有cRGD肽靶向作用的姜黄素包合物和阿霉素双载药靶向脂质体,与单独使用阿霉素相比,双载药靶向脂质体对结肠癌细胞HCT-8和耐药结肠癌细胞HCT-8/TAX均具有较高的细胞毒性,脂质体中的姜黄素不仅起到化疗增敏剂的作用还能逆转MDR。
3.3 聚合物胶束Mohanty等[82]以两亲性甲氧基聚乙二醇-聚己内酯共聚物为载体,制备了负载姜黄素和雷帕霉素两种抗癌药物的聚合物胶束,载药胶束对人脑胶质细胞T98G的摄取量约是游离药物的3.3倍,与单纯药物合用相比,载药胶束能增强线粒体膜电位去极化从而导致更高的细胞凋亡。Abouzeid等[83]制备了聚乙二醇-磷脂酰乙醇胺聚合物和维生素E共载紫杉醇和姜黄素的胶束用于克服卵巢癌的多药耐药性,结果表明两药联合使用对卵巢癌细胞SKOV3抑制作用提高了3倍,在治疗卵巢癌耐药方面体现出了显著的临床优势。Zeng等[84]设计研制出了一种姜黄素与达沙替尼双载药pH敏感性靶向胶束,结果表明双载药胶束能有效提高对肝癌细胞HepG2细胞的杀伤作用,并且可以通过阻滞肝癌细胞HepG2的G1/S和G2/M周期来诱导细胞凋亡,从而发挥协同作用。
3.4 聚合物-纳米载体高分子聚合物的纳米载体有良好的生物相容性、能延长药物在血液中的循环时间、无毒无害可降解,作为新型递药系统具有极大的优势[85]。近年来,一系列基于pH值、酶、光、磁、超声敏感等环境刺激响应型聚合物纳米载体被开发并用于多种癌症的治疗[86]。Guo等[87]采用聚合物纳米材料甲氧基聚乙二醇聚苯丙氨酸共负载阿霉素和姜黄素用于淋巴瘤的协同治疗,此载药系统通过增强淋巴瘤细胞BJAB和Raji线粒体凋亡的途径达到治疗效果。Muthoosamy等[88]利用两亲性高分子共聚物普朗尼克对氧化石墨烯进行共价修饰,通过负载紫杉醇和姜黄素得到双载药系统,研究表明双载药系统中中姜黄素和紫杉醇均能够促进肺癌细胞A549和乳腺癌细胞MDA-MB-231中ROS的产生,诱导癌细胞凋亡,显示出良好协同抗肿瘤活性。
4 总结和展望相较于单一化疗药物制剂,虽然姜黄素配合的双载药纳米制剂克服了诸如生物利用度低、靶向性差、滞留时间短、毒性大等问题,在体内外实验中均产生了良好的抑制肿瘤效果,但从实验研发到临床试验阶段的成果转化面临诸多未知与挑战。随着人们对中药活性成分的不断研究探索,预计在不久的将来会有更多具有高效、低毒和多靶点的中药小分子登上抗癌舞台,进一步减小中药与化疗药物合用所产生的药物毒性和副作用。
随着纳米递送系统的发展,纳米载体经过功能化修饰,可以达到主动靶向和精准治疗的目的。但是不同药物的药代动力学不尽相同,在体内释放的趋势难以保持一致,如何寻求合适的药物配比以达到最佳的协同治疗效果仍是现阶段面临的主要问题。相信在已有研究成果的基础上,随着对纳米技术的深入探索以及国内外临床试验的陆续开展,能够促进抗癌中药活性成分纳米递药系统的研发及成果转化,为饱受癌症痛苦的患者带来福音。
| [1] |
SIEGEL R L, MILLER K D, WAGLE N S, et al. Cancer statistics, 2023[J]. CA: A Cancer Journal for Clinicians, 2023, 73(1): 17-48. DOI:10.3322/caac.21763 |
| [2] |
DARVISHI M, TOSAN F, NAKHAEI P, et al. Recent progress in cancer immunotherapy: overview of current status and challenges[J]. Pathology, Research and Practice, 2023, 241: 154241. DOI:10.1016/j.prp.2022.154241 |
| [3] |
ZHANG L, YE B W, CHEN Z, et al. Progress in the studies on the molecular mechanisms associated with multidrug resistance in cancers[J]. Acta Pharmaceutica Sinica B, 2023, 13(3): 982-997. DOI:10.1016/j.apsb.2022.10.002 |
| [4] |
ASSARAF Y G, BROZOVIC A, GONÇALVES A C, et al. The multi-factorial nature of clinical multidrug resistance in cancer[J]. Drug Resistance Updates: Reviews and Commentaries in Antimicrobial and Anticancer Chemotherapy, 2019, 46: 100645. |
| [5] |
王俊敏, 王慧杰, 孙彦君, 等. 逆转肿瘤细胞多药耐药活性的天然产物研究进展[J]. 中成药, 2019, 41(4): 879-883. DOI:10.3969/j.issn.1001-1528.2019.04.033 |
| [6] |
刘海晔. 中药逆转肿瘤多药耐药性的研究进展[J]. 中草药, 2015, 46(7): 1096-1102. |
| [7] |
刘伟, 顾秀竹, 吴筱霓, 等. 姜黄素药理作用的研究进展[J]. 华西药学杂志, 2021, 36(3): 336-340. |
| [8] |
周豫昆, 吴兰珍, 韩芸, 等. 姜黄素逆转多药耐药的研究进展[J]. 新疆中医药, 2016, 34(2): 110-112. |
| [9] |
LU H F, YANG J S, LAI K C, et al. Curcumin-induced DNA damage and inhibited DNA repair genes expressions in mouse-rat hybrid retina ganglion cells (N18)[J]. Neurochemical Research, 2009, 34(8): 1491-1497. DOI:10.1007/s11064-009-9936-5 |
| [10] |
LOPES-RODRIGUES V, SOUSA E, VASCONCELOS M H. Curcumin as a modulator of P-glycoprotein in cancer: challenges and perspectives[J]. Pharmaceuticals, 2016, 9(4): 71. DOI:10.3390/ph9040071 |
| [11] |
YU L L, WU J G, DAI N, et al. Curcumin reverses chemoresistance of human gastric cancer cells by downregulating the NF-κB transcription factor[J]. Oncology Reports, 2011, 26(5): 1197-1203. |
| [12] |
TALIB W H, AL-HADID S A, ALI M B W, et al. Role of curcumin in regulating p53 in breast cancer: an overview of the mechanism of action[J]. Breast Cancer, 2018, 10: 207-217. |
| [13] |
YU J, ZHOU X M, HE X S, et al. Curcumin induces apoptosis involving bax/bcl-2 in human hepatoma SMMC-7721 cells[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2011, 12(8): 1925-1929. |
| [14] |
ZHANG J, ZHANG T, TI X Y, et al. Curcumin promotes apoptosis in A549/DDP multidrug-resistant human lung adenocarcinoma cells through an miRNA signaling pathway[J]. Biochemical and Biophysical Research Communications, 2010, 399(1): 1-6. DOI:10.1016/j.bbrc.2010.07.013 |
| [15] |
WEI Y M, YANG P J, CAO S S, et al. The combination of curcumin and 5-fluorouracil in cancer therapy[J]. Archives of Pharmacal Research, 2018, 41(1): 1-13. DOI:10.1007/s12272-017-0979-x |
| [16] |
FIROUZI AMOODIZAJ F, BAGHAEIFAR S, TAHERI E, et al. Enhanced anticancer potency of doxorubicin in combination with curcumin in gastric adenocarcinoma[J]. Journal of Biochemical and Molecular Toxicology, 2020, 34(6): e22486. DOI:10.1002/jbt.22486 |
| [17] |
张惜琴, 范媛媛, 梁靓靓, 等. 姜黄素纳米制剂抗消化系统肿瘤的药理作用研究进展[J]. 药物评价研究, 2022, 45(7): 1440-1445. |
| [18] |
陈进, 代文婷, 邢海燕, 等. 微载体药物递送系统在姜黄素中的应用研究进展[J]. 中国现代应用药学, 2012, 29(10): 885-889. |
| [19] |
刘静, 唐浩, 米鹏, 等. 抗肿瘤纳米药物临床转化研究进展[J]. 科技导报, 2018, 36(22): 118-126. |
| [20] |
葛界芳, 熊向源. 抑制癌症治疗多药耐药性的纳米药物递送体系[J]. 精细化工, 2023, 40(5): 989-999. |
| [21] |
匡正, 秦超, 杨磊, 等. 纳米制剂克服肿瘤多药耐药的研究进展[J]. 药学研究, 2022, 41(10): 667-672, 696. |
| [22] |
石金凤, 李杰, 杨晓琴, 等. 中药活性成分协同化疗药物的纳米共载体系联合抗肿瘤现状分析[J]. 药学学报, 2019, 54(2): 258-268. |
| [23] |
程德怀. 中医对癌症病因的认识及防治措施[J]. 长春中医药大学学报, 2010, 26(4): 511-512. |
| [24] |
孙梅艳, 易敏春, 李庆兰. 中医古籍中对肿瘤病名及其病因病机的认识荟萃[J]. 中国卫生产业, 2013, 10(33): 172-173. |
| [25] |
朱紫薇, 顾媛媛, 韩玉生, 等. 中医药在癌症治疗中的定位思考与研究[J]. 辽宁中医杂志, 2018, 45(2): 423-425. |
| [26] |
华何与, 杨运高, 张红栓. 论气虚血瘀与肿瘤转移[J]. 中国中医基础医学杂志, 2005, 11(8): 564-565. DOI:10.3969/j.issn.1006-3250.2005.08.002 |
| [27] |
刘毅波. 血瘀证的病理及活血化瘀中药的临床应用[J]. 天津中医药, 2008, 25(3): 246-249. |
| [28] |
崔明花, 付二花, 林贞花, 等. 姜黄素抗肿瘤药理作用的研究进展[J]. 中国临床药理学杂志, 2021, 37(2): 186-188, 196. |
| [29] |
陈美霓, 郭巍, 郝琴, 等. 姜黄素的药理作用、临床应用及机制研究进展[J]. 延安大学学报(医学科学版), 2021, 19(3): 96-99. |
| [30] |
FADUS M C, LAU C, BIKHCHANDANI J, et al. Curcumin: An age-old anti-inflammatory and anti-neoplastic agent[J]. Journal of Traditional and Complementary Medicine, 2017, 7(3): 339-346. DOI:10.1016/j.jtcme.2016.08.002 |
| [31] |
DENG Y I, VERRON E, ROHANIZADEH R. Molecular mechanisms of anti-metastatic activity of curcumin[J]. Anticancer Research, 2016, 36(11): 5639-5647. DOI:10.21873/anticanres.11147 |
| [32] |
RAHBAN M, HABIBI-REZAEI M, MAZAHERI M, et al. Anti-viral potential and modulation of Nrf2 by curcumin: Pharmacological implications[J]. Antioxidants, 2020, 9(12): 1228. DOI:10.3390/antiox9121228 |
| [33] |
LLANO S, GÓMEZ S, LONDOÑO J, et al. Antioxidant activity of curcuminoids[J]. Physical Chemistry Chemical Physics: PCCP, 2019, 21(7): 3752-3760. DOI:10.1039/C8CP06708B |
| [34] |
HAJAVI J, MOMTAZI A A, JOHNSTON T P, et al. Curcumin: a naturally occurring modulator of adipokines in diabetes[J]. Journal of Cellular Biochemistry, 2017, 118(12): 4170-4182. DOI:10.1002/jcb.26121 |
| [35] |
LI H, SUREDA A, DEVKOTA H P, et al. Curcumin, the golden spice in treating cardiovascular diseases[J]. Biotechnology Advances, 2020, 38: 107343. DOI:10.1016/j.biotechadv.2019.01.010 |
| [36] |
SEO H J, WANG S M, HAN C S, et al. Curcumin as a putative antidepressant[J]. Expert Review of Neurotherapeutics, 2015, 15(3): 269-280. DOI:10.1586/14737175.2015.1008457 |
| [37] |
RUIZ DE PORRAS V, LAYOS L, MARTÍNEZ-BALIBREA E. Curcumin: a therapeutic strategy for colorectal cancer?[J]. Seminars in Cancer Biology, 2021, 73: 321-330. DOI:10.1016/j.semcancer.2020.09.004 |
| [38] |
SINHA D, BISWAS J, SUNG B, et al. Chemopreventive and chemotherapeutic potential of curcumin in breast cancer[J]. Current Drug Targets, 2012, 13(14): 1799-1819. DOI:10.2174/138945012804545632 |
| [39] |
WAN MOHD TAJUDDIN W N B, LAJIS N H, ABAS F, et al. Mechanistic understanding of curcumin's therapeutic effects in lung cancer[J]. Nutrients, 2019, 11(12): 2989. DOI:10.3390/nu11122989 |
| [40] |
LIU Z C, YANG Z X, ZHOU J S, et al. Curcumin regulates hepatoma cell proliferation and apoptosis through the Notch signaling pathway[J]. International Journal of Clinical and Experimental Medicine, 2014, 7(3): 714-718. |
| [41] |
XIANG L, HE B, LIU Q, et al. Antitumor effects of curcumin on the proliferation, migration and apoptosis of human colorectal carcinoma HCT-116 cells[J]. Oncology Reports, 2020, 44(5): 1997-2008. |
| [42] |
ZHANG Z W, CHEN H T, XU C, et al. Curcumin inhibits tumor epithelial-mesenchymal transition by downregulating the Wnt signaling pathway and upregulating NKD2 expression in colon cancer cells[J]. Oncology Reports, 2016, 35(5): 2615-2623. DOI:10.3892/or.2016.4669 |
| [43] |
雷鸣, 易朝锋. 姜黄素对人乳腺癌MCF-7细胞凋亡的影响及机制研究[J]. 临床合理用药杂志, 2020, 13(30): 163-165. |
| [44] |
MOGHTADERI H, SEPEHRI H, ATTARI F. Combination of Arabinogalactan and curcumin induces apoptosis in breast cancer cells in vitro and inhibits tumor growth via overexpression of p53 level in vivo[J]. Biomedicine & Pharmacotherapy, 2017, 88: 582-594. |
| [45] |
WU L C, GUO L X, LIANG Y H, et al. Curcumin suppresses stem-like traits of lung cancer cells via inhibiting the JAK2/STAT3 signaling pathway[J]. Oncology Reports, 2015, 34(6): 3311-3317. DOI:10.3892/or.2015.4279 |
| [46] |
TANG L L, LIU J J, ZHU L Y, et al. Curcumin inhibits growth of human NCI-H292 lung squamous cell carcinoma cells by increasing FOXA2 expression[J]. Frontiers in Pharmacology, 2018, 9: 60. DOI:10.3389/fphar.2018.00060 |
| [47] |
郑爽, 许林晖, 夏书月. 姜黄素抑制肺癌细胞A549上皮间质转化的机制研究[J]. 中国现代医学杂志, 2022, 32(9): 32-40. |
| [48] |
HAN L N, WANG Y, SUN S L. Curcumin inhibits proliferation of hepatocellular carcinoma cells through down regulation of DJ-1[J]. Cancer Biomarkers: Section A of Disease Markers, 2020, 29(1): 1-8. |
| [49] |
REN B Q, LUO S D, TIAN X F, et al. Curcumin inhibits liver cancer by inhibiting DAMP molecule HSP70 and TLR4 signaling[J]. Oncology Reports, 2018, 40(2): 895-901. |
| [50] |
牟海军, 金海, 陈幸幸, 等. 姜黄素对肝癌模型小鼠Keap1/ARE信号通路及胆汁酸肝肠循环的影响[J]. 中国比较医学杂志, 2020, 30(9): 8-14. |
| [51] |
JI J L, HUANG X F, ZHU H L. Curcumin and its formulations: Potential anti-cancer agents[J]. Anti-Cancer Agents in Medicinal Chemistry, 2012, 12(3): 210-218. DOI:10.2174/187152012800228733 |
| [52] |
LIU J Y, CHEN S Y, LV L, et al. Recent progress in studying curcumin and its nano-preparations for cancer therapy[J]. Current Pharmaceutical Design, 2013, 19(11): 1974-1993. |
| [53] |
王敏, 杨中澜, 周莉莉, 等. 固体脂质纳米粒吸入粉雾剂的研究进展[J]. 中国新药杂志, 2022, 31(6): 567-572. |
| [54] |
张延鹏, 赵东贤, 许珊珊, 等. 白藜芦醇新型递药系统制剂抗肿瘤研究进展[J]. 农业与技术, 2022, 42(19): 25-27. |
| [55] |
JOURGHANIAN P, GHAFFARI S, ARDJMAND M, et al. Sustained release curcumin loaded solid lipid nanoparticles[J]. Advanced Pharmaceutical Bulletin, 2016, 6(1): 17-21. DOI:10.15171/apb.2016.04 |
| [56] |
YALLAPU M M, KHAN S, MAHER D M, et al. Anti-cancer activity of curcumin loaded nanoparticles in prostate cancer[J]. Biomaterials, 2014, 35(30): 8635-8648. DOI:10.1016/j.biomaterials.2014.06.040 |
| [57] |
刘一, 张煜杰, 王梓榆, 等. 脂质体纳米药物制剂的生物分析方法及药代动力学研究进展[J]. 药学学报, 2023, 58(4): 834-843. |
| [58] |
BASNET P, HUSSAIN H, THO I, et al. Liposomal delivery system enhances anti-inflammatory properties of curcumin[J]. Journal of Pharmaceutical Sciences, 2012, 101(2): 598-609. DOI:10.1002/jps.22785 |
| [59] |
CHEN Y, WU Q Q, ZHANG Z H, et al. Preparation of curcumin-loaded liposomes and evaluation of their skin permeation and pharmacodynamics[J]. Molecules, 2012, 17(5): 5972-5987. DOI:10.3390/molecules17055972 |
| [60] |
ZHAO M, ZHAO M N, FU C, et al. Targeted therapy of intracranial glioma model mice with curcumin nanoliposomes[J]. International Journal of Nanomedicine, 2018, 13: 1601-1610. DOI:10.2147/IJN.S157019 |
| [61] |
杜艳, 杜丽. 姜黄素聚合物胶束的制备及抗肿瘤活性评价[J]. 中国医院药学杂志, 2023, 43(2): 181-185. |
| [62] |
郭娜, 吕佳琦, 李云, 等. 聚合物胶束作为抗癌药物纳米递送载体的研究进展[J]. 天津科技大学学报, 2022, 37(4): 71-80. |
| [63] |
LI X Y, CHEN T K, XU L, et al. Preparation of curcumin micelles and the in vitro and in vivo evaluation for cancer therapy[J]. Journal of Biomedical Nanotechnology, 2014, 10(8): 1458-1468. DOI:10.1166/jbn.2014.1840 |
| [64] |
SARIKA P R, JAMES N R, ANIL KUMAR P R, et al. Gum Arabic-curcumin conjugate micelles with enhanced loading for curcumin delivery to hepatocarcinoma cells[J]. Carbohydrate Polymers, 2015, 134: 167-174. DOI:10.1016/j.carbpol.2015.07.068 |
| [65] |
秦子振, 徐祖顺. 基于温度和pH敏感的刺激响应纳米凝胶的研究进展[J]. 胶体与聚合物, 2021, 39(3): 146-150. |
| [66] |
CHACKO R T, VENTURA J, ZHUANG J M, et al. Polymer nanogels: a versatile nanoscopic drug delivery platform[J]. Advanced Drug Delivery Reviews, 2012, 64(9): 836-851. DOI:10.1016/j.addr.2012.02.002 |
| [67] |
P R S, JAMES N R, P R A K, et al. Preparation, characterization and biological evaluation of curcumin loaded alginate aldehyde-gelatin nanogels[J]. Materials Science & Engineering C, Materials for Biological Applications, 2016, 68: 251-257. |
| [68] |
NIU J X, YUAN M, LIU Y, et al. Silk peptide-hyaluronic acid based nanogels for the enhancement of the topical administration of curcumin[J]. Frontiers in Chemistry, 2022, 10: 1028372. DOI:10.3389/fchem.2022.1028372 |
| [69] |
JIANG H, GENG D M, LIU H Q, et al. Co-delivery of etoposide and curcumin by lipid nanoparticulate drug delivery system for the treatment of gastric tumors[J]. Drug Delivery, 2016, 23(9): 3665-3673. DOI:10.1080/10717544.2016.1217954 |
| [70] |
颜雯璐, 郎天群, 尹琦, 等. 主动靶向肿瘤的纳米递药系统改善肿瘤免疫治疗研究进展[J]. 药学学报, 2022, 57(1): 46-63, 275. |
| [71] |
HU L D, PANG S X, HU Q F, et al. Enhanced antitumor efficacy of folate targeted nanoparticles co-loaded with docetaxel and curcumin[J]. Biomedicine & Pharmacotherapy, 2015, 75: 26-32. |
| [72] |
CUI T X, ZHANG S H, SUN H. Co-delivery of doxorubicin and pH-sensitive curcumin prodrug by transferrin-targeted nanoparticles for breast cancer treatment[J]. Oncology Reports, 2017, 37(2): 1253-1260. DOI:10.3892/or.2017.5345 |
| [73] |
陈珊, 张庭瑜, 杨梅, 等. pH敏感纳米药物载体在肿瘤治疗中的应用研究[J]. 生命的化学, 2020, 40(3): 358-368. |
| [74] |
XING H, HWANG K, LU Y. Recent developments of liposomes as nanocarriers for theranostic applications[J]. Theranostics, 2016, 6(9): 1336-1352. DOI:10.7150/thno.15464 |
| [75] |
CHENG Y, ZHAO P X, WU S P, et al. Cisplatin and curcumin co-loaded nano-liposomes for the treatment of hepatocellular carcinoma[J]. International Journal of Pharmaceutics, 2018, 545(1/2): 261-273. |
| [76] |
RUTTALA H B, KO Y T. Liposomal co-delivery of curcumin and albumin/paclitaxel nanoparticle for enhanced synergistic antitumor efficacy[J]. Colloids and Surfaces B: Biointerfaces, 2015, 128: 419-426. DOI:10.1016/j.colsurfb.2015.02.040 |
| [77] |
JIANG K Q, SHEN M J, XU W H. Arginine, glycine, aspartic acid peptide-modified paclitaxel and curcumin co-loaded liposome for the treatment of lung cancer: In vitro/vivo evaluation[J]. International Journal of Nanomedicine, 2018, 13: 2561-2569. DOI:10.2147/IJN.S157746 |
| [78] |
YE X, CHEN X, HE R X, et al. Enhanced anti-breast cancer efficacy of co-delivery liposomes of docetaxel and curcumin[J]. Frontiers in Pharmacology, 2022, 13: 969611. |
| [79] |
周伟成, 岳鹏飞, 雷方方, 等. 环糊精包合物脂质体技术及其在药物递送中的应用进展[J]. 中国医药工业杂志, 2022, 53(7): 943-952. |
| [80] |
GHARIB R, GREIGE-GERGES H, FOURMENTIN S, et al. Liposomes incorporating cyclodextrin-drug inclusion complexes: current state of knowledge[J]. Carbohydrate Polymers, 2015, 129: 175-186. |
| [81] |
陈仕红. 姜黄素和阿霉素双载药靶向脂质体的制备及抗肿瘤活性研究[D]. 武汉: 湖北中医药大学, 2019.
|
| [82] |
MOHANTY A K, MOHANTA G P. Micelle-assisted combination therapies for effective glioblastoma treatment: an in-vitro assessment[J]. Anti-Cancer Drugs, 2015, 26(3): 312-322. |
| [83] |
ABOUZEID A H, PATEL N R, TORCHILIN V P. Polyethylene glycol-phosphatidylethanolamine (PEG-PE)/vitamin E micelles for co-delivery of paclitaxel and curcumin to overcome multi-drug resistance in ovarian cancer[J]. International Journal of Pharmaceutics, 2014, 464(1/2): 178-184. |
| [84] |
ZENG X L, ZHANG Y W, XU X, et al. Construction of pH-sensitive targeted micelle system co-delivery with curcumin and dasatinib and evaluation of anti-liver cancer[J]. Drug Delivery, 2022, 29(1): 792-806. |
| [85] |
李宁, 刘晓燕. 聚合物-药物结合物递药系统的研究进展[J]. 药物生物技术, 2015, 22(4): 357-361. |
| [86] |
孙雅静, 王一斌, 刘艳杰, 等. 聚合物纳米药物用于治疗脑胶质瘤的最新研究进展[J]. 中国科学: 生命科学, 2021, 51(7): 819-835. |
| [87] |
GUO W, SONG Y Y, SONG W T, et al. Co-delivery of doxorubicin and curcumin with polypeptide nanocarrier for synergistic lymphoma therapy[J]. Scientific Reports, 2020, 10: 7832. |
| [88] |
MUTHOOSAMY K, ABUBAKAR I B, BAI R G, et al. Exceedingly higher co-loading of curcumin and paclitaxel onto polymer-functionalized reduced graphene oxide for highly potent synergistic anticancer treatment[J]. Scientific Reports, 2016, 6: 32808. |
 2024, Vol. 41
2024, Vol. 41