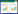文章信息
- 赵露, 张舒静, 王毅.
- ZHAO Lu, ZHANG Shujing, WANG Yi.
- 中药药效物质及靶点发现新技术的研究进展
- Research progress of new technologies for the discovery of pharmacodynamic substances and targets in Chinese medicines
- 天津中医药, 2024, 41(10): 1298-1308
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(10): 1298-1308
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.10.13
-
文章历史
- 收稿日期: 2024-05-06
编者按: 天津中医药大学组分中药国家重点实验室开放课(2021年度、2022年度)围绕新型冠状病毒感染(COVID-19)防治、出院康复阶段证候梳理及中药应用研究资助了系列项目,为了推广项目的研究成果,展示先进的研究经验,本刊现设“炎症与免疫”专栏,以此作为专题进行组稿,通过多学科交叉、联合攻关方式,系统阐述病毒性肺炎发病不同阶段的“病-证”特征;临床有效中药如宣肺败毒方、清金益气方改善呼吸系统、免疫系统等功能紊乱的化学物质基础及其作用机制,以期为后续中医药治疗病毒性呼吸道疾病研究提供客观依据。
2. 浙江大学药学院中药科学与工程学系, 杭州 310058;
3. 组分中药国家重点实验室, 天津 301617
在本次全球肆虐的新型冠状病毒感染疫情中,“三方三药”突出了中药在防治新发性传染病方面具有独特的优势,充分体现了中医药在保护人类健康中的重要价值[1]。中药是中医药理论体系中的重要组成部分,是中医治疗疾病的主要载体,主要依靠中药的化学成分调节机体内生理活动[2]。但中药化学成分较多,作用机制错综复杂,因此需要解决的问题是如何从中药中筛选有效的活性物质并对其靶点进行验证。据此,为了更加全面地了解前沿技术在中药药效物质筛选及靶点发现研究中的应用,本文归纳总结了药效物质发现及靶标蛋白快速辨析的新技术及策略并对其原理及应用实例进行阐述,以期能够为中药药效物质发现及作用机制探究提供新的思路。
1 中药药效物质发现新技术为了能够更加高效、全面地探索开发中药的药效物质,国内外研究者依据中药自身特点,交叉引用了一系列前沿的技术,构建符合中药多靶点多成分特点的药效物质筛选体系。现将近年来在中药药效物质筛选领域应用的技术手段逐个进行总结。见图 1。
|
| 注:本图由Figdraw(www.figdraw.com)绘制。 图 1 中药药效物质发现新技术概述 Fig. 1 Overview of new technologies for discovery of pharmacodynamic substances in traditional Chinese medicines |
超分子,又称“超越分子的化学”,是指主客体化合物间通过非共价键作用形成新的分子[3]。随着研究的不断深入,有科研人员基于超分子化学的概念构建超分子荧光传感器,该超分子荧光传感器是通过主-客体间非共价相互键合,再与目标分析物结合形成新的合成系统,根据反应前后荧光团的荧光强度变化对目标分析物的特性进行剖析。
随着超分子化学的不断发展,无须化学基团共价标记的荧光探针层出不穷。研究者基于主客体置换原理提出了荧光指示剂置换策略(IDA)。在该策略中,荧光染料被大环分子结合,其光物理性质发生变化,常表现为荧光强度降低或增强,目标分析物会竞争性地结合大环主体置换出染料,恢复其光物理性质,实现信号的转导。该策略可以实现在缓冲溶液、血液、尿液等体液中检测目标分析物,无需合成优化,只需根据目标分析物筛选合适的主客体传感对即可[4]。其时间分辨模式即超分子串联检测(STA)常被应用于对酶活性的检测,简而言之,就是在IDA的基础上,由酶产生目标分析物竞争性结合大环主体,置换染料以实现荧光信号的变化,进而实时反应酶促过程[5]。Yu等[6]通过IDA技术筛选黄素单加氧酶3(FMO3)的抑制剂,磺化环4芳烃[4](SC4A)和Oxazine 1阳离子荧光染料(OX1),它是一种荧光强度较弱的报告基因对,当底物三甲胺(TMA)与该报告基因对发生结合后会使其荧光强度增加;报告基因对未能选择性结合底物时,FMO3催化底物TMA转化为产物三甲胺N-氧化物(TMAO),其荧光强度减弱。该团队基于IDA策略设计了以FMO3活性为指标的超分子化学探针,之后借助该探针从血府逐瘀汤中筛选发现柚皮苷、芍药苷、β-蜕皮酮、18β-甘草酸、苦杏仁苷、芍药苷及柴草皂苷A可减弱FMO3的活性,增加报告基因对的荧光强度。此探针的优势在于无须引入其他共价结合的荧光基团,适用于荧光基团共价结合后导致活性下降或消失的小分子化合物的筛选。
超分子化学的出现为生物成像提供了新的见解,但由于细胞结构复杂且容易对分析物与宿主之间结合造成干扰,因此通过超分子宿主-客体报告对特异性跟踪活细胞中的酶依旧很困难。近期Li等[7]基于超分子串联分析STA的原理,采用经典的主客体报告对[SC4A和光敏素(LCG)],通过设计人工多肽库来筛选对靶酶具有高亲和力的多肽序列,开发了一种以组蛋白脱乙酰基酶1(HDAC1)活性为检测指标的活细胞成像荧光传感系统,并进一步使用该系统从147个中药化合物中筛选发现人参的主要成分人参皂苷RK3能够降低HEK293T细胞中HDAC1蛋白水平,是治疗与HDAC1表达异常升高相关疾病的潜在药物。该探针具有灵敏度高、特异性较强、便于成像等特点,在天然药物活性物质筛选方面表现出了巨大的潜力。但该探针的局限性在于未能对活细胞中HDAC1蛋白的空间位置进行确定,因此还需结合其他实验策略明确蛋白空间定位以便减少复杂环境中背景荧光等其他干扰因素,进一步提高探针的特异性。荧光成像是目前生物成像领域中最为简便、灵敏的方式,其中基于超分子化学原理设计的荧光探针已经在体内外成像中成功应用,但大部分超分子探针主要围绕基础研究展开,以期未来能够应用于临床,推动精准医疗的发展。
1.2 微流控芯片技术微流控芯片是一种集微量样品进样、反应、分离、培养细胞及分选细胞等多种操作于一体的多功能芯片,且该芯片仅有几平方厘米大小[8]。与传统细胞培养和分析方法相比,微流控技术可以动态监控细胞培养、给药等过程,且其自动化的信号检测装置可以对细胞吸收药物后产生的信号分子进行采集分析。因其灵敏度高、特异性强、实验时间短且实验样品需求极少,非常适合用于中药活性物质的检测分析。近年来,类器官[9]和单细胞组学[10]等前沿技术与微流控芯片技术的联合应用,能够在体外模拟人体的生理病理状态,被广泛应用于高通量药物筛选[11]、生物标志物分析[12]等过程,为中药活性物质筛选及其药理作用评价提供了新的思路和方案。
Ai等[13]建立了一种精确的单细胞微流控装置,该装置通过优化微坑尺寸捕获单细胞,采用无泵被动阀技术实现微量、低剪切力的换液过程,具有快速、结果重现性好且能实现多次加药换液等优点。研究团队应用此装置从近200种中药化合物中对瞬时受体电位(TRP)通道的调节剂进行筛选,发现其可将传统Ca2+成像的假阳性/假阴性率从76.2%降低到4.8%,并从九里香中鉴定出4种抑制TRP通道的香豆素衍生物,其中香豆素衍生物B-304可缓解体内TRPA1介导的炎症性疼痛,验证了该筛选体系的可靠性。该微流控装置充分考虑了单细胞的异质性,提高了活性物质筛选的准确率,且封闭通道的设计有利于对痕量物质进行筛选,期待此系统可以进一步扩大筛选规模,实现中药药效物质的超高通量自动化筛选。此外,在针对如何研究肿瘤干细胞异质性并解析其分子特征和信号通路的关键问题时,Jia等[14]开发了一种无标记串联微流控肿瘤干细胞(CSCs)分选新方法。针对CSCs具有不稳定表型的异质种群,提出基于细胞变形性和细胞基质黏附特性的微流体串联机械分类策略。集成的MS-HCA芯片通过初筛获得高变形性和转移倾向的柔性细胞,复筛过程精确净化低黏性癌细胞,可以通过高通量、无标记的方式实现具有高变形性和低黏合能力的CSCs的强化分离,在体外和体内都表现出显著的干细胞样特征和转移能力。研究人员进一步将分选系统应用于靶向CSCs中药化合物的筛选和鉴定,成功从甘草的14种成分中发现异甘草素在体外和体内对肺癌干细胞表型均表现出很强的抑制能力,这证明了用于CSCs分离和靶向药物筛选的微流体集成系统的可靠性。与普通的微流控系统相比,基于细胞力学设计的单细胞微流控体系同时具有细胞纯化和化合物筛选两种功能,可以保证细胞分离结果的准确性和药物筛选结果的可重复性。近年来,随着显微技术的发展逐渐成熟,超分辨显微镜[15]和微流体的结合运用为单分子水平上对细胞结构和生物学特性研究提供了便利,如在细胞器成像过程中,可借助微流控芯片上的微孔道实现免疫染色等操作的高通量并行,使超分辨显微镜拍摄误差减小,分析统计结果更可靠;其次由于微流控尺寸极小,可对活细胞进行位置固定,联合超分辨显微镜可实现长时间且稳定的图像获取,期望二者合用能够进一步加快中药活性物质发现的进程。
1.3 质谱成像技术质谱成像技术(MSI)是一种融合经典质谱分析与离子成像对分子进行分析检测的无标记、可视化的新型技术手段。基质辅助激光解析电离-质谱学成像技术(MALDI-MSI)是质谱成像技术史上重要的转折点,Caprioli等[16]首次采用该方法对生物组织样本中的蛋白质等分子进行成像解析。该方法摒弃了传统分析方法样品前处理的复杂,又在原组织中保留了化合物的空间分布信息,被广泛应用于神经生物、肿瘤研究及药学等领域。
Wu等[17]对心肌梗死的大鼠灌胃给予附子提取物、附子多糖以及附子生物碱,处死后取其心脏组织进行冰冻切片,借助MALDI-MSI技术对大鼠心脏组织中代谢产物的变化进行分析,发现附子生物碱可对心肌能量代谢和磷脂水平进行调节从而缓解心肌梗死。此外该团队[18]对心梗后缺血性心力衰竭大鼠模型连续7周腹腔注射参麦注射液,利用MALDI-MSI对大鼠心脏组织的代谢物水平的变化进行分析,发现参麦注射液可减轻心肌缺血导致的磷脂水平升高。综上所述MALDI-MSI技术可直观地反映出大鼠体内代谢物含量和分布的变化趋势,以便从多角度对活性物质及其作用机制进行探讨,但是MALDI-MSI分析仪存在空间小、操作不方便等缺点。为了解决这一问题,Jiang等[19]采用纳米材料构建了新的MSI方法,实现了对小鼠肺中大气碳质气溶胶颗粒物的多组分的成像,可分析得到有机碳比无机碳更容易进入癌组织中。该方法虽然进一步改进了MALDI-MSI分析方法,但在单细胞水平对药物分子作用过程进行成像等这一问题依旧未能实现。基于此国内外多个研发团队对技术和方法进行了改进并取得了较好的成果,厦门大学杭纬课题组开发出了微透镜光纤激光解吸后电离飞行时间质谱仪[20]、近场解吸成像质谱仪[21]等创新技术,直观地呈现了药物在单个细胞中的分布情况及药物作用的动态过程。近几年,代谢组学技术作为生命科学重要的组成部分已在医药领域被广泛应用,将代谢组学技术与MSI技术整合联用,可实现代谢组整体分析与原位可视化图像分析双重呈现,有利于获得更多空间分布和动态变化的信息,能够直观且动态地展示病变及药物治疗过程,期待该技术能够在中药药效物质探索中得到广泛应用,推动中医药事业现代化发展的进程。
1.4 表面增强拉曼散射光谱分析技术拉曼光谱分析技术是一种分子光谱分析技术,通过分析与入射光频率不同的散射光谱得到被测物质的拉曼频移,进而得到分子运动的信息,确定待测物质的结构。拉曼光谱的应用总是因拉曼信号强度微弱而被限制,而表面增强拉曼散射光谱(SERS)是在拉曼光谱的基础上,结合贵金属基底使拉曼信号产生3~14个数量级的增强,解决了传统拉曼信号强度低的问题。SERS光谱分析技术是一种无损、准确的快速检测技术,能方便地给出物质的结构、组分等指纹信息,并且能从分子层面上识别各类物质及晶形结构,非常适合用于制药过程及药品检测。在中药材原料的鉴定和分析、掺杂物的表征和假冒伪劣产品的检测和中药产品的质量控制等方面应用广泛,为中药现代化研究提供了有效的手段[22]。
近日,Zhang等[23]开发了一种用于识别活性成分靶蛋白的新技术-高分辨率微共聚焦拉曼光谱仪的光亲和微阵列(HRMR-PM)。该原理主要基于在365 nm紫外照射下,小分子化合物与光亲和基团发生光交联反应,之后会产生新的光亲和微阵列,该光亲和微阵列附着的小分子化合物可特异性对靶蛋白进行富集。该方法无须进行标签修饰、化合物需求极少且分析速度快,可实现高通量筛选。利用上述原理该团队将参芪降糖颗粒中的十几种成分分别制成小分子化合物探针微阵列,对能够与α-葡萄糖苷酶特异性结合的小分子化合物进行筛选,发现人参皂苷Mb、芒柄花素、Gomisin D可与α-葡萄糖苷酶紧密结合。基于拉曼光谱仪光交联反应的非选择性固定化策略可同时对多种不同结构的天然药物进行筛选,经济成本低,适用性高。但该微阵列上小分子化合物固定量不一致会使目的蛋白的结合量产生差异,从而导致药物筛选结果存在一定的误差。此外,Zhang等[24]开发了一种双功能SRES探针,不仅含有6-氯己酸的SiO_2@Ag纳米团可对小分子化合物进行吸附,还共价固定了5-羟色胺转运体(5-HTT),可用于从天然产物中快速检测与5-HTT蛋白特异性结合的小分子化合物,进一步应用该探针对栀子花提取物的成分进行筛选,发现藏红花素Ⅰ可与5-HTT发生结合。该探针可直接对与靶蛋白结合的小分子化合物进行捕获和检测,具有特异性强、效率高的特点,在天然药物筛选及发现方面展示出了巨大的潜力。但目前SERS技术主要用于药材中痕量物质的检测,以期未来SERS探针技术可以在小分子化合物筛选中广泛应用。
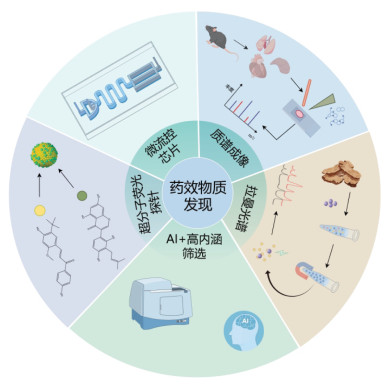
1.5 AI辅助多指标融合的高内涵表型分析技术高内涵筛选出现于20世纪90年代[25],利用自动化成像系统对生物样本进行大规模拍摄,通过高分辨图像处理软件对生物样本表型的特异性变化进行分析,是一种多参数、动态地反映生物样本信息的高通量筛选技术。高内涵筛选以高效快速、图像信息丰富、自动化程度高等优点取代了传统的筛选技术,更有助于中药复杂成分体系中的药效物质筛选[26]。但是运用该技术进行筛选往往会产生大量数据集,现有数据分析软件可能会因为图像采集的批次不一致,细胞数量较多时手动分割易出错等原因,导致数据统计结果误差偏大。因此,需要开发灵敏、智能的自动化软件,可以对采集的图像进行批量处理且无较大的误差。
基于AI辅助高内涵中药药效物质筛选方法的开发和应用是药效物质领域研究的热点,Jiang等[27]构建了一类以1,2,4,5-四嗪基为超氧阴离子作为特异性识别荧光探针,应用以超氧阴离子产生为指标的过氧叔丁醇(t BHP)损伤的H9c2细胞模型,从223种中药化合物库中筛选发现7,8-二羟基黄酮、青藤碱、甲钴胺、汉防己碱及5α-胆甾烷-3-酮可有效抑制t BHP刺激H9c2细胞时所产生的超氧阴离子的积聚。该工作依旧采用传统的分析软件对采集图像进行分析统计,很难保证根据主观判断设定的参数满足所有图像。基于此,为了减少在图像分割和生物学信息提取分析过程中人为操作的差异,Xun等[28]基于深度学习方法开发了一种新型细胞图像分割软件-Scellseg,该软件可对细胞器、细胞及生物体3个方面的显微荧光图像进行精准分割并分析,几乎不需要手动操作即可获得用户所需的细胞分割图像。随后Fang等[29]借助该软件对其线虫图像进行单虫图像分离分析,根据实验结果发现维生素A组线虫荧光面积高于正常组,与文献报道一致,说明该软件可被用于药物高通量筛选实验中线虫荧光图像的统计分析。深度学习已经成为医学图像分析的有力工具且在细胞分类及亚细胞定位及活性物质筛选等方面得到了广泛的应用。Chen等[30]开发了一种根据荧光图像评估DNA损伤的图像分析软件-FociNet,该软件不仅可以自动进行图像分割,还可以细胞核中Foci的数量为指标对每个细胞的DNA损伤进行分析。研究人员利用该技术筛选了315种中药单体化合物,首次发现吴茱萸碱、异甘草素、草质素可以减弱DNA损伤标志物--53BP1的表达。FociNet软件的成功运用,表明了深度学习非常适用于海量图像处理和药效物质发现领域,不但提高实验效率还保证了筛选结果的准确性。此外,Liu等[31]进一步联合计算机技术开发了一种用于对斑马鱼胚胎心室的自动定位以及心功能参数分析的深度学习算法,应用该算法处理了80 G的动态图像。通过对300多种中药化合物进行筛选,发现了能够改善斑马鱼心肌损伤的活性成分-氯化矢车菊素。结合细胞和小鼠模型发现氯化矢车菊素可通过调控Nrf2/Keap1通路有效改善化疗过程中阿霉素诱导的心力衰竭,且不影响化疗效果。总体来讲,深度学习算法的发展推动了高内涵筛选技术的进步,借助AI和高内涵技术探索中药的药效物质,建立高效快速且稳定的高通量中药药效物质筛选平台,有效推进了药效物质创新发展的进程,但目前高内涵技术的应用较浅,与类器官等热门技术的结合应用还需进一步地加强。中药药效物质发现新技术比较见表 1。
|
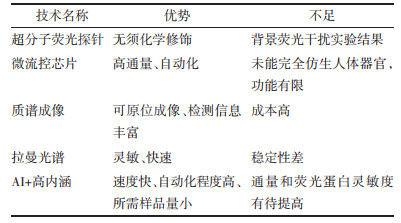
中药活性成分是中药发挥临床疗效的物质基础,对于中药药效物质的研究不但需要寻找具有功效的活性成分,还需探究该活性成分与体内受体、酶等生物大分子之间的相互作用关系。这对临床应用、新药研发及中医药现代化的推进具有重大意义。为了更简便高效地探究中药活性物质与蛋白靶点的互作关系,科研人员引入了“点击化学”技术、靶标响应可及性变化谱技术(TRAP)、表面等离子共振技术(SPR)及分子对接等前沿技术手段。下文将对几种在探索中药药效物质作用机制研究中所应用的技术方法进行阐述。见图 2。
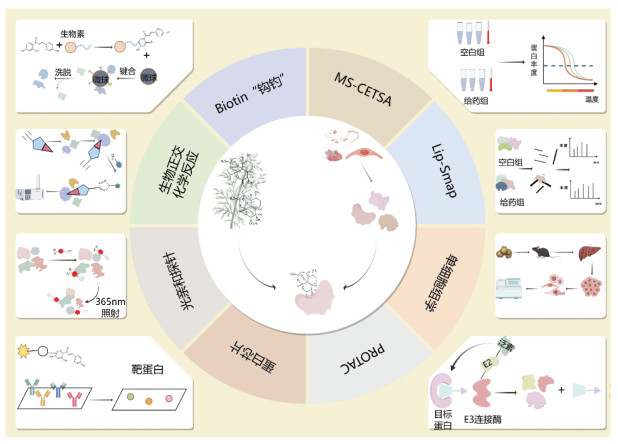
|
| 注:本图由Figdraw(www.figdraw.com)绘制。 图 2 中药药效物质靶点发现新技术概述 Fig. 2 Overview of new technologies for discovery of pharmacodynamic substance targets in traditional Chinese medicine |
基于小分子探针的靶点发现策略是指将药物小分子与便于检测的标签结合,或者将药物小分子固定在基质上构建具有药物修饰的探针。将该探针和细胞提取物共同孵育,吸附细胞提取物中可以与药物结合的特异性蛋白,利用合适的缓冲溶液对小分子探针上的特异性蛋白进行洗脱,之后借助凝胶电泳和高分辨质谱法对该特异性蛋白进行纯化分析。
2.1.1 Biotin“钩钓”技术应用生物素(Biotin)对目标活性化合物进行修饰是靶点“钩钓”技术常用的方法之一,其钩钓原理是基于生物素和链霉亲和素结合起来可形成稳定的生物素-链霉亲和素复合物,应用链霉亲和素磁珠可将小分子探针(Biotin修饰)特异性识别的靶蛋白从蛋白裂解液混合体系中分离出来。该探针的优点在于其可以穿过细胞膜,使药物小分子与胞内的蛋白原位结合。
Liao等[32]对苏木的活性成分苏木酮A进行Biotin标记,通过Pull-down实验联合氨基酸稳定同位素标记法,发现苏木酮A的直接作用靶点蛋白为肌苷-5'-单磷酸脱氢酶2(IMPDH2),通过直接作用于IMPDH2的140位半胱氨酸位点诱导其发生变构失活,进而抑制下游核因子-κB(NF-κB)等炎症相关信号通路发挥其抗神经炎症的作用。该实验通过分子靶点“钩钓”技术结合氨基酸稳定同位素标记法从分子层面对苏木酮A的抗炎机制进行了揭示,靶点“钩钓”技术在探索中药化合物靶点领域应用广泛,具有重要意义。但因biotin自身位阻偏大,将体积较大的亲和标签连接到药物分子上会导致药物分子活性减弱甚至失活,并且通过磁珠富集的靶蛋白特异性差出现假阳性的概率较大。
2.1.2 生物正交化学反应生物正交化学反应用结构简单的炔基或叠氮基取代位阻大的生物素标签,之后与靶蛋白进行结合形成新的复合物,再利用亚铜离子催化加成反应将被炔基等基团修饰的报告基因连接到复合物上,最后对靶蛋白进行纯化分析[33]。该方法解决了药物分子可能会失活的问题,进一步优化了对靶蛋白的富集效果。
Wang等[34]合成了炔烃修饰的姜黄素分子探针,可结合荧光染料在原位可视化姜黄素的直接结合靶点;通过结合同位素标签相对和绝对定量技术,在原位确定了姜黄素在HCT116细胞中特异性结合的靶点,随后对其潜在靶点的关键途径进行功能验证,验证了姜黄素在下调细胞蛋白质合成中的作用,以及诱导自噬、溶酶体激活和增加活性氧(ROS)产生的作用。另有Zhao等[35]将炔基修饰探针和串联质谱标签进行联合应用,发现小白菊内酯可与泛素羧基末端水解酶10(USP10)相互作用,减少细胞的增殖从而达到抗肿瘤的目的。该策略将点击化学和液质联用技术等其他技术整合到靶点发现的流程之中,扩大了靶蛋白确定的范围并提高了靶蛋白确定的准确性。然而,由于点击化学反应中存在亚铜离子,在利用活细胞进行实验时还需避免重金属对细胞产生毒性的问题。
2.1.3 光亲和探针上述两种亲和化学探针均属于对小分子化合物进行化学修饰,很大程度上限制了可供应用的范围。为了弥补现有化学探针的缺陷,研究人员开发了一种连接有光敏基团的化学探针,该探针的光敏基团受到特定波长光照射后会产生活性极高的中间体,之后与受体蛋白进行结合。
Wei等[36]以二苯基酮作为光敏基团,在紫外光356 nm照射下使该基团的自由基快速生成,且与靶标蛋白的羟基、氢基等基团发生结合,随后在蛋白分子20~80 kDa共鉴定出44个潜在的靶标蛋白。另有Gao等[37]在对青蒿素抗疟疾的相关机制进行研究时,将重氮嘧啶作为光反应基团构建青蒿素光亲和探针,利用356 nm的紫外光对重氮嘧啶进行激活,从而产生碳自由基,77个蛋白被鉴定为青蒿素的潜在靶标。该方法很好地解决了化学修饰困难等问题,但该探针特异性较差,易与非靶点蛋白产生共价结合,且光亲和基团合成较为困难,目前尚无最佳的光敏基团适用于绝大多数靶蛋白的确认。因此光敏基团的合理设计以及对靶蛋白的有效标记对于光亲和探针成功识别目标蛋白具有重要意义。
2.1.4 蛋白芯片技术蛋白芯片技术是一种由载体和载体蛋白组成的,可直接用于检测药物小分子与靶标蛋白相互作用的芯片。蛋白芯片技术对样品需求量小、操作简单、灵敏度高且可以同时对多种蛋白进行检测,极大地提高了工作效率,现在被广泛应用于药物作用靶点的确定中。目前,人类蛋白质图谱蛋白质片段阵列、ProtoArray人类蛋白质微阵列及HuProt人类蛋白质组微阵列等是较为常用的蛋白微阵列平台。其中HuProt人类蛋白质组包含超过21 000种人类蛋白质和蛋白质亚型,覆盖了人类蛋白质图谱定义的81%标准表达蛋白质,获得生物标志物可能性大。
Chen等[38]使用生物素标记的雷公藤红素和HuProtTM人类蛋白质微阵列研究雷公藤红素直接结合的目标蛋白,排名靠前的蛋白质被鉴定为抗氧化剂过氧化物酶。过氧化物还原酶1-4(Prdx1-4)都会与雷公藤红素发生相互作用,其中Prdx2展现了最大的信噪比和高结合力。进一步通过表面等离振子共振、等温滴定热分析、分子模拟方法和分子生物学手段确定了雷公藤红素直接结合并抑制Prdx2活性,从而增加ROS积累,诱导胃癌细胞的内质网应激、线粒体功能障碍和细胞凋亡。Zhang等[39]合成了生物素标记的野马追内酯B(Bio-EB),通过HuProt蛋白质组芯片来挖掘化合物的作用靶点,结果显示靶点中信噪比最高的为泛素特异性蛋白酶7(USP7),进一步通过CETSA实验和DARTS实验证明了Bio-EB和USP7蛋白结合,由此发现野马追内酯B可以靶向USP7蛋白非催化结构域抑制小胶质细胞的活化,证明了其在神经退行性疾病的治疗中的应用潜力。蛋白芯片技术集蛋白纯化和分析检测于一体,具有灵敏、高效等特点,弥补了普通蛋白靶点“垂钓”不能对低丰度蛋白检测的缺陷。但其检测结果假阳性率较高,需要借助其他分子生物学手段对所富集的蛋白进行印证或结合其他方法对作用靶蛋白进行捕获。CUI等[40]将药物蛋白质芯片与无标记差示扫描荧光法(DSF)进行结合,提出了Chip-DSF联合应用捕获药物作用靶点的新方法,该方法的原理是当蛋白质被置于高温时,蛋白展开暴露出可与荧光染料结合的疏水部分,通过记录温度和荧光信号之间的变化关系,可根据不同温度下蛋白的结合情况对目的蛋白进行筛选。随后他们应用该技术成功筛选出了人参皂苷-Rg2的靶标蛋白Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)。Chip-DSF技术无须对药物进行化学修饰且与单一的蛋白芯片技术相比该方法可以降低蛋白质芯片中的假阳性结果,提高靶标筛选的效率。
2.2 基于蛋白稳定性的靶点发现策略虽然标记的化学探针技术日趋成熟且应用广泛,但有的中药成分构效关系较为复杂,难以找到合适的修饰位点;且中药活性成分分子探针的构效关系具有极强的特异性,对所有成分进行结构修饰这一策略实施较为困难。因此需要寻找一种操作简单、灵敏度高、无须添加标签且适用于大多数药物分子的靶点发现策略。
随着蛋白质组学技术的不断发展完善,以及蛋白水解、热稳定性等相关研究的不断深入,无标记的蛋白组学靶点识别技术被广泛应用于中药活性小分子靶标蛋白的探索。此类技术主要基于活性小分子通过高亲和力与靶标蛋白结合后使靶标蛋白的理化性质发生变化,例如蛋白的水解稳定性、热稳定性等特性。基于蛋白稳定性的靶标发现技术包括细胞热迁移分析技术(CETSA)、氧蛋白稳定性分析技术(SPROX)、药物亲和靶标稳定性分析技术(DARTS)等。
2.2.1 MS-CETSACETSA技术的原理是当小分子化合物与靶蛋白结合时可提高蛋白质的热稳定性,但未与小分子化合物结合的蛋白会随温度的变化发生降解。MS-CETSA融合了CETSA和质谱技术,解决了CETSA技术工作强度大,且筛选通量低的问题。其过程主要分为3个步骤:首先在不同温度梯度下对细胞/组织样品进行加热,其次对样品进行裂解获得可溶性的蛋白上清液,最后通过质谱检测蛋白质的融化曲线并对目标蛋白进行分析鉴定[41]。
近年来,MS-CETSA技术在靶点验证方面得到了广泛的应用。Xu等[42]利用高通量筛选发现白术内酯Ⅰ(ATT-Ⅰ)可通过促进人和小鼠结直肠癌(CRC)细胞的肿瘤抗原呈递,进一步增强对细胞毒性T细胞的细胞毒性反应,并以未经处理的小鼠结肠癌细胞(MC38细胞)作为对照组,ATT-Ⅰ处理的MC38肿瘤细胞作为实验组,通过多重定量质谱蛋白质组学和热位移技术发现ATT-Ⅰ的主要靶标蛋白是蛋白酶体26S亚基非ATPase4(PMSD4)。Dziekan等[44-45]采用CETSA-MS技术手段对人类疟疾的主要病原体恶性疟原虫进行药物靶点鉴定,结合生物化学、生物物理学及细胞生物学研究确定了恶性疟原虫嘌呤核苷磷酸化酶(PfPNP)和临床使用的抗疟药奎宁具有极高的相互作用力,是奎宁的作用靶点。以MS-CETSA技术为基础,结合等温剂量实验探讨药物剂量的改变是否会影响药物靶蛋白的结合,不但保证了药物靶点的准确性还可对药物和靶蛋白间的作用亲和力进行测定。Wang等[43]在探究花生皮中的化合物是否具有抗化疗引起的血小板减少症(CIT)血栓形成的功效时,先后借助CETAS及等温剂量反应指纹图谱(ITDRFCETSA)技术,发现原花青素A1与JAK激酶2结合后使后者的稳定性增加,成为JAK激酶2的第一个天然激活剂,该研究利用ITDRFCETSA技术成功发现了原花青素A1治疗CIT血栓的作用靶点,对花生皮发挥抗CIT的功效进行了科学的解释。非标记的MS-CETSA能够在整个蛋白质组范围内监测小分子药物与蛋白质靶点的结合,因此非常适用于作用模式未知的中药活性小分子的靶标鉴定,是对现有方法的有效补充。MS-CETSA技术相较于CETSA技术而言,提高了蛋白检测分析的通量和速度,但不适用于对热稳定性较好的靶蛋白的检测。
2.2.2 Lip-SMap2009年,Lomenick等[46]提出了DARTS的概念,其确定靶标蛋白的原理是基于靶蛋白与药物小分子结合后,该靶蛋白不易被蛋白酶水解,通过蛋白免疫印迹实验对未被降解的蛋白进行确认并通过MS进行分析。以DARTS技术为基础,研究人员提出了一项新的蛋白质组学分析方法--有限水解酶质谱法(LiP-SMap)策略。该技术不但能识别与药物分子结合的靶向蛋白,还可反应与药物分子结合时肽段的结合顺序。Zhang等[47]借助LiP-SMap技术研究异甘草素预防非酒精性脂肪肝病的靶蛋白。首先用异甘草素(ISO)对样品进行处理,利用广谱蛋白酶K对其进行分解以便得到具有特定结构的蛋白质片段;通过胰酶对蛋白质片段进行消化分解并利用定量质谱对消化产物进行分析,共获得与ISO相关靶蛋白86个;之后通过GO功能富集及RNAi等分子生物学方法验证GTPase激活蛋白(IQGAP2)可能是ISO发挥降脂作用的靶点,可用于调节体内脂质稳态平衡。Chen等[48]利用LiP-SMap结合微尺度热电泳及分子对接等技术手段,验证了二氢脂酰胺S-乙酰转移酶(Dlat)是传统中药贯叶连翘的提取物贯叶金丝桃素的直接作用靶点,促进脂肪组织产热,证实了其在肥胖症治疗中的潜力。与DARTS技术相比较,Lip-SMap技术利用高分辨率的质谱监测技术代替银染技术对差异蛋白进行检测,不仅能够得出靶蛋白结合域的相关信息,能够对低丰度的蛋白进行检测还可实现高通量筛选。应用LiP-SMap技术筛选药效物质的靶点具有速度快,定量准,结果可靠等优势,加快了中药药效物质靶标发现的进程,有利于科研突破和成果转化。
2.3 其他靶点发现策略 2.3.1 PROTAC蛋白降解靶向联合体(PROTAC)概念在2001年由Sakamoto等[49]研究者提出并设计出了首个PROTAC分子,2004年[50]开发出了具有细胞渗透作用的PROTAC,解决了第一代PROTAC渗透性差等问题。随后Schneekloth等[51]首次合成了全小分子PROTAC,为靶向传统难以成药的靶点奠定了基础。PROTAC分子是由泛素E3连接酶配体和靶蛋白配体通过连接体连接所形成的一种复合物,当泛素活化酶E1将泛素传递给E2连接酶后,E2连接酶与E3连接酶形成二元复合物,E3连接酶和靶蛋白通过连接体连接进而缩小E2连接酶与靶蛋白的距离,从而将泛素传递给靶蛋白,实现该靶蛋白的降解。PROTAC已成为包括癌症在内的多种疾病靶向治疗的方法,在临床前和早期临床研究中显示出巨大的潜力。
目前,PROTAC技术可以在没有高亲和力的情况下降解靶蛋白,因此该技术在中药活性物质作用靶点探究中的应用引起了科研人员的高度关注。WU等[52]借助PROTAC技术结合蛋白质组学定量分析方法探究千金子中的活性成分千金烷二萜类化合物的作用靶点。将千金子二萜醇通过PEG linker与E3连接酶CRBN配体沙利度胺相连从而得到PROTAC分子,随后通过定量蛋白质组学方法检测PROTAC分子或载体处理前后的蛋白质水平变化进行分析,研究发现V-MAF肌肉腱膜纤维肉瘤癌基因同源物F(MAFF)的降解效率最高,是千金子二萜类化合物降低ROS产生、抑制NF-κB活化和维持线粒体质量而发挥抗炎作用的关键靶蛋白。此外,Li等[53]采用PROTAC策略,选择青蒿琥酯、双氢青蒿素和青蒿素二聚体SM1044作为起始原料,PEG Linker与CRBN E3连接酶配体泊马度胺偶联,通过对青蒿素不同位点进行修饰得到4个青蒿素衍生化合物。发现SM1044衍生物AD4可能具有治疗血液瘤的潜在功效,进一步结合蛋白质组学方法发现AD4可能通过直接靶向PCNA钳夹相关因子(PCLAF)起到抑制血液瘤的作用。与其他亲和小分子探针相比较,该技术最大的优势在于对靶点进行识别时无须考虑药物和靶蛋白之间的结合力,只需要保证PROTAC分子可与目的蛋白的配体结合,即可诱导目的蛋白进行降解,且其利用定量蛋白质组学对降解的蛋白质进行分析,可降低假阳性结果的概率。因此PROTAC探针结合定量蛋白质组学的方法可以作为中药药效物质靶点鉴定的一种新的途径,值得进一步应用和研究。
2.3.2 单细胞组学技术单细胞测序技术是在单细胞水平上对基因结构及基因表达进行检测的一种高通量技术,2009年Tang等[54]首次通过单细胞转录组扩增方法分析了小鼠早期胚胎发育阶段单个生殖细胞转录组,随后单细胞测序技术受到越来越多的关注,2013年《科学》杂志更是将单细胞测序技术列为了年度最值得关注的科学技术。近年来,随着单细胞测序技术的不断完善发展,为阐明中药复杂的作用机制以及加快中药现代化的发展带来了新的机遇,应用单细胞测序技术对中药活性成分干预前后不同细胞基因表达差异进行识别有助于阐明中药的作用靶点及相关机制。
杨鹏挥等[55]认为将单细胞测序技术应用于中药研究中,可以在单细胞水平辨析机体不同层次的动态调控及中药干预的过程,赋予药效原理新的科学解释。Jin等[56]对小鼠心梗模型不同时间点及丹参酮Ⅱ A干预后的心脏CD45+免疫细胞进行单细胞RNA测序分析,确定了主要的免疫细胞群体、不同的亚群和动态变化。该研究阐明了各免疫细胞对心梗后损伤修复过程的动态调控作用,同时发现丹参酮Ⅱ A可以抑制主要浸润巨噬细胞亚群,从而减少后续的不良心室重构。Zhang等[57]借助单细胞组学技术对复方雄黄天然靛蓝片中的活性成分丹参酮ⅡA治疗血液疾病的作用机制进行探究,发现丹参酮Ⅱ A与靛红联合使用可调节急性早幼粒细胞白血病小鼠骨髓间充质系细胞成骨分化、成脂分化和内皮细胞迁移相关基因,改善白血病小鼠正常造血相关基因表达。与传统组学技术不同的是,单细胞组学技术以单个细胞作为研究对象,对细胞复杂的生物学功能进行多方面的解析从而可以更全面地解释药物的疗效和作用机制。该策略的出现弥补了传统组学技术忽略细胞异质性所导致的误差,且能够对天然药物复杂的作用靶点进行精准的鉴定,因此单细胞组学技术非常适用于鉴定活性物质的作用靶点。
中药药效物质靶标发现新技术的比较情况见表 2。
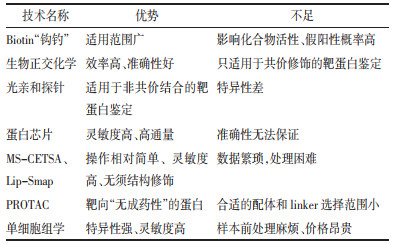
|
中药药效物质的筛选及作用靶点的鉴定对中药疗效的科学诠释及新药研发具有重要意义,也是推动中医药现代化和国际化发展的重要环节。本文归纳总结了近年来应用于药效物质筛选、作用靶点鉴定两方面的现代科学技术,发现研究人员在中药单体化合物药效物质和作用靶点发现领域中已经取得了阶段性的突破,建立了中药单体化合物特有的研究策略和体系,为更多活性成分的挖掘及靶标确认奠定了基础。但本文所提及的方法均存在一定的局限性,例如MS-CETSA技术虽然利用质谱组学的方法代替了银染技术对靶蛋白进行分析,实现了对低丰度靶蛋白的鉴定,但从大量数据集中提取到靶蛋白的相关信息较为困难。此外,现有技术手段主要应用于体外模型,在体内复杂的环境中是否适用,还需要进一步的探索和验证。且在中药复方多成分、多作用通路的情况下,利用现有技术手段很难对其药效物质、作用靶标进行全面地阐述,因此研究者仍需在中医药理论指导下,继续发挥多学科、多领域技术交叉融合的优势,对中药复方复杂体系中的药效物质及其作用机制进行更深入探讨,期待未来能够用科学原理揭示中药复方药效物质和作用机制的内涵,助推中医药研究的现代化进程。
| [1] |
张晓雨, 刘硕, 孙杨, 等. 从"三药三方"谈中药新药审评理念、研发思路及策略[J]. 中国新药杂志, 2020, 29(16): 1818-1821. DOI:10.3969/j.issn.1003-3734.2020.16.004 |
| [2] |
王毅, 张晗, 张伯礼, 等. 中药药效物质多模态辨识方法学及其应用研究[J]. 中国中药杂志, 2020, 45(1): 1-6. |
| [3] |
LEHN J M. Supramolecular chemistry-Scope and perspectives molecules, supermolecules, and molecular devices(Nobel lecture)[J]. Angewandte Chemie International Edition in English, 1988, 27(1): 89-112. DOI:10.1002/anie.198800891 |
| [4] |
NGUYEN B, ANSLYN E. Indicator-displacement assays[J]. Coordination Chemistry Reviews, 2006, 250: 3118-3127. DOI:10.1016/j.ccr.2006.04.009 |
| [5] |
GUO D S, UZUNOVA V D, SU X, et al. Operational calixarene-based fluorescent sensing systems for choline and acetylcholine and their application to enzymatic reactions[J]. Chemical Science, 2011, 2(9): 1722-1734. DOI:10.1039/c1sc00231g |
| [6] |
YU H J, CHAI X, GENG W C, et al. Facile and label-free fluorescence strategy for evaluating the influence of bioactive ingredients on FMO3 activity via supramolecular host-guest reporter pair[J]. Biosensors & Bioelectronics, 2021, 192: 113488. |
| [7] |
LI M, YU H J, LI Y R, et al. Rational design of supramolecular self-assembly sensor for living cell imaging of HDAC1 and its application in high-throughput screening[J]. Biosensors & Bioelectronics, 2023, 242: 115716. |
| [8] |
XIONG B, REN K N, SHU Y W, et al. Recent developments in microfluidics for cell studies[J]. Advanced Materials, 2014, 26(31): 5525-5532. DOI:10.1002/adma.201305348 |
| [9] |
SALMON I, GREBENYUK S, ABDEL FATTAH A R, et al. Engineering neurovascular organoids with 3D printed microfluidic chips[J]. Lab on a Chip, 2022, 22(8): 1615-1629. DOI:10.1039/D1LC00535A |
| [10] |
GERARD A, WOOLFE A, MOTTET G, et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics[J]. Nature Biotechnology, 2020, 38(6): 715-721. DOI:10.1038/s41587-020-0466-7 |
| [11] |
FAN X Y, DENG Z F, YAN Y Y, et al. Application of microfluidic chips in anticancer drug screening[J]. Bosnian Journal of Basic Medical Sciences, 2022, 22(3): 302-314. |
| [12] |
WANG C, WANG C H, WU Y, et al. High-throughput, living single-cell, multiple secreted biomarker profiling using microfluidic chip and machine learning for tumor cell classification[J]. Advanced Healthcare Materials, 2022, 11(13): e2102800. DOI:10.1002/adhm.202102800 |
| [13] |
AI X N, WU Y, LU W B, et al. A precise microfluidic assay in single-cell profile for screening of transient receptor potential channel modulators[J]. Advanced Science, 2020, 7(11): 2000111. DOI:10.1002/advs.202000111 |
| [14] |
JIA Y Y, SHEN P L, YAN T, et al. Microfluidic tandem mechanical sorting system for enhanced cancer stem cell isolation and ingredient screening[J]. Advanced Healthcare Materials, 2021, 10(20): e2100985. DOI:10.1002/adhm.202100985 |
| [15] |
YANG W, HOU L, LUO C X. When super-resolution microscopy meets microfluidics: Enhanced biological imaging and analysis with unprecedented resolution[J]. Small, 2023, 19(23): e2207341. DOI:10.1002/smll.202207341 |
| [16] |
CAPRIOLI R M, FARMER T B, GILE J. Molecular imaging of biological samples: Localization of peptides and proteins using MALDI-TOF MS[J]. Analytical Chemistry, 1997, 69(23): 4751-4760. DOI:10.1021/ac970888i |
| [17] |
WU H, LIU X, GAO Z Y, et al. Anti-myocardial infarction effects of Radix aconiti lateralis preparata extracts and their influence on small molecules in the heart using matrix-assisted laser desorption/ionization-mass spectrometry imaging[J]. International Journal of Molecular Sciences, 2019, 20(19): 4837. DOI:10.3390/ijms20194837 |
| [18] |
WU H, DAI Z F, LIU X, et al. Pharmacodynamic evaluation of Shenfu injection in rats with ischemic heart failure and its effect on small molecules using matrix-assisted laser desorption/ionization-mass spectrometry imaging[J]. Frontiers in Pharmacology, 2019, 10: 1424. DOI:10.3389/fphar.2019.01424 |
| [19] |
JIANG Y M, SUN J, XIONG C Q, et al. Mass spectrometry imaging reveals in situ behaviors of multiple components in aerosol particles[J]. Angewandte Chemie, 2021, 60(43): 23225-23231. DOI:10.1002/anie.202103874 |
| [20] |
LI X P, HANG L, WANG T T, et al. Nanoscale three-dimensional imaging of drug distributions in single cells via laser desorption post-ionization mass spectrometry[J]. Journal of the American Chemical Society, 2021, 143(51): 21648-21656. DOI:10.1021/jacs.1c10081 |
| [21] |
YIN Z B, CHENG X L, LIU R, et al. Chemical and topographical single-cell imaging by near-field desorption mass spectrometry[J]. Angewandte Chemie, 2019, 58(14): 4541-4546. DOI:10.1002/anie.201813744 |
| [22] |
YILMAZ H, YILMAZ D, TASKIN I C, et al. Pharmaceutical applications of a nanospectroscopic technique: Surface-enhanced Raman spectroscopy[J]. Advanced Drug Delivery Reviews, 2022, 184: 114184. DOI:10.1016/j.addr.2022.114184 |
| [23] |
ZHANG H, XIE J H, FENG Q, et al. High resolution micro-confocal Raman spectrometer-based photo-affinity microarray technology for the investigation of active ingredients-Target protein recognition strategy[J]. Analytica Chimica Acta, 2023, 1268: 341373. DOI:10.1016/j.aca.2023.341373 |
| [24] |
ZHANG D D, MA J, ZHENG X X, et al. Fabrication of a bioconjugated dual-functional SERS probe for facile compound screening and detection[J]. Biosensors & Bioelectronics, 2023, 234: 115369. |
| [25] |
孙婉, 李敏. 药物筛选技术的最新进展: 高内涵筛选[J]. 中国新药杂志, 2006, 15(1): 12-16. |
| [26] |
赵永娟, 高雯, 邢绪东, 等. 高内涵成像技术在中药药效物质研究中的应用进展[J]. 中国中药杂志, 2022, 47(16): 4269-4276. |
| [27] |
JIANG X F, LI M, WANG Y L, et al. 1, 2, 4, 5-Tetrazine-tethered probes for fluorogenically imaging superoxide in live cells with ultrahigh specificity[J]. Nature Communications, 2023, 14(1): 1401. DOI:10.1038/s41467-023-37121-8 |
| [28] |
XUN D J, CHEN D H, ZHOU Y T, et al. Scellseg: A style-aware deep learning tool for adaptive cell instance segmentation by contrastive fine-tuning[J]. iScience, 2022, 25(12): 105506. DOI:10.1016/j.isci.2022.105506 |
| [29] |
FANG J Y, WU X Y, MENG X N, et al. Discovery of natural small molecules promoting collagen secretion by high-throughput screening in Caenorhabditis elegans[J]. Molecules, 2022, 27(23): 8361. DOI:10.3390/molecules27238361 |
| [30] |
CHEN X C, XUN D J, ZHENG R Z, et al. Deep-learning-assisted assessment of DNA damage based on foci images and its application in high-content screening of lead compounds[J]. Analytical Chemistry, 2020, 92(20): 14267-14277. DOI:10.1021/acs.analchem.0c03741 |
| [31] |
LIU C T, WANG Y C, ZENG Y X, et al. Use of deep-learning assisted assessment of cardiac parameters in zebrafish to discover cyanidin chloride as a novel Keap1 inhibitor against doxorubicin-induced cardiotoxicity[J]. Advanced Science, 2023, 10(30): e2301136. DOI:10.1002/advs.202301136 |
| [32] |
LIAO L X, SONG X M, WANG L C, et al. Highly selective inhibition of IMPDH2 provides the basis of antineuroinflammation therapy[J]. Proceedings of the National Academy of Sciences, 2017, 114(29): E5986-E5994. |
| [33] |
SCINTO S L, BILODEAU D A, HINCAPIE R, et al. Bioorthogonal chemistry[J]. Nature Reviews Methods Primers, 2021, 1: 30. DOI:10.1038/s43586-021-00028-z |
| [34] |
WANG J G, ZHANG J B, ZHANG C J, et al. In situ proteomic profiling of curcumin targets in HCT116 colon cancer cell line[J]. Scientific Reports, 2016, 6: 22146. DOI:10.1038/srep22146 |
| [35] |
ZHAO W S, CHEN K F, LIU M, et al. Investigation of targets and anticancer mechanisms of covalently acting natural products by functional proteomics[J]. Acta Pharmacologica Sinica, 2023, 44(8): 1701-1711. DOI:10.1038/s41401-023-01072-z |
| [36] |
WEI W, ZENG Q X, WANG Y, et al. Discovery and identification of EIF2AK2 as a direct key target of berberine for anti-inflammatory effects[J]. Acta Pharmaceutica Sinica B, 2023, 13(5): 2138-2151. DOI:10.1016/j.apsb.2022.12.009 |
| [37] |
GAO P, CHEN J Y, SUN P, et al. Chemical proteomic profiling with photoaffinity labeling strategy identifies antimalarial targets of artemisinin[J]. Chinese Chemical Letters, 2023, 34(12): 108296. DOI:10.1016/j.cclet.2023.108296 |
| [38] |
CHEN X, ZHAO Y, LUO W, et al. Celastrol induces ROS-mediated apoptosis via directly targeting peroxiredoxin-2 in gastric cancer cells[J]. Theranostics, 2020, 10(22): 10290-10308. DOI:10.7150/thno.46728 |
| [39] |
ZHANG X W, FENG N, LIU Y C, et al. Neuroinflammation inhibition by small-molecule targeting USP7 noncatalytic domain for neurodegenerative disease therapy[J]. Science Advances, 2022, 8(32): eabo0789. DOI:10.1126/sciadv.abo0789 |
| [40] |
CUI Z, CHEN P, LI C F, et al. Chip-DSF: A rapid screening strategy for drug protein targets[J]. Pharmacological Research, 2022, 182: 106346. DOI:10.1016/j.phrs.2022.106346 |
| [41] |
JAFARI R, ALMQVIST H, AXELSSON H, et al. The cellular thermal shift assay for evaluating drug target interactions in cells[J]. Nature Protocols, 2014, 9(9): 2100-2122. DOI:10.1038/nprot.2014.138 |
| [42] |
XU H C, VAN DER JEUGHT K, ZHOU Z L, et al. Atractylenolide Ⅰ enhances responsiveness to immune checkpoint blockade therapy by activating tumor antigen presentation[J]. The Journal of Clinical Investigation, 2021, 131(10): e146832. DOI:10.1172/JCI146832 |
| [43] |
WANG R, HU X L, WANG J J, et al. Proanthocyanidin A1 promotes the production of platelets to ameliorate chemotherapy-induced thrombocytopenia through activating JAK2/STAT3 pathway[J]. Phytomedicine, 2022, 95: 153880. DOI:10.1016/j.phymed.2021.153880 |
| [44] |
DZIEKAN J M, YU H, CHEN D, et al. Identifying purine nucleoside phosphorylase as the target of quinine using cellular thermal shift assay[J]. Science Translational Medicine, 2019, 11(473): eaau3174. DOI:10.1126/scitranslmed.aau3174 |
| [45] |
DZIEKAN J M, WIRJANATA G, DAI L Y, et al. Cellular thermal shift assay for the identification of drug-target interactions in the Plasmodium falciparum proteome[J]. Nature Protocols, 2020, 15(6): 1881-1921. DOI:10.1038/s41596-020-0310-z |
| [46] |
LOMENICK B, HAO R, JONAI N, et al. Target identification using drug affinity responsive target stability(DARTS)[J]. Proceedings of the National Academy of Sciences, 2009, 106(51): 21984-21989. DOI:10.1073/pnas.0910040106 |
| [47] |
ZHANG L, YANG S Y, QI-LI F R, et al. Administration of isoliquiritigenin prevents nonalcoholic fatty liver disease through a novel IQGAP2-CREB-SIRT1 axis[J]. Phytotherapy Research, 2021, 35(7): 3898-3915. DOI:10.1002/ptr.7101 |
| [48] |
CHEN S Z, LIU X X, PENG C, et al. The phytochemical hyperforin triggers thermogenesis in adipose tissue via a Dlat-AMPK signaling axis to curb obesity[J]. Cell Metabolism, 2021, 33(3): 565-580.e7. DOI:10.1016/j.cmet.2021.02.007 |
| [49] |
SAKAMOTO K M, KIM K B, KUMAGAI A, et al. Protacs: Chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation[J]. Proceedings of the National Academy of Sciencesa, 2001, 98(15): 8554-8559. DOI:10.1073/pnas.141230798 |
| [50] |
SCHNEEKLOTH J S Jr, FONSECA F N, KOLDOBSKIY M, et al. Chemical genetic control of protein levels: Selective in vivo targeted degradation[J]. Journal of the American Chemical Society, 2004, 126(12): 3748-3754. DOI:10.1021/ja039025z |
| [51] |
SCHNEEKLOTH A R, PUCHEAULT M, TAE H S, et al. Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(22): 5904-5908. |
| [52] |
WU Y L, YANG Y Y, WANG W, et al. PROTAC technology as a novel tool to identify thetarget of lathyrane diterpenoids[J]. Acta Phar- maceutica Sinica B, 2022, 12(11): 4262-4265. DOI:10.1016/j.apsb.2022.07.007 |
| [53] |
LI Y, ZENG Z W, CHEN D, et al. Facilitated drug repurposing with artemisinin-derived PROTACs: Unveiling PCLAF as a therapeutic target[J]. Journal of Medicinal Chemistry, 2023, 66(16): 11335-11350. DOI:10.1021/acs.jmedchem.3c00824 |
| [54] |
TANG F C, BARBACIORU C, WANG Y Z, et al. mRNA-Seq whole-transcriptome analysis of a single cell[J]. Nature Methods, 2009, 6(5): 377-382. DOI:10.1038/nmeth.1315 |
| [55] |
杨鹏挥, 金丽君, 廖杰, 等. 基于单细胞组学的中药现代研究: 技术及思路[J]. 中国中药杂志, 2022, 47(15): 3977-3985. |
| [56] |
JIN K Y, GAO S, YANG P H, et al. Single-cell RNA sequencing reveals the temporal diversity and dynamics of cardiac immunity after myocardial infarction[J]. Small Methods, 2022, 6(3): e2100752. DOI:10.1002/smtd.202100752 |
| [57] |
ZHANG X X, CHEN H B, HUANG X, et al. Single-cell transcriptomics profiling the compatibility mechanism of As2O3-indigo naturalis formula based on bone marrow stroma cells[J]. Biomedicine & Pharmacotherapy, 2022, 151: 113182. |
2. Department of Chinese Medicine Science and Engineering, College of Pharmaceutical Science, Zhejiang University, Hangzhou 310058, China;
3. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41