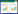文章信息
- 袁也, 马琳, 赵倩茹, 等.
- YUAN Ye, MA Lin, ZHAO Qianru, et al.
- 宣肺败毒颗粒增加T细胞数量减轻流感病毒肺炎的机制研究
- The mechanism of Xuanfei Baidu Granules to treat influenza virus pneumonia by increasing T cells
- 天津中医药, 2024, 41(10): 1309-1314
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(10): 1309-1314
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.10.14
-
文章历史
- 收稿日期: 2024-05-27
2. 天津中医药大学中西医结合学院, 天津 301617;
3. 天津中医药大学中医药研究院, 天津 301617;
4. 中国中医科学院研究所, 北京 100091;
5. 清华大学, 北京 100084
甲型流感病毒性肺炎,是流感病毒引发的急性呼吸道传染病[1]中传播最广泛的一种,发病率和病死率高,是威胁人类健康的最主要传染病之一[2]。中医认为,流感病毒感染为外感邪气所致[3-4]。因此,建立符合中医药特点的流感病毒肺炎动物模型对解析中药的多组分、多靶点、多通路的作用特点,具有重要的现实意义。
金刚烷胺和奥司他韦等神经氨酸酶或M2离子通道抑制剂等小分子药物,广泛用于流感病毒患者的临床治疗,但其具有治疗窗口期短、毒副作用大等局限性,因此亟待寻找更安全有效的抗流感病毒感染的药物。宣肺败毒颗粒(XFBD)用于普通型、湿毒郁肺证的新型冠状病毒感染患者的临床治疗[3],并且通过抑制新型冠状病毒的复制[5]、抑制过度固有免疫应答、减轻炎症反应[7],进而减轻肺、肠等靶器官损伤。然而,XFBD能否用于低温高湿环境下流感病毒感染的治疗,以及潜在的分子机制尚不明确。因此本研究通过建立流感病毒肺炎小鼠模型,同时,给予低温高湿的环境因素刺激,明确XFBD治疗流感病毒感染的药效及作用机制,为治疗病毒性肺炎的有效药物筛选及扩大XFBD的临床适应证提供实验支撑。
1 材料 1.1 实验动物25只SPF级4周龄ICR小鼠,雌雄各半,体质量(20±1) g,购自北京维通利华实验动物技术有限公司[SCK(京)2021-0006]。小鼠饲养于中国中医科学院中药研究所,温度(25±1) ℃,相对湿度40%~60%。所有动物实验均遵循北京市实验动物伦理委员会的规定。
1.2 实验药物XFBD购于山东步长制药股份有限公司。将XFBD颗粒溶于水中形成浓度为200 mg/mL的母液。
1.3 实验试剂胎牛血清(FBS)、磷酸盐缓冲液(PBS,美国康宁公司,批号:8122256);TRIzol Reagent(美国Life公司,批号:350110);4%细胞组织固定液(北京百瑞极生物科技有限公司,批号:20211229);抗体p-P65、P65、GAPDH和山羊抗兔二抗(批号分别为CST 4548、CST 8242、abcam ab8245,中杉金桥);抗体CD3-FITC、CD4-PE、CD8-APC、CD16/32(批号分别为BioLegend 100203、BioLegend 100407、BioLegend 344727、BioLegend 101301)等。
1.4 实验病毒株A/PR/8/34(H1N1) 毒株购自于美国ATCC公司,由中国中医科学院中药研究所ABSL-2实验室传代,于-80 ℃冰箱保存。
1.5 实验仪器电子分析天平,型号AR1140 MAX110 g,购自美国Ohaus公司;石蜡包埋机,型号EG1140H;自动染色机,型号XL5010,购自德国Leica公司;全自动轮转式切片机,型号HM355S,购自德国Microm公司;全景组织定量分析系统,型号Tissue FAXS Plus,购自奥地利TissueGnostics公司;小动物Micro-CT,型号Inveon MM,购自德国Siemens公司;流式细胞仪,型号Accuri C6 Plus,购自美国BD公司;Real-time PCR仪,型号QuantStudio 5,购自美国Applied biosystems公司;八连排管迷你离心机,型号LX-300等。
2 方法 2.1 动物实验设计小鼠每天持续置于95%±3%相对湿度,无风,温度(4±2) ℃的人工气候箱中,刺激4 h后取出,连续9 d,于低温高湿环境刺激第5天,小鼠用轻度麻醉后,以100倍半数感染剂量(TCID50)、体积为50 μL的病毒流感病毒稀释液滴鼻感染。感染当天连续5 d对小鼠进行灌胃给药(低剂量组为4 g/kg,高剂量组为8 g/kg)。以饮用水为空白对照,以奥司他韦(Oseltamivir)为阳性对照。
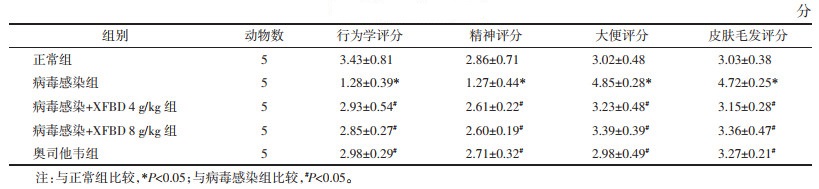
每隔2 d记录小鼠体质量,并绘制体质量变化曲线。第9天,将正常对照组小鼠和给药组小鼠进行Micro-CT肺部扫描。扫描后解剖取肺和脾,并称质量,计算肺指数=[肺质量(g)/体质量(g)]×100%,计算脾脏指数=[脾脏湿质量(g)/体质量(g)]×100%。取小鼠肺组织置于4%组织细胞固定液中,用于苏木素-伊红(HE)病理分析,剩余肺组织-80 ℃保存用于测定肺组织中病毒载量。具体流程见OSID开放科学标识码。
2.2 相关行为表征的评价造模后,第8天进行行为表征观察和评分,包括行为状态(扎堆不动=1分,少动=2分,适量活动=3分,活跃=4分,兴奋多动= 5分),精神状态(迟滞=1分,倦怠=2分,适度=3分,易激惹=4分,躁怒=5分),皮肤毛发状态(枯乱=1分,不泽=2分,顺泽=3分,潮湿=4分,油腻=5分),粪便状态(硬结=1分,干燥=2分,适宜=3分,黏腻=4分,便溏=5分)。
2.3 小鼠肺组织病理分析将固定后小鼠肺组织用乙醇和二甲苯进行脱水,并进行石蜡包埋。石蜡切片经HE染色后脱水封片,用光学显微镜镜检,图像采集分析肺组织病理变化。对各组小鼠肺组织进行评分,其中,无炎性渗出、水肿、明显出血红染计0分,肺间质有轻度炎性渗出,肺细支气管及周围无明显炎症计1分,肺间质轻度渗出炎症、有少量出血红染、肺细支气管周围轻度炎性渗出计2分,肺间质出血红染,伴肺泡塌陷、组织水肿、炎性渗出计3分。
2.4 小鼠肺组织中病毒载量检测(qPCR法)提取小鼠肺组织mRNA。向1.5 mL微型离心管中加入1 mL TRIzol,剪切肺组织至均能通过1 mL枪为止,混匀吹打,冰上裂解细胞5 min。随后加入200 μL三氯甲烷,剧烈震荡30 s,静置15 min后4 ℃,12 000 r/min离心5 min(离心半径8.6 cm)。收集上层水相约400 μL。加入等体积(400 μL)异丙醇,混合均匀,静置5 min后4 ℃,12 000 r/min离心10 min(离心半径8.6 cm),弃上清。加入75%乙醇(500 μL),重悬沉淀,涡旋,洗涤,4 ℃,12 000 r/min离心5 min(离心半径8.6 cm)。离心后弃上清,重复上述步骤。随后弃上清,吸净残留乙醇,冰上静置,放于通风处晾干,约2 h。用20 μL无酶水溶解沉淀,振荡混匀。运用NanoPhotometer N60 Touch测定mRNA浓度及A260/A280,A260/A230,A260,然后进行cDNA模板合成。最后对所有的测试样和校准样本,用内参基因的CT值归一目标基因的CT值:ΔCT(test)=CT(target,test)-CT(ref,test);ΔCT(calibrator)=CT(target,calibrator)-CT(ref,calibrator)。用校准样本的ΔCT值归一试验样本的ΔCT值:ΔΔCT=ΔCT(test)-ΔCT(calibrator)。计算表达水平比率:2-ΔΔCT=表达量的比值。PR8-HA引物序列:正向引物5′-CAAGCTGGGAGGATGAACTATT-3′,反向引物5′-TACTCAGTGCGAAAGCATACC-3′。
2.5 流式细胞术制备小鼠脾脏单细胞悬液,利用抗CD16/CD32阻断受体后,染色细胞标志物,固定细胞。将这些细胞与特异性表面结合抗体4 ℃孵育30 min。使用BD FACScalibur和Flow Jo软件对样本进行分析。根据正向散射和侧向散射对细胞进行门控,根据表型确定细胞类型。CD4+T细胞:CD3、CD4;CD8+T细胞:CD3、CD8;巨噬细胞:CD11b、F4/80。
2.6 Western blot检测取小鼠肺部组织2 mg,加入0.5 mL RIPA缓冲液和5 μL PMSF抑制蛋白降解液,将组织裂解后提取各组总蛋白。采用BCA试剂检测样本的总浓度,使各组的总蛋白浓度调为一致,将其于99 ℃进行变性保存至-20 ℃。SDS-PAGE电泳分离总蛋白后,将其转膜至PVDF膜。然后用5%BSA封闭1 h,TBST洗涤4次,每次4 min后,将其放入对应的一抗稀释液(P65,p-P65和GAPDH)中,4 ℃孵育过夜。再用TBST洗涤4次,每次4 min。放入二抗和二抗稀释液(1:15 000)混悬液中,室温孵育1 h。TBST洗涤4次,每次4 min,将显影液滴在膜上,放入化学发光成像仪(Invitorgen,USA)进行蛋白显影。通过Image J软件进行分析结果,相对蛋白表达以GAPDH标准化。
2.7 统计学方法采用SPSS 20.0统计软件进行统计分析,结果以均数±标准差(x±s)表示,服从正态分布且具有方差齐性的两组数据采用t检验,方差不齐则采用Dunnett T3检验进而比较各组间差异,P<0.05为差异具有统计学意义。
3 结果 3.1 流感病毒肺炎小鼠在低温高湿环境下的行为学评价造模第8天,病毒感染组每只小鼠的行为和精神状态评分低于正常,与相关文献报道一致[8],且毛发油腻、便溏,皮肤毛发和大便状态评分高于正常,XFBD给药后一定程度上缓解模型组小鼠的指标变化。见表 1。
|
采用体质量(20±1) g,4周龄的ICR鼠,构建流感病毒肺炎小鼠模型。在模拟低温高湿环境刺激的同时,并使用流感病毒A/PR/8/34进行滴鼻,诱导小鼠肺部炎症。如表 2所示,在此模型下,XFBD给药显著降低了小鼠肺部病毒载量(P<0.05),但对于病毒感染组小鼠体质量的降低无明显作用,对于小鼠脏器指数也未见明显改善。
|
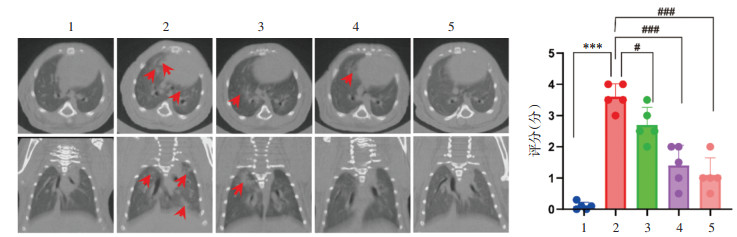
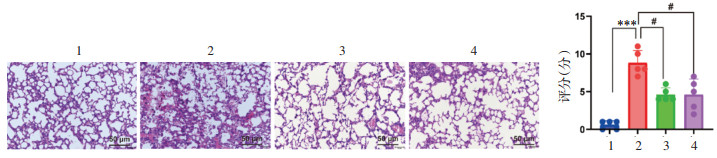
由肺部Micro CT及肺组织HE结果可得,XFBD可明显改善小鼠肺部阴影部分面积,减轻肺水肿,降低肺部炎性浸润并改善肺泡完整性(图 2和图 3)。
|
| 注:1,正常组;2,病毒感染组;3,病毒感染+XFBD 4 g/kg组;4,病毒感染+XFBD 8 g/kg组;5,奥司他韦组。与正常组比较,***P<0.001;与病毒感染组比较,#P<0.05,###P<0.001。 图 2 各组小鼠的肺部影像学改变(x±s,n=5) Fig. 2 Imaging changes of the mice lung in each group(x±s, n=5) |
|
| 注:1,正常组;2,病毒感染组;3,病毒感染+XFBD 4 g/kg组;4,病毒感染+XFBD 8 g/kg组。与正常组比较,***P<0.001;与病毒感染组比较,#P<0.05 图 3 各组小鼠的肺部病理学改变(HE染色,×200) Fig. 3 Pathological changes of the mice lung in each group(HE staining, ×200) |
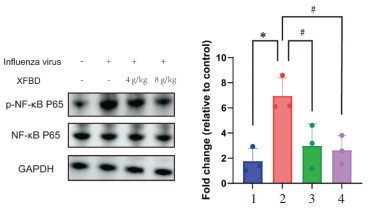
与正常组比较,病毒感染组p-NF-κB P65升高(P<0.05);与病毒感染组比较,XFBD给药后p-NF-κB P65降低(P<0.05)。见图 4。
|
| 注:1,正常组;2,病毒感染组;3,病毒感染+XFBD 4 g/kg组;4,病毒感染+XFBD 8 g/kg组。与正常组比较,*P<0.05;与模型组比较,#P<0.05。 图 4 各组小鼠肺组织中NF-κB蛋白表达(x±s,n=3) Fig. 4 NF-κB protein expression in the lung tissues of the mice lung in each group(x±s, n=3) |
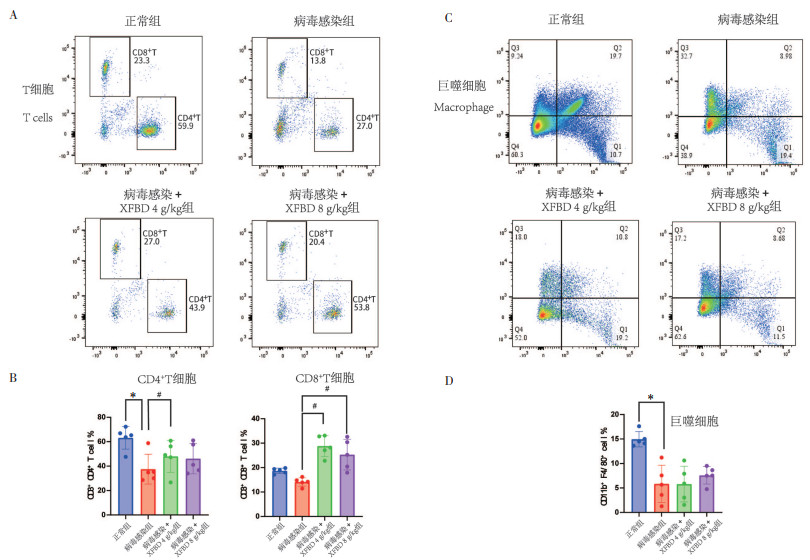
对模型小鼠脾脏中的CD4+、CD8+T和巨噬细胞的百分比进行检测,结果发现,与病毒感染组相比,XFBD可显著提高CD4+和CD8+T细胞的数量(图 5A-B),对巨噬细胞无显著影响(图 5C-D)。
|
| 注:A,各组小鼠CD4+和CD8+T细胞百分比;B,CD4+和CD8+T细胞百分比的显著性分析;C,各组小鼠巨噬细胞百分比;D,巨噬细胞百分比的显著性分析。与正常组比较,*P<0.05;与病毒感染组相比,#P<0.05。 图 5 流式细胞术检测小鼠脾脏各组免疫细胞变化(x±s,n=5) Fig. 5 Immune cell changes in each group of the mice spleen determined by flow cytometry(x±s, n=5) |
流感病毒感染可诱发机体快速产生细胞因子,激活动员机体众多防御机制,将免疫细胞募集到肺部,造成肺组织免疫病理性损伤,其传播途径、临床表现等与新型冠状病毒感染极为相似,亦曾经造成数次大流行[9]。中医药在流感病毒的治疗中有着丰富经验和积极的疗效,与西医不同,其并不针对病毒本身,而是强调根据疾病证候特点辨证论治,更多关注机体整体状态的调节。XFBD在抗疫实践中已被证实可以改善肺部炎症反应,促进淋巴细胞数量恢复[10]。
本研究发现,小鼠在低温高湿环境下感染流感病毒后,出现肺指数显著升高、肺部病毒载量增多、毛发油腻和大便黏稠等。此外,病毒感染组小鼠出现肺组织水肿、肺泡结构破坏、局部肺泡实质化、支气管管腔狭窄和炎性细胞浸润等组织病理学改变,以及肺部阴影等影像学改变,与临床中流感所致的病毒性肺炎的病理学和影像学表现一致,说明该模型在流感病毒肺炎模型药效评价中具有一定的可靠性。给予XFBD后,小鼠多项指标大多有不同程度的缓解。
研究表明,流感病毒感染呼吸道上皮细胞后,会诱导促炎因子TNF-α分泌,进而诱导白细胞迁移,导致大量炎症因子的释放,从而加重炎症反应[11]。核因子κB(NF-κB)在细胞应对炎症反应、损伤、应激等过程中发挥重要作用,可促进白介素等炎性因子的分泌,导致急性炎症反应,其异常激活是流感病毒复制中的重要调节枢纽[12]。据相关研究表明,XFBD主要调控NF-κB信号通路来抑制炎症达到治疗病毒性肺炎的作用[13]。因此,本研究进一步检测XFBD给药后炎症关键蛋白NF-κB的表达。结果表明,病毒感染组小鼠中p-P65表达明显升高,而XFBD处理后p-P65表达明显降低,说明XFBD能够通过抑制NF-κB蛋白来发挥其抑制炎症的作用。
与体液免疫对病毒特异性免疫反应的“专一性”相较,细胞免疫抵抗不同抗原变异的流感病毒侵染机体的能力更强,这也被称为T细胞免疫反应的交叉性[14]。CD4+T细胞可促进CD8+T细胞的激活和增殖,并且和CD8+T细胞相同,可以在一定程度上杀伤病毒感染的细胞,在抗流感病毒感染免疫过程中是相辅相成的[15]。此外,临床研究还发现,XFBD不仅可以加速一系列典型症状的消失,还可以促使白细胞和淋巴细胞的数量恢复正常[16],因此本研究对XFBD给药后CD4+T和CD8+T细胞进行了检测。结果表明,小鼠在感染流感病毒后,病毒感染组小鼠CD4+和CD8+T细胞百分比显著降低,可能与淋巴细胞被招募至感染部位并发生活化后凋亡有关,其与临床上病毒性肺炎造成CD4+和CD8+T细胞降低的现象一致[17]。XFBD给药后可显著提高低温高湿环境下湿流感病毒肺炎模型所致的CD8+T和CD4+T细胞的降低。此外,本研究还检测了巨噬细胞的变化,但XFBD给药后并没有缓解病毒感染组脾脏中巨噬细胞的下降,提示XFBD可能主要通过调节小鼠T细胞免疫而不是巨噬细胞来发挥其治疗作用。
综上所述,本研究成功建立了符合中医药特点的流感病毒肺炎动物模型,为临床筛选药物提供平台。此外,本研究发现XFBD能在低温高湿环境下的流感病毒肺炎模型中展现出良好治疗流感的抗病毒药效,揭示XFBD对T细胞数量和炎症关键蛋白NF-κB的调节作用,但未对其他靶点进行验证,未来应该实验来验证相关的活性成分、核心靶点和关键信号通路,进一步阐释XFBD的作用机制,明确XFBD的药效物质基础,研究药物在体内的分布及代谢,并基于不同疾病模型的药效药代特征,调整组分中药的配伍。
| [1] |
赵璐, 姜涛, 冯烨. Ⅲ型干扰素抗流感病毒作用的研究进展[J]. 病毒学报, 2023, 39(5): 1455-1462. |
| [2] |
BEN C T, LUYT C E, MARTIN-LOECHES I. Influenza infections and emergent viral infections in intensive care unit[J]. Seminars in Respiratory and Critical Care Medicine, 2019, 40(4): 488-497. DOI:10.1055/s-0039-1693497 |
| [3] |
翟志光, 侯石. 甲型H1N1流感的中医学病因与发病研究[J]. 中国中医基础医学杂志, 2012, 18(9): 945-947. |
| [4] |
赵荣华, 孙静, 时宇静, 等. 宣肺化痰法对冠状病毒肺炎寒湿疫毒袭肺小鼠病证结合模型的干预作用[J]. 中国实验方剂学杂志, 2020, 26(11): 21-27. |
| [5] |
ZHANG M, LIU L T, ZHAO Y, et al. Discovery and evaluation of active compounds from Xuanfei Baidu formula against COVID-19 via SARS-CoV-2 Mpro[J]. Chinese Medicine, 2023, 18(1): 94. DOI:10.1186/s13020-023-00790-0 |
| [6] |
YAN H M, LU J, WANG J B, et al. Prevention of cyclophosphamide-induced immunosuppression in mice with traditional Chinese medicine Xuanfei Baidu Decoction[J]. Frontiers in Pharmacology, 2021, 12: 730567. DOI:10.3389/fphar.2021.730567 |
| [7] |
MENG T T, DING J Y, SHEN S J, et al. Xuanfei Baidu Decoction in the treatment of coronavirus disease 2019(COVID-19): Efficacy and potential mechanisms[J]. Heliyon, 2023, 9(9): e19163. DOI:10.1016/j.heliyon.2023.e19163 |
| [8] |
周游, 张杰. 内湿证动物模型研究进展[J]. 辽宁中医药大学学报, 2018, 20(10): 141-144. |
| [9] |
王毅, 李翔, 张俊华, 等. 基于网络药理学的宣肺败毒汤治疗新型冠状病毒肺炎机制研究[J]. 中国中药杂志, 2020, 45(10): 2249-2256. |
| [10] |
JIA K X, LI Y J, LIU T G, et al. New insights for infection mechanism and potential targets of COVID-19:Three Chinese patent medicines and three Chinese medicine formulas as promising therapeutic approaches[J]. Chinese Herbal Medicines, 2023, 15(2): 157-168. DOI:10.1016/j.chmed.2022.06.014 |
| [11] |
薛岳进, 屈彬, 邵瑞, 等. 基于网络药理学分析宣肺败毒方治疗SARS、MERS和COVID-19的作用机制[J]. 现代药物与临床, 2021, 36(12): 2473-2487. |
| [12] |
孙树雅, 沈泓渺, 佟晴晴, 等. 栀黄解毒饮联合磷酸奥司他韦治疗儿童甲型流感的疗效及对炎症因子的影响[J]. 四川中医, 2020, 38(7): 90-93. |
| [13] |
张立兴. 基于肠道菌群探究宣肺败毒颗粒对急性肺损伤的保护机制[D]. 天津: 天津大学, 2021.
|
| [14] |
杨宣叶, 胡欣妍, 高明阳, 等. CD4+和CD8+T细胞在抗流感病毒免疫中的重要作用[J]. 病毒学报, 2024, 40(1): 206-214. |
| [15] |
TSANG T K, LAM K T, LIU Y P, et al. Investigation of CD4 and CD8 T cell-mediated protection against influenza A virus in a cohort study[J]. BMC Medicine, 2022, 20(1): 230. DOI:10.1186/s12916-022-02429-7 |
| [16] |
PAN X Q, DONG L, YANG L, et al. Potential drugs for the treatment of the novel coronavirus pneumonia(COVID-19) in China[J]. Virus Research, 2020, 286: 198057. DOI:10.1016/j.virusres.2020.198057 |
| [17] |
ARTERO-CASTRO A, CALLEJAS F B, CASTELLVI J, et al. Cold-inducible RNA-binding protein bypasses replicative senescence in primary cells through extracellular signal-regulated kinase 1 and 2 activation[J]. Molecular and Cellular Biology, 2009, 29(7): 1855-1868. DOI:10.1128/MCB.01386-08 |
2. School of Integrative Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
4. China Academy of Chinese Medical Sciences, Beijing 100091, China;
5. Tsinghua University, Beijing 100084, China
 2024, Vol. 41
2024, Vol. 41