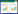文章信息
- 李艳, 翁思颖.
- LI Yan, WENG Siying.
- 益气化浊汤经PI3K/Akt通路减轻氧化应激治疗2型糖尿病大鼠胰岛素抵抗
- Yiqi Huazhuo Decoction alleviates oxidative stress through PI3K/Akt pathway to treat insulin resistance in T2DM rats
- 天津中医药, 2024, 41(10): 1335-1341
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(10): 1335-1341
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.10.17
-
文章历史
- 收稿日期: 2024-05-14
2. 浙江中医药大学附属宁波市中医院, 宁波 315010
糖尿病是一类发病率极高的慢性病。国际糖尿病联盟发布的调查报告显示,截至2021年全球有近5.37亿的成人糖尿病患者(10.5%)[1]。2型糖尿病(Type2 Diabetes mellitus)在糖尿病中占比超过90%[2]。高糖高脂的内环境可导致机体处于慢性低度炎症、产生大量活性氧(ROS),导致胰岛素靶器官受损与胰岛素信号通路转导障碍,引起胰岛素抵抗(IR)与糖尿病[3]。其相关信号通路的激活可诱导IR,其中胰岛素信号转导通路磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)也是导致氧化应激反应的重要通路之一[4]。故如何减轻氧化应激、缓解IR已成为近年T2DM治疗的重要研究领域。
中医学认为饮食过甚伤及脾气、脾失运化而致谷气留于脉中,终滋生痰浊是伴有胰岛素抵抗的2型糖尿病发病重要原因。本团队在既往研究中对气虚痰浊证的2型糖尿病患者运用益气化浊法干预,发现患者血糖降低、炎性因子及氧化应激因子降低、IR缓解[5],在动物实验中笔者也观察到了相似的研究结果[6-7]。故本研究拟基于PI3K/Akt通路探讨益气化浊汤(YD)是否经此通路减轻大鼠肝脏氧化应激、缓解IR。
1 材料 1.1 实验动物SPF级8周龄雄性ZDF(Zucker Diabetic Fatty)大鼠32只,体质量200~220 g,SPF级8周龄雄性ZL(Zucker Lean)大鼠8只,体质量200~220 g,购买于北京维通利华实验动物科技有限公司,许可证号:SCXK(京)2021-0006。动物饲养于浙江中医药大学动物研究中心SPF级饲养室内。动物研究获得浙江中医药大学机构动物保护委员会批准,批准号:No.82004325。
1.2 仪器与试剂一抗兔单克隆抗p-PI3K-p85αTyr458抗体(ThermoFisher,PA5-99518),兔单克隆抗Akt抗体(CST,4685S),抗p-AktS473抗体(CST,4060S),山羊抗兔免疫球蛋白G(IgG)抗体(Thermo Fisher,A-11006),PVDF转印膜购(Millipore,IPVH00010);BCA试剂盒(ASPEN,AS1012),RIPA裂解液(ASPEN,AS1004);苏木精-伊红(HE)染色套装(Bingcure CORP,RE1100),活性氧(ROS)染色套装(Bingcure CORP,RE1112),胰岛素酶联免疫吸附测定试剂盒(CUSABIO,CSB-E05070r)。主要仪器:ACCU-CHEK Advant age血糖仪(罗氏);紫外分光光度计(Beckman,DU800),全自动生化检测仪(日立,U2700),高速冷冻离心机(Sigma),Mini-PROTEAN电泳系统以及Mini Trans-Blot转印系统(Bio-Rad),VersaDoc 4000 MP成像系统(Bio-Rad)。生物组织包埋一体机(金华科迪,KD-BM&BL),石蜡切片机(金华科迪,KD-2258),生物组织摊片机(金华科迪,KD-P),烘片箱(上海精宏,PHG-9070A),光学显微镜(Olympus,CKX41),成像系统(MshOt,MD50)。
1.3 药品制备YD由黄芪30 g,白术30 g,葛根30 g和丹参20 g组成。所有中药材均由浙江中医药大学中药饮片有限公司提供。制法:全方药材粉碎后加8倍水煎煮,每次1 h,煎煮2次后合并滤液,用柠檬酸钠和碳酸钠将滤液调整为pH 7.0。通过比色法测定所得YD的粗药含量为3 g/mL,分装后4 ℃保存备用。盐酸二甲双胍标准品:100 mM/mL(上海麦克林公司,批号:M794099),临用前无菌条件下用蒸馏水溶解至所需浓度。
2 实验方法 2.1 动物模型建立与分组所有大鼠在开始实验前均驯化1周。ZDF大鼠喂高糖高脂饲料4周,对照组ZL大鼠喂正常饲料4周。T2DM大鼠建模成功标准为空腹血糖≥11.1 mmol/L。将造模成功后的ZDF大鼠随机分为4组,每组8只。参照团队既往的研究[8],设立高剂量YD组(YD-hi,30 g/kg·d)和低剂量YD组[(YD-lo,15 g/(kg·d)],阳性对照组(Met组)给予盐酸二甲双胍[0.15 g/(kg·d)],模型组(model组)小鼠给予等量蒸馏水;每天1次,连续灌胃8周。对照组(control组)ZL大鼠以正常饲料喂养8周。实验结束后,各组大鼠禁食12 h,采用戊巴比妥进行麻醉后,腹主动脉大量取血处死,并打开腹腔取肝脏组织,分别在-80 ℃条件下冻存用于蛋白免疫印迹法(Western blot)的检测,或4 ℃冷藏及10%中性甲醛固定以备后续实验使用。
2.2 检测指标与方法 2.2.1 大鼠空腹血糖测定及糖耐量测试造模成功后,每只大鼠每2周取一次尾静脉血样,用葡萄糖试纸测定空腹血糖水平。治疗结束后,进行葡萄糖耐量测试(OGTT)。大鼠禁食12 h后取尾静脉采血,用血糖仪以葡萄糖氧化酶法测定血糖水平。各组大鼠空腹采血后给予相应药物或蒸馏水,然后按照2 g/kg剂量腹腔注射20%葡萄糖注射液,分别于葡萄糖给药后30、60、120、180 min测定血糖值。观察各组葡萄糖给药后各时间点血糖曲线下面积(AUC)。公式为AUC=0 min+30 min×0.25+(30 min+60 min)×0.25+(60 min+90 min)×0.5+(90 min+120 min)×0.5。
2.2.2 大鼠胰岛素抵抗指数测定大鼠禁食12 h,腹主动脉取血,按胰岛素酶联免疫吸附测定试剂盒说明书方法,测定大鼠空腹血清胰岛素。IR水平用HOMA-IR指数表示,公式为:HOMA-IR index=fasting glucose(mmol/L)×fasting insulin(μU/mL)/22.5。
2.2.3 大鼠血脂水平测定大鼠禁食12 h,腹主动脉取血,使用自动生化分析仪检测血清总胆固醇(CHOL)和三酰甘油(TG)水平,使用制造商的试剂和说明书。
2.2.4 大鼠肝组织超氧化物歧化酶(SOD)、丙二醛(MDA)的生化检测取肝脏样本4 ℃下机械匀浆,制备成10%的匀浆液后进行离心(10 min,3 000 rpm,离心半径20 cm),取上清液,以生化检测仪进行SOD、MDA水平测定。将准备好的样本稀释40倍后取样本10 μL。将每毫克组织蛋白在1 mL反应液中,SOD抑制率达50%时所对应的SOD量定义为一个SOD活力单位(U)。SOD活力(U/mg prot)=(对照OD值-测定OD值)/对照OD值/50%×反应液总体积/取样量/待测样本蛋白浓度。MDA含量(nmol/mg prot)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(10 nmol/mL)/待测样本蛋白浓度(mg prot/mL)。
2.2.5 大鼠肝组织石蜡切片HE染色大鼠肝脏组织在10%甲醛中固定5 d后,用乙醇脱水,二甲苯处理30 min进行透明,再放置于石蜡中5 h,包埋,将石蜡切片(厚度4 μm)。石蜡切片用二甲苯脱蜡,放入100%、95%、80%和70%的乙醇中各10 min,再放入纯水10 min。将组织滴加苏木精染液,150 μL盐酸酒精分色,磷酸盐缓冲溶液(PBS)返蓝,0.5%伊红染色。在乙醇脱水和二甲苯透明后,用中性胶密封切片后烘干切片。光镜下观察肝脏组织病理改变。细胞核呈蓝色,细胞质呈粉红色,红细胞呈橙红色。采用Schmidt病理量表对胰腺进行病理评分[9]。评分依据组织水肿程度、坏死面积、出血程度和炎症细胞浸润程度。
2.2.6 大鼠肝组织冰冻切片的活性氧ROS染色将大鼠肝脏组织冰冻切片在室温下复温,在组织上加入自发荧光淬灭剂5 min,流水冲洗,滴加ROS染液,避光恒温箱37 ℃孵育30 min;将玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5 min,切片稍甩干后,在圈内滴加DAPI染液,避光室温孵育10 min,完成DAPI复染细胞核;玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5 min,切片稍甩干后用抗荧光淬灭,以封片剂封片;最后将切片于荧光显微镜下观察并采集图像。ROS表达呈绿色荧光,细胞核呈蓝色荧光。
2.2.7 Western blot肝脏组织在RIPA裂解中裂解,超声波细胞破碎仪(功率20%,工作2 s,间歇3 s,4 ℃,5 min),4 ℃离心(15 min,12 000 rpm,离心半径=20 cm)。使用BCA试剂盒测定蛋白浓度。每组蛋白样品40 μg,用6×SDS上样液煮沸10 min后,通过SDS-PAGE分离蛋白并将其转移到PVDF膜上。用5%脱脂奶粉在室温下封闭膜1 h。一抗兔单克隆抗PI3K-p85(1:1000)、抗p-PI3K-p85(1:1 000)、抗Akt(1:1 000)、抗p-Akt(1:1 000)抗体,4 ℃下孵育过夜。二抗山羊抗兔(1:10 000)在25 ℃放置1 h。在VersaDoc 4000 MP系统中使用增强化学发光对条带进行可视化。使用Image-Pro Plus 6.0软件分析光密度值,以确定各蛋白的相对表达水平。
2.3 统计学方法数据采用SPSS 23.0进行统计分析。所有图表均使用Graphpad Pism 9.5绘制。所有正态分布连续性变量使用均数±标准差(x±s)表示,采用t检验进行分析;组间连续性变量比较采用单因素方差分析,方差齐采取LSD检验,方差不齐采用Dunnett’t3检验,以P<0.05为差异有统计学意义。
3 结果 3.1 YD改善T2DM-IR大鼠血糖、胰岛素抵抗、血脂水平治疗8周后,model组大鼠的空腹血糖较control组明显升高(P<0.05),YD-lo组、YD-hi组和二甲双胍组的空腹血糖较model组均明显下降(P<0.05),其中Met组下降最多,与YD-lo组、YD-hi组相比,差异均有统计学意义(P<0.05)。YD-hi组与二甲双胍组水平相对接近,但仍高于YD-hi组。见表 1。
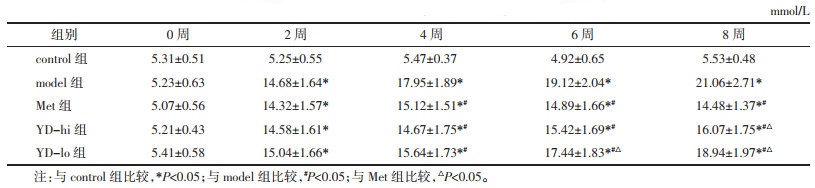
治疗8周后观察到,与model组相比,YD-lo组、YD-hi组和Met组血糖水平(OGTT AUC值)均不同程度明显下降(P<0.05),其中YD-hi组与Met组差异无统计学意义(P>0.05),YD-lo组较Met组升高(P<0.05),见图 1A。治疗后的胰岛素抵抗水平(HOMA-IR指数),YD-lo组、YD-hi组和Met组均出现不同程度的下降(P<0.05),其中YD-hi组与Met组无明显差异(P>0.05),YD-lo组较Met组升高(P<0.05),见图 1B。治疗后,YD-lo组、YD-hi组、Met组的血清TG和CHOL水平较model组均出现不同程度下降(P<0.05),其中YD-hi组、YD-lo组、Met组TG水平依次下降,组间相比差异有统计学意义(P<0.05),但这3组间的CHOL水平差异均无统计学意义(P>0.05),见图 1C。
|
| 注:两组间比较,*P<0.05。 图 1 YD对大鼠血糖、胰岛素抵抗、血脂水平的影响(x±s) Fig. 1 Effects of YD on blood glucose, IR and blood lipid levels in rats(x±s) |
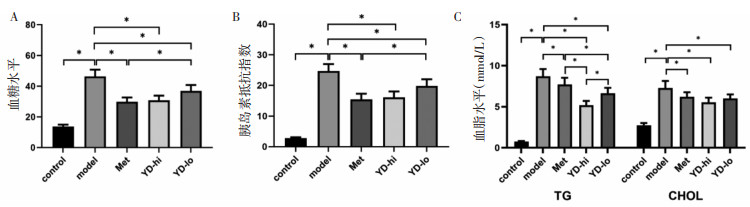
control组大鼠肝组织病理学观察显示,肝组织结构正常,细胞形态完整,炎性细胞数目正常,细胞质中未观察到明显的脂质沉积。model组肝细胞内可见大小不一的脂肪空泡,细胞明显肿胀,肝窦消失,肝板结构不清,汇管区炎性细胞浸润。YD-lo组与二甲双胍组均可见部分脂肪沉积,部分细胞轻度肿胀与少量炎细胞浸润。YD-hi组大鼠肝细胞内可见少量脂肪空泡,少量细胞轻度肿胀,肝板和肝窦尚可分清,炎细胞浸润不明显,上述改变相较model组、YD-lo组、Met组均明显减轻。YD-lo组、YD-hi组、Met组的大鼠肝组织病理评分均不同程度低于模型组(P<0.01),且YD-hi组低于Met组,为模型组的46.6%(P<0.01),YD-lo组与Met组相比差异不明显(P>0.05)。见图 2。
|
| 注:两组间比较,**P<0.01。 图 2 HE染色观察各组大鼠肝组织形态学变化及病理评分(×200,x±s) Fig. 2 HE staining on hepatic tissue(×200, x±s) |
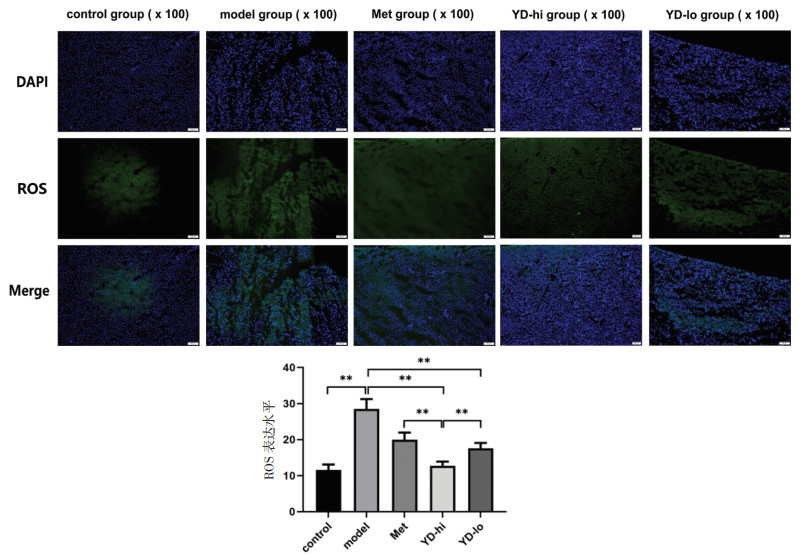
结果显示,相较control组,model组ROS表达明显升高(P<0.01);相较model组,YD-hi组、YD-lo组、Met组中均出现不同程度的ROS表达下降(P<0.01),其中YD-hi组ROS表达水平最低,为model组的45.2%(P<0.01)。见图 3。
|
| 注:两组间比较,**P<0.01。 图 3 免疫荧光法检测大鼠肝组织ROS表达水平(×100,x±s) Fig. 3 Immunofluorescence analysis of ROS expression in the hepatic tissue of rats(×100, x±s) |
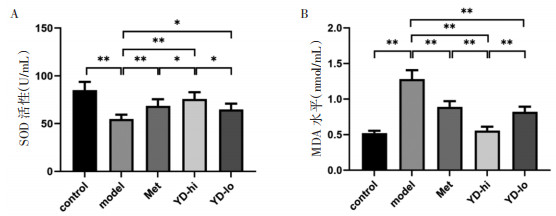
结果显示,model组SOD水平较control组明显下降(P<0.01);与model组比较,YD-hi组、YD-lo组、Met组的肝组织中均出现不同程度的SOD水平升高(P<0.01或P<0.05),其中YD-hi组SOD水平最高,为model组的138.3%(P<0.01),见图 4A。control组比较,model组MDA水平明显升高(P<0.01),YD-hi组、YD-lo组、Met组肝组织中的MDA水平较model组均出现不同程度的下降(P<0.01),其中YD-hi组MDA表达水平最低,为model组的43.4%(P<0.01),见图 4B。
|
| 注:两组间比较,*P<0.05,**P<0.01。 图 4 YD对大鼠肝组织SOD、MDA水平的影响(x±s) Fig. 4 Effect of YD on the level of SOD and MDA in the hepatic tissue of rats(x±s) |
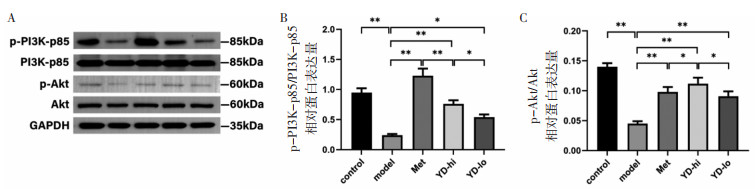
结果显示,p-PI3K-p85/PI3K-p85蛋白相对表达量比值,model组明显低于control组(P<0.01),YD-lo组、YD-hi组与Met组的比值均高于model组,以Met组最高,YD-hi组、YD-lo组分别递减,其中YD-hi组为model组的316.6%,组间差异均有统计学意义(P<0.01或P<0.05)。另外,p-Akt/Akt蛋白相对表达量比值,model组明显低于control组(P<0.01),YD-lo、YD-hi与Met组比值均高于model组,按Met组、YD-hi组、YD-lo组分别递减,其中YD-hi组为model组的248.8%,组间差异均有统计学意义(P<0.01或P<0.05)。见图 5。
|
| 注:两组间比较,*P<0.05,**P<0.01。 图 5 YD对大鼠肝组织PI3K、Akt蛋白活性的影响(x±s) Fig. 5 Effect of YD on the activities of PI3K and Akt in the hepatic tissue of rats(x±s) |
中医糖尿病属“消渴”范畴。《素问·经脉别论》曰“食气入胃,浊气归心,淫精于脉……饮入于胃,游溢精气,上输于脾,脾气散精”,表明饮食过甚而伤脾,导致体液中糖脂等精微之物运化失司而痰浊滋生,故气虚痰浊是本病重要病机。团队学术带头人王晖教授基于糖尿病“原始期、前驱期、消渴期、逆归期”的“四期辨证”理论,认为其治疗需以“补元调气”为要,各期分型辨证,从气论治。YD是由王教授针对消渴期的气虚痰浊证2型糖尿病患者所创经验方化裁,由生黄芪、苍术、葛根、丹参组成,方中生黄芪益气补中,苍术健脾化湿,葛根升举脾阳,丹参活血祛瘀,合用和调动脾胃运化功能,升清化浊,祛湿通络。
本研究采用YD治疗自发性肥胖的2型糖尿病模型ZDF大鼠,观察到干预8周后,大鼠血糖血脂下降、糖耐量受损改善、IR减轻;对大鼠肝组织的病理学观察显示YD可减少炎性细胞产生、降低病理评分、减轻组织损伤;免疫荧光法测定肝组织ROS,发现YD可减少ROS产生;生化法测肝组织SOD及MDA,发现YD可增加SOD水平、减少MDA水平,提示抗氧自由基能力的提高可能有助于胰岛素靶器官的损伤减轻与胰岛素敏感性增加。另外,采用Western blot法对PI3K/Akt通路蛋白活性测定,发现YD干预后PI3K-p85Tyr458磷酸化与AktS473磷酸化程度均明显升高,提示YD可增加上述蛋白的活性。由于PI3K/Akt通路的激活程度主要以p-PI3K及p-Akt蛋白含量比例体现,故本研究以p-PI3K-p85/PI3K-p85与p-Akt/Akt表达相关蛋白活性。
PI3K/Akt途径是促细胞代谢、调节氧化应激的重要信号通路[10]。磷酸化的PI3K可经磷脂酰肌醇环产生第二信使3、4、5-三磷酸磷脂酰肌醇,与细胞内丝-苏氨酸激酶Akt结合,被激活后的Akt可通过对下游靶蛋白如核因子E2相关因子2的作用,通过调控抗氧化酶、Ⅱ相解毒酶等多种保护性蛋白的表达,抑制氧化应激反应,减少ROS带来的组织损伤[11]。相似的研究[12]以益气养阴法干预T2DM-IR大鼠,观察到肝组织氧化应激损伤减轻、糖原合成增加、IR缓解,并推测其机制可能与肝脏PI3K/Foxo1通路激活有关。
值得注意的是,与二甲双胍相比,YD降低血糖的能力相对较弱,但高浓度YD降低TG的能力优于二甲双胍,降低CHOL、改善IR的能力与二甲双胍相近,且高浓度YD在促进抗氧化反应、减轻氧化应激因子生成、减轻肝组织损伤方面也优于二甲双胍。上述结果提示YD对T2DM-IR模型肥胖大鼠的治疗是结合了糖代谢与脂代谢的共同调节结果,YD通过降糖、降脂尤其是小分子脂质的水平,促进肝内抗氧化酶生成、抑制氧化应激水平,减轻高糖高脂内环境对胰岛素靶器官肝脏带来的氧化应激损伤。YD可上调肝内PI3K-p85Tyr458及其下游AktS473磷酸化水平,通过增加PI3K/Akt通路活性,缓解下游氧化应激反应、减轻组织损伤、增加肝胰岛素敏感性。
综上所述,YD可通过调节机体的糖脂代谢,减轻氧化应激给胰岛素靶器官肝脏带来的损伤,改善肝IR。YD调节肝IR的机制可能是通过激活PI3K/Akt通路,调节下游蛋白以及抗氧化酶的表达来实现。
| [1] |
董慧. 糖尿病生殖功能障碍和中医干预对策[J]. 中国中西医结合杂志, 2023, 43(7): 781-784. |
| [2] |
ELSAYED N A, ALEPPO G, ARODA V, et al. Improving care and promoting health in populations: standards of care in diabetes-2023[J]. Diabetes Care, 2023, 46(Supple1): S10-S18. |
| [3] |
DARENSKAYA M A, KOLESNIKOVA L I, KOLESNIKOV S I. Oxidative stress: Pathogenetic role in diabetes mellitus and its complications and therapeutic approaches to correction[J]. Bulletin of Experimental Biology and Medicine, 2021, 171(2): 179-189. DOI:10.1007/s10517-021-05191-7 |
| [4] |
OCHIENG J M, CRIST J D. Social determinants of health and health care delivery: African American women's T2DM self-management[J]. Clinical Nursing Research, 2021, 30(3): 263-272. DOI:10.1177/1054773820916981 |
| [5] |
李栽栽, 翁思颖, 柴可夫, 等. 益气养阴活血方对非酒精性脂肪胰合并2型糖尿病患者血清脂肪因子及炎性因子的影响[J]. 浙江中医杂志, 2018, 53(2): 101-102. |
| [6] |
龚文波, 陈霞波, 翁思颖. 益气化浊法与养阴清热法对GK大鼠糖耐量及胰岛素抵抗的影响[J]. 中华中医药杂志, 2013, 28(12): 3660-3662. |
| [7] |
龚文波, 陈霞波, 周开, 等. 益气化浊法与养阴清热法对GK大鼠胰岛素分泌及血清GLP-1的影响[J]. 中华中医药学刊, 2013, 31(10): 2249-2251. |
| [8] |
WU D J, WENG S Y, XU S Y, et al. Yiqi Huazhuo Decoction increases insulin secretion in type 2 diabetic rats by regulating the pancreatic GPR40-IP3R-1 signaling pathway[J]. Frontiers in Pharmacology, 2023, 14: 1136778. DOI:10.3389/fphar.2023.1136778 |
| [9] |
SCHMIDT J, RATTNER D W, LEWANDROWSKI K, et al. A better model of acute pancreatitis for evaluating therapy[J]. Annals of Surgery, 1992, 215(1): 44-56. DOI:10.1097/00000658-199201000-00007 |
| [10] |
FOJTÍK P, BECKEROVÁ D, HOLOMKOVÁ K, et al. Both hypoxia-inducible factor 1 and MAPK signaling pathway attenuate PI3K/AKT via suppression of reactive oxygen species in human pluripotent stem cells[J]. Frontiers in Cell and Developmental Biology, 2020, 8: 607444. |
| [11] |
LENNICKE C, COCHEMÉ H M. Redox regulation of the insulin signalling pathway[J]. Redox Biology, 2021, 42: 101964. |
| [12] |
史丽伟, 孙敏, 陈玉鹏, 等. 新消渴方调控PI3K/AKT/FOXO1信号通路改善2型糖尿病大鼠肝脏胰岛素抵抗机制研究[J]. 环球中医药, 2023, 16(10): 1927-1934. |
2. Ningbo Hospital of Traditional Chinese Medicine, Zhejiang University of Traditional Chinese Medicine, Ningbo 315010, China
 2024, Vol. 41
2024, Vol. 41