文章信息
- 袁惠, 魏佳明, 施敏, 等.
- YUAN Hui, WEI Jiaming, SHI Min, et al.
- 基于“正邪理论”探讨心力衰竭心肌能量代谢及中药干预机制
- Exploring myocardial energy metabolism in heart failure and the mechanism of Chinese medicine intervention based on the "theory of antipathogenic qi and pathogenic factors"
- 天津中医药, 2024, 41(10): 1347-1353
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(10): 1347-1353
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.10.19
-
文章历史
- 收稿日期: 2024-05-15
2. 湖南中医药大学慢病中医智能诊断与治未病湖南省普通高等学校重点实验室, 长沙 410208;
3. 互联网+慢病中医诊治与养生智能化应用研究生联合培养基地, 长沙 410208
心力衰竭(HF)是多种心血管疾病发展的终末期表现,表现为心室充盈或射血功能受损等[1],其发病率和病死率居高不下[2]。近年来大量实验和临床研究表明,肥大和衰竭的心肌其特征在于能量代谢的改变与重塑。能量代谢改变反映出心肌能量需求增加和心肌三磷酸腺苷(ATP)产能受损。自2004年Bilsen等提出心肌能量代谢重构的概念后,优化心肌能量代谢便成为治疗HF的重要手段之一,能量代谢途径的药理学靶向也成为一种有吸引力的治疗方法。“正邪理论”是中医阐释疾病基本病机的重要理论,中医认为HF病变乃本虚标实之证,正虚为本,邪实为标,正邪相争贯穿HF发病始终。本文基于“正邪理论”,结合心肌能量代谢,从中西医两个维度进一步对HF的病理机制进行阐述,并系统总结中药改善心肌能量代谢防治HF的方法,以期为HF的能量代谢治疗提供新的思路和参考。
1 心肌能量代谢与HF 1.1 正常心肌能量代谢特点心脏对于能量的需求极高,但能量储备极少,心肌必须通过代谢脂肪酸、葡萄糖、乳酸、酮体、丙酮酸和氨基酸等多种燃料底物产生大量ATP以维持其收缩功能[3]。线粒体氧化磷酸化和糖酵解是心脏产生ATP的两个主要代谢来源。生理状态下,线粒体氧化磷酸化可提供约95%的心肌ATP供应[4],其中40%~60%源于脂肪酸的氧化,其余源自丙酮酸、酮体和氨基酸的氧化。糖酵解可厌氧生产ATP,该特点使葡萄糖成为心肌能量代谢中最有效的能量底物。根据负荷增加、缺氧、应激等不同的机体状态,心肌细胞可随时在不同的能量底物之间灵活切换,调节其利用比率及代谢途径,从而适应不同的病理生理条件,维持ATP产能[5]。
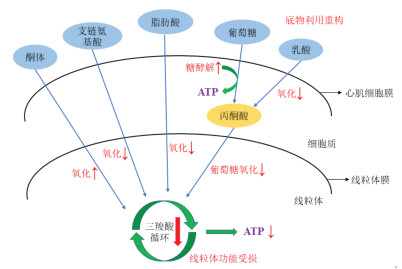
1.2 HF心肌能量代谢特点HF病变时心肌能量代谢会发生多个方面的改变,导致心脏产能效率降低。HF末期的ATP含量可比正常心脏低30%[4],造成严重的能量不足。这种能量受损主要是因为线粒体氧化能力下降造成的,包括线粒体功能受损和底物利用重构两方面。见图 1。
|
| 注:向上的箭头表示增加,向下的箭头表示减少。 图 1 HF心肌能量代谢特点 Fig. 1 Characteristics of myocardial energy metabolism in HF |
线粒体功能受损的核心是呼吸链受损与ATP合成障碍。HF时心肌细胞线粒体呼吸链复合物活性明显下降,导致线粒体呼吸效率低下,能量代谢减弱,ATP合成减少。在HF病程中,线粒体功能受损的原因有很多,包括:1)活性氧(ROS)产生增加和线粒体Ca2+稳态失调;2)线粒体生物发生及动力学障碍,线粒体自噬过度或不足,心肌细胞自噬性死亡的增加;3)线粒体蛋白转录调节的改变和翻译后蛋白修饰(如乙酰化)的增加。这些因素可以影响线粒体的生成、清除、质量控制、抗氧化能力以及相关代谢酶的活性等,甚至从基因和蛋白层面破坏线粒体的功能,影响其对底物的代谢,导致ATP产能降低[6]。有大量研究发现在HF患者中线粒体的形态、数量和功能都发生明显改变,造成心脏产能不足[7]。
1.2.2 底物利用重构随着HF进展,线粒体对不同产能底物的氧化利用有所改变。1)心肌脂肪酸的氧化率随HF加重而降低[8]。2)心肌对葡萄糖的摄取和糖酵解随脂肪酸氧化的减少而增加,但葡萄糖氧化呈减少趋势[9]。3)糖酵解产生的丙酮酸可转化为乳酸,被心脏吸收后可以通过乳酸脱氢酶催化再转化为丙酮酸,通过线粒体氧化生产ATP,也可造成心肌细胞内乳酸超载,触发Na+和Ca2+的流入,导致心肌收缩功能下降[10]。4)酮体氧化的增加与脂肪酸和葡萄糖氧化的减少相互调节,有研究表明,增强心肌酮体代谢对HF具有适应性,外源性酮疗法在动物模型和人类HF研究中具有潜在益处[11]。5)HF患者血浆支链氨基酸(BCAA)水平升高被认为是心血管疾病进展的早期预测因子,其原因可能是由于HF时BCAA氧化受损,造成了BCAA的积累。研究表明,增强BCAA氧化可以改善HF小鼠心脏功能[12]。
2 “正邪理论”内涵“正邪理论”源于《黄帝内经》,是中医用来阐释疾病病机的最基本理论。《素问·评热病论》“邪之所凑,其气必虚”指明正气不足是发病的根本,邪气来犯是发病的条件[13]。《素问·刺法论》中“正气存内,邪不可干”指明正气御邪的作用,《金匮要略·脏腑经络先后病脉证》中“五脏元真通畅,人即安和”表明五脏精气旺盛通达,气血阴阳和合,对人体保持平和健康的重要性。正气是维持机体组织器官正常生理功能、促进机体达到最佳状态的所有因素的总和,涉及机体内、外部环境一切微观、宏观、具象、抽象等因素的稳定与统一[14-15]。邪气与正气是一组相对立的概念。《素问·调经论》“夫邪之生也,或生于阴,或生于阳。其生于阳者,得之风雨寒暑;其生于阴者,得之饮食居处,阴阳喜怒。”指出邪的源头分阴阳而论之,生于阳则邪从外来,生于阴则邪自内生。因此邪气可泛指各种致病因素,包括存在于机体内、外部环境的能够损伤正气、致人发病的各种不正之气,可单独为病,亦可相合而具有更强的侵害性[16-17]。
正气与邪气具有相互斗争的关系,如《灵枢·根结》言“刺不知逆顺,真邪相搏”。正邪相争一方面表现为正气抵御、驱逐邪气,另一方面则表现为邪气对正气的耗伤,如《素问·玉机真藏论》言“邪气胜者,精气衰也”。正邪相争是疾病产生的重要特点,正胜邪却,则机体可以维持良好的生理功能,邪盛正衰,则机体便会感而发病。正邪相争的盛衰变化,直接决定了机体虚实病理状态,以及疾病的症状特点、发展、转归和预后。邪气太强或正气抗邪时间太久,都会造成正气渐虚,邪气难除,疾病迁延难愈[18]。
3 “正邪理论”与HF心肌能量代谢正气充足是心脏发挥正常生理功能的前提,这与心肌能量代谢为心脏供能的作用十分类似,心肌能量代谢障碍乃正气亏虚之微观表现。HF中各种风险因素以及心肌能量代谢过程中产生的脂毒性和ROS等病理产物的蓄积,是进一步损伤心功能的重要因素,这与中医邪气的概念具有理论共通性。正邪相争贯穿HF发病始末,HF发展过程中包括代偿期(A期、B期)和失代偿期(C期、D期)[19],采用“正邪理论”阐释HF不同时期的正邪相争关系及心肌能量代谢特点,可以立足中西结合的角度,把握HF发展转归的整体和阶段性规律,有助于提升辨证论治的精准度。
3.1 A期——正胜邪退,心肌能量代谢完全代偿HF风险期,患者无HF症状和体征,无功能性和结构性心脏病或异常生物标志物,比如患有高血压、冠心病、糖尿病和代谢综合征,以及暴露于心脏毒性制剂或心肌病家族史阳性的患者。心脏毒性制剂和上述基础病导致的心脏后负荷增加、血管脂质沉积、炎性介质大量释放等,皆可作为邪气而影响“心主血脉”的正常发挥,心脏线粒体氧化供能效率开始下降。此时邪气来袭,扰动机体气血阴阳平衡,通过积极改善生活方式,及早治疗原发病,控制风险因素进展,可使正气充盛,奋起抗邪,从而维持机体脏腑功能的动态平衡。心肌能量代谢可以完全代偿,通过线粒体自身稳态调节,保证心脏产生足够量的ATP以维持心功能的正常运行,故病邪对机体的侵害作用不会体现,患者无HF症状[20]。研究表明,高血压患者心脏能量代谢的变化先于心脏结构和功能的改变,长期的血压升高可造成心脏代偿功能失调而导致HF,因此改善能量代谢对高血压患者延缓心脏重塑具有重要意义[21]。
3.2 B期——邪正相持,心肌能量代谢不完全代偿HF前期,邪气进一步入侵导致气血阴阳失衡,脏腑功能失常,心肺气虚而运血无力,机体表现出客观的危险证据,如心脏结构性改变,B型利钠肽(BNP)水平和心肌肌钙蛋白持续升高,ATP产能缺失已超过了心脏的代偿能力。此时机体心肌能量代谢虽不能完全代偿,但通过灵活切换能量底物和肥厚心肌,心脏可产生一定量的ATP以避免心功能减退过多,使“心主血脉”功能得以维持,正气尚能阻止邪气的进一步深入,机体处于邪正相持状态。因此患者虽无明显HF症状,但生物标志物出现异常,心脏重构初现端倪,心肌开始代偿性肥大。心肌能量代谢的代偿可以看成是机体对正邪相争的调节反应,维护机体自身的平衡与稳定。研究表明,心肌受损初期,心肌摄取葡萄糖增加以代偿能量需求[9]。血浆BNP水平与HF患者心室重构指标(如心肌肥厚程度)之间呈正相关,与心功能指标呈负相关[22]。
3.3 C期——正虚邪亢,心肌能量代谢轻度失代偿HF症状期,邪气愈发亢盛,机体正气遭受明显损伤,病邪对机体的侵害作用进一步加重,HF的症状可随时发生,其基本病机为“正虚邪实”,可用王永炎院士提出的“虚气留滞”病机理论来概括[23]。“虚气”即“正虚”,最早表现为心肺气虚,血液的运行主要依赖心气的推动和“肺朝百脉”的助力,气不足则血行瘀滞;气虚日久可累及阳,发展为气阳两虚;久虚会加重“心主血脉”功能失司,进一步导致血运不利,血不利则为水,加之阳虚不能气化水饮,水湿停聚,便会导致瘀血、水饮、痰浊“留滞”,即为“邪实”。如果HF处于症状较轻的稳定期,积极辅以药物“补虚气”从而激发正气奋起抗邪,可压制亢盛的邪气,使回到邪正相持状态;如果HF急性发作则邪气占据优势,及时予以药物“通留滞”,削弱邪气的侵袭力,可减少对机体的侵害,反之则会导致邪正相争进入下一阶段。此时机体正气逐渐亏虚,抗邪能力不断下降,标志着心肌能量代谢明显障碍,进入了失代偿期。研究表明,心力衰竭症状明显时,能量代谢失代偿,供能结构紊乱,线粒体氧化功能明显下降[7],心肌对底物的利用也失去了灵活性,心肌摄取葡萄糖减少,糖酵解增加的ATP不足以弥补能量的缺失,心脏产生的ATP大大减少,而病理产物逐渐增多,加重心脏舒缩功能障碍及结构性改变[9]。
3.4 D期——邪盛正衰,心肌能量代谢严重失代偿HF晚期,机体正气遭受严重损伤,抗邪能力日渐低下,六淫、疫毒之邪也极易趁虚内犯于心,如《温热论》“温邪上受,首先犯肺,逆传心包。”久病耗伤,心体失荣,心气耗散,正气极虚而邪气独盛,“虚气”和“留滞”两者可互为彼此之因果,呈恶性循环式发展,加剧心血瘀阻、水饮内停。病邪对机体的侵害作用一直存在且日益加重,尽管优化药物干预,患者仍病情日趋恶化,住院率和病死率也趋于最高。此时心肌能量代谢已严重失代偿,心脏已不仅仅是能量产生不足的功能性受损,而是发展成为病理产物(包括超负荷的Ca2+、ROS、毒性脂质、乳酸、炎性物质、受损细胞器等)蓄积,毒性损伤心肌细胞的器质性损伤,心脏会出现严重不可逆的心肌重构[24]。心肌能量代谢障碍和各种病理产物蓄积可以分别看作是“正虚”和“留滞”的微观表现。研究表明,在晚期失代偿HF中,线粒体自噬能力明显减弱,造成受损线粒体不能及时清除而堆积损伤心肌细胞[13]。同时机体促炎机制和抗炎机制平衡被破坏,促使白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等大量炎症因子生成,释放进入血液循环并可直接作用于心肌,加重脏腑功能损伤[25]。另外,脂肪酸氧化酶表达下调且利用率降低,血浆脂肪酸水平升高,脂肪酸向心肌细胞的输送增加,脂肪酸摄取和利用紊乱导致脂类在细胞内积累,这些脂类可能进入非氧化途径而产生脂毒性,再加上脂肪酸β氧化伴随大量ROS产生,可进一步导致线粒体功能障碍和细胞凋亡,加重心肌损伤及能量代谢障碍,推动HF进展[26]。
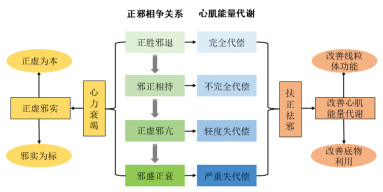
综上,正邪的盛衰变化决定着心肌能量代谢的代偿变化,正邪相争贯穿HF从无症状到心肌代偿性肥大再到失代偿性衰竭的整个发生发展过程。见图 2。
|
| 图 2 正邪相争与HF心肌能量代谢及中药干预机制 Fig. 2 The struggle between antipathogenic qi and pathogenic factors vs. the myocardial energy metabolism and the intervention mechanism of Chinese medicine in HF |
心肌能量代谢障碍与人体邪气太过和正气不足有关,其中正虚为本,邪实为标。基于正虚邪实的病机,“扶正祛邪”当为HF的治疗原则。根据“虚气留滞”的特点,当HF处于代偿期,可予以益气、温阳等药物“补虚气”进一步加强正气,调整脏腑功能,维持能量的不竭产出,辅助祛邪,预防病情向失代偿进展。当HF处于失代偿期时,大量病理产物蓄积毒损心肌细胞,在扶正基础上加用活血、利水等药物,可起到“通留滞”以祛邪外出的作用。临床上往往扶正祛邪兼顾,从而使所虚之气、阳得补,心主血脉的功能正常发挥,血液运行通利,水液布散有常,以达到标本同治的效果。研究表明,多种中药可以对心肌线粒体功能及底物利用进行调节,达到改善心肌能量代谢治疗HF的成效。
4.1 改善线粒体功能 4.1.1 益气温阳黄芪可补气升阳,其活性成分如黄芪甲苷和黄芪多糖[27-29],可以通过多种途径改善线粒体功能,其调节机制包括通过恢复线粒体呼吸、防止线粒体膜通透性转换孔开放和减少细胞色素C释放,改善血管紧张素Ⅱ(AngⅡ)诱导的心肌细胞能量代谢障碍;或者通过激活单磷酸腺苷活化蛋白激酶(AMPK)信号通路,减轻HF大鼠心肌线粒体结构破坏及心肌组织病理变化等。灵芝具有补气功效,灵芝多糖[30]能够提高HF大鼠心肌组织中Na+-K+-ATP酶和Ca2+-ATP酶的表达水平,进而调节心肌线粒体Ca2+稳态,减轻细胞内Ca2+超载而改善HF大鼠心肌能量代谢。肉苁蓉是温补肾阳之品,松果菊苷[31]是从肉苁蓉提取的有效活性成分之一,实验证明其可上调与线粒体生物合成相关的过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)/核呼吸因子(NRFs)信号通路,促进线粒体生物合成,提高异丙肾上腺素诱导的HF大鼠心肌线粒体能量产出。参附注射液[32]干预AngⅡ诱导的肥大心肌细胞可保护线粒体结构和功能,其机制包括降低线粒体单胺氧化酶活性,升高细胞色素C氧化酶活性,降低线粒体外膜损伤率,升高线粒体膜电位,以及升高心肌细胞内总腺苷酸池含量和ATP含量等。温阳益气方[33]可通过下调AMPK蛋白介导的线粒体自噬改善心梗后心力衰竭大鼠的心肌功能。肾气丸[34]可以明显提高肾阳虚大鼠Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶,以及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性,有效保证三羧酸循环和氧化磷酸化的正常进行。保元汤[35]在体内和体外实验中均显示出抑制ROS生成的作用,有效保护心肌细胞线粒体功能。
4.1.2 活血利水丹参为活血化瘀要药,丹参醇A[36]通过修复线粒体的结构和功能,提高线粒体复合物活性,增加线粒体ATP产能,并抑制ROS产生,有效减轻AngⅡ诱导的心肌细胞凋亡,以及改善自发性高血压大鼠心肌重构和心肌能量代谢。川芎为活血行气之品,其活性成分川芎嗪[37]可以抑制乳酸脱氢酶的活性,并减少ROS的产生,促进B淋巴细胞瘤-2(BCL-2)蛋白向心肌细胞线粒体的转移,改善线粒体功能,进而防止脂多糖引起的心肌损伤。降香可化瘀理气,降香水提取物[38]可通过调节AMPK/PGC-1α信号通路降低左冠状动脉结扎诱导的HF大鼠线粒体氧化应激水平,增强线粒体能量合成和能量代谢,改善其心功能障碍。陈皮理气健脾化痰饮,其提取物橙皮素[39]可逆转过氧化氢诱导的H9c2心肌细胞线粒体膜电位下降,降低心肌细胞线粒体凋亡率,并升高ATP水平,表明其可抑制氧化应激导致的心肌细胞线粒体损伤,改善心肌细胞能量代谢。在体实验证实补阳还五汤[40]可通过调控AMPK/过氧化物酶体增殖物激活受体(PPAR)α信号通路,激活线粒体生物合成机制,改善线粒体功能结构,从而改善心功能。温阳益气活血方[41]可以升高HF模型大鼠心肌Na+-K+-ATP酶和Ca2+-ATP酶活性及蛋白表达,调整Ca2+稳态,以改善线粒体产能和减少心肌损伤。芪苈强心胶囊[39, 42]可抑制心梗后HF大鼠血清乳酸脱氢酶和ROS水平,减轻心肌细胞线粒体氧化应激损伤,抑制心肌细胞线粒体依赖性凋亡,还可上调PGC-1α表达保护心肌线粒体功能与氧化呼吸活性。
4.2 改善底物利用 4.2.1 益气温阳黄芪活性成分[43-44]亦可从改善底物利用对心肌能量代谢进行调节,其机制包括增加脂肪酸转位酶(FAT/CD36)转位以及肉毒碱软脂酰转移酶-1的表达,促进心肌对脂肪酸的摄取与氧化利用,降低HF大鼠心肌脂肪酸浓度,并降低心肌细胞对糖酵解的依赖,从而纠正HF大鼠心肌底物代谢异常,改善心肌代谢底物结构,增加ATP产能以改善心功能。人参可大补元气,人参皂苷Rb1[45-46]可调节HF大鼠Ca2+摄取和释放功能,减轻钙超载,还可激活AMPK通路介导的改善脂肪酸β氧化,并通过抑制转化生长因子β1(TGF-β1)/Smad和细胞外信号调节激酶(ERK)通路以及激活蛋白激酶B(Akt)通路,增强葡萄糖转运体(GLUT)4介导的葡萄糖摄取,以增加线粒体产能,改善HF。参附汤[47]通过调节心肌能量代谢中脂肪酸和葡萄糖的代谢灵活性,减轻横向主动脉缩窄诱导的HF小鼠心肌纤维化和肥大,从而减少其心脏不良重构期间心脏功能的丧失。参芪益心汤[48]以益气温阳法组方,临床治疗HF效果明显,实验研究表明其能减少心肌细胞游离脂肪酸含量,通过调节心肌糖脂代谢增加心肌ATP产量,同时减少耗氧量及大量心肌毒性物质生成,有效抑制阿霉素诱导的HF大鼠心肌代谢重构。加味真武汤[49]可以降低心肾阳虚型HF患者血清游离脂肪酸水平,有效改善心肌能量代谢和心肌纤维化。
4.2.2 活血利水三七对于活血散瘀疗效极佳,三七皂苷R1[50]可调节线粒体呼吸链,改善线粒体功能,并能促进脂肪酸氧化而减轻其对心脏的脂毒性,从而改善心肌能量代谢,减轻心梗后HF大鼠心肌重构和心功能衰退。芪苈强心胶囊[42]可通过p-AMPK/PPARα通路调节糖脂代谢,降低循环血中脂肪酸浓度,改善胸主动脉缩窄术诱导的压力负荷型HF大鼠心肌能量代谢。以益气活血法组方的暖心康[51]可以通过增加葡萄糖氧化而实现代谢底物的转换,并能保护线粒体结构,减少心肌细胞的凋亡,改善HF的心肌能量代谢。益气活血中药心复康口服液[52]能抑制心肌梗死后心力衰竭大鼠模型左室重构,改善血浆不饱和脂肪酸、葡萄糖代谢紊乱,促进心肌细胞GLUT4和GLUT1的表达,增加葡萄糖在心肌细胞膜的转运并促进其利用,还能优化心肌的线粒体质量控制,提高其心肌ATP含量,促进心肌能量代谢。芪参益气滴丸[53]可以通过PPARα/PGC-1α信号通路调节线粒体的数量和功能,并且促进心肌脂肪酸的氧化降解,提高ATP含量,有效改善阿霉素所致心肌损伤大鼠的心功能。体内外实验证实丹七片[54]能够调节PPARγ通路介导的糖脂代谢,包括增强脂肪酸氧化,促进葡萄糖的摄入、糖原的合成和糖酵解,纠正心肌糖脂代谢紊乱,为缺血性心脏和心肌细胞提供更多的能量。
5 小结本文立足于“正邪理论”,探讨HF不同时期正邪相争的关系及心肌能量代谢特点,确立“扶正祛邪”的治疗原则,以改善心肌能量代谢为靶点,从心肌线粒体功能及底物利用两方面进行调节,为中医药防治HF提供了新的视角和思考。目前,对HF的能量代谢改变仍有许多未知与不明确,西医基于能量代谢改善HF的药物也很有限,采用中医药多靶点调控心肌能量代谢在HF的防治中有着一定的前景和研究价值。后续,应致力于将基础研究结果应用于临床,积极开展相关临床研究,方能在中西医的临床协同工作中充分彰显中医药的价值。
| [1] |
魏佳明, 朱俊平, 王健章, 等. 中药治疗心力衰竭分子机制研究进展[J]. 中国中医药信息杂志, 2019, 26(7): 137-140. DOI:10.3969/j.issn.1005-5304.2019.07.033 |
| [2] |
马丽媛, 王增武, 樊静, 等. 《中国心血管健康与疾病报告2021》概要[J]. 中国介入心脏病学杂志, 2022, 30(7): 481-496. DOI:10.3969/j.issn.1004-8812.2022.07.001 |
| [3] |
BELOUKAS A I, MAGIORKINIS E, TSOUMAKAS T L, et al. Milestones in the history of research on cardiac energy metabolism[J]. The Canadian Journal of Cardiology, 2013, 29(11): 1504-1511. DOI:10.1016/j.cjca.2012.10.008 |
| [4] |
LOPASCHUK G D, KARWI Q G, TIAN R, et al. Cardiac energy metabolism in heart failure[J]. Circulation Research, 2021, 128(10): 1487-1513. DOI:10.1161/CIRCRESAHA.121.318241 |
| [5] |
TUOMAINEN T, TAVI P. The role of cardiac energy metabolism in cardiac hypertrophy and failure[J]. Experimental Cell Research, 2017, 360(1): 12-18. DOI:10.1016/j.yexcr.2017.03.052 |
| [6] |
CHISTIAKOV D A, SHKURAT T P, MELNICHENKO A A, et al. The role of mitochondrial dysfunction in cardiovascular disease: A brief review[J]. Annals of Medicine, 2018, 50(2): 121-127. DOI:10.1080/07853890.2017.1417631 |
| [7] |
WU C N, ZHANG Z, ZHANG W D, et al. Mitochondrial dysfunction and mitochondrial therapies in heart failure[J]. Pharmacological Research, 2022, 175: 106038. DOI:10.1016/j.phrs.2021.106038 |
| [8] |
BERTERO E, MAACK C. Metabolic remodelling in heart failure[J]. Nature Reviews Cardiology, 2018, 15(8): 457-470. DOI:10.1038/s41569-018-0044-6 |
| [9] |
TRAN D H, WANG Z V. Glucose metabolism in cardiac hypertrophy and heart failure[J]. Journal of the American Heart Association, 2019, 8(12): e012673. DOI:10.1161/JAHA.119.012673 |
| [10] |
DONG S H, QIAN L H, CHENG Z Q, et al. Lactate and myocardiac energy metabolism[J]. Frontiers in Physiology, 2021, 12: 715081. DOI:10.3389/fphys.2021.715081 |
| [11] |
SELVARAJ S, KELLY D P, MARGULIES K B. Implications of altered ketone metabolism and therapeutic ketosis in heart failure[J]. Circulation, 2020, 141(22): 1800-1812. DOI:10.1161/CIRCULATIONAHA.119.045033 |
| [12] |
KARWI Q G, LOPASCHUK G D. Branched-chain amino acid metabolism in the failing heart[J]. Cardiovascular Drugs and Therapy, 2023, 37(2): 413-420. DOI:10.1007/s10557-022-07320-4 |
| [13] |
黄淑敏, 李书楠, 钟森杰, 等. 基于"正邪理论"探讨自噬在慢性心力衰竭发展中的作用[J]. 中国实验方剂学杂志, 2022, 28(12): 233-239. |
| [14] |
张维波, 宋晓晶. 《黄帝内经》真气及相关气概念解析[J]. 中医学报, 2022, 37(1): 1-6. |
| [15] |
刘又嘉, 龙承星, 贺璐, 等. 中医正邪理论的微生态学思考[J]. 中国微生态学杂志, 2017, 29(3): 367-369, 373. |
| [16] |
贺娟. 论《黄帝内经》之"虚邪"[J]. 北京中医药大学学报, 2021, 44(1): 9-13. |
| [17] |
徐强. 基于仲景正邪观的六经病证研究[D]. 成都: 成都中医药大学, 2016.
|
| [18] |
邱素. 邪正相争在疾病过程中的多重作用研究[D]; 江西中医药大学, 2022.
|
| [19] |
HEIDENREICH P A, BOZKURT B, AGUILAR D, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: Executive summary: A report of the American college of cardiology/American heart association joint committee on clinical practice guidelines[J]. Circulation, 2022, 145(18): e876-e894. |
| [20] |
POZNYAK A V, KIRICHENKO T V, BORISOV E E, et al. Mitochondrial implications in cardiovascular aging and diseases: The specific role of mitochondrial dynamics and shifts[J]. International Journal of Molecular Sciences, 2022, 23(6): 2951. DOI:10.3390/ijms23062951 |
| [21] |
WU J, LU J, HUANG J Y, et al. Variations in energy metabolism precede alterations in cardiac structure and function in hypertrophic preconditioning[J]. Frontiers in Cardiovascular Medicine, 2020, 7: 602100. DOI:10.3389/fcvm.2020.602100 |
| [22] |
余其贵. 心力衰竭生物标志物在老年慢性心力衰竭中的应用价值研究[D]. 合肥: 安徽医科大学, 2022.
|
| [23] |
黄世敬, 王永炎. 缺血性脑白质病变"虚气留滞"病机探讨[J]. 北京中医药大学学报, 2011, 34(8): 513-516. |
| [24] |
FRANTZ S, HUNDERTMARK M J, SCHULZ-MENGER J, et al. Left ventricular remodelling post-myocardial infarction: Pathophysiology, imaging, and novel therapies[J]. European Heart Journal, 2022, 43(27): 2549-2561. DOI:10.1093/eurheartj/ehac223 |
| [25] |
廉坤, 姚涛, 杨梦, 等. 基于"虚气留滞"理论辨治Ⅱ型心肾综合征进展[J]. 中国中医药信息杂志, 2022, 29(12): 147-151. |
| [26] |
NGUYEN T D, SCHULZE P C. Lipid in the midst of metabolic remodeling-Therapeutic implications for the failing heart[J]. Advanced Drug Delivery Reviews, 2020, 159: 120-132. DOI:10.1016/j.addr.2020.08.004 |
| [27] |
郭依宁, 方崇锴, 王俊岩, 等. 黄芪甲苷通过AMPK/ACSS2/PPARα信号通路改善心肌细胞能量代谢的机制研究[J]. 中华中医药杂志, 2022, 37(8): 4389-4393. |
| [28] |
WANG R Y, WANG M, ZHOU J H, et al. Saponins in Chinese herbal medicine exerts protection in myocardial ischemia-reperfusion injury: Possible mechanism and target analysis[J]. Frontiers in Pharmacology, 2020, 11: 570867. |
| [29] |
刘莉莉, 王国良. 黄芪多糖对慢性心力衰竭大鼠心肌细胞能量代谢的影响[J]. 中西医结合心脑血管病杂志, 2022, 20(3): 420-426. |
| [30] |
朱娇玉, 姚乐, 赵浩, 等. 灵芝多糖对心力衰竭大鼠心肌能量代谢和心肌纤维化的影响[J]. 中西医结合心脑血管病杂志, 2022, 20(7): 1217-1221. |
| [31] |
倪雅娟, 白鸿远, 朱文静, 等. 松果菊苷通过上调PGC-1/NFR信号通路促进线粒体生物合成抑制心肌细胞凋亡[J]. 西安交通大学学报(医学版), 2022, 43(4): 607-611. |
| [32] |
于妍. 川芎嗪、黄芪液和参附液抑制心肌肥大及对线粒体和能量代谢的影响[D]. 北京: 北京中医药大学, 2012.
|
| [33] |
曹程浩, 韩丽华, 张会超. 基于AMPK介导的线粒体自噬分析温阳益气方改善大鼠梗死后心衰的药理机制[J]. 中国比较医学杂志, 2019, 29(12): 39-44. |
| [34] |
邱林, 赵群菊, 戴子凌, 等. 基于线粒体能量代谢的肾气丸"少火生气"配伍机理探讨[J]. 时珍国医国药, 2019, 30(8): 1850-1853. |
| [35] |
ZHANG Y, LI C, MENG H, et al. BYD ameliorates oxidative stress-induced myocardial apoptosis in heart failure post-acute myocardial infarction via the P38 MAPK-CRYAB signaling pathway[J]. Frontiers in Physiology, 2018, 9: 505. |
| [36] |
CHEN K, GUAN Y Q, MA Y C, et al. Danshenol A alleviates hypertension-induced cardiac remodeling by ameliorating mitochondrial dysfunction and suppressing reactive oxygen species production[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 2580409. |
| [37] |
HUANG B W, YOU J G, QIAO Y, et al. Tetramethylpyrazine attenuates lipopolysaccharide-induced cardiomyocyte injury via improving mitochondrial function mediated by 14-3-3γ[J]. European Journal of Pharmacology, 2018, 832: 67-74. |
| [38] |
张会涛, 郄涛. 基于AMPK通路降香水提物对急性心肌梗死大鼠心肌细胞线粒体能量代谢的影响[J]. 中医药导报, 2021, 27(12): 15-19, 23. |
| [39] |
张泸丹, 王彬, 王新陆, 等. 中医药靶向调控线粒体质量控制系统防治慢性心力衰竭的研究进展[J]. 中药新药与临床药理, 2023, 34(7): 1017-1024. |
| [40] |
王臻, 李洁白, 董昕, 等. 补阳还五汤对舒张性心衰大鼠心肌线粒体能量代谢及AMPK/PPARα信号通路的影响[J]. 中国实验方剂学杂志, 2019, 25(9): 12-17. |
| [41] |
吕李飞, 魏孝钦, 王梦歌, 等. 温阳益气活血方对慢性心力衰竭大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶的影响[J]. 中国中医药信息杂志, 2023, 30(2): 74-80. |
| [42] |
张军芳. 芪苈强心胶囊对心力衰竭微血管损伤、心室重构及代谢重构的影响[D]. 石家庄: 河北医科大学, 2013.
|
| [43] |
宋杰, 胡阳黔, 刘坚, 等. 黄芪多糖对慢性心衰大鼠心肌AMPK活性和FFA代谢的影响[J]. 中国病理生理杂志, 2015, 31(1): 28-32. |
| [44] |
唐斌, 张金国, 谭洪勇, 等. 黄芪甲苷对慢性心衰大鼠心肌纤维化及能量代谢的影响[J]. 中国病理生理杂志, 2017, 33(3): 411-416. |
| [45] |
孔宏亮, 赵雨婷, 蒋玉昆. 人参皂甙Rbl对心力衰竭大鼠心肌细胞钙调控的影响[J]. 岭南心血管病杂志, 2021, 27(3): 356-360. |
| [46] |
KONG H L, HOU A J, LIU N N, et al. The effects of ginsenoside Rb1 on fatty acid β-oxidation, mediated by AMPK, in the failing heart[J]. Iranian Journal of Basic Medical Sciences, 2018, 21(7): 731-737. |
| [47] |
HUANG Y T, ZHANG K, JIANG M M, et al. Regulation of energy metabolism by combination therapy attenuates cardiac metabolic remodeling in heart failure[J]. International Journal of Biological Sciences, 2020, 16(16): 3133-3148. |
| [48] |
王晓琳, 车驰, 陈智勇, 等. 中药对心力衰竭心肌糖脂代谢干预的研究进展[J]. 海南医学院学报, 2022, 28(16): 1275-1280. |
| [49] |
陶延丽, 许绍信, 王琳. 加味真武汤对心肾阳虚型慢性心力衰竭患者心肌纤维化、氧化应激、血管内皮功能及心肌能量代谢的影响[J]. 中医药导报, 2021, 27(6): 86-90. |
| [50] |
陈卓彬. 三七皂苷R1防治心血管疾病的研究进展[J]. 现代药物与临床, 2023, 38(4): 1003-1007. |
| [51] |
江佳林, 陈梓欣, 董鑫, 等. 益气活血法通过改善线粒体能量途径减轻缺血再灌注致心衰小鼠心肌纤维化[J]. 中华中医药杂志, 2021, 36(7): 3967-3971. |
| [52] |
邱志凌. 心复康口服液干预心力衰竭大鼠心肌线粒体质量控制的机制研究[D]. 北京: 中国中医科学院, 2018.
|
| [53] |
马莉, 刘志超, 高晟玮, 等. 芪参益气滴丸治疗心血管疾病药理作用与临床应用研究进展[J]. 药物评价研究, 2022, 45(4): 780-787. |
| [54] |
ZHANG Q, SHAO M Y, ZHANG X F, et al. The effect of Chinese medicine on lipid and glucose metabolism in acute myocardial infarction through PPARγ pathway[J]. Frontiers in Pharmacology, 2018, 9: 1209. |
2. Hunan Provincial Key Laboratory of Intelligent Diagnosis of Chronic Diseases by Traditional Chinese Medicine and Treatment of Future Diseases, Hunan University of Chinese Medicine, Changsha 410208, China;
3. Postgraduate Joint Training Base of Internet+TCM Diagnosis and Treatment of Chronic Diseases and Intelligent Application of Health Care, Changsha 410208, China
 2024, Vol. 41
2024, Vol. 41