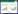文章信息
- 王帅杰, 张学琴, 吴媛, 等.
- WANG Shuaijie, ZHANG Xueqin, WU Yuan, et al.
- 基于Th17/Treg细胞免疫平衡探讨升阳益胃汤治疗特发性膜性肾病的作用及机制
- Study on the effect and mechanism of Shengyang Yiwei Decoction in treating idiopathic membranous nephropathy based on the immune balance of Th17/Treg cells
- 天津中医药, 2024, 41(11): 1438-1444
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(11): 1438-1444
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.11.14
-
文章历史
- 收稿日期: 2024-07-30
2. 河北中医药大学, 石家庄 050091;
3. 河北省中医院, 石家庄 050010
膜性肾病是一种免疫介导的肾小球疾病,其病理改变以原位免疫复合物沿毛细血管襻颗粒状沉积为主,根据病因的不同可分为特发性膜性肾病(IMN,又称为原发性膜性肾病)和继发性膜性肾病(SMN)两大类[1]。IMN的发病率在全国范围内呈显著上升趋势。调查显示,在其他肾小球病占比相对稳定情况下,MN占比从2004年的12.2%增至2014年的24.9%,其患病率平均每年增加13%[2]。2018年,1项基于国家卫生健康委员会的医院质量监测系统数据中心的研究结果也显示,中国三级医院原发性肾小球病住院患者中[3],膜性肾病的比例呈快速上升趋势(从2010年的4.5%上升至2015年的8.8%)。
IMN作为自身免疫性肾脏病,其发病过程大致如下:针对足细胞膜上某些抗原的自身抗体[以免疫球蛋白G4(IgG4)为主],与该抗原结合沉着于肾小球基底膜上皮细胞侧,T淋巴细胞通过分泌白介素等多种细胞因子刺激B淋巴细胞增殖和激活,B淋巴细胞则通过介导体液免疫,主要通过旁路途经激活补体,诱导膜攻击复合物C5b-9的形成,激活足细胞的多种信号分子,促进足细胞凋亡和增加细胞外基质产生等,造成基底膜通透性增加、完整性破坏,肾小球滤过屏障受损,引起蛋白尿和肾脏病理改变[4]。因此,足细胞是IMN病理过程中的主要损伤细胞,同时,T细胞及其分泌细胞分子的异常在IMN全程发挥重要的调控作用,而Th17/调节性T细胞(Treg)免疫失衡是其中一个关键因素。
升阳益胃汤是由黑龙江省中医科学院河北籍名老中医、第一届国医大师、全国著名肾脏病专家张琦教授引入慢性肾脏疾病临床治疗的。目前,该方在慢性肾脏病领域得到广泛应用,其良好的疗效得到业界广泛认可。王耀献教授认为脾肾亏虚为MN发病基础,同时湿邪在发病中起举足轻重作用,临床多以升阳益胃汤为基础方,疗效显著[5]。顾婉莹等[6]也认为脾肾亏虚贯穿MN各期始末,应用补火生土即升阳益胃汤加附子、肉桂等方法治疗MN。本研究基于Th17/Treg细胞免疫平衡探讨升阳益胃汤减轻IMN足细胞损伤,延缓疾病进展的机制。以期为升阳益胃汤在MN治疗中的应用提供实验依据。
1 材料 1.1 动物雄性SD大鼠40只,SPF级,鼠龄6周,体质量150~200 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2021-0011。本实验方案经河北中医药大学第一附属医院动物伦理委员会批准(伦理号:2023-YS-076-01)。
1.2 药物升阳益胃汤颗粒组成黄芪30 g,清半夏9 g,党参12 g,炙甘草6 g,独活12 g,防风9 g,白芍30 g,羌活9 g,陈皮12 g,茯苓30 g,北柴胡9 g,泽泻9 g,白术12 g,黄连6 g(购于广东一方制药有限公司,批号分别为A2010033、A2111013、A2069403、A2110283、A1120423、A2032143、A1081263、A3010573、
A2032283、A208A243、A2090483、A2082583、A2102133、A1123663);盐酸贝那普利片(批准文号:国药准字H20030514)。
1.3 试剂α-actinin-4抗体(Abcam公司,货号AB108201),Podxl抗体(Bioss公司,货号bs-1345R),白细胞介素(IL)-17A抗体(Bioss公司,货号bs-1183R),IL-10抗体(proteintech公司,货号BC104252),β-肌动蛋白(β-actin)抗体(中国三鹰公司,货号20536-1-AP),绵羊抗大鼠FX1A血清(美国Probetex公司,货号PTX-002s),Marker(赛默飞公司,货号26616),10%、12.5%预混胶(雅酶,货号PG111)、脱脂奶粉(biosharp,货号BS102-100g),BCA蛋白测定试剂盒(索莱宝,货号PC0020),大鼠蛋白试剂盒(南京建成生物工程研究所,货号C035-2-1),RIPA裂解液(biosharo,货号BL504A),SDS-PADE loading buffer(bioss,货号C05-03001),苯甲基磺酰氟(PMSF)(bioss,货号C05-01002)。
1.4 仪器7170A型全自动生化分析仪(日本Hitachi公司),BX51型光学显微镜(日本Olympus公司),Image Quant LAS4000型化学发光成像分析仪(美国GE Healthcare公司),PowerPac型电泳仪(美国Bio-Rad公司),Semi-Day型半干转膜仪,1-15K型高速冷冻离心机(美国Sigma公司),UC7型超薄切片机(德国Leica公司),JT-12脱水机,JB-L5包埋机,JK-6烤片机(武汉俊杰电子有限公司),Memmer烤箱(美墨尔特贸易有限公司)。
2 方法 2.1 造模及分组40只SD大鼠适应性喂养1周后,随机选取10只作为对照组,其余30只大鼠按照尾静脉注射羊抗大鼠FX1A血清(0.4 mL/100 g)制备Heymann肾炎模型,对照组大鼠注射同等剂量的生理盐水。1周后,造模组大鼠24 h尿蛋白(24 h-UTP)均大于10 mg,提示造模成功。按随机数字表法将造模成功的大鼠分为模型组、升阳益胃汤组、盐酸贝那普利组,每组10只。
2.2 给药药物用量按照大鼠与人等效剂量方法折算,即灌胃升阳益胃汤6.5 g/(kg·d)、盐酸贝那普利0.88 mg/kg,每日1次,对照组和模型组大鼠每日给予灌胃蒸馏水2 mL。共给药6周。
2.3 标本采集各组大鼠经代谢笼收集24 h尿液并记录尿量。腹腔注射乌拉坦1.2 g/kg麻醉大鼠,暴露腹腔,腹主动脉取血,留取血清;分离大鼠脾脏,置于3 mL 10%完全培养基中;取左肾,磷酸盐缓冲液冲洗后置于液氮中;取右肾,放入4%多聚甲醛中,固定24 h备用。
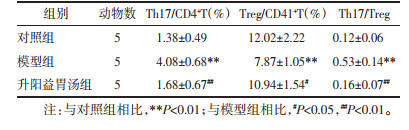
2.4 指标检测 2.4.1 生化指标检测尿蛋白定量检测试剂盒检测24 h尿蛋白水平;全自动生化分析仪检测血清总蛋白(TP)、白蛋白(Alb)、血清总胆固醇(TC)、三酰甘油(TG)、肌酐(Scr)、尿素氮(BUN)水平。
2.4.2 肾脏组织病理学改变将固定于4%多聚甲醛的肾组织脱水,透明,石蜡包埋,切片,分别予苏木素-伊红(HE)、马松(Masson)和六胺银(PASM)染色,光学显微镜下观察肾脏组织形态学改变。
2.4.3 免疫组化法检测肾组织α-actinin-4、Podxl的表达使用组织切片机将石蜡包埋肾组织切成约4 μm的薄片,放置于黏附载玻片上,二甲苯脱蜡,乙醇水化,双氧水淬灭过氧化物酶,EDTA修复抗原(α-actinin-4 pH 9.0、Podxl pH 6.0),山羊血清封闭,一抗孵育过夜,孵试剂二于水浴锅中20 min,试剂三于水浴锅中30 min,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树脂封片,显微镜下观察拍照。
2.4.4 蛋白免疫印迹法(Western blot)检测肾组织α-actinin-4、Podxl、IL-17A和IL-10的表达取肾组织放入离心管中,置于冰上,加入RIPA裂解液,用组织匀浆器裂解组织。4 ℃,12 000 r/min离心(离心半径6 cm,下同),取上清用BCA法检测蛋白浓度,沸水浴使蛋白变性。蛋白样品经凝胶电泳,转至聚偏二氟乙烯(PVDF)膜,用5%脱脂奶粉封闭90 min,分别加入α-actinin-4抗体(1:1 000)、Podxl抗体(1:2 000)、IL-17A抗体(1:1 000)、IL-10抗体(1:2 000)、β-actin抗体(1:1 000),4 ℃孵育过夜。TBST洗涤后,加入HRP标记的山羊抗兔IgG,室温摇床孵育1 h,TBST洗涤后,加入化学发光试剂显影,并用Image Quant LAS4000成像系统拍照。
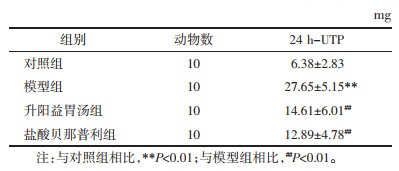
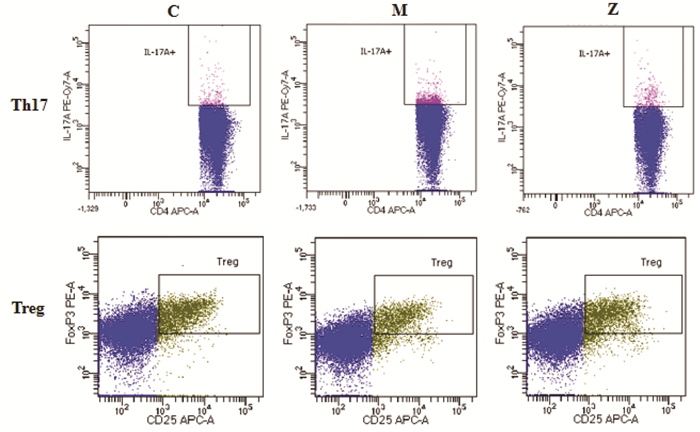
2.4.5 流式细胞仪检测Th17/Treg水平变化将脾脏制成单细胞悬液。取3 mL淋巴细胞分离液于试管中,将单细胞悬液加至上层,2 500 r/min离心20 min,除上清,洗涤后加入1 mL培养基重悬细胞后计数,调整细胞数为2×107/mL,置于CO2培养箱中培养6 h。将培养后的单细胞悬液置于磷酸缓冲盐溶液(PBS)中至8 mL,1 000 r/min离心10 min,洗涤,调整为1×107/ mL,加入藻红蛋白-花青染料5(PE/CY5)标记的CD4抗体,孵育20 min。加入组织固定液,4 ℃固定,PBS冲洗,离心。加入标记的IL-17A和叉状头转录因子p3(Foxp3),PBS冲洗,取上清。流式细胞仪检测Th17细胞与Treg细胞占CD4+T细胞百分比(Th17%、Treg%),并分析Th17/Treg比值。
2.5 统计学方法采用SPSS 25.0进行统计分析,计量资料用均数±标准差(x±s)表示,若数据符合正态分布且方差齐,组间比较用单因素方差分析,采用LSD法。若数据不符合正态分布,则选用非参数秩和检验,P < 0.05表示差异有统计学意义。
3 结果 3.1 各组大鼠一般情况模型组大鼠表现为活动迟缓,毛发干枯,甚则掉毛,食欲较差。与模型组大鼠相比,各治疗组大鼠活动较为灵活,毛发逐渐光泽,食欲较好,升阳益胃汤组改善最为明显。
3.2 各组大鼠24 h-UTP定量与对照组比较,模型组24 h-UTP水平显著升高(P < 0.01);与模型组相比,各治疗组24 h-UTP水平显著降低(P < 0.01);治疗组间24 h-UTP差别无统计学意义(P > 0.05),见表 1。
与对照组比较,模型组大鼠TC、TG水平显著升高(P < 0.01),TP、Alb水平显著降低(P < 0.01);与模型组相比,各治疗组TC、TG显著降低(P < 0.01)、TP、Alb水平升高(P < 0.05或P < 0.01);各治疗组间TC、TG、TP、Alb水平差别无统计学意义;各组大鼠血清Scr、BUN水平无明显统计学意义(P > 0.05),见表 2。
|
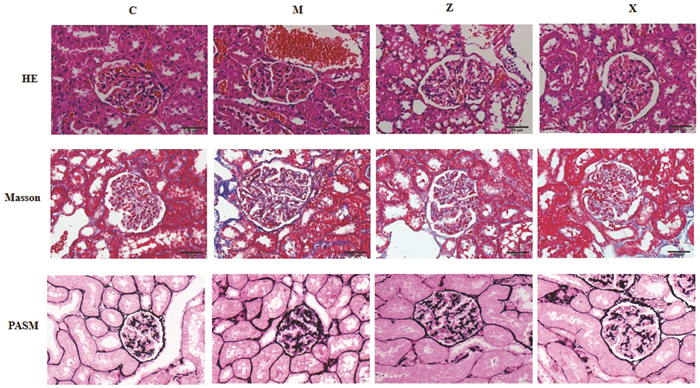
模型组大鼠肾小球结构紊乱,可见广泛钉突形成,嗜复红蛋白沉积于上皮下,基底膜增厚。与模型组相比,各治疗组大鼠肾小球结构改善,偶见嗜复红蛋白,基底膜增厚程度减轻,见图 1。
|
| 注:C,对照组;M,模型组;Z,升阳益胃汤组;X,盐酸贝那普利组。 图 1 各组大鼠肾组织病理学改变(×400) Fig. 1 Pathological changes in the kidneys of rats in each group(×400) |
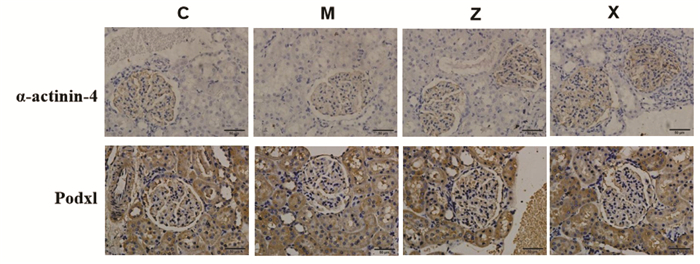
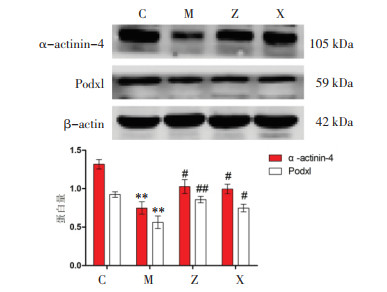
免疫组化及Western blot结果显示,与对照组比较,模型组α-actinin-4、Podxl的表达显著减少(P < 0.01);与模型组相比,各治疗组α-actinin-4、Podxl的表达明显升高(P < 0.05或P < 0.01),各治疗组间比较α-actinin-4、Podxl差异无统计学意义(P>0.05),见图 2、图 3,表 3。
|
| 注:C,对照组;M,模型组;Z,升阳益胃汤组;X,盐酸贝那普利组。 图 2 各组大鼠α-actinin-4、Podxl免疫组化(×400) Fig. 2 Immunohistochemistry of α-actinin-4, Podxl of rats in each group(×400) |
|
| 注:C,对照组;M,模型组;Z,升阳益胃汤组;X,盐酸贝那普利组。与对照组相比,**P < 0.01;与模型组相比,#P < 0.05,##P < 0.01。 图 3 各组大鼠α-actinin-4、Podxl蛋白的表达(x±s,n=3) Fig. 3 Protein expression of α-actinin-4, Podxl of rats in each group(x±s, n=3) |
|
与对照组相比,M组Th17%、Th17/Treg显著升高,Treg%显著降低(P < 0.01);与模型组比较,升阳益胃汤组Th17%、Th17/Treg均下降显著(P < 0.01),Treg%明显升高(P < 0.05),见图 4、表 4。
|
| 注:C,对照组;M,模型组;Z,升阳益胃汤组。 图 4 各组大鼠Th17/Treg水平(x±s,n=5) Fig. 4 Th17/Treg of rats in each group(x±s, n=5) |
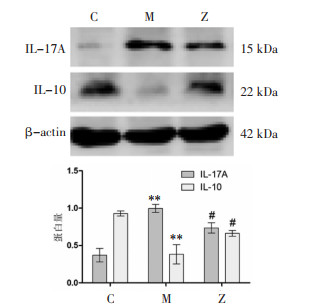
与对照组相比,M组IL-17A显著升高(P < 0.01),IL-10显著降低(P < 0.01);与模型组相比,升阳益胃汤组IL-17A明显下降(P < 0.05),IL-10明显升高(P < 0.05)。见图 5。
|
| 注:C,对照组;M,模型组;Z,升阳益胃汤组。与对照组相比,**P < 0.01;与模型组相比,#P < 0.05。 图 5 各组大鼠IL-17A、IL-10的表达(x±s,n=3) Fig. 5 IL-17A, IL-10 of rats in each group(x±s, n=3) |
IMN依其临床表现而言,属于中医“水肿病”或“水气病”的范畴,《素问·水热穴论》云:“肾者,胃之关也,关门不利,故聚水而从其类也。上下溢于皮肤,故为胕肿”。《景岳全书·肿胀》指出:“凡水肿等证,乃肺脾肾三脏相干之病,盖水为至阴,故其本在脾,令肺虚则气不化精而化水,脾虚土不制水而反克,肾虚则水无主而妄行,水不归经则逆而上泛,故传于脾而肌肉浮肿,传于肺则气息喘急”;“水肿证,以精血皆化为水,多属虚败,治宜温脾补肾,此正法也”,此强调精血亏虚发为水肿,并以温补脾肾法治疗水肿等。《丹溪心法·水肿》云:“水肿因脾虚不能制水,水渍妄行,当以参术补脾,使脾气得实,则自健运,自能升降运动其枢机,则水自行”,指出脾虚致肿,提出了补脾的治疗思路。病机总属“本虚标实”之证,本虚以脾肾亏虚为主,而标实则以水湿、瘀血等为患。概言之,脾虚湿盛为该病的核心病机。升阳益胃汤为体现李东垣脾胃论学术思想的代表方剂。方中黄芪、党参、白术、炙甘草健脾胃而补元气;柴胡、防风助其升发有力;黄连、茯苓、陈皮、泽泻、半夏清热除湿;羌活、独活祛风胜湿;茯苓、泽泻又可导湿热从小便排出,使浊邪去,而清阳得升。诸药合用,补泻有度,升降相宜,共奏益气升阳、健脾益胃、化湿清热之功,与膜性肾病“脾虚湿胜”的病机相契合。升阳益胃汤为临床治疗膜性肾病的有效方剂,在2021年底发布的《特发性膜性肾病中医临床实践指南》中,基于该方的中成药-益肾化湿颗粒被列为推荐中药。但升阳益胃汤的具体效应机制,还要进一步探讨。本团队已研究[7]升阳益胃汤12、24 g/(kg·d)剂量可保护足细胞,调节免疫失衡。本实验以临床最常应用升阳益胃汤剂量为参考,即以成人临床用量×等效剂量系数6.2倍为大鼠用药剂量,探讨常规剂量下升阳益胃汤的具体作用机制。
薛雪等[8]发现Heymann模型大鼠足细胞足突弥漫融合伴电子致密物沉积,足细胞骨架重构。足细胞在肾小球滤过系统中发挥分子屏障和电荷屏障的作用[9]。足细胞结构和功能的变化是导致肾小球滤过膜通透性改变的主要原因,因此足细胞在肾小球滤过屏障中的重要性越来越受到人们的重视[10]。α-actinin-4是细胞骨架肌动蛋白交联蛋白,仅在足细胞中表达[11],是足细胞上最重要的骨架蛋白之一。α-actinin-4在滤过屏障的形成中起桥接作用,可将SD复合体锚定于细胞骨架上,对于维持足细胞形态稳定具有重要作用[12]。王颖超等[13]发现,α-actinin-4表达与蛋白尿呈负相关,与足细胞数目呈正相关。Podxl是带有负电荷的CD34家族的唾液酸蛋白,是维持电荷屏障的重要阴离子蛋白,主要分布于足突顶部,足细胞阴电荷水平下降或丢失会导致足突融合并产生大量蛋白尿[14]。Kavoura等[15]在51例肾脏样本中评估了Podxl的免疫组化表达,包括健康对照、微小病变、局灶节段性肾小球硬化和膜性肾小球病患者,与正常组相比,所有疾病病例中Podxl表达均下降。有研究表明,Podxl的表达减少可引起足突融合,并与蛋白尿产生密切相关[16]。同时,蛋白尿也能进一步损伤足细胞,加速炎症反应[17],膜性肾病迁延难愈,湿邪弥漫三焦[18],本团队前期研究发现三焦祛湿方能明显降低MN小鼠蛋白尿水平[19],且能上调Podxl蛋白的表达,修复肾脏损伤[20]。在本实验中,模型组大鼠肾组织中α-actinin-4、Podxl的表达显著下降,表明其足细胞完整性遭到破坏,屏障功能受损,故而产生大量蛋白尿,给予升阳益胃汤干预后,α-actinin-4和Podxl的表达均升高,表明升阳益胃汤具有减轻足细胞损伤、修复滤过屏障的作用。
IMN为自身免疫性肾病。近年来越来越多的证据显示,Th17/Treg的细胞免疫平衡对维持免疫稳态、预防自身免疫性疾病有着重要作用。Th17及Treg均来源于幼稚型CD4+T的分化。Th17细胞能够释放IL-17A、IL-17F等细胞因子[21],还能刺激IL-1、IL-6、趋化因子等促炎分子分泌,并因此发挥动员中性粒细胞、加速炎症介质释放及加速细胞增殖等多种功能[22]。王莉等[23]研究显示IL-17可能通过降低足细胞Podxl蛋白的表达、减少足细胞数目、诱导足细胞凋亡而导致大量蛋白尿引起原发性肾病综合征。Treg细胞亦是近年免疫学研究的热点之一,其主要功能是抑制自身反应性T细胞的活性和维持免疫耐受,可以在树突状细胞的诱导下高表达IL-10。Treg与Th17分化和功能相互抑制。Ma等[24]对60例IMN患者Th17、Treg细胞及细胞因子和肾组织中Foxp3蛋白进行了检测,结果显示:外周血单个核细胞中Th17和IL-17显著升高,Treg和IL-10显著降低;IMN患者外周血IL-17浓度与尿蛋白呈正相关,IL-10浓度与尿蛋白呈负相关;PMN患者肾组织中Foxp3蛋白表达明显降低,IL-17蛋白表达明显升高;并且,经治疗缓解的15例PMN患者,其Th17/Treg比例亦恢复正常。因此调控Th17/Treg细胞免疫平衡是防治IMN的重要手段。在本实验中,模型组大鼠IL-17A、Th17%和Th17/Treg水平显著升高,IL-10和Treg%水平明显降低,表明体内发生了Th17/Treg免疫失衡;给予升阳益胃汤干预后,肾组织内IL-17A、Th17%、Th17/Treg水平显著降低,IL-10、Treg%水平明显升高,证明升阳益胃汤可以修复Th17/Treg免疫失衡,抑制炎症反应。
综上所述,升阳益胃汤可降低膜性肾病大鼠蛋白尿,减轻肾脏病理损伤,并提高足细胞α-actinin-4、Podxl的表达,具有明显的肾脏保护作用,其作用机制可能与调节Th17/Treg免疫平衡有关。
| [1] |
赵亚云, 方敬, 刘海平, 等. 基于NOX4/ROS/p38信号通路探讨三焦祛湿方对膜性肾病小鼠的抗氧化应激作用[J]. 中草药, 2022, 53(4): 1076-1083. |
| [2] |
XU X, WANG G B, CHEN N, et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China[J]. Journal of the American Society of Nephrology, 2016, 27(12): 3739-3746. DOI:10.1681/ASN.2016010093 |
| [3] |
LI J N, CUI Z, LONG J Y, et al. Primary glomerular nephropathy among hospitalized patients in a national database in China[J]. Nephrology, Dialysis, Transplantation, 2018, 33(12): 2173-2181. |
| [4] |
李昊, 胡章学. 膜性肾病相关靶抗原及自身抗体的研究进展[J]. 肾脏病与透析肾移植杂志, 2021, 30(4): 357-361. DOI:10.3969/j.issn.1006-298X.2021.04.012 |
| [5] |
曹博宁, 王耀献. 王耀献教授应用升阳益胃汤治疗膜性肾病蛋白尿经验[J]. 世界中西医结合杂志, 2023, 18(4): 663-667. |
| [6] |
顾婉莹, 宋光明. 补火生土祛湿法论治膜性肾病之探析[J]. 中医临床研究, 2020, 12(25): 65-67. |
| [7] |
吴媛, 张学琴, 安恒通, 等. 基于Th1/Th2平衡探讨升阳益胃汤对膜性肾病大鼠足细胞的影响[J]. 中国实验方剂学杂志: 1-8.
|
| [8] |
薛雪, 吴健, 付彤飞, 等. 温阳活血利水方对被动型Heymann肾炎大鼠足细胞的影响[J]. 中华中医药杂志, 2023, 38(2): 603-608. |
| [9] |
贺丽蓉, 邵晓珊. Th17、Treg及足细胞损伤与原发性肾小球疾病研究进展[J]. 国际儿科学杂志, 2016, 43(1): 66-69, 70. |
| [10] |
NAGATA M. Podocyte injury and its consequences[J]. Kidney International, 2016, 89(6): 1221-1230. DOI:10.1016/j.kint.2016.01.012 |
| [11] |
陶花, 顾乐怡. 足细胞骨架相关蛋白的调节及其在细胞生物学中的作用[J]. 中国中西医结合肾病杂志, 2011, 12(7): 641-645. DOI:10.3969/j.issn.1009-587X.2011.07.028 |
| [12] |
KOS C H, LE T C, SINHA S, et al. Mice deficient in alpha-actinin-4 have severe glomerular disease[J]. Journal of Clinical Investigation, 2003, 111(11): 1683-1690. DOI:10.1172/JCI17988 |
| [13] |
王颖超, 于眉, 杨敏, 等. 糖肾平对糖尿病肾病大鼠α-actinin-4表达及足细胞数目影响[J]. 辽宁中医药大学学报, 2018, 20(4): 31-35. |
| [14] |
LING L, CHEN L B, ZHANG C N, et al. High glucose induces podocyte epithelial-to-mesenchymal transition by demethylation-mediated enhancement of MMP9 expression[J]. Molecular Medicine Reports, 2018, 17(4): 5642-5651. |
| [15] |
KAVOURA E, GAKIOPOULOU H, PARASKEVAKOU H, et al. Immunohistochemical evaluation of podocalyxin expression in glomeru- lopathies associated with nephrotic syndrome[J]. Human Pathology, 2011, 42(2): 227-235. DOI:10.1016/j.humpath.2010.05.028 |
| [16] |
查冬青, 陈铖, 张静静, 等. Podocalyxin在大鼠嘌呤霉素肾病模型中的表达及其意义[J]. 武汉大学学报(医学版), 2012, 33(2): 154-157. |
| [17] |
万金艳, 龙宇, 张羽璐, 等. PI3K/Akt信号通路在糖尿病肾病中的作用及中药干预的研究进展[J]. 中草药, 2021, 52(12): 3705-3716. |
| [18] |
潘永梅, 王开爽, 代成, 等. 陈志强中医药治疗特发性膜性肾病经验[J]. 中华中医药杂志, 2020, 35(7): 3460-3462. |
| [19] |
陈静洁, 方敬, 赵亚云, 等. 三焦祛湿方对膜性肾病小鼠肾组织ZO-1和synaptopodin蛋白表达的影响[J]. 天津中医药, 2022, 39(5): 649-655. |
| [20] |
刘海平, 赵亚云, 马贇, 等. 三焦祛湿方对膜性肾病小鼠足细胞中α-actinin-4、Podocalyxin表达的影响[J]. 中国中西医结合肾病杂志, 2022, 23(10): 860-864, 942. |
| [21] |
田野, 高泓, 谢春光. 中医药调节代谢类疾病Th17/Treg免疫平衡的研究进展[J]. 中华中医药学刊, 2022, 40(9): 180-183. |
| [22] |
YASUDA K, TAKEUCHI Y, HIROTA K. The pathogenicity of Th17 cells in autoimmune diseases[J]. Seminars in Immunopathology, 2019, 41(3): 283-297. |
| [23] |
王莉, 李秋, 王莉佳, 等. 白细胞介素-17对足细胞相关分子和凋亡的影响及其分子机制研究[J]. 中国小儿急救医学, 2017, 24(8): 587-592. |
| [24] |
MA D H, YANG X D, HUA Q J, et al. Changes and significance of Treg and Th17 inadult patients with primary membranous nephropathy[J]. Clinical Nephrology, 2021, 96(3): 155-164. |
2. Hebei University of Chinese Medicine, Shijiazhuang 050091, China;
3. Hebei Provincial Hospital of Traditional Chinese Medicine, Shijiazhuang 050010, China
 2024, Vol. 41
2024, Vol. 41