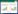文章信息
- 吴子聪, 蔡丽, 赵艳青, 等.
- WU Zicong, CAI Li, ZHAO Yanqing, et al.
- 神经复元方对卒中后抑郁大鼠海马神经元雄激素受体表达和活性的影响研究
- Study on the effect of Shenjing Fuyuan Decoction on androgen receptor expression and activity of hippocampal neurons in poststroke depression rats
- 天津中医药, 2024, 41(12): 1569-1575
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1569-1575
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.15
-
文章历史
- 收稿日期: 2024-06-05
2. 上海中医药大学附属市中医医院脑病科, 上海 200071
卒中后抑郁(PSD)是脑卒中后常见的并发症,严重影响卒中患者神经功能缺损的恢复,极大地增加了患者的致残率、复发率和病死率,已经成为卒中复发的独立危险因素[1-2]。据流行病学数据,目前中国PSD发病率约为29.0%~37.9%[3-4]。阐明PSD发病机制对增强PSD治疗效果、提高患者生活质量、减轻家庭和社会负担等均具有重要意义。前期研究证实神经复元方对改善PSD患者抑郁症状有较好疗效[5-6],其修复海马神经元损伤可能是通过激活BDNF/TrkB信号通路实现[7-9]。有研究发现雄激素受体(AR)缺乏会加重慢性轻度应激型抑郁小鼠的抑郁样行为,AR能够调节BDNF的表达[10]。药物靶点网络分析提示神经复元方多种有效成分作用于AR,因此该研究拟建立卒中后抑郁模型大鼠(PSD大鼠),通过实验验证神经复元方是否影响PSD大鼠海马神经元AR的表达和活性,为研究神经复元方治疗PSD的机制提供一定的实验依据。
1 材料与方法 1.1 材料 1.1.1 动物SPF级健康雄性SD大鼠40只,3个月龄,体质量(210±30)g,斯贝福(北京)生物有限公司提供。所有大鼠分笼喂养于20~26 ℃,湿度40%~70%的SPF级循环房内,光/暗周期为12 h/l2 h,适应饲养7 d,允许动物自由获取食物和水。所有实验操作经上海中医药大学附属中医医院医学伦理委员会批准并指导进行(伦理批件号:2021036),操作期间充分考虑动物的利益,善待动物,减少动物的应激、痛苦和伤害,尊重动物生命,采取痛苦最少的方法处置动物。
1.1.2 药物神经复元方药,采用单味中药配方颗粒冲调而成,由江苏省江阴市天江药业有限公司生产提供,全方由熟地黄15 g,制黄精15 g,广郁金9 g,石菖蒲12 g,全蝎3 g,僵蚕9 g,丹参9 g组成。氟西汀(仟源医药,国药准字H20073985)。
1.1.3 试剂与仪器 1.1.3.1 试剂4%组织细胞固定液(货号:P1110,北京索莱宝科技有限公司);牛血清白蛋白(BSA,货号:A8020,北京索莱宝科技有限公司);即用型DAPI染液(货号:KGA215-50,江苏凯基生物技术股份有限公司);二辛可酸(BCA)蛋白定量试剂盒(货号:E-BC-K318-M,武汉伊莱瑞特生物科技);超纯RNA提取试剂盒(货号:CW0581M,江苏康为世纪生物科技股份有限公司);放射免疫沉淀法(RIPA)细胞裂解液(货号:C1053,北京普利莱基因技术有限公司);超灵敏发光液[货号:RJ239676,赛默飞世尔科技(中国)有限公司];十二烷基硫酸钠(SDS)(货号:151-21-3,西陇科学股份有限公司)及磷酸化AR与非磷酸化AR(p-AR)相关抗体等。
1.1.3.2 仪器低温高速离心机(5424R,Eppendorf);热恒温培养箱(DHP-9054);Morris水迷宫(XR-XM101,上海欣软信息科技有限公司);恒温浴槽(HX-101,上海诺顶仪器设备有限公司);全自动酶标仪(SuPerMax 3100,上海闪普);荧光显微镜(CKX53,奥林巴斯);蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);全自动化学发光图像分析系统(Tanon-5200,上海天能科技有限公司)及相关移液枪、单道可调移液器等。
1.2 方法 1.2.1 分组与模型制备将40只SD大鼠采用随机数字表法随机分为假手术组、PSD模型组、神经复元方组、氟西汀组,共4组,各10只。采用经典的线栓法大脑中动脉阻塞手术(MCAO)建立脑缺血模型,加用慢性不可预见温和应激(CUMS)结合孤养,建立大鼠PSD模型。MCAO手术参照Longa等[11-12]改良的Koizumi方法建立,术后24 h按Longa等的标准进行神经功能评分,1~3分的入组。手术结束后恢复2 d后进行慢性不可预见温和应激(CUMS),参照方力群等[13]方法每日选取1种刺激,持续14 d,建立大鼠PSD模型,用糖水偏好实验和旷场实验评价抑郁模型的可靠程度并分析药物干预效果。假手术组每笼饲养5只,共饲养10只,在其他大鼠进行造模的同时,给予相同的MCAO手术流程,但不插入线栓,不进行温和应激处理和孤养,作为1组排除手术对大鼠抑郁状态的影响。模型组和两个药物干预组大鼠每笼1只,按以上造模方法进行造模,各组留取相同数量造模成功的大鼠进行实验观察。
1.2.2 干预方法将72 g的神经复元方加纯水配成48 mL,浓度为1.5 g/mL的药剂。神经复元方组在造模成功基础上给予神经复元方药剂灌胃处理,剂量参考文献[14]根据人日用剂量折算成大鼠日用剂量而成,给药剂量10 mL/kg。假手术组、模型组予以0.9%生理盐水灌胃,2 mL/d。氟西汀组在造模成功基础上予以氟西汀混悬液灌胃,每日给予5 mg/kg。自第14天起(应激结束后)连续干预14 d。
1.2.3 行为学观察和测试分作糖水偏好实验、旷场实验及Morris水迷宫测试,每组记录统计多样本数据。糖水偏好实验参照文献[15]进行,实验开始手术前训练动物适应含糖饮水,适应结束后,大鼠单笼饲养并禁水禁食12 h,然后每只大鼠分别给予提前称质量的1瓶浓度为1 %的蔗糖水和1瓶自来水,12 h后蔗糖水和自来水互换位置。再过12 h后,收集剩余的蔗糖水和自来水,再次称质量。测试分别安排在手术前、应激第7、14天和药物干预第14天进行,记录大鼠蔗糖水消耗量,并计算糖水偏好指数(SPI),SPI=蔗糖水摄入量/(蔗糖水摄入量+自来水摄入量)×100%。SPI越高,表示动物对糖水的偏好程度越高;反之,则可能表示动物出现快感缺失或抑郁症状。实验中糖水浓度、笼子环境、实验时间等条件保持一致。
旷场实验参照文献[16]进行,实验前1 h将动物放置到测试室适应环境,使用旷场行为观察箱,地面用黑线划分为面积相等的25格。实验开始时,将动物轻轻放置在旷场装置的中央,记录动物在旷场中的行为,观察时间5 min。大鼠四爪进入同一方格内计为行走1格,两前肢离地1 cm以上计为站立1次。以动物穿越地面方格数作为水平活动得分,以站立次数作为垂直活动得分。每只大鼠单独测试,室内隔音、干净,用摄像头和运动跟踪软件记录并分析动物的行为,统计得分。为验证实验的可重复性,每次实验选择在同一时间段内完成,并保持条件和环境的一致,由2名研究者在严格不知鼠源时同时操作观察,并取得分均值为最后得分,两次实验之间,清洗实验设备并保持旷场内干燥整洁,以免上次实验的动物余留信息影响下次实验的结果。
Morris水迷宫测试安排在药物干预结束后1周,参照文献[17]进行,采用定位航行实验测试学习功能,采用空间探索实验测试记忆功能。1)定位航行实验。通过观察大鼠从入水到寻找到并爬上平台所用时间(即逃避潜伏期)来测量其学习记忆能力。前5 d为训练阶段,将大鼠分别从不同的象限放入水中,放入时面向池壁,计算机跟踪分析大鼠寻找平台的潜伏期,若120 s内仍未找到平台,则人为引到平台并停留30 s,此时逃避潜伏期记为120 s。每只动物每天训练4次,每次训练之间间隔10 min,连续训练5 d。将每天4次的平均逃避潜伏期作为当天大鼠的学习指标。潜伏期越短,说明动物的空间学习记忆能力越强。2)空间探索实验,于5 d训练结束后移除平台,在水池第三象限周边壁上做黑色三角标记,将大鼠放入任一象限,分析60 s内大鼠在平台所在象限的停留时间作为空间探索时间,穿越原站台位置的次数记为跨平台次数,空间探索时间越长和跨平台次数越多,说明其空间学习记忆能力越好。为确保Morris水迷宫测试结果的可靠性和可重复性,实验中,水温、水质、实验动物种类和年龄等实验条件保持一致,实验人员操作规范保持一致。
1.2.4 细胞观察样本采集方法待各组大鼠Morris水迷宫测试完成后,分别采集免疫荧光检测(IF)和蛋白质免疫印迹(Western Blot)所需用海马组织标本,并分离得到大鼠海马神经元细胞,分离得到的神经元细胞放置于培养基中培养待检,方法参照文献[18]。
1.2.5 免疫荧光检测取分离的大鼠海马神经元细胞,用4%组织细胞固定液(货号:P1110,北京索莱宝科技有限公司)固定30 min,0.5%曲拉通X-100(Triton X-100)通透20 min,经5% 牛血清白蛋白溶液(BSA)在37 ℃下封闭30 min后,分别用抗体p-AR(货号:AF8407,美国Affinity抗体公司,1∶200)和AR(货号:22089-1-AP,美国Proteintech抗体公司,1∶200)在4 ℃下孵育过夜。洗涤后滴加荧光二抗Cy3标记免疫球蛋白(IgG)[货号:AS007,武汉爱博泰克(ABclonal),1∶200],在复染DAPI(货号:KGA215-50,凯基生物)后封片,在荧光显微镜(型号:CKX53,奥林巴斯)下观察并采集图像。DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的p-AR、AR红光。
1.2.6 蛋白质免疫印迹检测各组培养待检的细胞弃去培养基,加入放射免疫沉淀法(RIPA)细胞裂解液(货号:C1053,北京普利莱基因技术有限公司)裂解细胞,提取总蛋白。12 000 r/min高速离心机4 ℃离心10 min,离心半径8 cm,取上清液,二辛可酸(BCA)蛋白定量试剂盒(货号:E-BC-K318-M,武汉伊莱瑞特生物科技有限公司)对总蛋白进行定量。对蛋白样品进行变性后,进行十二烷基苯磺酸钠凝胶电泳(SDS-PAGE)1 h,后用300 mA恒流转膜1.5 h。PVDF膜(货号:IPVH00010,美国密理博(Millipore)公司)用脱脂奶粉封闭后,一抗β-肌动蛋白(β-Actin)(货号:HC201,北京全式金生物技术股份有限公司,1∶2 000)、AR(货号:66747-1-lg,美国Proteintech抗体公司,1∶1 000)和p-AR(货号:AF8407,美国Affinity抗体公司,1∶1 000)4 ℃孵育过夜,次日PVDF膜室温分别孵育二抗Goat Anti-Mouse IgG(H+L)-HRP Conjugated(货号:GB23301,武汉赛维尔生物科技有限公司,1∶2 000)和Goat Anti-Rabbit IgG(H+L)-HRP conjugated(货号:GB23303,武汉赛维尔生物科技有限公司,1∶2 000)2 h,用超灵敏发光液[货号:RJ239676,赛默飞世尔科技(中国)有限公司]浸湿PVDF膜,置于全自动化学发光图像分析系统中进行显影。
1.3 统计学方法采用SPSS 20.0统计软件进行数据分析,符合正态分布以及方差齐性的计量资料以均数±标准差(x±s)表示,治疗前后比较采用配对样本t检验,组间比较采用独立样本t检验;计数资料以率表示,组间比较采用检验和Mann Whitney U检验;P<0.05为差异有统计学意义。
2 结果本实验PSD大鼠模型成功建立28只,故PSD模型组、神经复元方组、氟西汀组各留取9只开展实验,假手术大鼠选取9只作对比实验,实验过程中氟西汀组死亡1只大鼠。
2.1 各组糖水消耗量比较手术前,各组糖水消耗无统计学差异。应激第14天,模型组、氟西汀组及神经复元方组消耗量与手术前和假手术组比较明显降低,差异有统计学意义(P<0.01)。经药物干预14 d后,氟西汀组、神经复元方组糖水消耗量较应激第14天时明显增多,且明显高于模型组,差异有统计学意义(P<0.05)。假手术组糖水消耗量前后无明显变化(P > 0.05)。见表 1。
|
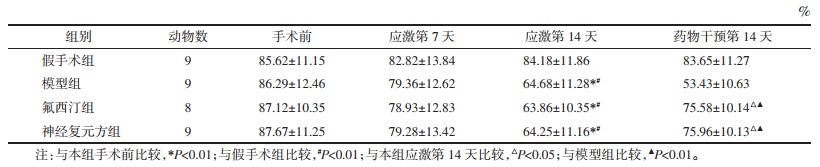
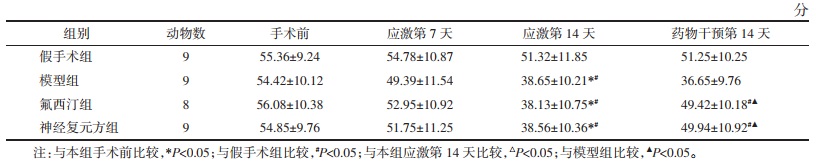
应激第14天,模型组、氟西汀组及神经复元方组大鼠旷场实验水平、垂直得分较假手术组和手术前均明显降低,差异有统计学意义(P<0.05)。药物干预14 d后,氟西汀组、神经复元方组大鼠水平、垂直得分较应激第14天时明显增多,且明显高于模型组,差异有统计学意义(P<0.05)。假手术组水平、垂直得分前后无明显变化(P > 0.05)。见表 2、表 3。
|
|
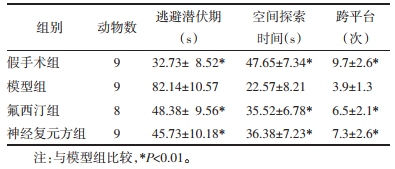
在药物干预结束后1周经Morris水迷宫测试,大鼠逃避潜伏期,假手术组、氟西汀组和神经复元方组显著短于模型组,差异有统计学意义(P<0.01);空间探索时间,假手术组、氟西汀组与神经复元方组显著长于模型组,差异有统计学意义(P<0.01)。跨平台次数,假手术组、氟西汀组与神经复元方组明显多于模型组,差异有统计学意义(P<0.01)。见表 4。
|
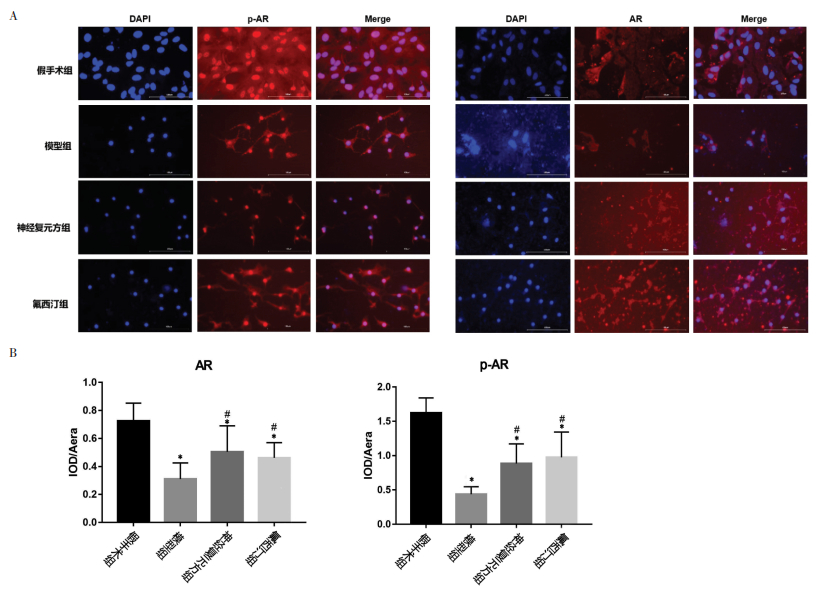
IF检测结果显示,与假手术组比较,模型组的AR、p-AR核内表达数显著减少,差异有统计学意义(P<0.05);与模型组比较,神经复元方组、氟西汀组中的AR、p-AR核内阳性表达数明显增加(P<0.05)。见图 1。
|
| 注:A,各组免疫荧光图片(1∶100 μm);B,各组细胞核AR阳性平均光密度比较;C.各组细胞核p-AR阳性平均光密度比较细胞核阳性表达为相应荧光素标记的p-AR、AR红光。与假手术组比较,*P<0.05;与模型组比较,#P<0.05。 图 1 免疫荧光中各组AR、p-AR核内表达数量比较 Fig. 1 Comparison of the expression levels of AR and p-AR nuclei in each group detected by IF |
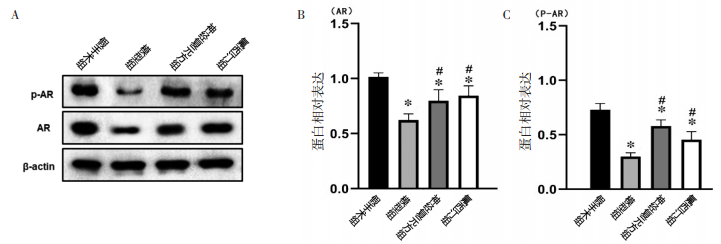
利用Western Blot检测细胞中磷酸化及非磷酸化AR蛋白变化情况。与假手术组比较,模型组PSD大鼠的AR蛋白及非磷酸化蛋白p-AR表达受到抑制,显著下降(P < 0.05);神经复元方组和氟西汀组经过药物处理后PSD模型大鼠AR和p-AR蛋白表达水平明显提高,与模型组比较有统计学意义(P < 0.05)。见图 2。
|
| 注:A,各组蛋白质免疫印迹分析总体结果;B,各组AR表达比较;C,各组p-AR表达比较。与假手术组比较,*P<0.05;与模型组比较,#P<0.05。 图 2 各组大鼠海马AR蛋白及p-AR蛋白表达情况比较 Fig. 2 Comparison of AR and p-AR protein expression in the hippocampus of rats in each group |
PSD是卒中后常见的并发症之一,被认为与炎症、神经元损伤和神经递质失衡等有关。AR是一种核转录因子,它一旦被雄激素激活,便能识别靶因子上专一的DNA序列并与之结合,从而调控该基因的转录,表达新的蛋白质,最终使得细胞的功能发生改变,促进细胞分化和组织器官的发育。AR在大脑中的分布广泛,尤其是在与情绪、认知和性行为相关的区域,因此,AR的功能异常可能直接或间接地影响个体的情绪状态。慢性温和不可预见性应激是抑郁症的一个主要促发因素,本研究采用经典的线栓大脑中动脉加用慢性不可预见温和应激结合孤养法建立PSD大鼠模型,分组开展实验对照,通过行为学观察和细胞中磷酸化AR和非磷酸化AR(p-AR)细胞核内阳性表达数量与蛋白含量表达水平变化,分析AR表达和活性改变与PSD症状改善之间的关联性。
本实验结果显示,在对大鼠进行应激14 d后,模型组、氟西汀组、神经复元方组大鼠糖水消耗量明显减少,旷场实验的大鼠水平、垂直得分降低,变化差异均有统计学意义,表明采用经典的线栓大脑中动脉加用慢性不可预见温和应激结合孤养法有效诱导卒中模型大鼠快感缺乏、探索行为减少等抑郁核心症状,建模成功。经神经复元方和氟西汀药物干预14 d后,与模型组比较,神经复元方组和氟西汀组大鼠在Morris水迷宫中定位航行潜伏期明显缩短,空间探索时在目标象限的持续时间明显延长、跨越平台次数明显增多,且糖水消耗量和旷场实验水平、垂直得分均有明显提高,假手术组应激和干预前后各项得分变化不明显,表明两种药物对PSD模型大鼠抑郁症状和记忆能力有一定的改善。药物干预结束后,利用免疫荧光检测发现模型组的AR、p-AR核内表达数相比假手术组显著减少,神经复元方组、氟西汀两组中的AR、p-AR核内表达数相比模型组明显增加。利用Western-Blotting检测各组细胞中磷酸化及非磷酸化AR蛋白变化情况,发现与假手术组相比,模型组、神经复元方组和氟西汀组AR、p-AR蛋白表达明显下降;与模型组比较,神经复元方组和氟西汀组的AR、p-AR蛋白表达显著上升,表明AR与大鼠抑郁状态相关,神经复元方对SD大鼠海马神经元损伤(即PSD模型)有一定的修复作用,能够促进AR活化,提示AR可能为神经复元方治疗PSD的重要靶蛋白。
美国国立精神卫生研究所的流行病学调查表明,女性抑郁症的患病率高达8%,将近男性抑郁症的2倍,性激素与抑郁症存在密切关系[19-20]。苏巧荣等[21]研究发现AR的(CAG)n微卫星多态被发现影响相关的性激素受体的活性,与血清性激素水平存在联系,并与抑郁症或抑郁状态有关。杨佳微等[22]研究发现脑源性DHT/AR信号路径是PFOS损伤成年雄性大鼠学习记忆能力的分子机制之一。另外一些研究[23-24]还发现,AR可以调节神经元的凋亡过程,抑制凋亡相关基因的表达,从而增加神经元的存活率;AR还可以促进神经元的生长和分化,增强神经元的连接和功能。前期体外细胞实验[25]也发现神经复元方对H2O2诱导的SD大鼠海马神经元损伤有一定修复作用,能够促进AR活化。武晓蓉等[26]研究发现,肉苁蓉总苷特异性介导AR提高SAMP8小鼠的突触可塑性,进而改善学习认知功能。洪雷等[27]研究发现生理剂量睾酮通过雄激素受体改善小鼠行为学能力。可见临床和模式动物研究均提示,AR与PSD的发生和发展存在关联,本实验进一步验证了AR表达和活性改变对PSD症状改善的影响,提示神经复元方治疗PSD的作用机制可能与促进海马神经元AR活化有关。抑郁症是一种复杂的疾病,其发病机制涉及多种生物因素,包括遗传、神经递质、神经内分泌等多个方面,目前关于AR与抑郁症关系的研究相对有限,尚未形成大规模、系统性的研究体系,AR只是其中的可能因素之一,与其他因素的相互作用和相互影响尚未完全明确。且本实验研究样本量相对较小,后续研究还需扩大样本,特别是神经复元方通过影响AR表达介导什么信号通路起到作用尚需进一步验证。
| [1] |
张晓春, 李佳良, 李婷. 脑卒中后抑郁的相关因素分析[J]. 延安大学学报(医学科学版), 2020, 18(1): 42-45. |
| [2] |
吕淑珍, 詹焱. 脑卒中后抑郁发病及相关影响因素分析[J]. 医药前沿, 2020, 10(3): 26-27. |
| [3] |
谢晓彬, 张卫. 卒中后抑郁病因机制研究进展[J]. 中医临床研究, 2020, 12(5): 145-148. |
| [4] |
WANG Z, SHI Y M, LIU F F, et al. Diversiform etiologies for post-stroke depression[J]. Frontiers in Psychiatry, 2018, 9: 761. |
| [5] |
蔡丽, 刘毅, 陆小青, 等. 神经复元方治疗缺血性卒中后抑郁临床研究[J]. 陕西中医, 2019, 40(11): 1523-1527. |
| [6] |
张凌凌, 金如锋, 英洪友, 等. 神经复元方治疗脑梗死恢复期病人125例临床疗效观察[J]. 中西医结合心脑血管病杂志, 2018, 16(23): 3419-3421. |
| [7] |
蔡丽, 董耀荣, 李文涛, 等. 神经复元方对原代大鼠海马神经元BDNF/TrKB信号通路影响的研究[J]. 陕西中医, 2020, 41(6): 720-723, 727. |
| [8] |
蔡丽, 刘毅, 李文涛, 等. 神经复元方对卒中后抑郁大鼠BDNF/TrkB表达及海马神经元突触可塑性的影响[J]. 世界中医药, 2021, 16(4): 597-602. |
| [9] |
何明, 马飞月. 卒中后抑郁影响因素及其与脑源性神经营养因子基因多态性的关系研究[J]. 实用心脑肺血管病杂志, 2019, 27(5): 29-35. |
| [10] |
HUNG Y Y, HUANG Y L, CHANG C, et al. Deficiency in androgen receptor aggravates the depressive-like behaviors in chronic mild stress model of depression[J]. Cells, 2019, 8(9): 1021. DOI:10.3390/cells8091021 |
| [11] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.STR.20.1.84 |
| [12] |
肖莹, 刘树民. 线栓法制备大鼠局灶性脑缺血模型的研究进展[J]. 中国康复理论与实践, 2006, 12(11): 939-940. |
| [13] |
方力群, 樊自豪, 刘利. 卒中后抑郁模型大鼠海马BDNF mRNA的表达及舍曲林的干预作用[J]. 黑龙江医学, 2011, 35(5): 333-337. |
| [14] |
黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072. DOI:10.3969/j.issn.1009-2501.2004.09.026 |
| [15] |
汪洋, 王玉娟, 武九龙, 等. 电针对PSD大鼠行为学及神经营养因子和炎症因子的影响[J]. 南京中医药大学学报, 2021, 37(2): 263-269. |
| [16] |
蔡丽, 刘毅. 针刺对卒中后抑郁大鼠行为学及单胺类神经递质影响的实验研究[J]. 江苏中医药, 2013, 45(10): 71-73. |
| [17] |
王俊亚, 张冬梅. Morris水迷宫实验的测试方法介绍及注意事项[J]. 现代医药卫生, 2012, 28(21): 3289-3290. |
| [18] |
孟盼, 王宇红, 张秀丽, 等. 百事乐胶囊对慢性应激抑郁模型大鼠海马神经元凋亡的影响[J]. 中国实验方剂学杂志, 2013, 19(19): 203-207. |
| [19] |
ROHR U D. The impact of testosterone imbalance on depression and women's health[J]. Maturitas, 2002, 41: 25-46. DOI:10.1016/S0378-5122(02)00013-0 |
| [20] |
杨剑虹, 兰光华. 性激素与抑郁症关系的研究进展[J]. 浙江临床医学, 2008, 10(8): 1132-1133. |
| [21] |
苏巧荣. 青春期首发的青少年抑郁症患者雄激素受体基因微卫星多态性研究[C]. 北京: 中国心理卫生协会儿童心理卫生专业委员会第十次学术交流会论文集. 2006.
|
| [22] |
杨佳微. 脑源性DHT/AR信号路径在PFOS损伤成年雄性大鼠学习记忆能力中的作用[D]. 大连: 大连医科大学, 2023.
|
| [23] |
LA ROSA P, BARTOLI G, FARIOLI VECCHIOLI S, et al. Androgen receptor signaling promotes the neural progenitor cell pool in the developing cortex[J]. Journal of Neurochemistry, 2021, 157(4): 1153-1166. DOI:10.1111/jnc.15192 |
| [24] |
HAMMOND J, LE Q, GOODYER C, et al. Testosterone-mediated neuroprotection through the androgen receptor in human primary neurons[J]. Journal of Neurochemistry, 2001, 77(5): 1319-1326. DOI:10.1046/j.1471-4159.2001.00345.x |
| [25] |
蔡丽, 张凌凌, 赵艳青, 等. 神经复元方对H2O2诱导的大鼠海马神经元损伤后雄激素受体活化的影响[J]. 天津中医药, 2024, 41(4): 490-494. |
| [26] |
武晓蓉, 朱世龙, 巩世纪, 等. 肉苁蓉总苷介导特异性雄激素受体对SAMP8小鼠突触相关蛋白及认知功能的影响[J]. 包头医学院学报, 2023, 39(11): 1-5. |
| [27] |
洪雷, 吴赛珠, 郑华, 等. 生理剂量睾酮通过雄激素受体改善小鼠行为学能力的研究[J]. 中国老年学杂志, 2010, 30(9): 1218-1221. |
2. Department of Encephalopathy, Shanghai Municipal Hospital of Traditional Chinese Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China
 2024, Vol. 41
2024, Vol. 41