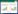文章信息
- 韩玉, 王耀光.
- HAN Yu, WANG Yaogaung.
- 加味防己黄芪汤干预lncRNA NKILA介导的HK-2细胞肾间质纤维化模型抑制上皮细胞-间充质转化作用的机制研究
- To investigate the mechanism by which modified Jiawei Fangji Huangqi Decoction intervenes in the lncRNA NKILA-mediated RIF model of HK-2 cells to inhibit EMT
- 天津中医药, 2024, 41(12): 1576-1585
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1576-1585
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.16
-
文章历史
- 收稿日期: 2024-10-18
2. 天津中医药大学第一附属医院, 天津 300381
肾间质纤维化是指胶原蛋白及相关蛋白在肾皮质间质异常沉积,是各类肾脏疾病的常见组织学异常,同时也代表了几乎所有慢性和进行性肾病的共同最终途径[1-2]。上皮细胞-间充质转化(EMT)是肾间质纤维化的重要起始环节,以往研究表明EMT在肾组织损伤修复中具有重要作用。在EMT的初始阶段,受损的上皮细胞或实质细胞触发纤维化反应,随后导致免疫细胞的募集和激活,免疫细胞可分泌细胞因子,促进纤维化过程[3]。而随着基因测序技术的不断发展,研究发现在免疫细胞激活的过程中会伴随着大量长链非编码RNA(lncRNA)的表达量变化。越来越多的证据表明,lncRNA参与广泛的生物过程,包括基因调控、染色质结构和细胞分化,并且能够参与免疫细胞募集、分化和功能的调节,以及细胞因子和趋化因子信号传导,参与细胞增殖和迁移以及细胞凋亡的调节[4-5]。
本研究中所选取的lncRNA NKILA是活化B细胞的核因子κ轻链增强子(NF-κB)相关性的lncRNA[6]。在以往的研究中表明,NF-κB是在肾间质纤维化过程中经典的促进纤维化形成的细胞因子,同时具有明显的促进炎症进展的功能,且在不同器官的纤维化进程中均展现出相似的致纤维化能力[7-9]。而lncRNA NKILA具有同NF-κB相互作用的结构域,现阶段的研究表明lncRNA NKILA能够表现出同NF-κB相似的致纤维化能力,同时具有激活先天性和获得性免疫反应的功能,能够参与调节肾脏细胞的炎症反应及凋亡过程[10]。
本课题组前期已经证实了,加味防己黄芪汤能够改善单侧输尿管结扎(UUO)大鼠肾功能等生化指标、肾间质纤维化病理损伤、抑制肾间质纤维化过程中EMT表型蛋白E-cad、α-SMA蛋白的表达以及炎症因子NF-κB、IκBa的蛋白表达,同时能够干预JAK2/STAT3信号通路,对于肾间质纤维化的进程起到延缓作用,并且在通过不同剂量浓度的结果对比中发现,高剂量的加味防己黄芪汤抑制UUO大鼠肾间质纤维化的效果更为显著[11]。因此,本研究通过高剂量加味防己黄芪汤含药血清干预由lncRNA NKILA过表达构建的HK-2细胞肾间质纤维化模型,并设置AG490干预组进行对照,通过检测EMT表型指标FN、Col1、Vim、α-SMA、E-cad的表达量变化,以及JAK2/STAT3信号通路相关指标的变化,在细胞层面进一步探索加味防己黄芪汤含药血清对HK-2细胞纤维化过程中的EMT作用机制的干预作用。
1 实验材料 1.1 实验细胞人肾皮质近曲小管上皮细胞株(HK-2细胞,Procell CL-0109),购买于武汉普诺赛生命科技有限公司,STR鉴定正确。
1.2 主要试剂及耗材兔GAPDH单克隆抗体(武汉三鹰生物技术有限公司,10494-1-AP)、兔alpha-SMA单克隆抗体(江苏亲科生物研究中心有限公司,AF1032)、兔E-cadherin单克隆抗体(江苏亲科生物研究中心有限公司,AF0131)、兔Vimentin单克隆抗体(武汉三鹰生物技术有限公司,10366-1-AP)、山羊抗兔IgG(H+L)HRP(江苏亲科生物研究中心有限公司, S0001)、Anti-Fibronectin(Abcam,ab45688)、兔Collagen I单克隆抗体(沈阳万类生物科技有限公司,WL0088)、兔Jak2单克隆抗体(武汉三鹰生物技术有限公司,17670-1-AP)、兔STAT3单克隆抗体(武汉三鹰生物技术有限公司,10253-2-AP)、Anti-P-JAK2 Rabbit pAb(沈阳万类生物科技有限公司,WL02997)、兔Anti-P-STAT3单克隆抗体(沈阳万类生物科技有限公司,WLP2412)、CCK-8(兰杰柯科技有限公司,BS350B)。
1.3 主要实验仪器伯乐小型电泳仪(美国BIO-RAD公司,164-5050)、多功能酶标仪(美国Thermo公司,Varioskan LUX)、冷冻高速离心机(美国Thermo Fisher公司,75002445)、梯度PCR仪(美国ABI ProFlex公司,4484073)、荧光定量PCR仪(瑞士Roche公司,LightCycler96)、凝胶成像仪(德国耶拿公司,ChemStudio)、正置光学显微镜(日本OLYMPUS公司,OLYMPUS CK31)等。
2 实验方法 2.1 细胞培养方法HK-2细胞采用含10%胎牛血清的RPMI 1640培养基培养,加入1%的青霉素链霉素双抗,于37 ℃,5% CO2条件下进行培养,隔天换液,细胞融合至70%~80%时,0.25%胰蛋白酶消化,按照1∶3比例传代。取对数生长期HK-2细胞进行后续实验。
2.2 慢病毒构建及转染提供人源lncRNA NKILA的序列全长信息,由上海吉凯基因技术公司针对序列信息,设计并合成过表达lncRNA NKILA靶点,构建慢病毒载体。
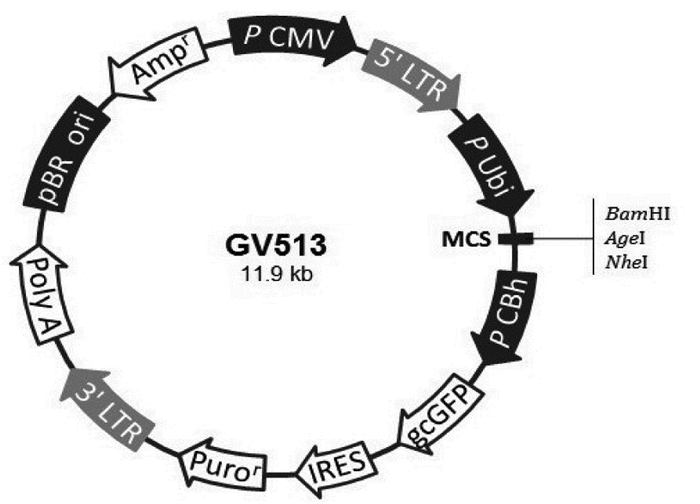
过表达载体为GV513,元件顺序Ubi-MCS-CBh-gcGFP-IRES-puromycin,见图 1。过表达病毒目的基因片段获取信息见表 1。
|
| 图 1 过表达载体为GV513,元件顺序Ubi-MCS-CBh-gcGFP-IRES-puromycin Fig. 1 Overexpression vector GV513, element sequence Ubi MCS CBh gcGFP IRES puromycin |

|
所有动物实验均遵循天津市医学实验动物保护中心的指导原则,动物实验方案经易生源基因科技(天津)有限公司的动物伦理委员会批准[方案号YSY-DWLL-2021069,实验动物许可证SYXK(津)2021-0003]。
加味防己黄芪汤高剂量水煎剂,制备方法:生黄芪30 g,防己10 g,生白术10 g,地龙10 g,赤芍10 g,以上药材由天津中医药大学第一附属医院提供,并对药物进行煎煮浓缩。按照《药理实验方法学》体表面积换算方法,体表面积系数为0.018,将每付药液浓度浓缩至高剂量1.26 g/mL,4 ℃保存。
含药血清制备:10只SPF级雄性SD大鼠,每次灌胃前测量大鼠体质量,按照10 mL/kg剂量进行高剂量加味防己黄芪汤灌胃,每日清晨灌胃2 mL,连续7 d。并于第6天晚禁食不禁水,第7天给药2 h后,采用戊巴比妥钠40 mg/kg腹腔注射麻醉大鼠,进行腹主动脉采血。血液样本室温静置1 h,3 000 r/min离心15 min,离心半径为144 mm,留取血清,56 ℃水浴箱灭活30 min,0.22 μm滤膜过滤除菌,无菌分装后-80 ℃冰箱保存备用。
2.4 CCK-8法筛选含药血清给药浓度取对数生长期的HK-2细胞,调整细胞密度为4×104/mL的细胞密度接种于96孔板中(每孔100 μL),培养板周边孔接种等量无菌磷酸盐缓冲液(PBS),37 ℃、5% CO2培养箱中培养24 h,待细胞贴壁后加入不同浓度的高剂量含药血清浓度(0%、5%、7.5%、10%、12.5%、15%、17.5%、20%)诱导细胞24 h,每个浓度设置5个复孔,并设置无细胞对照孔。药物作用结束后,10 μL/孔避光加入CCK-8试剂,继续放入37℃、5% CO2培养箱内孵育2 h,酶联免疫检测仪上测定各孔OD值(单波长450 nm),根据细胞活力筛选出最合适的含药血清最适干预浓度。
2.5 实验分组方法HK-2细胞复苏后传代至第3~5代开始实验,取对数生长期HK-2细胞,以2×104/mL密度接种于6孔板上(每孔1 mL),待细胞生长至30%~40%密度时,更换不含胎牛血清(FBS)的RPMI 1640培养基中饥饿处理12 h,按以下分组进行干预。
1)过表达阴性对照慢病毒转染组(oe-NC组):使用过表达阴性对照病毒(LVCON335)进行转染,慢病毒24 h后收集细胞。2)过表达lncRNA NKILA慢病毒转染组(oe-NKILA组):使用过表达慢病毒Lv-NKILA(76304)进行转染,慢病毒24 h后收集细胞。3)过表达lncRNA NKILA慢病毒转染+AG490干预组(oe-NKILA+AG490组):使用过表达慢病毒Lv-NKILA(76304)进行转染,同时加入50 μmol/L AG490,共刺激24 h后收集细胞。4)过表达lncRNA NKILA慢病毒转染+高剂量防己黄芪汤含药血清组(oe-NKILA+TCM-H):使用过表达慢病毒Lv-NKILA(76304)进行转染,同时加入高剂量防己黄芪汤含药血清进行干预,共刺激24 h后收集细胞。
3 检测指标及方法 3.1 蛋白免疫印迹(Western Blot)检测 3.1.1 一抗稀释比例GAPDH 1∶2 000、Vim 1∶500、α-SMA 1∶500、FN 1∶1 000、Col1 1∶500、JAK2 1∶500、STAT3 1∶1 000、p-JAK2 1∶500、p-STAT3 1∶1 000,使用一抗稀释液稀释,置于4 ℃冰箱备用。
3.1.2RIPA裂解细胞提取蛋白,BCA法测定蛋白浓度。取10 μL蛋白样品、4 μL彩色预染蛋白标准品在8% SDS-PAGE胶中上样,设定100 V电压进行电泳,溴酚蓝至凝胶底部停止电泳。湿式电转膜法转移至PVDF膜上,400 mA恒定电流转膜30 min。5%脱脂奶粉,封闭液室温下封闭60 min,1×TBST洗膜3次,每次5 min。一抗孵育,4 ℃过夜,1×TBST洗膜3遍,Goat Anti-Rabbit IgG(1∶5 000)室温孵育1 h,再次1×TBST洗膜3遍,特超敏ECL化学发光试剂盒显影,凝胶成像仪检测。GAPDH为内参蛋白,Image J软件分析条带,以目的蛋白与内参蛋白比值为相对表达量。
3.2 免疫荧光检测E-cad蛋白表达量变化E-cad蛋白一抗稀释比例为1∶50,使用PBS稀释。HK-2细胞按照2×104/孔的密度接种于细胞爬片上。分组及模型构建同前。造模完成后,弃去原有培养液,使用PBS缓冲液清洗细胞后,吸净残留液体,用4%多聚甲醛室温固定细胞30 min后,使用PBS缓冲液洗涤3遍,每次5 min。0.5% Triton100室温下浸润细胞10 min进行细胞透膜处理,使用5%山羊血清封闭液室温下封闭30 min。滴加一抗孵育,室温下孵育30 min后,4 ℃孵育过夜,PBS洗涤细胞3次后。避光加入CoraLite594-conjugate Goat Anti-Rabbit IgG(1∶200,PBS稀释),37 ℃避光孵育1 h。避光环境下,捞出细胞爬片,并放置于黏附载玻片上,并滴加含DAPI的防荧光淬灭剂孵育套染细胞核2 min,盖玻片封片,荧光显微镜下观察并采集图像。
3.3 实时荧光定量PCR(qPCR)检测RIPA裂解细胞利用柱式法提取总RNA,利用分光光度仪测定RNA浓度。HiFiScript cDNA Synthesis Kit进行逆转录,配置20 μL体系进行cDNA逆转录,使用UltraSYBR Mixturet进行扩增,设置20 μL反应体系聚合酶链反应(PCR)检测。逆转录-聚合酶链反应(RT-PCR),反应体系:95 ℃预变形10 min,热启动40个循环(95 ℃变性15 s,60 ℃退火1 min,72 ℃延展1 min)。PCR通过计算基因的相对表达量(2-ΔΔCt)分析结果:以GAPDH为内参基因,计算方法为:ΔΔCt=ΔCt实验组(目的基因Ct值-内参基因Ct值)-ΔCt对照组(目的基因Ct值-内参基因Ct值)。引物由上海生工生物工程公司设计合成,引物序列见表 2。
利用SPSS 25.0统计分析软件进行分析,计量资料以均数±标准差(x±s)表示,各组数据比较前先进行正态性及方差齐性检验。组间差异比较采用单因素方差分析(One-Way ANOVA),符合正态分布且方差齐时采用SNK检验,方差不齐时采用Dunnett’s检验;不符合正态分布时使用非参数检验。以P < 0.05为差异具有统计学意义。
5 结果 5.1 含药血清浓度筛选结果CCK-8法筛选出含药血清浓度(0%、5%、7.5%、10%、12.5%、15%、17.5%、20%)给药24 h后对HK-2细胞活力的影响,结果显示在12.5%浓度开始,细胞活力出现明显的下降(P<0.01)。在10%浓度之前各梯度浓度之间细胞活力无明显差别,差异无统计学意义(P>0.05)。提示含药血清最适给药浓度为10%,故本实验后续采用10%浓度高剂量防己黄芪汤含药血清进行实验,见图 2。
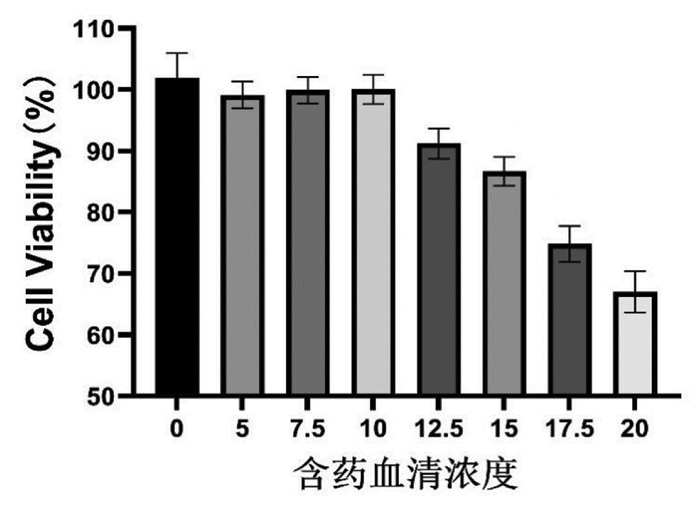
|
| 注:同10%浓度比较,**P<0.01。 图 2 CCK-8筛选含药血清给药浓度结果 Fig. 2 CCK8 screening drug-containing serum administration concentration results |
与oe-NC组比较oe-NKILA组FN、Col1、Vim、α-SMA蛋白表达量,明显呈上调趋势,差异具有统计学意义(P<0.01)。与oe-NKILA组比较,oe-NKILA+AG490组、oe-NKILA+TCM-H组表型蛋白均有明显的下调,差异具有统计学意义(P<0.05)。组间比较,oe-NKILA+AG490组虽然表型指标蛋白变化量下调的趋势较oe-NKILA+TCM-H组更低,但差异无统计学意义(P>0.05)。见图 3。
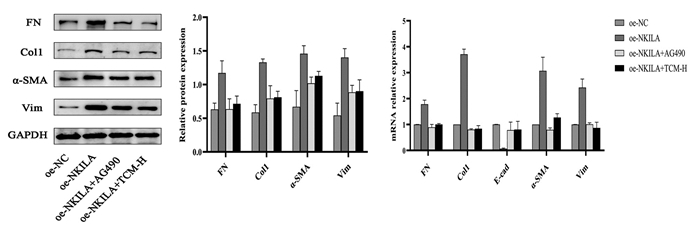
|
| 注:A-B,EMT指标Western Blot检测结果;C,EMT指标qPCR统计结果。n=3。与oe-NC组比较,**P<0.01;与oe-NKILA组比较,#P<0.05,##P<0.01。 图 3 EMT表型指标检测结果 Fig. 3 EMT phenotype index test results |
免疫荧光结果显示,oe-NC组E-cad蛋白沿细胞膜均匀分布,荧光强度均匀;oe-NKILA组中,荧光强度明显减弱,差异具有统计学意义(P<0.01);oe-NKILA+AG490组、oe-NKILA+TCM-H组,E-cad蛋白荧光强度较oe-NKILA组增强,差异具有统计学意义(P<0.01)。组间比较,oe-NKILA+AG490组荧光信号强度虽较oe-NKILA+TCM-H组表达较高,但差异无统计学意义(P>0.05)。见图 4。
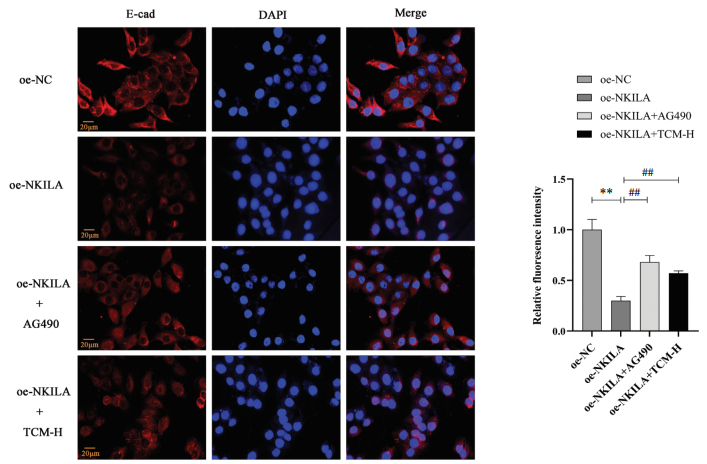
|
| 注:n=3。与oe-NC组比较,**P<0.01;与oe-NKILA组比较,##P<0.01。 图 4 E-cad蛋白细胞免疫荧光检测结果 Fig. 4 Immunofluorescence detection of E-cad protein |
qPCR结果显示,与oe-NC组比较,oe-NKILA组表型指标FN、Col1、Vim、α-SMA的mRNA表达量,均呈上调趋势,E-cad的mRNA表达量呈现明显下调趋势,差异具有统计学意义(P<0.05)。同oe-NKILA组比较,oe-NKILA+AG490组、oe-NKILA+TCM-H组FN、Col1、Vim、α-SMA的mRNA表达量均明显呈下调趋势,E-cad的mRNA表达量明显上调,差异具有统计学意义(P<0.05)。oe-NKILA+AG490组同oe-NKILA+TCM-H组,组间比较各表型指标的mRNA表达量变化未见明显差异,差异无统计学意义(P>0.05)。见表 3。
检测各组NKILA的表达量变化结果显示,与oe-NC组比较,oe-NKILA组NKILA表达量显著上调,差异具有统计学意义(P<0.01);与oe-NKILA组比较,oe-NKILA+AG490组的NKILA表达量显著下调(P<0.01),oe-NKILA+TCM-H组的NKILA表达量,明显下调(P<0.05)。oe-NKILA+AG490组与oe-NKILA+TCM-H组NKILA的mRNA表达量变化比较,差异无统计学意义(P>0.05)。见表 4,图 5。
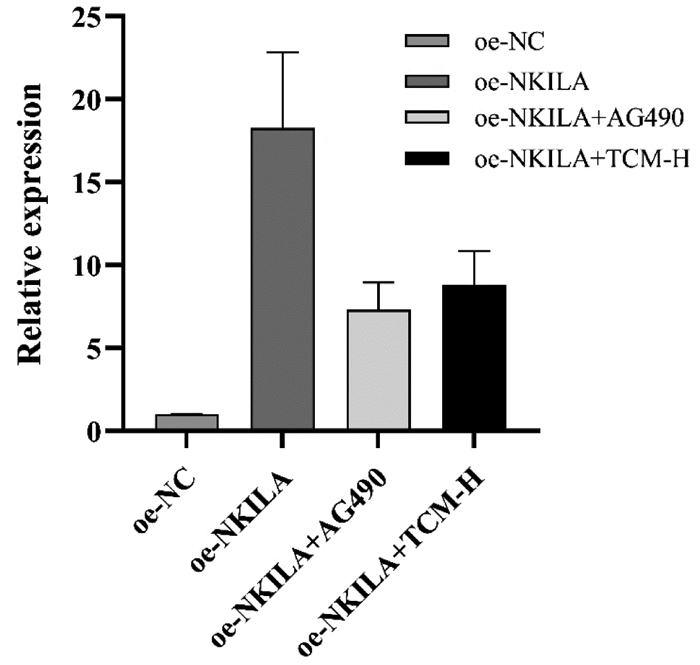
|
| 注:与oe-NC组比较,**P<0.01;与oe-NKILA组比较,#P<0.05,##P<0.01。n=3。 图 5 lncRNA NKILA的qPCR统计结果 Fig. 5 qPCR statistical results of lncRNA NKILA |
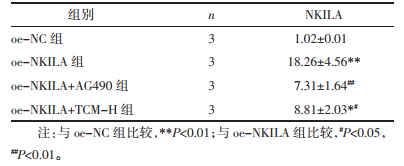
Western Blot检测JAK2/STAT3通路指标变化的结果显示,同oe-NC组相比oe-NKILA组JAK2、STAT3及其磷酸化蛋白表达量明显上调,差异具有统计学意义(P<0.01)。同oe-NKILA组比较,oe-NKILA+AG490组JAK2、STAT3及其磷酸化蛋白表达量显著下调,差异具有统计学意义(P<0.01);oe-NKILA+TCM-H组JAK2、STAT3及其磷酸化蛋白表达量明显下调,差异具有统计学意义(P<0.05)。组间比较,虽然加入AG490抑制剂干预oe-NKILA组对于JAK2、STAT3及其磷酸化蛋白的变化量下调趋势较TCM-H组更低,但差异不具备统计学意义(P>0.05)。见表 5、图 6。
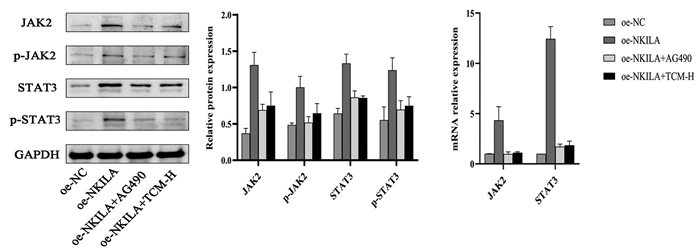
|
| 注:图A和图B,Western Blot检测JAK2/STAT3通路指标变化量结果;图C,qPCR检测结果。n=3。与oe-NC组比较,**P<0.01;与oe-NKILA组比较,#P<0.05,##P<0.01。 图 6 JAK2/STAT3通路指标检测结果 Fig. 6 Detection results of JAK2/STAT3 pathway indicators |
qPCR结果显示,同oe-NC组比较,oe-NKILA组通路指标JAK2、STAT3的mRNA表达量,均显著上调,差异具有统计学意义(P<0.01)。同oe-NKILA组相比,oe-NKILA+AG490组、oe-NKILA+TCM-H组的JAK2、STAT3的mRNA表达量,均显著下调,差异具有统计学意义(P<0.01)。oe-NKILA+AG490组同oe-NKILA+TCM-H组,组间比较JAK2、STAT3达量变化未见明显差异,差异无统计学意义(P>0.05)。
6 讨论肾间质纤维化的组织病理学特征是细胞外基质(ECM)成分沉积、肾小管细胞丢失、成纤维细胞聚集以及肾小管周围微血管系统稀疏[12]。组织损伤后ECM的沉积最初可能有助于组织修复过程,然而在慢性肾脏病(CKD)发生的持续性组织损伤期间,会招募和激活先天性和适应性免疫系统等多种炎性细胞,促使局部组织炎症持续发生,而炎症细胞产生的自由基则诱导EMT,使ECM沉积不受控制,促进肾脏纤维化进程[13-16]。CKD过程中持续进行的纤维化降低了肾组织的修复能力,破坏肾脏结构,减少血液供应并扰乱肾脏功能,最终导致CKD进一步进展为终末期肾病(ESRD)[17-18]。因此,减轻或延缓CKD过程中的肾间质纤维化进程,是现阶段中医药防治肾脏病的主要手段及优势领域。
JAK2/STAT3是一条经典的炎症因子信号通路,以磷酸化为主要的作用方式,可以响应多种细胞因子信号,如IL-6家族、TGF-β1、NF-κB等[19-21]。在CKD过程中,这些炎症细胞因子可以直接激活肌成纤维细胞,或诱导上皮细胞转化为成纤维细胞,从而导致肾脏纤维化的形成[22]。而STAT3一方面可以细胞内快速响应IL-6的刺激,并且作为正调节因子激活TGF-β1及NF-κB诱导的EMT;另一方面,STAT3本身可以作为一种炎症刺激因子,持续刺激肾脏组织的炎症反应,加剧肾脏纤维化进程,造成恶性循环[23-24]。因此,JAK2/STAT3信号通路在肾纤维化进程中,既是启动因素,也是肾间质纤维化信号通路的响应因子,在肾脏EMT环节中起到十分关键的作用。
本研究使用过表达lncRNA NKILA慢病毒转染正常的HK-2细胞后,除表现明显的EMT损伤特征外,JAK2、STAT3蛋白及其磷酸化蛋白的变化量,均明显上调,一定程度上证实了该过程中激活了JAK2/STAT3信号通路。为了进一步明确lncRNA NKILA对JAK2/STAT3信号通路的影响,研究引入了JAK2/STAT3通路的特异性抑制剂AG490作为对照组。AG490是一种剂量依赖性的抑制剂,本研究结合文献资料以及CCK-8结果,选取50 μmol/L浓度干预过表达lncRNA NKILA诱导HK-2细胞纤维化模型24 h,进行JAK2/STAT3信号通路的抑制[25-28]。结果显示,AG490能够减轻过表达lncRNA NKILA诱导HK-2细胞EMT表型损伤、同时抑制JAK2/STAT3信号通路的激活。因此,研究证实lncRNA NKILA过表达造成HK-2细胞EMT损伤的过程中激活了JAK2/STAT3信号通路。
本研究中使用的加味防己黄芪汤是王耀光教授治疗CKD的核心处方,全方由生黄芪30 g,生白术10 g,防己10 g,赤芍10 g,地龙10 g组成。该方从《金匮要略》防己黄芪汤化裁而来,具有益气固表、祛风除湿的功效。方中生黄芪30 g为君,温分肉,实腠理,泻阴火壮脾胃;生白术、防己为臣,白术味苦甘温,健脾益胃,化胃经痰水,理心下急满,利腰脐血结,祛周身湿痹;防己,辛、温,通行十二经,通腠理,利九窍,泻下焦血分湿热,白术、防己配合生黄芪,具有温阳利水之功效。方中加入赤芍、地龙为佐使,赤芍,苦酸微寒,入肝脾血分,安脾肺固腠理,尤能泻肝火、散恶血,利小便,配合白术更能固护脾胃之阴津,行血中之滞;地龙,咸寒,入肝、脾、膀胱经,清热止痉、平肝息风、搜风通络、平喘利水,配合全方行虫蚁搜剔之效,通经活血、祛瘀生新。全方从固表、燥湿、通经、和血4个方面共奏扶正祛邪之效。
王耀光教授认为CKD总属本虚标实之证。其中,“本虚之证,伤于气化、病在水分,其本在肾、其节在脾、其末在肺”。《本经疏证》云“肾者藏精泄浊之总汇”,既概括了中医肾脏的生理功能,即“藏精”与“泄浊”两个方面。中医的肾脏既是周身精气贮藏之所,同时也是体内废物代谢之所,这种认识同现代生理、病理基础相统一。肾间动气为三焦之本是经脉生化之源,其意义在于肾内寄元阳,具有蒸腾阳气的功能,全身津液的运行依赖于阳气的蒸化。《灵枢》云:“五脏皆柔弱者,善病消瘅。”饮入于胃而脾脏虚弱,则输布无力、失于运化;肾脏虚弱则元阳衰惫,生化乏源三焦则无力斡旋,失于蒸腾。《素问·水热穴论》中记载:“肾者,至阴也,至阴者,盛水也。肺者,太阴也,少阴者,冬脉也,故其本在肾,其末在肺,皆积水也。”因此,CKD本虚之证,责之肺脾肾三脏亏虚,其本在肾,肾元衰惫无力气化,以至水无所制,溢渍于下;其节在脾,脾气虚弱输布无力,则水蕴于内化生湿浊、脘腹胀满饮食不下;其末在肺,肺气虚弱宣肃失常,气竭于上、水湿四溢、咳逆喘急。
再则“标实之证,风为贼首、湿热、瘀血夹杂,累及血分”。肾为先天之本,脾为后天之本,脾肾亏虚则周身阳气亏虚,是以“其有不从毫毛生而五脏阳已竭也,津液充郭,其魄独居,孤精于内,气耗于外”。卫外不固,“贼风”趁势而入“使肌肉愤而有疡”。“风者百病之长。”风邪侵袭“善行数变”致病常无定型,其清扬激奋能搏水气于上,致使“一身尽疼”;又或伏于肠胃之间,致使“多寒则肠鸣飧泄”“多热则溏出糜”;亦或传于经脉,令“血气与邪并客于分腠之间”“稽留而不去,息而成积”。因此,在CKD过程之中,风邪为贼首,始于皮肤,可传至经络、伏于脏腑,勾连内外无孔不入。《景岳全书》载:“湿由内生者,以水不化气,阴不从阳而然也,悉由乎脾肾之亏败。”《灵枢·脉度》云:“五脏不和则七窍不通,六腑不和则留结为痈。”在CKD的进程中,本有卫外不固、风邪搅扰,又因脾肾衰惫而致内湿丛生,风湿相合内伤脏腑、外壅经络,致使周身气机壅塞不通,郁而化热,湿热之邪由此而生。“血即精之属也,但精藏于肾,所蕴不多,而血富于冲,所致皆是”“然血化于气而成于阴,阳虚固不能生血”,是以脾肾之虚,不仅累及于气,更伤之于血,“血主营气,不宜损也,而损则为病”。“水病则累血,血病则累气。”水湿日久则易耗气动血。《临证指南医案》记载:“初为气结在经,久则血伤入络。”阴损及阳,则湿、热、瘀血互相胶结,是以气、血、水杂而为病,亦可归为“癥瘕”之属[29-32]。CKD过程中的癥瘕之病,病位多居于肾脏,虽由瘀血而起但时刻处于动态变化之中,《景岳全书》载“病多在血分,血有形而静也”,《血证论》载“瘀血在经络脏腑之间,则结为癥瘕”[33]、“被气火煎熬,则为干血”[34]《金匮要略》中记载“血不利则为水”,瘀血既成,一方面会受机体湿热熏蒸煎熬成干血;另一方面则会进一步阻碍气机运转,正所谓“邪之所凑,其气必虚”,瘀血因素的搅扰会加重气分、水分的病变,造成恶性循环[33]。
因此,肾间质纤维化是CKD过程中贯穿疾病始终的主要病理改变[35-38],其本在于肺、脾、肾3脏元气衰惫,气化失司;其标在于风邪搅扰、湿热、瘀血夹杂,致使气分、水分、血分杂合为病,甚则因虚致瘀而生虚劳干血。
加味防己黄芪汤则是在中医学理论的指导下,综合了CKD过程中肾间质纤维化的病理改变及临床经验,精简而来的核心处方。现代药理研究表明,黄芪的化学成分主要包括萜类化合物、黄酮类化合物和多糖类化合物。黄芪提取物和植物化学成分具有多种药理活性,包括抗氧化、抗炎、抗癌、抗肿瘤、抗惊厥、免疫调节、抗纤维化等活性[39-40]。白术的主要有效成分,白术内酯Ⅲ,能够通过抑制JAK2/STAT3信号通路降低溃疡性结肠炎中的IL-1β、IL-6水平,减轻肠道损伤[41];白术内酯Ⅱ,能够通过PI3K/AKT通路,减轻神经元细胞在氧化应激状态下的细胞自噬及凋亡损伤[42]。赤芍的有效成分为芍药苷,具有广泛的抗炎及免疫调节作用,可通过调控GPCR通路、MAPKs/NF-κB通路、PI3K/Akt/mTOR通路、JAK2/STAT3通路、TGF-β/Smads等,抑制异常激活的细胞亚群和恢复调节细胞亚群来平衡免疫细胞亚群[43]。地龙提取物具有抗菌消炎、促进创伤修复、抗癫痫、抗纤维化的作用[44-45],同时能够通过减弱AP-1/ICAM-1信号通路抑制成纤维细胞的迁移和黏附活动,从而防止腹腔内粘连[46-48]。结合单味药药理研究及课题组前期实验基础,加味防己黄芪汤的组方成分均具有抗炎、抗纤维化、调节免疫等作用,并且高剂量组延缓肾脏肾间质纤维化进程的作用更加明显。
本研究利用加味防己黄芪汤高剂量含药血清干预过表达lncRNA NKILA诱导的HK-2细胞肾间质纤维化模型,通过EMT表型指标的检测,发现其能够下调细胞模型中FN、Col1、Vim、α-SMA蛋白表达,上调E-cad蛋白表达。并且利用qPCR检测了各干预组之间lncRNA NKILA的mRNA相对表达量变化,结果显示AG490干预组能够明显的下调lncRNA NKILA的表达,而高剂量含药血清干预组虽同样能够下调lncRNA NKILA的表达但趋势并不如AG490显著。能够从一定程度上表明,加味防己黄芪汤高剂量含药血清具备在肾间质纤维化过程中下调lncRNA NKILA的能力。进一步检测JAK2/STAT3信号通路指标变化量的结果也表明,加味防己黄芪汤能够抑制由过表达lncRNA NKILA诱导HK-2细胞EMT损伤过程中的JAK2/STAT3信号通路激活,且高剂量含药血清对于JAK2/STAT3信号通路的抑制作用同AG490干预组比较,虽然组间比较不具备统计学差异,但在数值水平上略高剂量含药血清优于AG490干预组。
综上,加味防己黄芪汤高剂量含药血清能够减轻由lncRNA NKILA过表达诱导的HK-2细胞EMT损伤,并且抑制lncRNA NKILA诱导HK-2细胞EMT过程中JAK2/STAT3信号通路的激活。本研究也存在一定的局限性,受限于客观条件的限制,研究仅使用了细胞实验进行了体外验证,并未在体内实验中进行进一步探索;同时对于lncRNA NKILA同JAK2/STAT3信号通路之间,是否具有直接的结合位点没有进行更深入的探索,未来将继续完善实验设计,挖掘更深层次的分子作用机制。
| [1] |
HUMPHREYS B D. Mechanisms of renal fibrosis[J]. Annual Review of Physiology, 2018, 80: 309-326. DOI:10.1146/annurev-physiol-022516-034227 |
| [2] |
LI M T, TANG X H, CAI H, et al. Editorial: Molecular mechanism and therapeutic approach to renal interstitial fibrosis[J]. Frontiers in Medicine, 2022, 9: 879927. DOI:10.3389/fmed.2022.879927 |
| [3] |
HERRERA J, HENKE C A, BITTERMAN P B. Extracellular matrix as a driver of progressive fibrosis[J]. The Journal of Clinical Investigation, 2018, 128(1): 45-53. DOI:10.1172/JCI93557 |
| [4] |
QIAN X Y, ZHAO J Y, YEUNG P Y, et al. Revealing lncRNA structures and interactions by sequencing-based approaches[J]. Trends in Biochemical Sciences, 2019, 44(1): 33-52. DOI:10.1016/j.tibs.2018.09.012 |
| [5] |
HERMAN A B, TSITSIPATIS D, GOROSPE M. Integrated lncRNA function upon genomic and epigenomic regulation[J]. Molecular Cell, 2022, 82(12): 2252-2266. DOI:10.1016/j.molcel.2022.05.027 |
| [6] |
SINGH A, MARTINEZ-YAMOUT M A, WRIGHT P E, et al. Interactions of a long noncoding RNA with domains of NF-κB and IκBα: Implications for the inhibition of non-signal-related phosphorylation[J]. Biochemistry, 2022, 61(5): 367-376. DOI:10.1021/acs.biochem.1c00732 |
| [7] |
YANG X, JIANG Z T, LI Y, et al. Non-coding RNAs regulating epithelial-mesenchymal transition: Research progress in liver disease[J]. Biomedecine & Pharmacotherapie, 2022, 150: 112972. |
| [8] |
GLASGOW A M A, DE SANTI C, GREENE C M. Non-coding RNA in cystic fibrosis[J]. Biochemical Society Transactions, 2018, 46(3): 619-630. DOI:10.1042/BST20170469 |
| [9] |
LV W C, REN Y P, HOU K, et al. Epigenetic modification mechanisms involved in keloid: Current status and prospect[J]. Clinical Epigenetics, 2020, 12(1): 183. DOI:10.1186/s13148-020-00981-8 |
| [10] |
GU Y Y, DOU J Y, HUANG X R, et al. Transforming growth factor-β and long non-coding RNA in renal inflammation and fibrosis[J]. Frontiers in Physiology, 2021, 12: 684236. DOI:10.3389/fphys.2021.684236 |
| [11] |
韩玉, 张婧, 赵晰, 等. 加味防己黄芪汤对UUO大鼠纤维化干预作用及对JAK2/STAT3信号通路影响[J]. 天津中医药大学学报, 2023, 42(2): 197-205. |
| [12] |
LIU Y, BI X J, XIONG J C, et al. MicroRNA-34a promotes renal fibrosis by downregulation of klotho in tubular epithelial cells[J]. Molecular Therapy, 2019, 27(5): 1051-1065. DOI:10.1016/j.ymthe.2019.02.009 |
| [13] |
BÜLOW R D, BOOR P. Extracellular matrix in kidney fibrosis: more than just a scaffold[J]. The Journal of Histochemistry and Cytochemistry, 2019, 67(9): 643-661. DOI:10.1369/0022155419849388 |
| [14] |
SALMINEN A. Increased immunosuppression impairs tissue homeostasis with aging and age-related diseases[J]. Journal of Molecular Medicine, 2021, 99(1): 1-20. DOI:10.1007/s00109-020-01988-7 |
| [15] |
LV J C, ZHANG L X. Prevalence and disease burden of chronic kidney disease[J]. Advances in Experimental Medicine and Biology, 2019, 1165: 3-15. |
| [16] |
MACK M. Inflammation and fibrosis[J]. Matrix Biol, 2018, 68-69: 106-121. DOI:10.1016/j.matbio.2017.11.010 |
| [17] |
HUANG J, ZHENG L L, WANG F, et al. Mangiferin ameliorates placental oxidative stress and activates PI3K/Akt/mTOR pathway in mouse model of preeclampsia[J]. Archives of Pharmacal Research, 2020, 43(2): 233-241. DOI:10.1007/s12272-020-01220-7 |
| [18] |
GBD CHRONIC KIDNEY DISEASE COLLABORATION. Global, regional, and national burden of chronic kidney disease, 1990-2017:A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2020, 395(10225): 709-733. DOI:10.1016/S0140-6736(20)30045-3 |
| [19] |
ALAAELDIN R, ALI F E M, BEKHIT A A, et al. Inhibition of NF-κB/IL-6/JAK2/STAT3 pathway and epithelial-mesenchymal transition in breast cancer cells by azilsartan[J]. Molecules, 2022, 27(22): 7825. DOI:10.3390/molecules27227825 |
| [20] |
DU L, CHEN Y B, SHI J S, et al. Inhibition of S100A8/A9 ameliorates renal interstitial fibrosis in diabetic nephropathy[J]. Metabolism: Clinical and Experimental, 2023, 144: 155376. DOI:10.1016/j.metabol.2022.155376 |
| [21] |
SUN H J, XIONG S P, CAO X, et al. Polysulfideκmediated sulfhydration of SIRT1 prevents diabetic nephropathy by suppressing phosphorylation and acetylation of p65 NFκκB and STAT3[J]. Redox Biology, 2021, 38: 101813. DOI:10.1016/j.redox.2020.101813 |
| [22] |
YOU X L, JIANG X Y, ZHANG C M, et al. Dihydroartemisinin attenuates pulmonary inflammation and fibrosis in rats by suppressing JAK2/STAT3 signaling[J]. Aging, 2022, 14(3): 1110-1127. DOI:10.18632/aging.203874 |
| [23] |
WANG X, DAI C Y, YIN Y F, et al. Blocking the JAK2/STAT3 and ERK pathways suppresses the proliferation of gastrointestinal cancers by inducing apoptosis[J]. Journal of Zhejiang University Science B, 2021, 22(6): 492-503. DOI:10.1631/jzus.B2000842 |
| [24] |
ZHU J, TANG Y, WU Q, et al. HIF-1α facilitates osteocyte-mediated osteoclastogenesis by activating JAK2/STAT3 pathway in vitro[J]. Journal of Cellular Physiology, 2019, 234(11): 21182-21192. DOI:10.1002/jcp.28721 |
| [25] |
ZHU H K, WANG X J, WANG X X, et al. Curcumin attenuates inflammation and cell apoptosis through regulating NF-κB and JAK2/STAT3 signaling pathway against acute kidney injury[J]. Cell Cycle, 2020, 19(15): 1941-1951. DOI:10.1080/15384101.2020.1784599 |
| [26] |
ZHOU Y, SUN Y X, HOU W J, et al. The JAK2/STAT3 pathway inhibitor, AG490, suppresses the abnormal behavior of keloid fibroblasts in vitro[J]. International Journal of Molecular Medicine, 2020, 46(1): 191-200. |
| [27] |
JIN J Y, GUO Q Y, XIE J J, et al. Combination of MEK inhibitor and the JAK2-STAT3 pathway inhibition for the therapy of colon cancer[J]. Pathology Oncology Research, 2019, 25(2): 769-775. DOI:10.1007/s12253-019-00592-6 |
| [28] |
ZHANG Y X, YAN L, LIU G Y, et al. Inhibition of Janus kinase 2 by compound AG490 suppresses the proliferation of MDA-MB-231 cells via up-regulating SARI(suppressor of AP-1, regulated by IFN)[J]. Iranian Journal of Basic Medical Sciences, 2015, 18(6): 599-603. |
| [29] |
韩宜臻, 陶嘉菌, 王珍, 等. 王耀献基于"内热致癥" 病机从三焦辨治糖尿病肾病[J]. 中医学报, 2021, 36(10): 2142-2145. |
| [30] |
李建省, 王英明, 闫燕顺, 等. "肾虚络瘀, 肾络癥瘕" 病机观与肾间质纤维化中自噬不足的相关性[J]. 中国实验方剂学杂志, 2023, 9(2): 186-194. |
| [31] |
王诗尧, 王世东, 傅强, 等. 国医大师吕仁和"微型癥瘕" 病理假说的源流及发展[J]. 中华中医药杂志, 2022, 8(8): 4555-4559. |
| [32] |
陈林, 杨力强. 陈士铎辨治癥瘕学术特色刍议[J]. 国医论坛, 2022, 37(6): 65-67. |
| [33] |
王艳蕾, 颜旭, 杨军辉. 从《血证论》气血水理论谈慢性心力衰竭的中医辨证[J]. 四川中医, 2022, 40(3): 36-39. |
| [34] |
马铭泽, 孟静岩. 试论唐荣川《血证论》痰瘀相关思想[J]. 西部中医药, 2022, 35(3): 61-63. |
| [35] |
冯慧, 蒋雪定. 基于《内经》肾风理论探讨慢性肾脏病从风论治[J]. 浙江中医杂志, 2022, 57(4): 245-246. |
| [36] |
邵建彬, 张玉倩, 刘孟瑞, 等. 赵玉庸运用"通肾络八法" 治疗慢性肾脏病经验[J]. 中医杂志, 2022, 63(8): 714-719. |
| [37] |
王英明, 李建省, 冯月阳, 等. 基于"虚实辨证" 探析慢性肾脏病的治疗[J]. 中医临床研究, 2022, 8(2): 31-34. |
| [38] |
徐飞鹏, 张亚君, 沈沛成, 等. 基于伏邪理论探讨肠-肾轴对慢性肾脏病的影响[J]. 上海中医药杂志, 2022, 56(5): 36-38. |
| [39] |
SU H F, SHAKER S, KUANG Y, et al. Phytochemistry and cardiovascular protective effects of Huang-Qi(Astragali Radix)[J]. Medicinal Research Reviews, 2021, 41(4): 1999-2038. DOI:10.1002/med.21785 |
| [40] |
ABD ELRAHIM ABD ELKADER H T, ESSAWY A E, AL-SHAMI A S. Astragalus species: Phytochemistry, biological actions and molecular mechanisms underlying their potential neuroprotective effects on neurological diseases[J]. Phytochemistry, 2022, 202: 113293. DOI:10.1016/j.phytochem.2022.113293 |
| [41] |
鲁慧东, 李艳梅. 白术内酯Ⅲ通过调节JAK2/STAT3信号通路减轻溃疡性结肠炎模型小鼠肠道损伤[J]. 中国病理生理杂志, 2023, 39(1): 142-149. |
| [42] |
余献文, 戚韵雯, 李智. 白术内酯Ⅱ通过磷脂酰肌醇-3激酶/蛋白激酶B改善氧化应激诱导的神经元细胞损伤[J]. 中国临床药理学杂志, 2023, 39(1): 37-41. |
| [43] |
ZHANG L L, WEI W. Anti-inflammatory and immunoregulatory effects of paeoniflorin and total glucosides of paeony[J]. Pharmacology & Therapeutics, 2020, 207: 107452. |
| [44] |
陈宏, 张伟, 郭建波, 等. 地龙提取物抗肺纤维化的有效成分分析[J]. 中医药信息, 2020, 37(3): 14-16. |
| [45] |
刘巧, 毕启瑞, 谭宁华. 地龙蛋白多肽类成分的研究进展[J]. 中草药, 2019, 50(1): 252-261. |
| [46] |
NGUYEN Q T T, RHEE H, KIM M, et al. Lumbrokinase, a fibrinolytic enzyme, prevents intra-abdominal adhesion by inhibiting the migrative and adhesive activities of fibroblast via attenuation of the AP-1/ICAM-1 signaling pathway[J]. BioMed Research International, 2023, 2023: 4050730. DOI:10.1155/2023/4050730 |
| [47] |
DANARTO R, HERIYANTO D S, RISAN M, et al. Lumbrokinase effects on pro- and anti-apoptotic gene expression in Wistar rats with testicular torsion[J]. Research and Reports in Urology, 2019, 11: 249-254. DOI:10.2147/RRU.S212431 |
| [48] |
YANG W Q, WANG W J, MA Y N, et al. Bioevaluation of Pheretima vulgaris antithrombotic extract, PvQ, and isolation, identification of six novel PvQ-derived fibrinolytic proteases[J]. Molecules, 2021, 26(16): 4946. DOI:10.3390/molecules26164946 |
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
 2024, Vol. 41
2024, Vol. 41