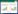文章信息
- 李晓玲, 孙凤霞, 郭雨菲, 等.
- LI Xiaoling, SUN Fengxia, GUO Yufei, et al.
- 基于“气血辨证”理论探讨益气和血方对CCL4诱导的肝硬化大鼠的治疗作用及其对TGF-β1表达的影响
- Discussion on the therapeutic effect of Yiqi Hexue Formula on CCL4-induced cirrhosis and its effect on TGF-β1 expression based on the theory of "qi and blood identification"
- 天津中医药, 2024, 41(12): 1586-1592
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1586-1592
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.17
-
文章历史
- 收稿日期: 2024-06-24
肝硬化是指由于各种慢性肝损伤机制导致的肝细胞变性坏死、肝脏结缔组织增生、弥漫性纤维化、假小叶形成为病理特征的慢性进行性肝病[1]。随着病程进展,晚期常出现腹水、上消化道出血、自发性细菌性腹膜炎、肝性脑病、原发性肝癌等并发症[2]。全球每年约有200万人死于肝病,其中因肝硬化死亡的人数占50%。肝硬化残疾调整寿命年和寿命损失年分别占全球疾病负担的1.6%~2.1%,严重威胁人类的生命与健康[3]。目前研究认为肝硬化主要是由以胶原为主的细胞外基质(ECM)合成大于降解,在肝脏内过度增生和沉积引起的。肝星状细胞(HSCs)是胶原等细胞外基质的主要来源,静息状态的HSCs的活化以及其向肌成纤维样细胞的转化是该过程的核心环节,肌成纤维样细胞的过度增殖合成大量的细胞外基质,形成肝纤维化。转化生长因子-β1(TGF-β1)是促进HSCs活化和增殖的主要细胞因子之一,其可触发细胞内的Smad通路,激活受体型Smad蛋白形成复合物,复合物转入细胞核内,调节靶基因的转录和活化,从而促进HSCs的激活和增殖[4-5]。此外,TGF-β1还可触发non-Smad通路,其可直接作用活化磷酯酰肌醇-3-激酶(PI3K)/蛋白激酶B、c-Jun氨基末端激酶(JNK)和P38丝裂原活化蛋白激酶(P38MAPK)等下游信号通路因子,促进肝硬化的发生发展[4]。目前西药抗纤维化基础研究已经比较深入,但是几乎没有一种能够经过大规模临床验证有效[2, 6]。
肝硬化属于中医药治疗的优势病种之一,归属于中医“积聚”“鼓胀”“胁痛”“黄疸”等病症范畴,气虚血瘀是其关键病机。著名肝病大家关幼波教授认为气虚血滞是肝硬化之本[7]。北京中医医院肝病科长期秉承关幼波教授“气血辨证”的学术思想[8],结合多年的临床经验,采用益气和血、软坚散结法,拟方益气和血基础方,用于肝硬化的治疗,临床疗效显著。前期研究发现:益气和血方联合恩替卡韦片能够改善乙型肝炎病毒(HBV)相关肝硬化患者的中医证候积分,减轻患者肝脏炎症程度、改善肝脏合成储备功能,表现为转氨酶的复常,白蛋白(ALB)、胆碱酯酶(CHE)和凝血酶原活动度(PTA)的上升,提高乙肝失代偿期肝硬化患者的白细胞(WBC)、中性粒细胞(NE)、血小板(PLT)水平,抑制乙肝病毒的复制,降低肝脏弹性值,缩小脾脏大小并降低门静脉宽度,从而延缓肝硬化的进展[9-11]。然而益气和血方治疗肝硬化的作用机制尚未阐明,TGF-β1作为肝硬化发生发展过程中的重要细胞因子之一,益气和血方是否通过调节TGF-β1的表达来达到治疗肝硬化的作用仍未知。本研究拟通过四氯化碳(CCL4)诱导肝硬化大鼠模型,给予益气和血方干预,通过观察大鼠肝功能、肝组织病理改变以及TGF-β1蛋白在肝组织中的表达水平,探讨益气和血方对肝硬化大鼠的治疗作用及机制。
1 材料与方法 1.1 动物SPF级SD雄性大鼠46只,6周龄,体质量(200±10)g,购于北京斯贝福生物技术有限公司[许可证号SCXK(京)2019-0010]。经北京市中医研究所实验动物管理委员会批准(伦理号2021030102),饲养于北京市中医研究所屏障动物房,施行分笼饲养,每笼5只,环境温度18~22 ℃,湿度40%~60%。适应性喂养3 d后开始造模。
1.2 药物益气和血方:生黄芪30 g,当归12 g,白芍15 g,醋鳖甲15 g,醋鸡内金10 g,上述药物由首都医科大学附属北京中医医院药剂科提供。参照《药理实验方法学》[12]中体表面积的折算方法,将以上药物按照成人和大鼠换算系数折算成大鼠的等效剂量为8.610 g/(kg·d)。将所有生药进行混合熬制水提,精炼成约含0.430 5、0.861 0、1.722 2 g/mL的益气和血方煎剂,于4 ℃冰箱保存备用。扶正化瘀胶囊:上海黄海制药有限责任公司生产,货号:211006,规格:每粒装0.3 g,用生理盐水配制成0.047 25 g/mL浓度溶液,存储在4度冰箱中备用。
1.3 试剂及仪器CCL4(货号:C805329,上海麦克林生化科技有限公司);苏木素(货号:C201002,珠海贝索生物技术有限公司);伊红染液(货号:C201201,珠海贝索生物技术有限公司);Masson三色试剂盒(货号:DC0032,北京雷根生物技术有限公司);RIPA总蛋白提取试剂盒(货号:R0278,美国Sigma公司);PMSF(货号:PMSF-RO,美国Sigma公司);蛋白酶抑制剂(货号:11697498001,瑞士Roche公司);磷酸化蛋白酶抑制剂(货号:4906837001,瑞士Roche公司);BCA蛋白定量试剂盒(货号:23227,美国Thermo公司);NuPAGE?誖MOPS SDS Buffer Kit(货号:NP0050,美国Thermo公司);NuPAGE?誖Transfer Buffer(20×,货号:NP0061,美国Thermo公司);山羊抗鼠IgG(H+L)HRP(货号:115035003,美国Jackson公司);β-actin鼠单抗(货号:REK0006,天津锐尔康生物科技有限公司);TGF-β1抗体(货号:346599,美国ZEN BIO公司)。全自动血清生化仪(型号:BS-VET型,深圳迈瑞生物医疗电子股份有限公司);离心机(型号:Centrifuge 5415D,德国EPPendorf公司);酶标仪(型号:MultiSkan3,美国Thermo scientific公司);电泳仪(型号:Mini Ge Tank,美国Thermo scientific公司);转膜仪(型号:Mini Blot Module,美国Thermo scientific公司)。
1.4 动物模型制备造模方法参考相关文献[13-14]并进行改良,从46只大鼠中随机选取8只作为空白组,其余38只造模组大鼠腹腔注射50% CCL4橄榄油溶液2 mL/kg 2周,3 mL/kg 4周,每周2次,空白组大鼠腹腔注射等量橄榄油,每周2次,连续6周。所有大鼠自由饮水和摄食。造模6周后随机选取造模组和空白组各3只大鼠,通过病理检测评估模型,确认造模成功。造模期间模型大鼠死亡10只,死亡率为26.32%,符合实验要求,死亡原因可能与大鼠之间撕咬致死,操作不当等因素相关。最终造模组剩余25只,空白组剩余5只。
1.5 分组与给药将造模组大鼠随机分为5组,分别为模型组、益气和血方低剂量组、中剂量组、高剂量组、扶正化瘀组(阳性药对照组),各5只。益气和血方低、中、高剂量组分别给予生药含量为0.430 5、0.861 0、1.722 2 g/mL的益气和血方煎剂10 mL/kg灌胃,扶正化瘀组给予0.047 25 g/mL的扶正化瘀溶液10 mL/kg灌胃,空白组和模型组给予0.9%的氯化钠溶液10 mL/kg灌胃,每日1次灌胃给药,连续给药4周。
1.6 标本采集在末次大鼠灌胃结束后,给予各组大鼠禁食禁水12 h,2%戊巴比妥钠2.5 mL/kg腹腔注射麻醉大鼠。麻醉后行腹主动脉取血,静置1 h,离心机3 000 r/min,4 ℃,离心15 min,离心半径10 cm,吸取上清液移入EP管中,分组标记,-80 ℃保存。取血后迅速将肝脏取出,生理盐水冲洗,切取1 cm×1 cm×1 cm大小肝右叶,置于4%多聚甲醛固定。余部分肝组织锡纸包裹迅速放于液氮中冷冻,再保存于-80 ℃冰箱中。
1.7 检测指标及检测方法 1.7.1 各组大鼠血清ALT、AST、TBIL、ALP、ALB、CHE含量测定将各组大鼠血清放入全血清自动生化仪中,分析血清中ALT、AST、TBIL、ALP、ALB、CHE的含量。
1.7.2 大鼠肝组织病理学观察取肝组织标本,分别制作石蜡切片进行苏木精-伊红(HE)染色和Masson染色。
1.7.3 Western Blot测定肝组织中TGF-β1蛋白的含量肝组织以100 mg加入900 μL裂解液为基准,匀浆1 min,冰上孵育30 min,4 ℃离心,12 000 r/min,离心半径10 cm,离心5 min,完成后取上清液,分装保存。配制BCA工作液A试剂∶B试剂=50∶1,将25 μL BSA标准品加入对应标椎品孔中,浓度分别为2 000、1 000、500、250、125、62.5、31.3、0 μg/mL,待测样品用磷酸盐缓冲液(PBS)稀释5~10倍后加入对应样品孔中,每孔25 μL,以上所有孔加入250 μL BCA工作液混匀,加盖37 ℃孵育30 min后室温放置2 h,酶标仪570 nm波长下读取OD值,通过标准品浓度和OD值软件计算出蛋白的浓度。样品上样量:每孔10 μL,含20 μg蛋白;选择MES缓冲体系,恒压90 V,约20 min后恒压120 V;湿转法转膜。目的蛋白检测:将膜完全浸没于5%脱脂奶粉-TBS中室温轻摇30 min,膜浸于5%脱脂奶粉-TBS稀释的一抗中,室温孵育30 min,放4 ℃过夜;第2天从4 ℃拿出膜,在室温孵育30 min,TBST洗膜3次,每次5 min,膜浸于5%脱脂奶粉-TBS稀释的二抗中,稀释比例1∶5 000,室温轻摇1~4 h,TBST洗膜3次,每次5 min。内参蛋白检测:用5%脱脂奶粉-TBS稀释抗体,1∶5 000~10 000,室温孵育30 min后放4 ℃过夜或37 ℃孵育2 h,TBST洗膜3次,每次5 min,用5%脱脂奶粉-TBS稀释二抗,山羊抗小鼠IgG(H+L)HRP,1∶5 000,室温轻摇1 h,TBST洗膜3次,每次5 min,ECL均匀滴加到PVDF膜上,后避光反应3~5 min,使用eBlot曝光仪进行曝光,曝光时间为1 s,并通过Image J软件测定条带灰度值。
1.8 统计学处理采用SPSS20.0统计学软件进行统计学分析。各组实验数据计量资料以均数±标准差(x±s)表示,服从正态分布,方差齐者两组数据采用两独立样本t检验,服从正态分布,方差齐者3组以上数据采用单因素方差分析(One-way ANOVA),两两比较采用最小显著差法(LSD),服从正态分布方差不齐者采用Welch ANOVA,采用GraPh Prism8.3.0对数据进行统计,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肝功能结果比较与空白组比较,模型组ALT、AST、TBIL、ALP含量显著升高(P < 0.01),ALB、CHE含量显著降低(P < 0.01)。与模型组比较,益气和血方中高剂量组和扶正化瘀组ALT、AST、TBIL、ALP含量显著降低(P < 0.01),ALB、CHE含量显著升高(P < 0.05,P < 0.01)。与益气和血方低剂量组比较,益气和血方高剂量组ALT、AST、TBIL、ALP含量显著降低(P < 0.01),ALB、CHE含量显著升高(P < 0.01);益气和血方中剂量组ALT、AST、TBIL含量显著降低(P < 0.01),ALB含量显著升高(P < 0.05),ALP、CHE差异无统计学意义(P > 0.05);扶正化瘀组ALT、AST、TBIL、ALP含量显著降低(P < 0.05,P < 0.01),CHE含量显著升高(P < 0.01),ALB差异无统计学意义(P > 0.05)。与扶正化瘀组比较,益气和血方高剂量组ALT、AST含量显著降低(P < 0.05,P < 0.01),ALB含量显著升高(P < 0.01),TBIL、ALP、CHE含量差异无统计学意义(P > 0.05)。见表 1。
|
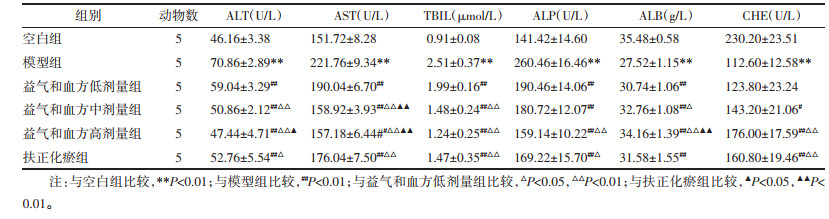
空白组肝细胞索排列整齐,小叶结构完整,无明显炎性细胞浸润。造模组肝小叶结构严重破坏,肝细胞索排列不整齐,可见肝细胞变性坏死,炎性细胞浸润。见图 1。

|
| 注:图A,空白组;图B,造模组。 图 1 造模6周大鼠肝组织HE染色(×100) Fig. 1 HE staining of rat liver tissue at 6 weeks after modeling (×100) |
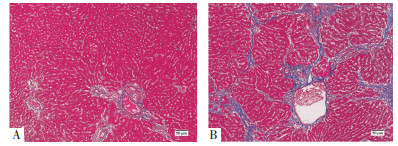
空白组汇管区可见少量纤维组织。造模组可见大量纤维组织,小叶结构紊乱,肝细胞结节性再生,假小叶形成。见图 2。
|
| 注:图A,空白组;图B,造模组。 图 2 造模6周大鼠肝组织Masson染色(×100) Fig. 2 Masson staining of liver tissue in rats after 6 weeks of modeling (×100) |
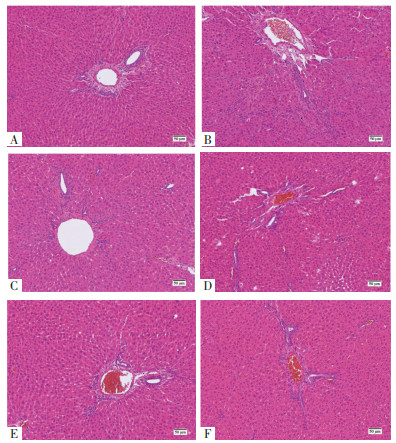
空白组肝小叶结构完整、正常,肝细胞大小排列均匀,无变性、坏死,肝板结构清楚,由中央静脉呈条索状向外放射性分布,汇管区无异常增生。模型组肝小叶正常结构严重破坏,肝细胞排列错乱,可见脂肪变性,汇管区和中央静脉有炎性浸润,肝细胞肿胀,排列不规律,并伴有不同程度的变性坏死和大量纤维组织增生,可见假小叶形成。益气和血方中、高剂量组肝小叶结构基本正常,肝小叶内肝细胞索排列较为整齐,与模型组相比,病变面积明显减少,肝细胞变性、水肿和坏死程度减轻,有少量炎性细胞浸润。益气和血方低剂量组肝细胞排列不整齐,可见部分细胞空泡或脂肪样变,与模型组比较,肝小叶结构破坏程度减轻。扶正化瘀组肝小叶结构基本完整,肝细胞排列不均匀,有部分细胞肿胀变性,与模型组比较,病变区域明显减少。见图 3。
|
| 注:图A,空白组;图B,模型组;图C,益气和血方低剂量组;图D,益气和血方中剂量组;图E,益气和血方高剂量组;图F,扶正化瘀组。 图 3 药物干预4周大鼠肝组织HE染色(×100) Fig. 3 HE staining of liver tissue in rats after 4 weeks of drug intervention (×100) |
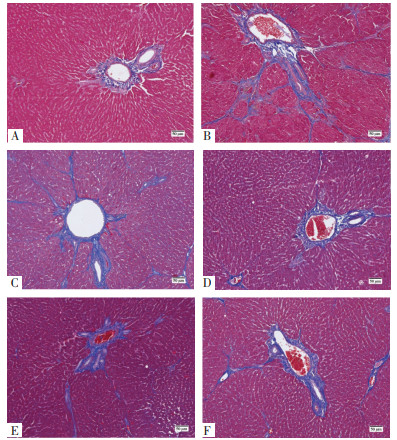
空白组肝小叶内、汇管区和中央静脉周围可见少量纤维组织。模型组汇管区、肝实质内可见大量纤维组织增生和胶原沉积,形成假小叶。益气和血方中、高剂量组肝小叶周围纤维组织明显减少。益气和血方低剂量组部分肝细胞间仍可见一定程度的纤维组织增生。扶正化瘀组肝小叶内和汇管区周围纤维组织相对减少,但仍可见一定数量的纤维组织增生。见图 4。
|
| 注:图A,空白组;图B,模型组;图C,益气和血方低剂量组;图D,益气和血方中剂量组;图E,益气和血方高剂量组;图F,扶正化瘀组。 图 4 药物干预4周大鼠肝组织Masson染色(×100) Fig. 4 Masson staining of liver tissue in rats after 4 weeks of drug intervention (×100) |
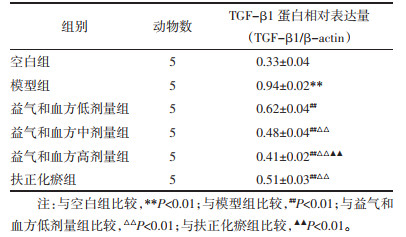
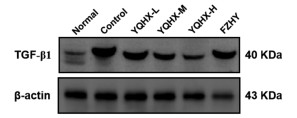
与空白组比较,模型组大鼠肝组织中TGF-β1蛋白水平显著升高(P < 0.01),与模型组比较,益气和血方各剂量组和扶正化瘀组TGF-β1蛋白水平显著降低(P < 0.01),与益气和血方低剂量组比较,扶正化瘀组、益气和血方中高剂量组蛋白水平显著降低(P < 0.01),与扶正化瘀组比较,益气和血方高剂量组蛋白水平显著降低(P < 0.01)。见表 2、图 5。
|
|
| 注:Normal,空白组;Control,模型组;YQHX-L,益气和血方低剂量组;YQHX-M,益气和血方中剂量组;YQHX-H,益气和血方高剂量组;FZHY,扶正化瘀组。 图 5 治疗后各组大鼠肝组织TGF-β1蛋白条带图 Fig. 5 Comparison of TGF-β1 content in liver tissue of rats in each group after treatment |
肝硬化是指由于各种慢性肝损伤机制导致的炎症坏死、肝脏弥漫性纤维化、假小叶形成为特征的病理阶段。近年来诸多研究表明,肝硬化的发病因素主要包括HSCs的激活,细胞信号通路的传导,ECM过度沉积,炎症免疫反应,细胞凋亡和细胞自噬等[15-16]。TGF-β1是生长因子超家族的一员,是肝脏组织发生纤维化过程中起着重要作用的细胞因子。当肝脏受到损伤时,TGF-β池中的TGF-β1生物活性被激活,从而促进肝纤维化的进展。
北京中医医院肝病科创始人著名肝病大家关幼波教授认为慢性肝炎长期反复不愈,湿热毒邪聚集,湿伤脾阳耗气,热灼阴血耗津,湿热相合日渐伤正,致气血两虚;气虚血行滞缓,以致血瘀;湿热生痰,痰瘀互结,阻滞血络而成痞块,疾病性质既有痰血瘀阻的一面,又有气血两亏的一面。关幼波教授重视气血辨证在疾病诊疗中的应用,强调“审证必求因、当在气血寻,辨证明病机、气血为主题,治病必治本、气血要遵循”。关幼波教授认为肝硬化发病以气虚血滞为本,湿热疫毒稽留血分为标。气虚血滞是肝硬化发病中的关键病理环节,贯穿在肝硬化发病的各个阶段。益气和血方是在关幼波教授“气血辨证”学术思想指导下形成的自拟方,药物组成为生黄芪、当归、醋鳖甲、白芍、醋鸡内金,方中生黄芪为君药,可益气健脾,利水消肿,醋鳖甲、当归、白芍为臣药,醋鳖甲可直达肝经,软坚散结加以滋阴,当归可补血活血,散瘀止痛,白芍养血敛阴,柔肝止痛。醋鸡内金为佐药,健脾开胃,消积化瘀。全方共奏益气健脾、养血和血、活血化瘀、软坚散结之功。现代药理研究也表明,黄芪能够抑制HSCs活化途径,降低肝硬化大鼠肝组织内ECM的合成水平,干预CCL4导致的大鼠肝纤维化进程。白术可降低肝损伤小鼠ALT、AST水平,具有显著的体外抗氧化活性,有效地缓解了CCL4诱导的小鼠肝损伤[17]。白芍可提高肝细胞的抗氧化能力,减少氧化应激和炎症反应的发生,具有保肝作用[18],还可通过抑制TGF-β表达,减少胶原纤维合成,从而有效防治放射性肝损伤[19]。鳖甲能够抑制HSCs增殖,清除体内氧自由基,促进肝细胞的修复和再生,具有抗肝硬化、保肝的作用[20-21]。鸡内金可增强功能性消化不良小鼠的胃肠运动,提高胃排空率和小肠推进率[22],还能够提高机体的脂代谢能力,降低其氧化应激水平[23]。益气和血方是否对肝硬化大鼠有改善作用?是否通过调节TGF-β1的表达来起到改善肝硬化气虚血滞这一关键病理环节的作用值得进一步深入研究。
肝硬化动物模型的成功建立是研究肝硬化治疗和机制的先决条件。CCL4是化学性肝硬化诱导剂,目前广泛应用于肝硬化相关动物实验中[24]。本研究在CCL4腹腔注射造模6周时进行模型评定,模型组大鼠部分肝细胞坏死,广泛炎性浸润,肝实质内可见大量纤维增生,肝细胞结节性再生,有纤维间隔生成,假小叶形成,提示肝硬化造模成功,与文献报道一致[25]。
本研究采用益气和血方干预后,不同剂量的益气和血方组和扶正化瘀组大鼠血清AST、ALT、TBI、ALP均有不同程度的下降,ALB、CHE也有不同程度的升高。益气和血方中高剂量组和扶正化瘀组ALT、AST、TBIL、ALP含量显著降低,ALB、CHE含量显著升高。益气和血方高剂量组恢复水平最好,中低剂量依次次之,表明高剂量益气和血方可显著改善肝硬化大鼠肝功能指标,减轻肝细胞损伤程度,提高肝脏代谢和合成功能,对大鼠肝硬化有较好的缓解作用。从肝脏组织病理水平来看,益气和血方可明显改善肝硬化大鼠的病理状态,减轻肝细胞的变性和坏死等病变程度,抑制肝硬化的进展,并且随着剂量的增加大鼠肝组织病理学改善程度越好。因此,从组织病理学的角度证实了益气和血方的抗肝硬化作用。从分子生物学蛋白表达水平来看,益气和血方可下调TGF-β1蛋白的表达,抑制HSCs的激活和ECM合成分泌,并促进其降解,起到抗肝硬化的作用。其中以益气和血方高剂量组干预效果最佳,表明益气和血方高剂量组可有效抑制TGF-β1蛋白表达。推测益气和血方可能通过下调或抑制TGF-β1的激活起到抗肝硬化的作用。研究发现TGF-β家族成员骨形态发生蛋白-2(BMP-2)和BMP-7可抑制TGF-β1的表达水平[26-27]。益气和血方直接抑制TGF-β1蛋白表达,还是通过BMP-2等抑制TGF-β1蛋白表达有待进一步研究,下一步可通过体外实验阻断相关影响因素来验证此结果。
| [1] |
TSOCHATZIS E A, BOSCH J, BURROUGHS A K. Liver cirrhosis[J]. The Lancet, 2014, 383(9930): 1749-1761. DOI:10.1016/S0140-6736(14)60121-5 |
| [2] |
徐小元, 丁惠国, 李文刚, 等. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. |
| [3] |
ASRANI S K, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. Journal of Hepatology, 2019, 70(1): 151-171. DOI:10.1016/j.jhep.2018.09.014 |
| [4] |
陈阳, 任思思, 范妤, 等. TGF-β1在肝纤维化发生发展中作用及机制的研究进展[J]. 山东医药, 2021, 61(28): 110-114. |
| [5] |
陈宵瑜, 杨长青. 肝纤维化发生机制研究新进展[J]. 实用肝脏病杂志, 2016, 19(1): 121-124. |
| [6] |
南月敏, 孔令波. 肝硬化的中西医结合诊治进展[J]. 中华肝脏病杂志, 2018, 26(5): 328-331. |
| [7] |
陈紫梦, 张莹雪, 孙凤霞, 等. 关幼波教授气血辨证学术思想在肝硬化诊疗中的应用[J]. 现代中医临床, 2022, 29(2): 23-26, 42. |
| [8] |
孙宁宁, 吴京京. 瞬时弹性成像及其在中医药治疗慢性肝病疗效评价中的应用[C]//中国民族医药学会肝病分会2018年中医民族医防治肝病学术交流会议. 上海, 2018.
|
| [9] |
李攀, 孙凤霞, 李晓玲, 等. 益气和血方联合恩替卡韦片治疗乙型肝炎病毒相关肝硬化失代偿期气虚血瘀证患者35例临床观察[J]. 中医杂志, 2018, 59(10): 857-860. |
| [10] |
王曼. 益气和血方联合恩替卡韦治疗乙肝肝硬化脾功能亢进的疗效分析[D]. 北京: 北京中医药大学, 2016.
|
| [11] |
李晓玲, 孙凤霞, 徐萌, 等. 益气和血法治疗失代偿期乙型肝炎肝硬化临床疗效的回顾性队列研究[J]. 中华中医药杂志, 2022, 37(8): 4867-4872. |
| [12] |
徐叔云. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002.
|
| [13] |
DONG Z H, LI S, WANG X H, et al. lncRNA GAS5 restrains CCl4-induced hepatic fibrosis by targeting miR-23a through the PTEN/PI3K/Akt signaling pathway[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2019, 316(4): G539-G550. |
| [14] |
YAO Q Y, XU B L, WANG J Y, et al. Inhibition by curcumin of multiple sites of the transforming growth factor-beta1 signalling pathway ameliorates the progression of liver fibrosis induced by carbon tetrachloride in rats[J]. BMC Complementary and Alternative Medicine, 2012, 12: 156. |
| [15] |
秦利静, 张露, 侯鹏, 等. 肝纤维化发病机制的研究进展[J]. 吉林医药学院学报, 2021, 42(5): 369-371. |
| [16] |
郑虹, 肖海, 吴雄健. 肝纤维化的发病机制及治疗的最新进展[J]. 赣南医学院学报, 2019, 39(3): 298-302, 308. |
| [17] |
HAN B, GAO Y, WANG Y L, et al. Protective effect of a polysaccharide from Rhizoma Atractylodis Macrocephalae on acute liver injury in mice[J]. International Journal of Biological Macromolecules, 2016, 87: 85-91. |
| [18] |
李尧, 贾睿, 杜金梁, 等. 白芍提取物对罗非鱼氧化损伤的保护作用[J]. 淡水渔业, 2019, 49(4): 62-68. |
| [19] |
高世乐, 胡宗涛, 董六一, 等. 白芍总苷防治放射性肝损伤形成的临床研究及其作用机制[J]. 中国中药杂志, 2017, 42(7): 1390-1394. |
| [20] |
高建蓉, 张赤志, 邵志华, 等. 鳖甲对肝星状细胞增殖影响的研究[J]. 实用医学杂志, 2007, 23(11): 1618-1620. |
| [21] |
韩秋俊, 徐士勋, 王鹏龙, 等. 鳖甲水提物W-A-80在模拟胃肠液中消化情况分析[J]. 中国实验方剂学杂志, 2013, 19(14): 23-27. |
| [22] |
沈明, 黄小强, 阮美江. 鸡内金对功能性消化不良模型大鼠胃肠功能改善作用[J]. 福建中医药, 2019, 50(4): 35-37. |
| [23] |
蒋长兴, 蒋顶云, 熊清平, 等. 鸡内金多糖对高脂血症大鼠血脂?血液流变学及氧化应激指标的影响[J]. 中药药理与临床, 2012, 28(5): 75-78. |
| [24] |
林文健, 李婕, 郭芬芬, 等. 大鼠肝硬化模型建立探讨[J]. 岭南急诊医学杂志, 2017, 22(4): 310-312. |
| [25] |
TU C T, GUO J S, WANG M, et al. Antifibrotic activity of rofecoxib in vivo is associated with reduced portal hypertension in rats with carbon tetrachloride-induced liver injury[J]. Journal of Gastroenterology and Hepatology, 2007, 22(6): 877-884. |
| [26] |
CHUNG Y H, HUANG Y H, CHU T H, et al. BMP-2 restoration aids in recovery from liver fibrosis by attenuating TGF-β1 signaling[J]. Laboratory Investigation, 2018, 98(8): 999-1013. |
| [27] |
ZHONG L, WANG X L, WANG S L, et al. The anti-fibrotic effect of bone morphogenic protein-7(BMP-7) on liver fibrosis[J]. International Journal of Medical Sciences, 2013, 10(4): 441-450. |
 2024, Vol. 41
2024, Vol. 41