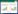文章信息
- 王瑞琪, 庞国明, 李立.
- WANG Ruiqi, PANG Guoming, LI Li.
- 贝母素乙通过调节Gas6/Axl信号通路对糖尿病大鼠心肌纤维化的影响
- Effect of Peiminine B on myocardial fibrosis in diabetes rats by regulating Gas6/Axl signaling pathway
- 天津中医药, 2024, 41(12): 1593-1598
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1593-1598
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.18
-
文章历史
- 收稿日期: 2024-07-12
2. 开封市中医院内分泌科, 开封 475002
糖尿病属于第三大慢性非传染性疾病,且随着人们饮食与生活方式的改变,中国糖尿病患者数量持续增加[1-2]。而持续高糖易引起糖尿病心肌病,主要表现为心肌纤维化,进而导致心脏功能降低、心脏器质性病变,甚至死亡,严重威胁患者生命健康[3]。因此控制血糖、抑制心肌纤维化对于延缓糖尿病引起的心肌病至关重要。贝母素乙提取自贝母的干燥鳞茎,具有降糖降脂、抗炎、抗凋亡、抗癌等多种药用价值,对心肌梗死诱导的心肌损伤和纤维化具有保护作用[4]。生长停滞特异性蛋白6(GAS6)/Axl信号通路参与多种生理病理活动,已知激活GAS6/Axl信号通路可改善衰老相关心脏重塑,减轻心肌纤维化和细胞凋亡[5]。贝母素乙能否通过调控GAS6/Axl信号通路改善糖尿病大鼠心肌纤维化尚未可知。本研究主要通过探究贝母素乙对糖尿病大鼠心肌纤维化及GAS6/Axl信号通路的影响,以期为糖尿病心肌纤维化治疗寻求新途径。
1 材料与方法 1.1 主要材料60只8周龄、体质量190~210 g SPF级雄性SD大鼠购自中国医学科学院医学生物学研究所,生产许可号为SCXK(滇)K2022-0002,本研究已获得动物伦理委员会批准(批号:2300419);贝母素乙(HPLC≥98%,Y10055-LFT)购自北京百奥博莱科技有限公司;乳酸脱氢酶(LDH)、血清肌酸激酶同工酶(CK-MB)酶联免疫吸附实验(ELISA)试剂盒(FY-A014670、FY-A014596)购自上海富雨生物科技有限公司;苏木精-伊红(HE)染色试剂盒(G1120-100)购自北京索莱宝科技公司;Masson染色(G1006)购于武汉塞维尔生物;R428(> 98 %,ab141364)及Gas6、Axl抗体(ab232720、ab215205)购自英国Abcam公司;p-Axl抗体(SAB4504605)购自德国默克集团。
1.2 方法 1.2.1 构建糖尿病大鼠模型先适应性喂养1周,所有48只造模大鼠给予单次腹腔注射55 mg/kg链脲佐菌素,72 h后血糖仪随机测大鼠空腹血糖(FBG),FBG≥16.7 mmol/L表示糖尿病大鼠模型构建成功,随后造模大鼠给予高脂饲料喂养4周,对照组大鼠给予普通饲料喂养[6]。
1.2.2 分组与处理将造模成功大鼠随机分为模型组(DM组)、贝母素乙低、高剂量组(PMI-L、PMI-H组)、贝母素乙高剂量+通路抑制剂R428组(PMI-H+R428组),各12只,另取12只正常大鼠作对照组(Control组);PMI-L、PMI-H组[7]:分别给予10、20 mg/kg贝母素乙灌胃;PMI-H+R428组[8]:给予20 mg/kg贝母素乙灌胃及腹腔注射75 mg/kg R428;Control组与DM组灌胃与PMI-L、PMI-H组等量生理盐水;给药持续4周。
1.2.3 心肌功能检测给药结束,30 mg/kg戊巴比妥钠麻醉并固定大鼠,M型超声心动图连续测量5个心动周期的左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD),计算左室短轴缩短率(LVFS)。
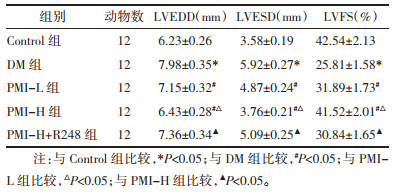
1.2.4 FBG及心肌损伤标志物水平检测心功能检测完毕,30 mg/kg戊巴比妥钠麻醉各组大鼠,腹主动脉取血5 mL,随后处死取心肌组织,冷冻待用。将血液静置后,2 500 r/min离心5 min,离心半径10 cm,取上清液,全自动血液分析仪检测FBG、CK-MB、LDH水平。
1.2.5 心肌组织病理观察取1.2.3收集的各组6个心肌组织,甲醛固定后浸蜡包埋,制成4 μm厚石蜡切片,然后脱蜡水化,HE染色,DAB显色,冲洗干净后,干燥封片,显微镜观察心肌组织切片病理情况。
1.2.6 心肌纤维化观察取1.2.4制备的石蜡切片,常规脱蜡水化,加入Masson染色,冲洗后,加入苯胺蓝染色,水洗后干燥封片,显微镜观察心肌组织切片纤维化程度。
1.2.7 心肌细胞凋亡检测取1.2.4制备的石蜡切片,脱蜡后,加入Triton X-100室温反应,再依次加入TUNEL、DAPI室温孵育,脱水封片,显微镜下观察TUNEL阳性细胞即凋亡细胞,分析心肌组织细胞凋亡情况。
1.2.8 心肌组织胶原蛋白检测取1.2.4制备的石蜡切片,脱蜡后与0.01 mol/L枸橼酸钠溶液反应进行抗原修复,冷却后,加入过氧化氢反应,血清封片,加入胶原蛋白Ⅰ(COLⅠ)、胶原蛋白Ⅲ(COLⅢ)抗体4 ℃过夜孵育,次日加入山羊抗兔二抗室温孵育30 min,再依次与DAB、苏木素反应,脱水封片,荧光显微镜观察染色区域并收集图像,Image软件分析阳性染色区域光密度取均值。
1.2.9 Gas6/Axl信号通路相关蛋白检测将各组剩余6个心肌组织蛋白裂解后,提取总蛋白BCA法定量,再将蛋白变性后40~60 V凝胶电泳4~5 h、200 V湿转膜1~2 h,封闭,然后将膜与兔源Gas6(1∶1 000)、p-Axl(1∶1 000)、Axl(1∶1 000)一抗4 ℃过夜共孵育,洗膜3次后再与山羊抗兔二抗孵育2 h,ECL显影,收集图像并进行条带灰度分析。
1.3 统计学方法采用SPSS 25.0进行统计分析,实验数据符合正态分布,以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05时表示差异有统计学意义。
2 结果 2.1 贝母素乙对糖尿病大鼠心肌功能的影响DM组较Control组LVEDD、LVESD增大,LVFS降低(P < 0.05);PMI-L、PMI-H组较DM组LVEDD、LVESD减小,LVFS升高(P < 0.05);PMI-H+R248组较PMI-H组LVEDD、LVESD增大,LVFS降低(P<0.05)。见表 1。
DM组较Control组FBG、CK-MB、LDH水平升高(P<0.05);PMI-L、PMI-H组较DM组FBG、CK-MB、LDH水平降低(P<0.05);PMI-H+R248组较PMI-H组FBG、CK-MB、LDH水平升高(P<0.05)。见表 2。
|
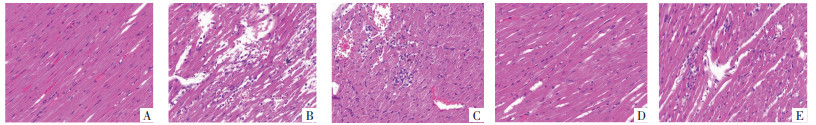
Control组心肌纤维排列整齐,心肌细胞完整有序,无炎性细胞浸润;DM组较Control组心肌纤维断裂,心肌细胞排列紊乱,细胞肥大,细胞核固缩深染,炎性细胞浸润明显,细胞减少,可见纤维化;PMI-L、PMI-H组较DM组心肌纤维排列相对整齐,细胞形态相对正常,炎性细胞浸润减少,细胞增多,纤维化现象减少;PMI-H+R248组较PMI-H组心肌组织病理损伤加重,炎性细胞浸润及心肌组织纤维化明显。见图 1。
|
| 注:图A,Control组;图B,DM组;图C,PMI-L组;图D,PMI-H组;图E,PMI-H+R248组。 图 1 HE染色观察各组大鼠心肌组织病理变化(×200) Fig. 1 Pathological changes of myocardial tissue of rats in each group observed by HE staining (×200) |
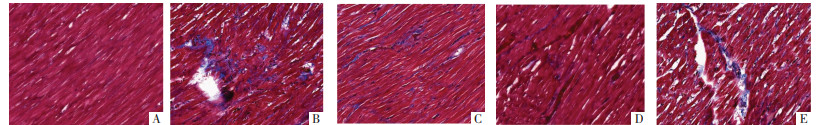
胶原纤维呈蓝色,Control组存在少量胶原纤维;DM组较Control组胶原纤维沉积增多,且排列紊乱,分布弥散;PMI-L、PMI-H组较DM组胶原纤维沉积减少,且排列相对整齐;PMI-H+R248组较PMI-H组胶原纤维沉积明显增多。见图 2。
|
| 注:图A,Control组;图B,DM组;图C,PMI-L组;图D,PMI-H组;图E,PMI-H+R248组。 图 2 Masson染色观察各组大鼠心肌组织胶原纤维化情况(×200) Fig. 2 Masson staining observation of myocardial collagen fibrosis of rats in each group (×200) |
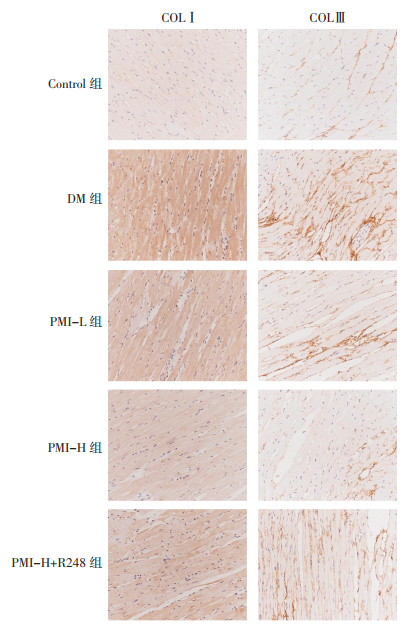
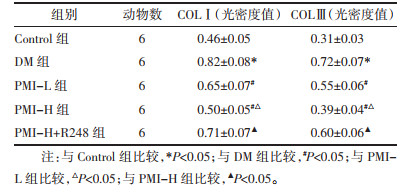
DM组较Control组COLⅠ、COLⅢ表达升高(P<0.05);PMI-L、PMI-H组较DM组COLⅠ、COLⅢ表达降低(P<0.05);PMI-H+R248组较PMI-H组COLⅠ、COLⅢ表达升高(P<0.05)。见图 3、表 3。
|
| 图 3 免疫组化检测各组大鼠心肌组织纤维化相关蛋白表达(×200) Fig. 3 Immunohistochemical detection of fibrosis-related protein expression in myocardial tissue of rats in each group (×200) |
|
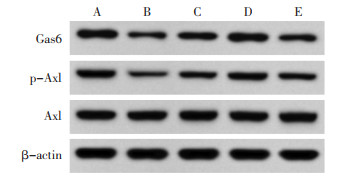
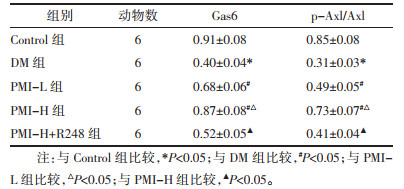
DM组较Control组Gas6、p-Axl/Axl表达降低(P<0.05);PMI-L、PMI-H组较DM组Gas6、p-Axl/Axl表达升高(P<0.05);PMI-H+R248组较PMI-H组Gas6、p-Axl/Axl表达降低(P<0.05)。见图 4、表 4。
|
| 注:A,Control组;B,DM组;C,PMI-L组;D,PMI-H组;E,PMI-H+ R428组。 图 4 Western Blot检测Gas6、p-Axl、Axl表达 Fig. 4 Western Blot analysis of Gas6, p-Axl and Axl expression |
|
糖尿病发病受糖代谢异常、遗传、氧化应激等多因素相互作用影响,加剧病情,诱发心肌纤维化,心肌细胞凋亡,心功能障碍,进而引发心力衰竭甚至死亡。贝母素乙在治疗糖尿病、保护心功能等方面具有重要作用。研究显示,贝母素乙可抑制肾小球系膜氧化应激水平及细胞凋亡,保护糖尿病肾病大鼠肾功能[7];还可以抑制心肌细胞的凋亡,缓解炎症水平,保护柯萨奇B病毒性心肌炎新生小鼠心肌受损,并显著改善其心脏功能[9]。本研究结果显示,贝母素乙可降低血糖,减少胶原纤维沉积及心肌细胞凋亡,保护糖尿病大鼠心肌损伤。
心肌纤维化是糖尿病心肌病主要病理基础,主要是由于胶原纤维过量沉积导致,而COLⅠ、COLⅢ胶原蛋白主要分布在心脏细胞外基质,是造成胶原纤维沉积的主要成分,参与糖尿病心肌病发生发展进程,并发挥重要作用[10]。心肌胶原蛋白的合成与降解处于平衡状态,对于维持心脏结构和功能具有重要作用,而心肌胶原蛋白合成增多会导致胶原纤维沉积,促使心肌纤维化,引发心功能障碍,甚至死亡。研究显示,减少COLⅠ、COLⅢ的合成可以减缓心肌纤维化症状[11]。另外抑制COLⅠ、COLⅢ表达可改善心肌收缩功能障碍及肥厚和损伤,减轻2型糖尿病大鼠心肌纤维化[12]。本研究显示,贝母素乙可抑制COLⅠ、COLⅢ表达,抑制糖尿病大鼠心肌纤维化。
心肌纤维化的最终将会导致心功能障碍,甚至死亡,期间往往伴随着心肌损伤。LVEDD、LVESD、LVFS等心功能相关指标的高低是评价心功能最直接表现方式,LVEDD、LVESD减小,LVFS升高可以改善糖尿病大鼠心功能[13]。另外研究显示,抑制COLⅠ、COLⅢ表达,升高LVFS,可减轻心肌纤维化程度,改善糖尿病心肌病大鼠心功能[14]。CK-MB、LDH是心肌损伤常见标志物,降低CK-MB、LDH水平,可以减轻心肌损伤,减少心肌细胞凋亡,减少心肌胶原纤维,保护糖尿病大鼠[15]。研究显示,降低CK-MB、LDH水平,抑制COLⅠ、COLⅢ表达,可减轻2型糖尿病大鼠心肌纤维化,发挥保护心脏作用[16]。本研究结果显示,贝母素乙治疗大鼠后,大鼠心功能指标明显改善,提示贝母素乙可改善糖尿病大鼠心功能。
GAS6/Axl信号通路参与调控细胞增殖、凋亡、趋化、免疫调节等多种细胞功能,还有降血糖、保护心肌等作用。已知GAS6属于维生素K依赖性蛋白家族成员,单跨膜蛋白Axl属于TAM(Tyro3、Axl和Mertk)受体酪氨酸激酶家族,GAS6可通过与其位于细胞膜表面的受体Axl结合,激活AXL,进而调控多种通路,抑制胶原合成及心肌细胞凋亡等进程,维持体内的稳定,发挥心肌保护的作用。研究显示,上调GAS6表达可以降低2型糖尿病小鼠的高血糖,维持体内葡萄糖稳态[17]。Axl的表达水平与心肌纤维化过程密切相关,上调Axl表达可降低心肌纤维化细胞的活力,抑制细胞增殖,进而改善心肌纤维化,延缓心肌重构[18-19]。激活GAS6/Axl信号通路可抑制心肌氧化应激、炎症反应、细胞凋亡和线粒体功能障碍,减轻心肌组织损伤,发挥心肌保护作用[20-21]。本研究结果显示,贝母素乙可上调Gas6、p-Axl/Axl表达,推测其可能激活GAS6/Axl信号通路抑制糖尿病大鼠心肌纤维化,另外对糖尿病大鼠进行通路抑制剂R248处理,发现R248可逆转贝母素乙对DM大鼠心肌纤维化的改善作用,说明贝母素乙可通过激活GAS6/Axl信号通路抑制糖尿病大鼠心肌纤维化。
综上所述,贝母素乙可抑制糖尿病大鼠心肌纤维化,其作用机制与激活GAS6/Axl信号通路有关。本研究仍存在不足之处,贝母素乙参与糖尿病、心肌损伤等进程的GAS6/Axl信号通路,对糖尿病引起的心肌纤维化具体作用机制尚不清晰,另外本研究初次探讨贝母素乙对糖尿病引起的心肌纤维化的影响,其中间的调控机制尚不清楚,可能通过调控多条通路影响糖尿病大鼠心肌纤维化,其具体作用机制还需进一步探究。
| [1] |
中华医学会糖尿病分会. 中国2型糖尿病防治指南(2020年版)(上)[J]. 中国实用内科杂志, 2021, 41(8): 668-695. |
| [2] |
牟严艳, 叶中慧, 林梅珍, 等. 糖尿病流行病学研究进展[J]. 糖尿病新世界, 2019, 22(4): 196-198. |
| [3] |
高嘉梦, 胡兵, 申锷. 心肌成纤维细胞转分化与糖尿病心肌病的研究进展[J]. 中华心血管病杂志, 2020, 48(10): 885-889. DOI:10.3760/cma.j.cn112148-20191027-00659 |
| [4] |
CHEN P, ZHOU D M, LIU Y S, et al. Peiminine inhibits myocardial injury and fibrosis after myocardial infarction in rats by regulating mitogen-activated protein kinase pathway[J]. The Korean Journal of Physiology & Pharmacology, 2022, 26(2): 87-94. |
| [5] |
CHEN F F, SONG F Q, CHEN Y Q, et al. Exogenous testosterone alleviates cardiac fibrosis and apoptosis via Gas6/Axl pathway in the senescent mice[J]. Experimental Gerontology, 2019, 119: 128-137. DOI:10.1016/j.exger.2019.01.029 |
| [6] |
汪四海, 方朝晖, 赵进东, 等. 丹蛭降糖胶囊通过上调Nrf2/HO-1信号通路减轻糖尿病心肌病大鼠心肌纤维化[J]. 中国老年学杂志, 2023, 43(10): 2457-2463. DOI:10.3969/j.issn.1005-9202.2023.10.044 |
| [7] |
郑海燕, 王建元, 徐晓琴, 等. 贝母素乙对糖尿病肾病大鼠肾功能保护的作用机制[J]. 医学分子生物学杂志, 2019, 16(5): 460-466. DOI:10.3870/j.issn.1672-8009.2019.05.009 |
| [8] |
HIRSCHI K M, TSAI K Y F, DAVIS T, et al. Growth arrest-specific protein-6/AXL signaling induces preeclampsia in rats[J]. Biology of Reproduction, 2020, 102(1): 199-210. |
| [9] |
黄亚萍, 肖惠玲, 李艳红, 等. 贝母素乙抑制MEK/ERK的磷酸化对新生小鼠柯萨奇B病毒性心肌炎心肌细胞凋亡和炎症水平的影响[J]. 中药药理与临床, 2020, 36(1): 94-99. |
| [10] |
SALVADOR D B J, GAMBA M R, GONZALEZ-JARAMILLO N, et al. Diabetes and myocardial fibrosis: a systematic review and meta-analysis[J]. JACC Cardiovascular Imaging, 2022, 15(5): 796-808. DOI:10.1016/j.jcmg.2021.12.008 |
| [11] |
WEI T W, DU Y Q, SHAN T K, et al. The crystallin alpha B (HSPB5)-tripartite motif containing 33(TRIM33) axis mediates myocardial fibrosis induced by angiotensinogen Ⅱ through transforming growth factor-β(TGF-β1)-Smad3/4 signaling[J]. Bioengineered, 2022, 13(4): 8836-8849. DOI:10.1080/21655979.2022.2054913 |
| [12] |
JIA Q, YANG R, MEHMOOD S, et al. Epigallocatechin-3-gallate attenuates myocardial fibrosis in diabetic rats by activating autophagy[J]. Experimental Biology and Medicine, 2022, 247(17): 1591-1600. DOI:10.1177/15353702221110646 |
| [13] |
吕朝阳, 杨营军, 敖文, 等. 高良姜素抑制IRAK-1/MAPK/NF-κB信号通路对糖尿病大鼠心肌损伤的影响[J]. 天津中医药, 2022, 39(11): 1476-1482. |
| [14] |
梁浩, 张娜, 赵乐, 等. MiR-92a通过调控TGF-β1/Smads通路对心房颤动心肌纤维化的影响[J]. 中国老年学杂志, 2023, 43(16): 4015-4021. |
| [15] |
李丽静, 刘峻玮, 周凯旋, 等. 参麦方通过PI3K/AKT通路改善糖尿病心肌损伤的作用研究[J]. 时珍国医国药, 2023, 34(4): 790-792. |
| [16] |
姜欣, 王智, 王娟. 金雀异黄素通过调控TGF-β1/Smad3信号通路对2型糖尿病大鼠心肌纤维化的影响[J]. 中成药, 2024, 46(2): 444-450. |
| [17] |
DIHINGIA A, OZAH D, BORAH T, et al. Gamma-glutamyl-carboxylated Gas6 mediates positive role of vitamin K on lowering hyperglycemia in type 2 diabetes[J]. Annals of the New York Academy of Sciences, 2020, 1462(1): 104-117. |
| [18] |
舒锦, 汪海娅, 金立. 基质金属蛋白酶3对大鼠心肌纤维化细胞活力的影响[J]. 老年医学与保健, 2020, 26(3): 476-479, 492. |
| [19] |
刘存飞, 杨群芳, 符江琳, 等. 高糖通过上调Axl受体表达促进心肌成纤维细胞增殖[J]. 医学研究杂志, 2011, 40(9): 110-113. |
| [20] |
LEI W R, XU X Z, LI N, et al. Isopropyl 3-(3, 4-dihydroxyphenyl) 2-hydroxypropanoate protects septic myocardial injury via regulating GAS6/Axl-AMPK signaling pathway[J]. Biochemical Pharmacology, 2024, 221: 116035. |
| [21] |
JI T, LIU Q, YU L M, et al. GAS6 attenuates sepsis-induced cardiac dysfunction through NLRP3 inflammasome-dependent mechanism[J]. Free Radical Biology and Medicine, 2024, 210: 195-211. |
2. Department of Endocrinology, Kaifeng Hospital of Traditional Chinese Medicine, Kaifeng 475002, China
 2024, Vol. 41
2024, Vol. 41