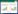文章信息
- 郭晓彤, 宋俊丽, 韦秋, 等.
- GUO Xiaotong, SONG Junli, WEI Qiu, et al.
- 菟丝子丸调控BMP2/RUNX2信号通路抗绝经后骨质疏松研究
- Study on the regulation of BMP2/RUNX2 signaling pathway by Cuscuizi Pills in the treatment of postmenopausal osteoporosis
- 天津中医药, 2024, 41(12): 1599-1604
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1599-1604
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.19
-
文章历史
- 收稿日期: 2024-07-10
骨质疏松症(OP)是一种以骨量减少、骨微结构破坏导致骨脆性增加、骨折风险增加为特征的全身性骨病,分为原发性与继发性[1]。骨质疏松症的发病率随人年龄的增大而逐渐升高,随着人口老龄化进程的加速,其在全球范围内呈上升趋势,严重影响着中老年人的身心健康[2]。2018年,国家卫生健康委员会进行了首个基于社区人群的大规模中国居民骨质疏松症流行病学调查,调查结果显示,骨质疏松症已成为困扰中国50岁以上中老年人身体健康与生活质量的重要问题,尤其是对绝经后女性[3]。绝经后骨质疏松症(PMOP)是原发性骨质疏松症的一种,病因与雌激素缺乏相关[4],多发生于妇女绝经后的5~10年间[5]。目前绝经后骨质疏松临床常用药物及疗法有双磷酸盐、雌激素替代疗法、选择性雌激素受体调节剂及钙剂等。但临床长期使用后出现诸多不良反应或疗效不佳的问题。如抗骨质疏松首选双磷酸盐类药物虽然具有良好的抗骨质疏松作用,但长期应用反而降低骨量且伴有下颌骨坏死、肾毒性及急性过敏等不良反应[6];长期使用雌激素替代治疗会增加患冠心病、中风、子宫癌及乳腺癌的风险[7]。因此研发安全、有效防治绝经后骨质疏松的药物刻不容缓。
菟丝子丸,别名二妙丸,包含菟丝子、牛膝两味中药,出自《证类本草》,具有壮真元的功效。菟丝子味辛、甘,性平,以补益肝肾,固精缩尿为主要功效。牛膝味甘、微苦,性平,以逐瘀通经,补肝肾,强筋骨,利尿通淋为主要功效。已有研究表明,菟丝子提取物增加去势小鼠股骨骨密度(BMD),改善骨微结构,显著增加骨保护素(OPG)水平[8]。也有研究显示,菟丝子黄酮通过调控Wnt/β-catenin通路抑制破骨细胞的分化,改善骨代谢[9]。同时,牛膝多糖通过激活Wnt/β-catenin通路,促进下游RUNT相关转录因子2(RUNX2)蛋白表达,发挥PMOP保护作用[10]。两者药效相合,若联合用药,其对PMOP可能具有协同治疗作用。且菟丝子丸主治腰膝积冷,酸疼或麻无力,这也与临床上骨质疏松症状相符合,但文献上却鲜少有关菟丝子丸抗PMOP的报道。因此,本研究通过建立绝经后骨质疏松小鼠模型,研究菟丝子、牛膝及其复方菟丝子丸对去势小鼠PMOP的影响,以期明确菟丝子丸抗PMOP作用及其机制。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级C57BL/6J雌性小鼠60只,8周龄,体质量(20±1.5)g,购于北京维通利华实验动物技术有限公司,于天津放射医学研究所饲养,通过动物实验伦理会批准,审批号:TCM-LAEC2022231。动物房室温控制在(23±3)℃,相对湿度为55%~64%,光暗交替12 h/d,标准饲料喂养,自由饮水。
1.1.2 实验仪器电子分析天平(美国华志公司),Viva CT骨密度测量仪(瑞士SCANCO MicroCT公司),小鼠骨骼强度测定仪(济南益延科技发展有限公司),双能X射线骨密度仪(美国Faxitron Bioptics公司),小型台式离心机(美国Beckman公司),微量多功能读板机(瑞士TECAN公司),涡旋混合器(美国Labnet公司),蛋白电泳转印系统(美国Bio-Rad公司),快速湿转仪(美国GenScript公司),-80 ℃冰箱(日本Sanyo公司)。
1.1.3 实验试剂及药品菟丝子与牛膝饮片购置于天津同仁堂,三溴乙醇购自美国Sigma公司,青霉素钠购自中国石药集团,结合性雌激素片购自新疆新姿源生物制药有限公司,Estradiol ELISA检测试剂盒由美国R&D Systems公司提供,碱性磷酸酶(ALP)采购于上海碧云天生物有限公司,75%乙醇购自天津市康科德科技有限公司,磷酸盐缓冲液(PBS)购自武汉赛维尔生物科技有限公司,RUNX2、OPG、骨成型蛋白2(BMP2)及β-肌动蛋白(β-actin)一抗购于美国Abcam公司等。
1.2 实验方法 1.2.1 绝经后骨质疏松症小鼠模型的建立将购买的8周龄C57BL/6J小鼠适应性饲养两周后,按体质量随机分为假手术组(Sham组),模型组(OVX组),雌激素39 μg/kg组(Estrogen组),菟丝子4 g/kg组(T 4 g/kg组),牛膝4 g/kg组(N 4 g/kg组),菟丝子丸8 g/kg组(CP 8 g/kg组),每组10只。提前1 d将全部小鼠备皮,即剃掉小鼠背部两侧毛发,手术时采用三溴乙醇对小鼠进行麻醉,除Sham组仅摘除卵巢周围相同大小的脂肪组织,其余组均按双侧卵巢摘除法(OVX)用眼科剪将小鼠腹部两侧卵巢全部切除,随后缝合肌肉与皮肤。手术后连续腹腔注射青霉素钠(每只0.1 mL,2×105 U/mL)3 d以防止细菌感染。
1.2.2 药品配置及给药中药菟丝子、牛膝饮片购置于天津同仁堂。称取菟丝子1 000 g,加5、4、3倍量80%乙醇回流提取3次,第1次2 h,第2次1.5 h,第3次1 h,合并滤液。取适量微孔滤膜过滤,旋蒸掉多余水分和乙醇,即得菟丝子浸膏。牛膝提取方法同上,菟丝子浸膏得率为9.4%,牛膝浸膏得率为45%。根据临床用药剂量换算后菟丝子和牛膝取生药给药量4 g/kg。分别按其浸膏得率换算后,用0.2% CMC-Na溶液配置混匀,现配现用。菟丝子丸剂量组(CP 8 g/kg)为菟丝子与牛膝1∶1配伍混匀使用。雌激素片在治疗骨质疏松症时临床给药剂量为每日3 mg,换算后小鼠给药剂量为39 μg/kg,同样使用0.2% CMC-Na溶液配置,放于4 ℃冰箱保存,灌胃给药前从冰箱取出放至常温后使用。Sham组和OVX组每天给予0.2% CMC-Na灌胃,共给药12周。每周称量各组小鼠体质量1次。
1.2.3 小鼠股骨BMD检测采用双能X射线骨密度仪对小鼠股骨骨密度进行检测。将三溴乙烷注射麻醉后的小鼠平铺在载物板上,打开Faxitron Vision软件等机器自动校准后启动X线,进行扫描成像。扫描完成后选中两侧股骨进行骨密度检测。
1.2.4 小鼠胫骨骨骼强度检测在取材时用剪刀与纱布剥离小鼠右侧胫骨上粘连的组织与肌肉,使用YLS-16A小动物骨骼强度测定仪测定其骨强度。
1.2.5 小鼠股骨骨微结构的检测股骨用PBS浸湿的纱布包好,放置于ViVa CT 40骨密度测量仪的进样器内,进行小鼠股骨远端骨微结构的检测。扫描完成对图片进行分析处理,计算骨体积分数(BV/TV)、骨表面积组织体积比(BS/TV)等指标,并对股骨扫描结果进行3D建模处理。
1.2.6 小鼠股骨石蜡切片制备及HE染色将小鼠股骨用快速脱钙液进行脱钙,脱钙后脱水,石蜡包埋后放入冰箱-20 ℃过夜,第2天进行切片,60 ℃烤片2 h后用二甲苯、梯度乙醇进行切片脱蜡,蒸馏水冲洗2 min,滴加苏木精,染色20 min,蒸馏水洗20 min。滴加盐酸乙醇分化2~3 s,蒸馏水洗至组织呈蓝紫色。滴加伊红,染色2 min。蒸馏水数秒冲洗后,用中性树脂封片。封片后的玻片置于显微镜下观察拍照。
1.2.7 小鼠血浆ALP、骨特异性碱性磷酸酶(BALP)、OPG的检测给药结束后取材时摘眼球取血,4 ℃、3 500 r/min,离心15 min分离血浆,离心半径10 cm。提前取出试剂盒恢复至室温,配置好洗涤液、标准品、抗体工作液、酶结合物工作液等,严格按照试剂盒说明书操作,检测小鼠血浆ALP、BALP、OPG含量。
1.2.8 蛋白免疫印迹(Western Blot)法检测骨髓中RUNX2、OPG及BMP2蛋白的表达取出股骨、胫骨置于冰上,PBS预冷,用1 mL注射器吸取预冷的PBS吹骨髓腔,将骨髓吹出。细胞悬液置于15 mL离心管中,4 ℃,14 000 r/min,离心15 min,离心半径10 cm,弃上清液。向沉淀中加入蛋白裂解液,震荡1 min,冰上静置15 min后于4 ℃,14 000 r/min,离心15 min,离心半径10 cm,其上清液即为骨髓总蛋白提取液。随后按BCA蛋白定量试剂盒进行定量。SDS-PAGE电泳分离蛋白、转膜、封闭,加入RUNX2、OPG、BMP2和β-actin(均1∶1 000)抗体4 ℃孵育过夜,第2天洗膜、敷二抗2 h,再洗膜后显影,使用Image J软件进行定量分析。
1.3 统计学方法采用SPSS 22.0分析软件对数据进行统计分析,计量资料数据均采用均数±标准差(x±s)表示,多组定量资料采用单因素方差分析(One-way AVOVA),符合方差性齐检验时,两两比较采用LSD检验,P<0.05表示差异具有统计学意义。
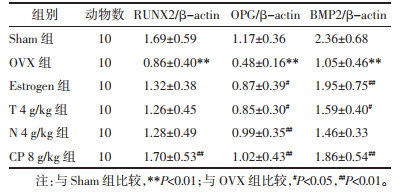
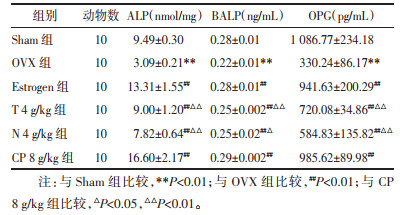
2 实验结果 2.1 菟丝子丸对去势小鼠BMD、骨强度的影响与Sham组比较,OVX组小鼠的股骨BMD、胫骨骨强度均显著降低(P<0.01)。与OVX组比较,Estrogen组与CP 8 g/kg组均能显著提高去势小鼠的BMD(P<0.01),CP 8 g/kg组也显著增加其胫骨骨强度(P<0.01)。同时,牛膝、菟丝子单独给药对去势小鼠的BMD与胫骨骨强度作用不明显。与菟丝子、牛膝单独给药比较,CP 8 g/kg给药对去势小鼠骨密度、骨强度的治疗效果更为显著(P<0.05)。见表 1。
|
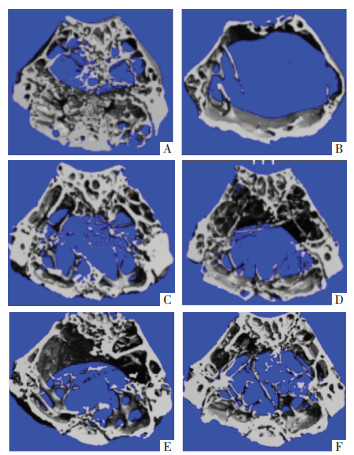
OVX组小鼠相较于Sham组骨骼结构稀疏,大面积无骨小梁区域,Estrogen与CP 8 g/kg给药后明显改善小鼠骨微结构。对图片进行分析处理,计算各组小鼠BV/TV、BS/TV水平,结果如表 2所示。与Sham组比较,去势后小鼠BV/TV、BS/TV水平显著降低(P<0.01);与OVX组比较,Estrogen组与CP 8 g/kg组均能显著增加去势小鼠的BV/TV与BS/TV(P<0.01),T 4 g/kg组显著增加了去势小鼠BV/TV(P<0.05),N 4 g/kg组显著升高去势小鼠的BS/TV(P<0.01);且与菟丝子、牛膝单独给药比较,CP 8 g/kg给药对去势小鼠骨微结构的治疗效果更为明显(P<0.05)。以上结果表明,菟丝子丸能显著改善去势所致的骨微结构损伤且其功效优于菟丝子、牛膝单独给药。见图 1。

|
|
| 注:图A,Sham组;图B,OVX组;图C,Estrogen组;图D,T 4 g/kg组;图E,N 4 g/kg组;图F,CP8 g/kg组。 图 1 各组小鼠股骨骨微结构变化 Fig. 1 Changes in femoral bone microstructure in mice in each group |
HE染色结果显示,与Sham组小鼠比较,OVX小鼠模型组骨微结构破坏,骨小梁稀疏,骨髓减少。CP 8 g/kg组能明显看到骨髓增加,骨微结构改善,其骨组织受损程度得到了一定程度的减轻,且作用明显优于T 4 g/kg与N 4 g/kg组。见图 2。
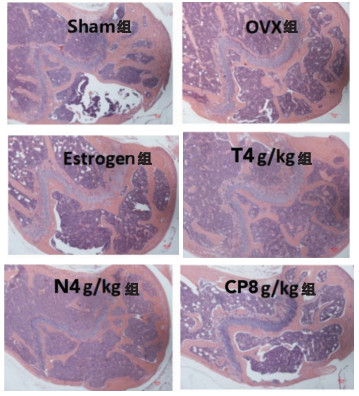
|
| 图 2 各组小鼠股骨HE染色形态图 Fig. 2 HE staining pattern of femoral bone in each group |
与Sham组比较,去势后小鼠血浆中ALP、BALP、OPG水平显著降低(P<0.01),Estrogen、牛膝、菟丝子及菟丝子丸给药均能显著提高去势后小鼠的ALP、BALP、OPG水平(P<0.01),相比于菟丝子与牛膝单独给药,菟丝子丸给药后去势小鼠血浆中ALP、BALP、OPG水平显著升高(P<0.05)。见表 3。
|
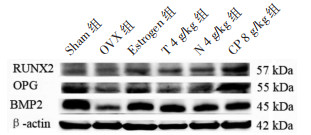
Western Blot检测结果显示,与Sham组小鼠比较,OVX组小鼠骨髓中OPG、RUNX2、BMP2蛋白表达显著降低(P<0.01);与OVX组比较,CP 8 g/kg给药显著增加了去势小鼠OPG、RUNX2、BMP2蛋白表达(P<0.01);与菟丝子、牛膝单独给药比较,菟丝子丸给药虽有增加OPG、RUNX2、BMP2蛋白表达的趋势,但差异无统计学意义(P>0.05)。见图 3、表 4。
|
| 图 3 各组RUNX2、OPG、BMP2、β-actin的蛋白表达 Fig. 3 Relative protein expression of RUNX2, OPG, BMP2 and β-actin in each group |
骨质疏松症是1种与年龄增加而密切相关的全身代谢性骨骼疾病,多发生于中老年人[11]。据1项2018年的调查报告显示,50岁以上骨质疏松症女性患者比例高达32.1%,而男性患者仅为6.0%,差距之大可见一斑。由此发现,骨质疏松症已成为困扰中国中老年女性生活质量的重要健康问题。
健康的骨骼处于持续的重建过程,即骨吸收与骨形成的动态平衡[12]。破骨细胞负责骨的分解吸收,而成骨细胞则生成新的骨[13]。有研究证明,雌激素参与成骨细胞促进骨形成[14]。因此,女性绝经后产生的内源性雌激素水平显著下降,很有可能是PMOP形成的重要原因之一。中药治疗PMOP具有多成分、多靶点、不良反应少等优势,大量的中草药及复方被报道在治疗PMOP上表现出了良好的疗效[15-16]。研究显示,葛根中的葛根素通过调控Wnt4/β-catenin通路,促进Wnt4的表达来抑制破骨细胞的增值与分化,从而达到抗POMP的目的[17]。金匮肾气丸通过调控BMP/Smad信号通路改善去势大鼠骨微结构,提高骨密度,提高血清中的OPG含量,改善骨质疏松[18];续苓健骨方通过调节白介素-17(IL-17)信号通路抑制破骨细胞的分化,改善骨代谢,缓解绝经后骨质疏松症患者的中医临床症状[19]等。
本研究结果显示,菟丝子丸给药后,OVX小鼠的骨组织的损伤得以减轻,其胫骨骨强度、股骨BMD增加,骨微结构改善,证实了其抗PMOP作用。同时,从本次研究结果也可以看出,菟丝子丸给药的抗PMOP作用显著优于菟丝子、牛膝单独给药。
由于人体中持续存在的骨骼重建过程,破骨细胞与成骨细胞处于一种动态平衡,一旦这种平衡被打破,人体则会出现骨骼疾病。OPG是破骨细胞分化因子(RANKL)的诱导受体,其能抑制破骨细胞的产生,促进破骨细胞的凋亡,促进骨形成[20]。本团队研究显示,菟丝子丸给药后显著逆转了OVX小鼠血浆、骨组织中OPG水平及蛋白表达的下降,促进了骨形成。RUNX2是转录因子RUNX家族中的一员,参与成骨细胞分化与骨骼形态发生过程[21],通过本实验,发现菟丝子丸可以诱导OVX小鼠骨髓组织中的RUNX2高表达,激活成骨细胞分化。BMP2是一种骨形态发生蛋白,在骨的修复重建中发挥着重要的作用,其促进成骨细胞分化成熟,改善骨代谢,并且参与骨的残缺修复[22]。在本实验中,OVX组小鼠组织中,BMP2表达显著下降,在给予菟丝子丸后,其表达得到了显著增加。
随着老龄化社会的来临,中国绝经期女性骨质疏松的防治形势亦日趋严峻,因此安全有效的绝经期骨质疏松防治药物研发刻不容缓。本研究结果显示,菟丝子丸醇提物具有抗PMOP的作用,其作用高于菟丝子、牛膝单独给药。菟丝子丸能够增加OVX小鼠骨密度、骨强度,改善骨微结构。其抗PMOP的作用机制可能是通过影响成骨相关因子OPG、RUNX2、BMP2等以调节骨代谢,促进骨形成,抑制骨吸收来实现的。
| [1] |
KANIS J A. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: synopsis of a WHO report. WHO study group[J]. Osteoporosis International, 1994, 4(6): 368-381. DOI:10.1007/BF01622200 |
| [2] |
WANG H, YANG L G, CHAO J W. Antiosteoporosis and bone protective effect of dieckol against glucocorticoid-induced osteoporosis in rats[J]. Frontiers in Endocrinology, 2022, 13: 932488. DOI:10.3389/fendo.2022.932488 |
| [3] |
中华医学会骨质疏松和骨矿盐疾病分会. 中国骨质疏松症流行病学调查及"健康骨骼" 专项行动结果发布[J]. 中华骨质疏松和骨矿盐疾病杂志, 2019, 12(4): 317-318. |
| [4] |
ALMEIDA M, LAURENT M R, DUBOIS V, et al. Estrogens and androgens in skeletal physiology and pathophysiology[J]. Physiological Reviews, 2017, 97(1): 135-187. DOI:10.1152/physrev.00033.2015 |
| [5] |
李雪. 乌鲁木齐市中老年人骨质疏松症与膳食及其他影响因素关系的现况调查[D]. 乌鲁木齐: 新疆医科大学, 2019.
|
| [6] |
TAMARI T, ELIMELECH R, COHEN G, et al. Endothelial progenitor cells inhibit jaw osteonecrosis in a rat model: a major adverse effect of bisphosphonate therapy[J]. Scientific Reports, 2019, 9(1): 18896. DOI:10.1038/s41598-019-55383-5 |
| [7] |
LOBO R A, PICKAR J H, STEVENSON J C, et al. Back to the future: hormone replacement therapy as part of a prevention strategy for women at the onset of menopause[J]. Atherosclerosis, 2016, 254: 282-290. DOI:10.1016/j.atherosclerosis.2016.10.005 |
| [8] |
YANG Y, WEI Q, AN R, et al. Anti-osteoporosis effect of Semen Cuscutae in ovariectomized mice through inhibition of bone resorption by osteoclasts[J]. Journal of Ethnopharmacology, 2022, 285: 114834. DOI:10.1016/j.jep.2021.114834 |
| [9] |
赵素霞, 刘会丽, 江红. 菟丝子黄酮通过调节Wnt/β-catenin信号通路干预去卵巢大鼠骨代谢的机制研究[J]. 临床和实验医学杂志, 2018, 17(1): 25-28. |
| [10] |
杨豪, 曾范慧. 牛膝多糖调控Wnt/β-catenin通路改善骨质疏松性骨折大鼠骨代谢的研究[J]. 中医学报, 2021, 36(10): 2188-2194. |
| [11] |
SERIOLO B, PAOLINO S, CASABELLA A, et al. Osteoporosis in the elderly[J]. Aging Clinical and Experimental Research, 2013, 25(Suppl 1): S27-S29. |
| [12] |
WANG L J, YOU X L, ZHANG L L, et al. Mechanical regulation of bone remodeling[J]. Bone Research, 2022, 10(1): 16. DOI:10.1038/s41413-022-00190-4 |
| [13] |
VEIS D J, O'BRIEN C A. Osteoclasts, master sculptors of bone[J]. Annual Review of Pathology, 2023, 18: 257-281. DOI:10.1146/annurev-pathmechdis-031521-040919 |
| [14] |
CHOU C W, CHIANG T I, CHANG I C, et al. Expression levels of estrogen receptor α mRNA in peripheral blood cells are an independent biomarker for postmenopausal osteoporosis[J]. BBA Clinical, 2016, 5: 124-129. DOI:10.1016/j.bbacli.2016.03.001 |
| [15] |
黄朱宋, 林煜, 陈翔, 等. 巴戟天醇提物对卵巢切除肥胖模型大鼠脂代谢及骨代谢的影响[J]. 中国组织工程研究, 2021, 25(2): 205-210. |
| [16] |
周建鸿. 仙灵骨葆结合阿仑磷酸钠对绝经后骨质疏松骨代谢指标、骨密度及骨痛症状的影响[J]. 中国老年学杂志, 2020, 40(3): 581-584. |
| [17] |
李兰. 葛根素通过Wnt4/β-catenin信号通路抑制绝经后骨质疏松的机制研究[D]. 右江: 右江民族医学院, 2021.
|
| [18] |
张倩. 金匮肾气丸通过调控BMP/Smad信号通路防治绝经后骨质疏松症的机制研究[D]. 济南: 山东中医药大学, 2021.
|
| [19] |
柴昊. 基于IL-17/Act1/FOSB通路探讨续苓健骨方治疗肾虚血瘀型绝经后骨质疏松症的作用机制[D]. 福州: 福建中医药大学, 2022.
|
| [20] |
HUANG Z, CHU L, LIANG J N, et al. H19 promotes HCC bone metastasis through reducing osteoprotegerin expression in a protein phosphatase 1 catalytic subunit Alpha/p38 Mitogen-activated protein Kinase-dependent manner and sponging microRNA 200b-3p[J]. Hepatology, 2021, 74(1): 214-232. |
| [21] |
XU J H, LI Z H, HOU Y D, et al. Potential mechanisms underlying the Runx2 induced osteogenesis of bone marrow mesenchymal stem cells[J]. American Journal of Translational Research, 2015, 7(12): 2527-2535. |
| [22] |
XU Y M, YANG Y, HUA Z Y, et al. BMP2 immune complexes promote new bone formation by facilitating the direct contact between osteoclasts and osteoblasts[J]. Biomaterials, 2021, 275: 120890. |
 2024, Vol. 41
2024, Vol. 41