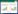文章信息
- 程媛, 唐熠, 王巧灵, 等.
- CHENG Yuan, TANG Yi, WANG Qiaoling, et al.
- 基于网络药理学及实验验证研究逍遥散干预结肠癌肝转移作用及机制
- Study on the effect and mechanism of Xiaoyao Powder in treating liver metastasis of colon cancer based on network pharmacology and experimental verification
- 天津中医药, 2024, 41(12): 1605-1613
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1605-1613
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.20
-
文章历史
- 收稿日期: 2024-07-27
2. 成都中医药大学附属医院科研部, 成都 610072;
3. 成都中医药大学附属医院药剂科, 成都 610072
结直肠癌是消化系统发病率及病死率较高的恶性肿瘤[1],肿瘤转移是其死亡的主要原因[2]。肝脏因血供丰富成为结直肠癌最常见的转移部位,肝转移患者一经发现即处于中晚期,预后较差[3]。阻延结肠癌患者肝转移对提高患者生存率具有重要意义。近年来中国中医药抗肿瘤研究取得了很大进展,在改善结肠癌患者的症状,减少术后并发症,提高生存质量,防止转移方面发挥重要作用[4-6]。总结文献发现,临床医生治疗结肠癌肝转移的遣方思路主要以“疏肝健脾”为基础[7-10]。逍遥散出自《太平惠民合剂局方》,具有调和肝脾、疏肝解郁、养血健脾之功效。临床研究以逍遥散为主要组分干预结肠癌或肝癌患者,将血清肿瘤标志物水平、血清相关炎性因子水平、肿瘤相关免疫细胞比例、全身症状及生存质量等作为有效率的观察及评价指标[11-12],发现可提高免疫细胞功能、降低血清肿瘤标志物和炎性因子水平,但发挥效应的具体机制尚未明确。本研究通过网络药理学构建成分-靶点-疾病作用网络,预测逍遥散干预结肠癌肝转移的靶点蛋白及信号通路;同时通过动物模型验证逍遥散阻延结直肠癌肝转移的作用及靶点,为明确其作用效应及机制提供实验依据。
1 材料 1.1 实验动物无特定病原体(SPF)级C57BL/6小鼠36只,雌雄各半,体质量为22~26 g。购自成都达硕生物科技有限公司,生产许可证号SCXK(川)2020-030;饲养于四川里来思诺生物科技有限公司,实验动物使用许可证号:SYXK(川)2021-246,环境等级为屏障系统,温度20~26 ℃,相对湿度40%~60%,12 h日/12 h夜光照循环。动物实验遵循3R原则,并经成都中医药大学附属医院动物伦理委员会批准(批准号:2023DL-009)。
1.2 细胞株小鼠结肠癌MC38细胞,购自赛百慷(iCell-m032),使用含10%胎牛血清、0.1 U/L青霉素和100 mg/L链霉素的RPMI 1640培养基,置于37 ℃、5% CO2培养箱中培养,0.25%胰酶消化传代。实验时用磷酸盐缓冲液(PBS)重悬成1×106个/mL细胞悬液用于注射小鼠。
1.3 药物与试剂逍遥散处方量为柴胡10 g,当归10 g,白芍10 g,白术10 g,茯苓10 g,炙甘草8 g,薄荷2 g,生姜10 g。全部饮片购于四川新荷花中药饮片股份有限公司,由成都中医药大学附属医院药剂科按照《中华人民共和国药典》2020版[13]逍遥丸(浓缩丸)制法标准制备成含生药1.4 g/mL溶液。注射用哌拉西林他唑巴坦钠2.25 g,批号A2211005,国药准字H20074053,湖南科伦制药有限公司。阳性药DNase Ⅰ(11284932001)购自德国罗氏(Roche)诊断有限公司,AKT(A17909)、β-actin(AC026)一抗购自武汉爱博泰克(ABclonal)生物科技有限公司;p-AKT(381555)、JNK(R22866)、p-JNK(381100)、c-Jun(380397)、p-c-Jun(R22955)一抗购自成都正能(Zen-bio)生物技术有限责任公司;辣根过氧化物酶(HRP)标记山羊抗兔IgG (H+L)(S0001)二抗购自澳大利亚(Affinity Biosciences)生物技术公司。
1.4 仪器Pannoramic 250型数字切片扫描仪,3DHISTECH(Hungary)公司;KZ-Ⅲ-F型低温高速组织研磨仪,Servicebio公司;H2050R型台式高速冷冻离心机,湘仪集团;5200 Multi型荧光图像分析系统,Tanon公司。
2 方法 2.1 网络药理学预测 2.1.1 逍遥散成分筛选及靶点收集通过中药系统药理数据库及分析平台(TCMSP)数据库(http://tcmspw.com/tcmsp.php),搜集整理逍遥散化学成分,限定为:1)以“吸收、分布、代谢与排泄(ADME)”属性值的药物的口服生物利用度(OB)≥30%。2)药物的相似性(DL)≥0.18。获得上述条件检索的药物化学成分信息,同时使用“getTargets.pl”脚本获取其相应靶标。
2.1.2 逍遥散干预结肠癌肝转移靶点获取与筛选以“Colon cancer liver metastasis”为关键词,在Gene cards数据库进行检索,得到结直肠癌肝转移疾病靶点。通过R语言的韦恩图包对2.1.1得到的靶点与疾病靶点进行取交集处理,得到逍遥散干预结肠癌肝转移的作用靶点。
2.1.3 蛋白相互作用网络构建和核心靶点鉴定通过string数据库,选择物种为“Homo sapiens”,利用Cytoscape 3.6.1软件构建逍遥散干预结肠癌肝转移靶点的蛋白相互作用(PPI)网络图。网络图中节点表示靶标蛋白,连线表示其存在相互关系。分析其网络拓扑参数,节点度值越大,表示其关系越密切,在网络中更重要,为核心靶点。
2.1.4 逍遥散干预结肠癌肝转移的GO和京都基因与基因组百科全书(KEGG)功能富集分析将逍遥散干预结肠癌肝转移共同基因和“clusterProfilerGO.R”脚本,使用“R统计编程语言”软件运行,进行基因本体论(GO)分类富集分析以及KEGG通路富集分析。选取满足P < 0.05的通路,并根据富集基因数量作降序排序处理,选取富集基因数最多的20条通路,绘制相关高级气泡图及柱状图。
2.2 实验验证 2.2.1 小鼠结肠癌肝转移模型构建及逍遥散给药C57BL/6小鼠36只,适应性喂养1周后按体质量随机分为6组,分别为空白组、模型组、逍遥散高(28 g/kg)、中(14 g/kg)、低(7 g/kg)剂量组、阳性药DNase Ⅰ组,每组6只。逍遥散高、中、低小鼠给药剂量约为人临床等效剂量的3、1.5、0.75倍。各小鼠称体质量后1%戊巴比妥钠以45 mg/kg腹腔注射麻醉,皮肤消毒后于左侧腋后线与肋缘交界下方行0.5~1.0 cm斜切口,剪开腹膜,于左腹腔外侧找到脾,将脾下极轻柔牵出腹腔外,棉签轻压固定,用1 mL胰岛素注射器从脾下极贴近脾包膜向上进针约1.0 cm,缓慢注射0.2 mL MC38肿瘤细胞悬液(2×105个/只)。空白组进行假手术,并注射0.2 mL PBS溶液。拔针后用75%乙醇棒压迫针眼至无活动性出血,以止血和杀灭可能外渗的癌细胞。将脾脏放回,依次间断缝合腹膜、皮肤,关腹。术后将小鼠置入保温毯上保暖,腹腔注射0.1 mL浓度为1%的哌拉西林。造模手术第2天开始给药,逍遥散组以20 mL/kg灌胃给予逍遥散,阳性药组以10 mL/kg腹腔注射DNase Ⅰ溶液,剂量为7.5 mg/kg,空白组及模型组予以等容量生理盐水灌胃。每天给药1次,连续给药21 d。末次给药1 h后小鼠腹腔注射1%戊巴比妥钠45 mg/kg麻醉,取部分肝脏4%中性甲醛溶液固定用于病理检测;部分肝脏用于蛋白免疫印迹法(Western Blot)检测。
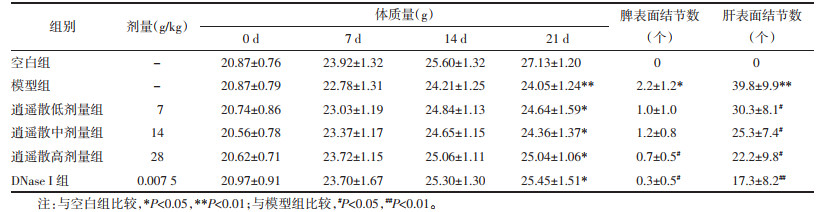
2.2.2 一般特征观察各组小鼠每7天称量1次体质量。末次给药麻醉后开腹,肉眼观察记录脾脏、肝脏表面癌结节数及腹腔受累情况。
2.2.3 苏木精-伊红(HE)染色取各小鼠固定肝组织,全自动脱水机梯度乙醇脱水,石蜡包埋,切片脱蜡至水,苏木精染色,盐酸乙醇分化,放入50 ℃的温水中或弱碱性水溶液返蓝,放入85%的乙醇3~5 min,伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封固,镜检。采用Pannoramic 250数字切片扫描仪对切片进行图像采集,每张切片先于低倍下观察全部组织大体病变,选择要观察的区域采集7倍和200倍图片,观察具体病变。采用四级计分法进行描述,轻微(+):表示出现的变化几乎不超过正常范围内的变化;轻度(++):病变易于识别,但严重程度有限,病变可能不会产生任何功能障碍,病变组织范围占受检组织的11%~20%;中度(+++):病变突出,很有可能向严重性发展的趋向,可能产生有限度的组织或器官功能障碍,21%~40%的组织受累;重度(++++):病变程度严重且已形成完全性病变,预期会产生明显的组织或器官功能障碍,病变涉及41%~100%的受检组织范围。
2.2.4 免疫组化取各组小鼠肝组织,石蜡包埋,切片脱蜡复水,抗原修复,血清封闭。滴加CDX2一抗(1∶100稀释),4 ℃孵育过夜。PBS浸泡清洗,二抗室温孵育1 h,PBS清洗3次,二氨基联苯胺(DAB)显色10 min,苏木精复染2 min,流水清洗10 min,乙醇梯度脱水处理,二甲苯透明处理,封片,镜检,采集400倍图片,观察各组CDX2抗体表达情况,阳性表达时细胞胞浆可染成深棕色。染色结果按以下标准进行半定量评价:-,阳性细胞百分比小于1%;+,阳性细胞百分比1%~10%;++,阳性细胞百分比10%~50%;+++,阳性细胞百分比大于50%。
2.2.5 Western Blot检测蛋白表达取各小鼠肝组织样本分别放入2 mL研磨管中,加入2颗3 mm研磨珠及RIPA裂解液(质量比样本/裂解液=1/10)于高速低温组织研磨仪内(-20 ℃)研磨4次,每次60 s;取出后于4 ℃裂解30 min,高速冷冻离心机(4 ℃)以12 000 r/min离心10 min,离心半径8 cm,取上清液,用二辛可宁酸(BCA)蛋白定量试剂盒测定蛋白浓度。蛋白变性后进行SDS聚丙烯酰胺凝胶电泳,200 mA转膜2 h,TBST Buffer稀释的5%脱脂牛奶封闭2 h。一抗4 ℃孵育过夜,一抗浓度:Stat3 1∶2 000;p-Stat3 1∶1 000;c-Jun 1∶1 000;p-c-Jun 1∶1 000;JNK 1∶1 000;p-JNK 1∶1 000;β-actin 1∶50 000。洗膜后二抗室温孵育2 h(稀释浓度:1∶5 000)。发光液显影,用Tanon荧光图像分析系统软件V2.0对条带进行曝光,以Gel-Pro analyzer4软件扫描目的蛋白积分光密度。以目的蛋白条带与内参蛋白(β-actin)条带的积分光密度比值表示目的蛋白的相对表达水平。
2.2.6 统计分析采用GraphPad Prism 8.0软件进行分析。数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05表示差异有统计学意义。
3 结果 3.1 逍遥散干预结肠癌肝转移的潜在作用靶点通过TCMSP数据库,获得了逍遥散197个靶点。通过Gene cards数据库获得结肠癌肝转移疾病8 626个靶点。通过R语言的韦恩图包进行取交集,获得了逍遥散干预结肠癌肝转移的178个靶点。结果见图 1A。
|
| 注:图A,逍遥散与结肠癌肝转移疾病的共有靶点;图B,逍遥散干预结肠癌肝转移靶点的PPI网络;图C,PPI网络靶点可视化图;图D,逍遥散干预结肠癌肝转移拓扑分析筛选的核心靶点;图E,逍遥散干预结肠癌肝转移的GO功能分析;图F,逍遥散干预结肠癌肝转移的KEGG通路富集分析。 图 1 逍遥散干预结肠癌肝转移的网络药理学分析 Fig. 1 Network pharmacological analysis of Xiaoyao Powder in the intervention of colon cancer liver metastasis |
将逍遥散干预结肠癌肝转移相关的178个靶蛋白导入String数据库中,获取其相互作用关系,结果见图 1B,作用线条为红色表示“基因融合”关系、黄色表示“蛋白互作”关系、黑色表示“共表达”关系、深蓝色表示“基因共现”关系、浅蓝色表示“蛋白质同源性”关系、绿色表示“基因邻接关系”。利用Cytoscape软件可视化,得到蛋白互作PPI网络,结果见图 1C,气泡越大、颜色越深代表该蛋白在网络中节度值越高,为核心靶点。网络拓扑参数分析得出,节点度值排名前5位的靶蛋白依次为JUN、STAT3、AKT1、细胞中丝裂源活化蛋白激酶1(MAPK1)、V-Rel网状内皮增生病毒癌基因同源物A(RELA),表明其为核心靶点,结果见图 1D。
3.3 GO及KEGG富集分析GO分析结果显示,逍遥散干预结肠癌肝转移的分子功能变化多集中在DNA结合转录因子结合、细胞因子受体结合、泛素样蛋白连接酶结合上,结果见图 1E。KEGG富集分析获得158条相关信号通路,通过筛选后得到高度相关的通路20条,显示逍遥散干预结肠癌肝转移的主要信号通路富集在动脉粥样硬化、糖尿病相关AGE-RAGE信号通路、肝炎、化学致癌-受体激活、肿瘤坏死因子(TNF)信号通路、白细胞介素-17(IL-17)信号通路等多个生物变化过程,结果见图 1F。
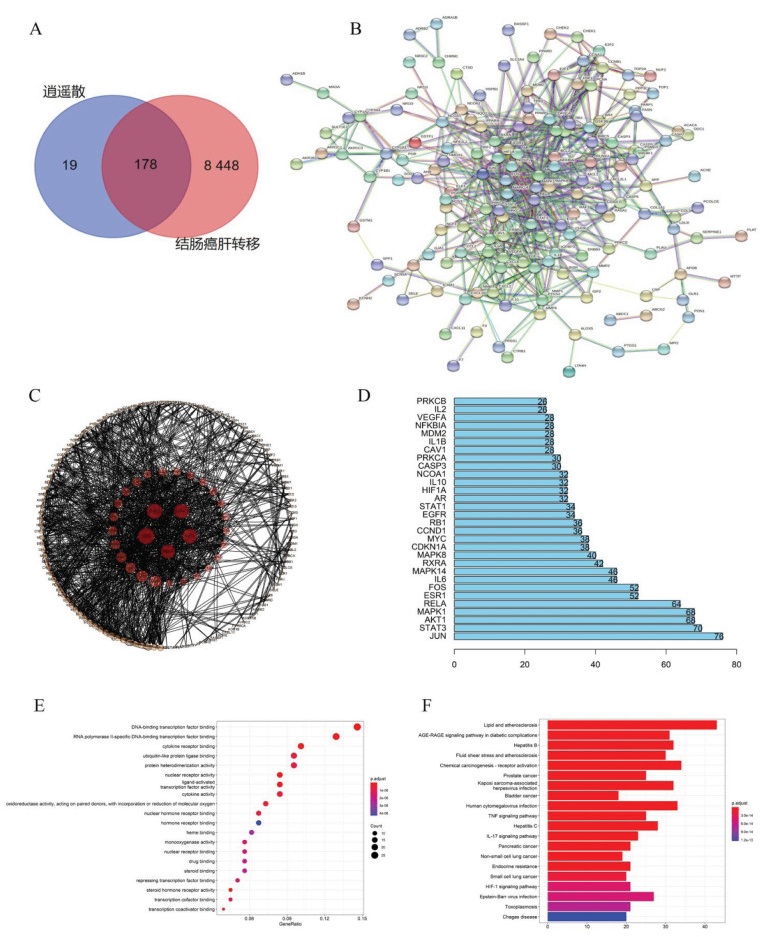
3.4 小鼠一般特征观察结肠癌肝转移造模1~2周,各组小鼠生命体征平稳,精神状态良好;3周开始,模型组与空白组相比出现腹部肿大、运动量减少、摄食量和饮水量有一定程度的减少。21 d称量时发现,模型组及给药组较14 d出现体质量轻微下降,与空白组比较差异有统计学意义(P < 0.01或P < 0.05)。逍遥散各剂量组及DNase Ⅰ阳性药给药组与模型组比较,腹部肿大现象较轻、体质量无统计学差异,麻醉处死开腹后观察腹水较少,脾脏和肝脏表面转移癌结节数与模型组比较明显减少(P < 0.05或P < 0.01)。结果见图 2、表 1。
|
| 注:图A,空白组;图B,模型组;图C,逍遥散低剂量组;图D,逍遥散中剂量组;图E,逍遥散高剂量组;图F,DNase Ⅰ组。 图 2 逍遥散对结肠癌肝转移小鼠肝脏(左)及脾脏(右)表面转移癌结节的影响 Fig. 2 Effects of Xiaoyao Powder on cancer nodules in liver (left) and spleen (right) of colon cancer liver metastasis mice model |
|
HE染色结果显示,空白组肝脏组织被膜完整,肝小叶分叶不明显,肝索排列较为整齐,中央静脉内皮完整,肝细胞围绕中央静脉呈放射状排列,肝窦结构正常,未见明显纤维组织增生和炎性细胞浸润。模型组可见炎性细胞轻度浸润,纤维组织增生,大量肿瘤样细胞浸润和肿瘤样细胞变性坏死等病理改变,多见病理性核分裂象。逍遥散给药组及阳性药DNase Ⅰ组炎性细胞轻微浸润,伴有轻度或中度肿瘤样细胞浸润,极少量或少量肿瘤样细胞变性坏死,多见病理性核分裂象。说明逍遥散给药组与模型组相比,能减少肝脏炎性细胞和肿瘤细胞浸润,减轻肿瘤样细胞变形坏死。结果见图 3。
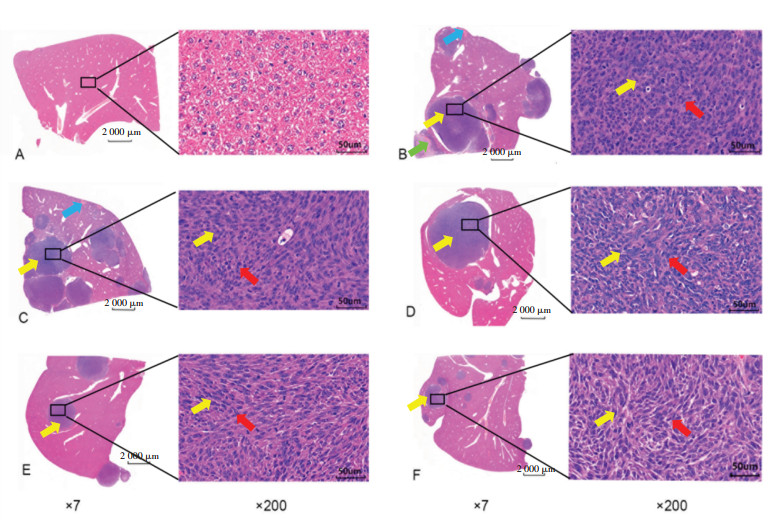
|
| 注:图A,空白组;图B,模型组;图C,逍遥散低剂量组;图D,逍遥散中剂量组;图E,逍遥散高剂量组;图F,DNase Ⅰ组。黄色箭头表示肿瘤样细胞浸润,蓝色箭头表示肝细胞坏死,绿色箭头表示肿瘤样细胞变性坏死,红色箭头表示病理性核分裂象。 图 3 逍遥散对结肠癌肝转移小鼠肝脏病理的影响(HE染色) Fig. 3 Effect of Xiaoyao Powder on liver pathology of mice with colon cancer liver metastasis (HE staining) |
免疫组化结果显示,空白组肝脏未见CDX2表达,模型组、逍遥散给药组及阳性药组肝脏CDX2表达均为阳性,表明小鼠肝脏肿瘤样细胞浸润来源于结肠癌细胞肝转移。逍遥散各给药组(++)及阳性药组(++)与模型组(+++)相比,CDX2阳性细胞较少。结果见图 4。
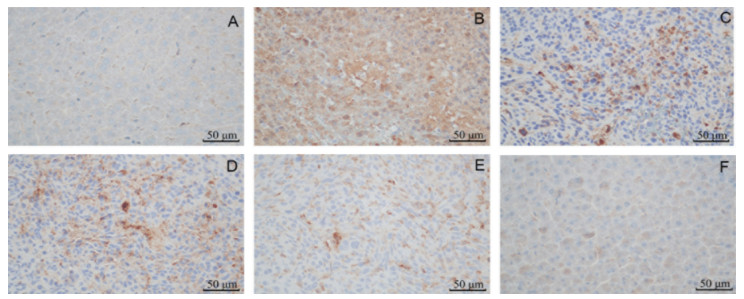
|
| 注:图A,空白组;图B,模型组;图C,逍遥散低剂量组;图D,逍遥散中剂量组;图E,逍遥散高剂量组;图F,DNase Ⅰ组。 图 4 逍遥散对结肠癌肝转移小鼠肝脏病理的影响(免疫组化,×400) Fig. 4 Effects of Xiaoyao Powder on liver pathology of mice with colon cancer liver metastasis (Immunohistochemistry, ×400) |
Western Blot结果显示,与空白组比较,模型组小鼠肝组织中c-Jun、Stat3、JNK蛋白表达无统计学差异,p-c-Jun、p-Stat3、p-JNK蛋白表达显著升高(P < 0.01)。与模型组比较,逍遥散高、中、低剂量组和阳性药DNase Ⅰ组肝组织中c-JUN、Stat3、JNK蛋白表达无统计学差异,但p-c-Jun、p-Stat3、p-JNK蛋白表达水平显著降低(P < 0.01),各给药组磷酸化蛋白与总蛋白比值与模型组相比均下降(P < 0.05或P < 0.01),说明逍遥散能抑制c-Jun、Stat3、JNK蛋白的磷酸化,结果见图 5、表 2。
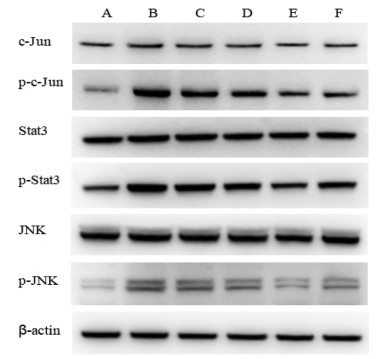
|
| 注:A,空白组;B,模型组;C,逍遥散低剂量组;D,逍遥散中剂量;E,逍遥散高剂量组;F,DNase Ⅰ组。 图 5 逍遥散对结肠癌肝转移小鼠蛋白表达的影响 Fig. 5 Effects of Xiaoyao Powder on protein expression of mice with colon cancer liver metastasis |

|
结直肠癌是最常见的恶性肿瘤之一,2018年中国癌症统计报告显示中国结直肠癌发病率、病死率在全部恶性肿瘤中分别位居第3及第5位[14]。结直肠癌肝转移极为常见:有15%~25%的结直肠癌患者在确诊时即合并肝转移,而另有15%~25%的患者将在结直肠癌原发灶根治术后发生肝转移,其中绝大多数(80%~90%)的肝转移灶初始无法获得根治性切除[15]。因此,结肠癌患者确诊时即应视为潜在肝转移人群进行防治干预,延缓转移性肝癌发生,延长生存期。
结肠癌肝转移中医临床总以“肝脾同病”辨证论治[16]。肝和脾是体内经络相通、克而互用、共荣同损的两个中医脏腑系统,任一脏腑病变都易累及另一脏腑导致“肝脾同病”。西医“肠”的功能毋庸置疑属于中医“脾”的功能,中医“肝”的概念也包括现代解剖学意义上的肝脏[17]。“肝脾同病”不仅是中医脏腑功能之间的病理互损,也是西医肠、肝器官功能性乃至器质性病变互相影响的体现。结肠癌肝转移的主要症状及体征除乏力、纳差、腹痛等脾虚症状外,还常见胁下结块、口苦咽干、脉弦细等肝郁症状[18]。结肠癌肝转移中医药治疗均以调和肝脾为主,减毒消癥为辅,所用的补脾、疏肝药物比例高于其他药物所占比例。逍遥散是“疏肝健脾”的代表方剂,方中白术、茯苓健脾以补脾虚,当归、白芍养血和血以护肝体,柴胡、薄荷疏肝解郁以助肝用,全方药味疏养兼施、体用并调,发挥肝脾同治之效。有临床观察结果显示其能降低肠癌转移率,减轻化疗不良反应,改善生活质量[19-20]。动物实验发现其能有效抑制结肠癌肝转移[21]和肺转移[22],其作用均与抑制肿瘤相关巨噬细胞表型转化,降低炎症因子表达,改善免疫有关,但其发挥作用的具体分子机制未有报道。
本研究构建小鼠脾注射结肠癌肝转移模型,研究逍遥散阻延结肠癌肝转移的效应及作用机制。结肠癌肝转移模型根据肿瘤种植部位的不同分为肿瘤细胞结肠原位种植和异位种植,后者又包括皮下、肝脏、肝门静脉、脾脏等。原位种植模型和皮下种植肝脏转移率较低且不稳定,而肝脏、肝门静脉、脾脏则有较高的转移率[23]。肝脏和肝门静脉注射的缺点在于小鼠易出现肝脏血栓而引起死亡[24];脾注射法病死率低,且能更好地模拟结肠癌因血行而发生肝转移的过程,因此笔者选用该方法构建动物模型。CDX2在结直肠肿瘤中特异性表达[25],可作为特异性标记区分原发性肝癌和结直肠肝转移,同时采用免疫组化方法检测肝组织CDX2阳性表达情况,证实肝脏肿瘤来源自结肠癌细胞肝转移。研究发现,逍遥散能改善结肠癌肝转移模型小鼠的一般特征,改善体质量下降和腹部肿大现象,减少肝脏转移瘤个数;病理结果显示逍遥散能明显降低结肠癌肝转移模型小鼠肝脏转移肿瘤细胞浸润和炎细胞数,减少肿瘤细胞坏死,与模型组比较,CDX2阳性染色细胞减少。一般特征改善程度和病理结果均呈现一定的剂量依赖性,说明逍遥散能较好地抑制动物模型结肠癌肝转移。
为研究逍遥散阻延结肠癌肝转移的作用机制,首先进行网络药理学分析,结果显示,逍遥散干预结肠癌肝转移主要信号通路与动脉粥样硬化、糖尿病相关AGE-RAGE信号通路、肝炎、化学致癌-受体激活等生物变化过程高度相关,通过与DNA结合转录因子结合、细胞因子受体结合、泛素样蛋白连接酶结合等分子作用,影响JUN、STAT3、MAPK1等主要靶点蛋白。分析其生物变化、分子变化及靶点蛋白,笔者认为JNK信号转导通路在逍遥散干预结肠癌肝转移发挥重要作用。JNK是c-Jun氨基末端激酶,是哺乳动物细胞中MAPK家族中的一员[26]。MAPK是一类丝氨酸/苏氨酸蛋白激酶,受到不同的细胞外刺激如细胞因子、神经递质、激素、细胞应激及细胞黏附等作用后,能介导信号从细胞膜向细胞核内传导,影响胞内基因表达调控和细胞质功能[27]。MAPK传递信号的通路基本依赖于三级激酶和两个磷酸化激活,既MAPK激酶(MKKK)、MAPK激酶(MKK)和MAPK,这3种激酶依次磷酸化激活后,细胞膜受体传递的信号进入细胞核内,促进细胞生长、增殖、分化或凋亡。目前发现有4种类型的MAPK级联通路[28]:细胞外信号调节激酶(ERK)、p38丝裂原活化蛋白激酶(p38 MAPK)、c-Jun氨基末端激酶(JNK)、细胞外信号调节激酶5(ERK5)。其中JNK信号通路在炎症和细胞凋亡等应激反应中发挥重要作用,与肿瘤细胞的侵袭和转移有关。JNK接受上游信号被磷酸化激活后,可以进一步使核内的转录因子c-Jun氨基末端63及73位的丝氨酸残基磷酸化,进而激活c-Jun而增强其转录活性[29]。c-Jun氨基末端的磷酸化还可以促进c-Jun异二聚体及同二聚体的形成,这些转录因子可以结合到许多基因启动子区激活蛋白1(AP-1)位点,增加特定基因的转录活性。JNK激活后还可以使Stat3的727位丝氨酸磷酸化来激活Stat3[30]。Stat3作为转录因子调控一系列与癌细胞生存、增殖、血管生成、侵袭、转移、耐药性和免疫逃避有关的基因[31]。在结肠癌肝转移小鼠模型上进行了逍遥散干预靶点蛋白的验证,结果发现逍遥散能明显抑制c-Jun、Stat3、JNK蛋白的磷酸化,随剂量增高,抑制磷酸化蛋白表达水平作用增强,说明逍遥散能通过调控JNK信号通路,阻延结肠癌肝转移。
综上所述,本研究通过网络药理学预测及结肠癌肝转移动物模型构建,确证逍遥散抑制结肠癌肝转移肿瘤生长的作用,并首次报道其作用机制与抑制p-c-Jun、p-Stat3、p-JNK磷酸化激活,调控JNK信号通路有关。通过对结肠癌肝转移的中医药防治效应及调控机制的探索,有助于丰富“肝脾同病”的科学内涵,为中医药干预肿瘤转移提供实验证据。本研究仅初步检测了JNK信号通路的蛋白水平,逍遥散是否还影响其他信号通路发挥多靶点多层次作用有待后续深入探讨。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA, 2021, 71(3): 209-249. |
| [2] |
田传鑫, 赵磊. 结直肠癌及结直肠癌肝转移流行病学特点[J]. 中华肿瘤防治杂志, 2021, 28(13): 1033-1038. |
| [3] |
KOW A W C. Hepatic metastasis from colorectal cancer[J]. Journal of Gastrointestinal Oncology, 2019, 10(6): 1274-1298. DOI:10.21037/jgo.2019.08.06 |
| [4] |
陶丽, 朱莹杰, 周琴, 等. 中医药辨证治疗对不可切除的大肠癌肝转移患者生存期影响的临床研究[J]. 中华中医药学刊, 2013, 31(5): 1206-1209. |
| [5] |
徐舟. 金龙胶囊联合化疗治疗结肠癌肝转移的临床观察[J]. 首都食品与医药, 2015, 22(22): 73-74. |
| [6] |
蔡艳阳, 谢璐帆. 基于现代中医临床思维的扶正祛邪中药治疗大肠癌肝转移患者临床疗效Meta分析[J]. 新中医, 2020, 52(15): 19-23. |
| [7] |
刘辉, 陈信义. 疏肝健脾方联合FOLFOX方案治疗晚期大肠癌肝转移疗效观察[J]. 现代中西医结合杂志, 2017, 26(30): 3394-3396. |
| [8] |
杜瑀煊, 柴可群, 陈嘉斌, 等. 治疗结直肠癌复发转移的中药用药规律分析[J]. 肿瘤学杂志, 2017, 23(2): 97-100. |
| [9] |
李伟良. 健脾化痰方干预结直肠癌肝转移的临床疗效评价及抗转移作用机制研究[D]. 南京: 南京中医药大学, 2020: 18-19.
|
| [10] |
吕欣妮, 钱丽君, 尹佳钰, 等. 方志军从"肝" 论治结直肠癌肝转移经验[J]. 辽宁中医杂志, 2023, 50(12): 23-26. |
| [11] |
赵璐, 倪依群. 逍遥散治疗晚期结直肠癌肝气郁结证的临床研究[J]. 中医药导报, 2019, 25(5): 110-112, 119. |
| [12] |
杨鹤. 逍遥散加味联合TACE治疗原发性肝癌(肝郁脾虚型)的临床观察[D]. 南宁: 广西中医药大学, 2018: 23-25.
|
| [13] |
国家药典委员会. 中华人民共和国药典-一部: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 1462.
|
| [14] |
国家卫生健康委医院管理局, 中国肿瘤学会, 中华医学会. 中国结直肠癌诊疗规范(2020年版)[J]. 中国实用外科杂志, 2020, 40(6): 601-625. |
| [15] |
朱德祥, 任黎, 许剑民. 中国结直肠癌肝转移诊断和综合治疗指南(2023版)[J]. 消化肿瘤杂志(电子版), 2023, 15(2): 86-99. |
| [16] |
潘丽, 井海亮, 任益锋, 等. 基于"肝脾同病" 探析结肠癌肝转移的中医治疗[J]. 中医杂志, 2022, 63(17): 1638-1643. |
| [17] |
陈晓乐, 杨梦蝶, 胡元佳, 等. 现代医学的传统诠释: 促进中医药发展的有效途径[J]. 世界科学技术-中医药现代化, 2017, 19(3): 381-386. |
| [18] |
王利民, 高宇, 张福鹏, 等. 王晞星辨治大肠癌肝转移经验[J]. 上海中医药杂志, 2020, 54(6): 79-81. |
| [19] |
肖敏伟. 疏肝健脾中药维持治疗降低肠癌术后复发转移风险的临床观察[J]. 中国社区医师, 2019, 35(24): 107-108. |
| [20] |
史碧霄, 曹云, 李烜. 归芍六君子汤加减辅助化疗治疗大肠癌肝转移25例临床研究[J]. 江苏中医药, 2018, 50(12): 36-38. |
| [21] |
ZHAO L, ZHU X D, NI Y Q, et al. Xiaoyaosan, a traditional Chinese medicine, inhibits the chronic restraint stress-induced liver metastasis of colon cancer in vivo[J]. Pharmaceutical Biology, 2020, 58(1): 1085-1091. |
| [22] |
汤晓霞, 邓皖利, 张勇, 等. 逍遥散通过调节肿瘤免疫微环境抑制肺转移前微环境形成[J]. 天津医药, 2023, 51(3): 263-268. |
| [23] |
王理, 张文斌. 结肠癌肝转移动物模型的研究进展[J]. 中国现代普通外科进展, 2014, 17(2): 162-165. |
| [24] |
周鑫, 张铃福, 谢海艇, 等. 不同途径裸鼠大肠癌肝转移模型的比较[J]. 中华普外科手术学杂志(电子版), 2016, 10(2): 140-144. |
| [25] |
方义湖, 来茂德. 结直肠肿瘤的新标记: CDX2[J]. 国际遗传学杂志, 2006, 29(4): 311-316. |
| [26] |
夏艳芹, 杜毓菁, 万福生. c-Jun氨基末端激酶[J]. 生命的化学, 2016, 36(2): 151-157. |
| [27] |
巩婷婷, 司凯, 刘会平, 等. MAPK级联调控细胞生长及其在免疫-炎症及癌症中作用的研究进展[J]. 中南大学学报(医学版), 2022, 47(12): 1721-1728. |
| [28] |
CHANG L, KARIN M. Mammalian MAP kinase signalling cascades[J]. Nature, 2001, 410(6824): 37-40. |
| [29] |
WESTON C R, DAVIS R J. The JNK signal transduction pathway[J]. Current Opinion in Cell Biology, 2007, 19(2): 142-149. |
| [30] |
CHEN B L, LIU J, CHANG Q S, et al. JNK and STAT3 signaling pathways converge on Akt-mediated phosphorylation of EZH2 in bronchial epithelial cells induced by arsenic[J]. Cell Cycle, 2013, 12(1): 112-121. |
| [31] |
杨毅, 袁杰, 牛瑞芳. STAT3的多重调控方式在肿瘤中的研究进展[J]. 中国肿瘤临床, 2016, 43(8): 352-357. |
2. Research Department, Affiliated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China;
3. Department of Pharmacy, Affiliated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China
 2024, Vol. 41
2024, Vol. 41