文章信息
- 彭嘉旋, 黄天煜, 余方向, 等.
- PENG Jiaxuan, HUANG Tianyu, YU Fangxiang, et al.
- 基于Wnt/β-catenin信号通路补肾活血中药治疗膝骨性关节炎与骨质疏松症“共病”机制研究进展
- Progress on the mechanism of traditional Chinese medicines for reinforcing kidney and activating blood circulation in the treatment of knee osteoarthritis and osteoporosis "co-morbidity" based on Wnt/β-catenin signaling pathway
- 天津中医药, 2024, 41(12): 1620-1626
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(12): 1620-1626
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.12.22
-
文章历史
- 收稿日期: 2024-07-23
2. 天津中医药大学第一附属医院, 天津 300381;
3. 国家中医针灸临床医学研究中心, 天津 300381;
4. 天津中医药大学中医学院, 天津 301617
膝骨性关节炎(KOA)是一种膝关节慢性退行性病变,其主要病理变化包括关节软骨进行性丧失和破坏,软骨下骨增厚,骨赘形成[1],主要表现为关节疼痛、肿大、僵硬,对患者生活质量造成极大影响,是中老年群体常见病之一。调查显示,中国65岁以上膝痛人群KOA患病率超过50 %,75岁以上膝痛人群KOA患病率超过80%[2]。骨质疏松症(OP)是一种全身性代谢性骨病,以骨量低下、骨微结构损坏为主要病理特征[3],进而导致骨脆性增加,易使患者发生骨折。调查显示,中国OP患病率较高,65岁以上人群OP患病率达32%,成为中国中老年人群重要健康问题[4]。
在传统中医理论中,KOA与OP均属于“痹证”“骨痹”“骨痿”等病证范畴,《素问·六节藏象论》中记载:“肾者,主蛰,封藏之本,精之处也;其华在发,其充在骨。”《灵枢·经脉》中记载:“足少阴气绝,则骨枯。”《素问·痿论》中记载:“肾气热,则腰脊不举,骨枯而髓减,发为骨痿。”肾藏精,精化髓,髓充于骨,肾精亏虚则骨失充养。精血同源,肾精亏虚则无以化生气血,造成血虚、血瘀,进一步加重骨病。可见“痿证”“痹证”病机与“肾虚血瘀”有密切关联,故临床常以补肾活血法治疗此类病症,疗效显著且安全性较高[5]。在西医理论中,KOA与OP是两种独立疾病,有着不同病因病机及病理特征。KOA多有软骨下骨密度病理性增加、骨赘增生等病理过程,而OP常伴有骨量丢失,两者矛盾的病理过程使其具体作用机制仍不明确。但随着对两种疾病深入研究,发现两种疾病均与骨和软骨形成与分解相关,在病理和治疗等方面均有着密切联系。经典Wnt/β-catenin信号通路在骨细胞增殖调控中具有重要意义,它以多种途径调节膝关节软骨细胞的形成与凋亡及骨细胞增殖发育[6]。中药能多成分、多靶点治疗疾病,对于治疗“共病”有显著优势。Wnt/β-catenin信号通路是补肾活血中药治疗慢性筋骨疾病的经典途径之一,许多研究者基于Wnt/β-catenin信号通路方面从补肾活血中药单体、提取物进行广泛探索。本研究主要从Wnt/β-catenin信号通路与KOA、OP两种疾病之间的联系及补肾活血中药单体调控Wnt/β-catenin信号通路治疗KOA与OP“共病”机制方面进行综述。
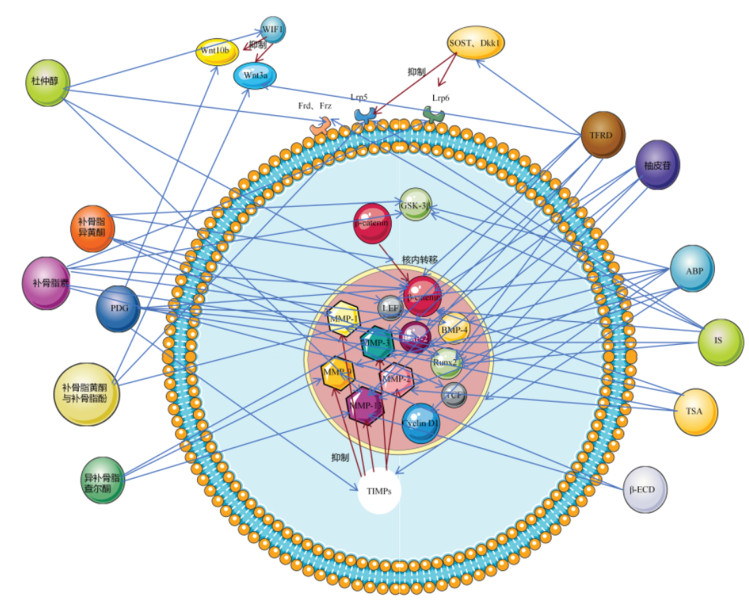
1 Wnt/β-catenin信号通路组成及作用机制Wnt/β-catenin信号通路主要构成包括[7-8]:细胞外信号蛋白,如Wnts蛋白;跨膜受体,包括辅助受体低密度脂蛋白受体相关蛋白5/6(LRP5/6)、卷曲蛋白(Frz、Fzd);胞质蛋白,包括轴蛋白(Axin)、散乱蛋白(Dsh)、腺瘤性结肠息肉病基因相关蛋白(APC)、β-catenin、糖原合成激酶-3β(GSK-3β);核内转录因子,包括T细胞因子/淋巴增强因子家族(TCF/LEF);下游靶基因及相关蛋白,包括基质金属蛋白酶(MMPs)、细胞周期蛋白D1(Cyclin D1)、骨形态发生蛋白(BMPs)、Runt相关转录因子2(Runx2)等。经典Wnt/β-catenin信号通路通过Wnt配体与跨膜受体结合启动,使细胞内β-catenin保持稳定、积累并向核内转运,在核内与TCF/LEF相互作用,最后激活靶基因发挥作用。若Wnt蛋白无法与Frz和LRP5/6结合,APC、GSK-3β、Axin三者将形成降解复合物与细胞质β-catenin结合,使β-catenin磷酸化后通过泛素蛋白酶体途径降解,导致细胞质中β-catenin水平显著降低,通路将受抑制进而影响下游靶基因表达。Wnt信号通路传导还受到Wnt特异性抑制物调节[9]。Wnt通路特异性抑制物有分泌型卷曲相关蛋白(sFRP)、Wnt抑制因子(WIF)、硬化蛋白基因(SOST)转录产物、dickkopf相关蛋白(Dkk)等。
2 Wnt/β-catenin信号通路与KOA与OP“共病”KOA与OP的发生均与骨代谢密切相关[10]。KOA的主要病理特征是关节软骨进行性丧失和破坏,软骨下骨增厚,骨赘形成;OP主要病理特征是骨量低下、骨微结构损坏。骨量受成骨细胞和破骨细胞之间平衡的影响。骨微结构损坏导致关节软骨下骨微结构异常,造成关节软骨进行性丧失和破坏、软骨下骨增厚和骨赘形成。因此,KOA与OP的发病均与骨量低下和骨微结构损坏密切相关,骨和软骨形成与分解是KOA与OP“共病”病程中的关键。
经典Wnt/β-catenin信号通路与骨和软骨稳态关系紧密。通路通过抑制替代间充质分化途径,如脂肪细胞和软骨细胞分化,促进成骨细胞定向分化增殖和矿化活性,同时阻断成骨细胞凋亡。激活经典Wnt/β-catenin信号通路还促使软骨下骨增厚和骨赘形成,使病程发展、症状加重[11]。调节经典Wnt/β-catenin信号通路中关键因子水平,进而调节骨和软骨稳态,可以影响KOA与OP“共病”。
2.1 基质金属蛋白酶和金属蛋白酶抑制因子MMPs是一类水解酶,组织金属蛋白酶抑制剂(TIMPs)是MMPs抑制剂。血清中MMP-1、MMP-2、MMP-3、MMP-9、MMP-13及TIMP-1水平均与骨代谢有着紧密联系[12-13]。MMP-2、MMP-9能影响破骨细胞激活及其活性,参与骨重塑和构建并表达骨吸收活性,MMP-13参与骨胶原降解。MMPs增加往往伴随着患处软骨受损[14-15],其中血清MMP-3、MMP-13水平与KOA关系更加密切。因此,MMPs与KOA与OP“共病”联系密切,在KOA与OP发病过程中,MMPs水平增加均导致病情发展加快,可通过抑制MMPs治疗“共病”。
2.2 Wnts蛋白Wnt是Wnt/β-catenin信号通路核心因子,与骨密度和骨代谢相关[16]。目前已知Wnt蛋白有19种,其中Wnt1、Wnt7a、Wnt6、Wnt10a和Wnt10b能通过Wnt/β-catenin信号通路促进骨髓间充质细胞(BMSCs)成骨分化;Wnt6、Wnt10a、Wnt10b还可以抑制BMSCs其他分化途径;Wnt3a、Wnt4、Wnt5a参与破骨细胞分化[17]。研究发现Wnt3a、Wnt5a、Wnt7a异常表达能引起相关靶基因表达,影响软骨化生,从而影响KOA发病[18-19]。
2.3 dickkopf蛋白Dkk是Wnt通路特异性抑制物之一,与骨吸收关系密切,能维持骨细胞生成和凋亡相对平衡。Dkk通过与LRP6直接结合,可抑制Wnt/β-catenin信号通路转导,增加成骨细胞数量,减少破骨细胞数量[20];还能对KOA软骨破坏起到抑制作用,从而减少骨赘发生,减缓KOA病情进展[21-22]。
2.4 骨形态发生蛋白BMPs分为4个亚族,其中BMP-2、BMP-6、BMP-7、BMP-9促进骨愈合,而BMP-3、BMP-13抑制骨生长。BMPs诱导BMSCs分化为成骨细胞,并促进成骨细胞分化、增殖和矿化;BMP-2还可通过诱导Wnt1、Wnt3a、LRP5表达来调节Wnt/β-catenin信号通路传导[23];BMP-3、BMP-13能导致KOA进一步加重,其表达随着KOA进展而增加[24-25];BMP-9通过增加软骨细胞增殖与迁移,抑制关节软骨退变进而延缓KOA进程[26]。
2.5 Runt相关转录因子2下游靶基因Runx2表达产物能刺激成骨分化和骨形成[27],还能调控软骨及骨骼发育,调节细胞外基质降解酶表达。Runx2表达增强会促进软骨降解,加重病理改变[28]。
2.6 其他相关因子LRP5是骨密度调节剂,其功能丧失、突变与KOA有关。Wnt/β-catenin信号通路可通过调控LRP5表达,促成骨细胞增殖[29];TCF1、Cyclin D1、sFRP表达水平也与OP病程发展有关[30]。
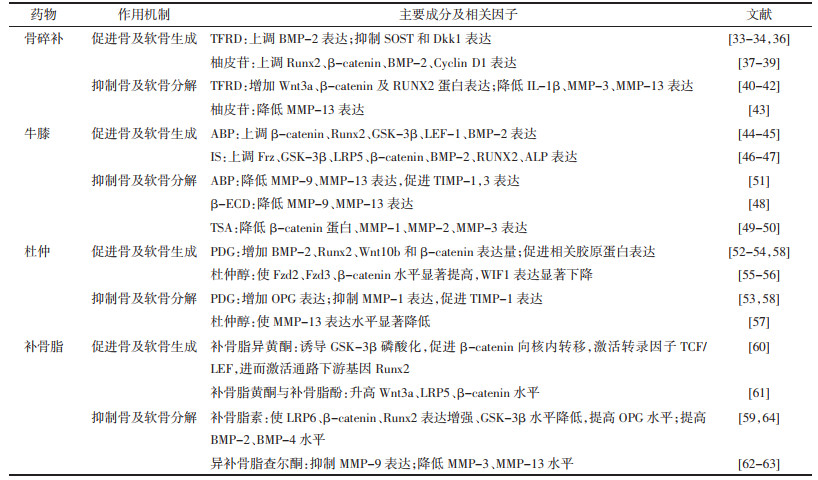
3 基于Wnt/β-catenin信号通路补肾活血中药治疗KOA与OP“共病”根据近年来实验和数据分析[31-32],可知骨碎补、牛膝、杜仲、补骨脂等在治疗KOA与OP领域研究较多。上述中药含有多种有效成分,能多靶点调节Wnt/β-catenin信号通路相关因子水平,推测其对KOA与OP“共病”有一定疗效。以下基于Wnt/β-catenin信号通路,以骨碎补[33-43]、牛膝[44-51]、杜仲[52-58]、补骨脂[59-64]为例,对于补肾活血中药治疗KOA与OP“共病”进行讨论。见表 1,图 1。
|
|
| 注:本图使用powerpoint绘图。 图 1 补肾活血中药通过调控Wnt/β-catenin信号通路干预KOA与OP“共病”的分子机制 Fig. 1 Molecular mechanism of traditional Chinese medicines for reinforcing kidney and activating blood circulation in intervention of knee osteoarthritis and osteoporosis"co-morbidity" by regulating Wnt/β-catenin signaling pathway |
骨碎补为水龙骨科植物槲蕨Drynaria roosii Nakaike的干燥根茎。骨碎补有效成分主要有黄酮类物质骨碎补总黄酮(TFRD)和二氢黄酮类物质柚皮苷等。
TFRD能够显著抑制骨细胞中Wnt特异性抑制物SOST和Dkk1表达,激活Wnt/β-catenin信号通路,提高OP大鼠骨质量和骨强度、刺激骨形成[33-34];能增加Wnt3a、β-catenin及RUNX2蛋白表达以减少骨量丢失[35];能上调BMP表达,诱导BMSCs分化为新骨,提高大鼠骨密度[36];还能通过降低IL-1β、MMP-3、MMP-13表达,从而抑制KOA软骨退行性改变、细胞外基质降解和滑膜炎症[40-42],对KOA早、中、晚期软骨退变有明显改善作用。
柚皮苷能通过上调Runx2、β-catenin、BMP-2、Cyclin D1蛋白表达提高骨细胞增殖分化能力[37-39];可降低MMP-13表达,进而调节软骨细胞基质和改善炎性微环境[43]。
3.2 牛膝牛膝是苋科植物牛膝(怀牛膝)Achyranthes bidentata Bl.的干燥根。牛膝多糖(ABP)、牛膝甾酮(IS)、脱皮甾酮(ECD)、牛膝总皂苷(TSA)是牛膝主要有效成分。
ABP能显著上调大鼠骨折端骨组织β-catenin、Runx2、GSK-3β、LEF-1、BMP-2表达,同时使骨小梁数量增多,形态增粗,连续性增加,进而促进骨生成[44-45];使软骨组织MMP-9、MMP-13表达水平均明显降低,TIMP-1、TIMP-3表达水平均明显升高,减缓软骨退化,改善细胞外基质(ECM)状态[51]。
IS能上调Frz、GSK-3β、LRP5、β-catenin表达,从而促进成骨细胞增殖分化[46];还提高了BMP-2、RUNX2、碱性磷酸酶(ALP)表达水平,促进成骨分化和细胞矿化[47]。β-ECD使MMP-9、MMP-13表达均明显降低,Ⅱ型胶原mRNA表达明显升高,证明了β-ECD能抑制软骨破坏、促进软骨修复,进而延缓关节软骨细胞退变[48]。TSA能使滑膜组织β-catenin蛋白、MMP-1、MMP-2、MMP-3表达水平均降低,从而减轻炎症、保护软骨和缓解骨关节炎膝关节活动障碍[49-50]。
3.3 杜仲杜仲是杜仲科植物杜仲Eucommia ulmoides Oliv.的干燥树皮。杜仲主要有效成分有松脂醇二葡萄糖苷(PDG)和杜仲醇等。
PDG能够使离体骨密度均明显增高,BMP-2、Runx2、护骨因子(OPG)、Wnt10b和β-catenin蛋白表达量明显增多,可能通过促进成骨细胞骨形成和抑制骨吸收来提高骨质量与骨强度[52-54];能抑制MMP-1表达,促进相关胶原蛋白和TIMP-1表达,减少软骨中胶原降解[58]。
杜仲醇提取物能使Fzd2、Fzd3、β-catenin水平显著提高,Wnt抑制因子1(WIF1)表达显著下降,促进骨髓间充质干细胞成骨性分化[55-56];使MMP-13表达水平显著降低,能减轻炎症反应、调节关节软骨ECM降解和抑制软骨细胞凋亡,发挥骨关节炎大鼠关节软骨保护作用[57]。
3.4 补骨脂补骨脂为豆科植物补骨脂Psoralea corylifolia L.的干燥成熟果实。补骨脂主要有效成分有补骨脂素、补骨脂黄酮、补骨脂异黄酮、补骨脂酚、异补骨脂查尔酮等。
补骨脂素能使LRP6、β-catenin、Runx2表达增强、GSK-3β水平降低,提高大鼠骨密度,提高血清及骨组织OPG水平,进而减少骨组织分解代谢[59];对BMP-2、BMP-4蛋白表达均有不同程度增强,能够促进关节软骨稳定,抑制关节软骨分解,减缓KOA发生与发展[64]。补骨脂异黄酮可诱导GSK-3β磷酸化,促进β-catenin向核内转移,激活转录因子TCF/LEF,进而激活通路下游基因Runx2,促进成骨细胞增殖与分化,从而促进骨形成[60]。补骨脂黄酮与补骨脂酚联用使Wnt3a、LRP5、β-catenin水平升高,促进成骨细胞分化[61]。异补骨脂查尔酮能抑制MMP-9表达,进而抑制破骨细胞功能,减少骨量丢失[62];使MMP-3、MMP-13水平显著下降,证明异补骨脂查尔酮能减轻软骨降解、保护软骨[63]。
4 总结与展望KOA与OP是两种常见慢性骨病,在中国发病率较高,是中国中老年人常见健康问题,且会使患者生活质量受到严重影响。随着中国人口老龄化加重,KOA与OP发病率仍在持续升高。虽然是两种独立疾病,但临床上两种疾病经常伴随发生。经典西医疗法通常分别治疗两种疾病,疗效差、服用药物种类较多,伴随着更高经济负担和更多不良反应。中药含有多种有效成分,多靶点、多功效治疗疾病,对“共病”治疗有极大优势,近年来受到广泛关注。在动物模型和体外实验中,补肾活血中药均表现出促进骨和软骨生成、抑制骨和软骨破坏的作用[64]。关于补肾活血中药通过调控Wnt/β-catenin信号通路治疗KOA与OP“共病”分子机制研究已较为深入,主要包括以下几点:1)抑制MMPs水平、提高TIMPs水平,缓解骨和软骨破坏。2)调节Wnts蛋白水平,促进成骨分化和软骨化生,抑制破骨分化。3)上调Dkk水平,进而促进骨细胞分化增殖、抑制软骨细胞破坏和骨赘增生。4)调控BMPs家族不同亚型,促进成骨细胞分化、增殖和矿化,抑制软骨破坏。5)调节Runx2水平,刺激成骨分化、抑制软骨降解。尽管目前研究较多,但现阶段关于补肾活血中药对KOA与OP影响的研究大多仍停留在动物实验及体外实验阶段,临床数据较少,说服力略显不足。随着学者们对补肾活血中药研究不断深入,越来越多药理作用及分子机制将会被发现,为新药开发和临床应用提供更多有力依据。
| [1] |
CHEN D, SHEN J, ZHAO W W, et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism[J]. Bone Research, 2017, 5: 16044. DOI:10.1038/boneres.2016.44 |
| [2] |
SONG P G, RUDAN D A, ZHU Y J, et al. Global, regional, and national prevalence and risk factors for peripheral artery disease in 2015: An updated systematic review and analysis[J]. The Lancet Global Health, 2019, 7(8): e1020-e1030. DOI:10.1016/S2214-109X(19)30255-4 |
| [3] |
中华医学会骨质疏松和骨矿盐疾病分会, 章振林. 原发性骨质疏松症诊疗指南(2022)[J]. 中国全科医学, 2023, 26(14): 1671-1691. DOI:10.12114/j.issn.1007-9572.2023.0121 |
| [4] |
中华医学会骨质疏松和骨矿盐疾病分会. 中国骨质疏松症流行病学调查及"健康骨骼" 专项行动结果发布[J]. 中华骨质疏松和骨矿盐疾病杂志, 2019, 12(4): 317-318. DOI:10.3969/j.issn.1674-2591.2019.04.001 |
| [5] |
尹润宇, 杨东元, 王世坤, 等. 补肾活血类中成药治疗膝骨性关节炎的有效性和安全性网状Meta分析[J]. 中草药, 2023, 54(13): 4266-4277. |
| [6] |
牛鲁豫, 张涛, 李嘉萌, 等. 软骨稳态与骨关节炎关系的研究进展[J]. 中华骨与关节外科杂志, 2024, 17(4): 377-384. DOI:10.3969/j.issn.2095-9958.2024.04.14 |
| [7] |
李涛, 吴山, 范志勇, 等. 基于Wnt/β-catenin通路中医药疗法治疗骨相关疾病研究进展[J]. 辽宁中医药大学学报, 2020, 22(4): 117-121. |
| [8] |
谢健, 童培建, 肖鲁伟. Wnt/β-catenin信号通路调节软骨代谢作用于骨坏死疾病的研究进展[J]. 中国骨伤, 2013, 26(7): 613-616. |
| [9] |
YU M, QIN K, FAN J M, et al. The evolving roles of Wnt signaling in stem cell proliferation and differentiation, the development of human diseases, and therapeutic opportunities[J]. Genes & Diseases, 2024, 11(3): 101026. |
| [10] |
曾国庆, 董铿, 黄建军. 膝骨关节炎与骨质疏松症的相关性分析[J]. 中国卫生标准管理, 2023, 14(18): 94-97. |
| [11] |
MONROE D G, MCGEE-LAWRENCE M E, OURSLER M J, et al. Update on Wnt signaling in bone cell biology and bone disease[J]. Gene, 2012, 492(1): 1-18. DOI:10.1016/j.gene.2011.10.044 |
| [12] |
黄金元, 赵雅靓, 李云芳. 骨质疏松症与血清基质金属蛋白酶的相关性[J]. 湖北中医药大学学报, 2015, 17(1): 111-112. |
| [13] |
郭家全, 王起奎, 赵明明, 等. 骨质疏松性胸腰椎压缩骨折MRI影像学表现及与血清MMP-3、TIMP-1、IL-6相关性研究[J]. 河北医药, 2023, 45(5): 736-739. |
| [14] |
赵婧, Singh S. 血清MMP-3与膝关节骨性关节炎[J]. 中国康复, 2023, 38(9): 547. |
| [15] |
LI Z, YUAN B, PEI Z, et al. Circ_0136474 and MMP-13 suppressed cell proliferation by competitive binding to miR-127-5p in osteoar-thritis[J]. Journal of Cellular and Molecular Medicine, 2019, 23(10): 6554-6564. |
| [16] |
郭迪, 高志攀, 张亚平, 等. 针刺通过Wnt信号通路对绝经后骨质疏松骨折大鼠骨密度和骨代谢的作用研究[J]. 中国骨质疏松杂志, 2023, 29(3): 349-355, 384. |
| [17] |
WEIVODA M M, RUAN M, HACHFELD C M, et al. Wnt signaling inhibits osteoclast differentiation by activating canonical and noncanonical cAMP/PKA pathways[J]. Journal of Bone and Mineral Research, 2019, 34(8): 1546-1548. |
| [18] |
刘晶, 林巧璇, 卢莉铭, 等. 基于Wnt3a/β-catenin信号通路探讨针刀对膝骨关节炎兔股直肌纤维化的影响[J]. 中华中医药杂志, 2022, 37(1): 136-140. |
| [19] |
申海艳, 周静, 肖丽娜, 等. 苗药五藤膏对膝关节炎兔GSK-3β、Wnt3a、Wnt5a、Wnt7a表达的影响[J]. 中国老年学杂志, 2023, 43(14): 3425-3430. |
| [20] |
HILDEBRANDT N, COLDITZ J, DUTRA C, et al. Role of osteogenic Dickkopf-1 in bone remodeling and bone healing in mice with type Ⅰ diabetes mellitus[J]. Scientific Reports, 2021, 11(1): 1920. |
| [21] |
ZAREI A, HULLEY P A, SABOKBAR A, et al. Co-expression of DKK-1 and sclerostin in subchondral bone of the proximal femoral heads from osteoarthritic hips[J]. Calcified Tissue International, 2017, 100(6): 609-618. |
| [22] |
TIMMERMANS R G M, BLOM A B, NELISSEN R G H H, et al. Mechanical stress and inflammation have opposite effects on Wnt signaling in human chondrocytes[J]. Journal of Orthopaedic Research, 2024, 42(2): 286-295. |
| [23] |
ZHANG Y, ZUO T, MCVICAR A, et al. Runx1 is a key regulator of articular cartilage homeostasis by orchestrating YAP, TGFβ, and Wnt signaling in articular cartilage formation and osteoarthritis[J]. Bone Research, 2022, 10(1): 63. |
| [24] |
JASWAL A P, KUMAR B, ROELOFS A J, et al. BMP signaling: a significant player and therapeutic target for osteoarthritis[J]. Osteoarthritis and Cartilage, 2023, 31(11): 1454-1468. |
| [25] |
PÉREZ-LOZANO M L, SUDRE L, VAN EEGHER S, et al. Gremlin-1 and BMP-4 overexpressed in osteoarthritis drive an osteochondral-remodeling program in osteoblasts and hypertrophic chondrocytes[J]. International Journal of Molecular Sciences, 2022, 23(4): 2084. |
| [26] |
李大壮. Gai1/3介导BMP9信号转导促进软骨细胞分化进而抑制骨关节炎的机制研究[D]. 苏州: 苏州大学, 2021.
|
| [27] |
冯晨曦, 殷澳, 侯相竹, 等. 中药多糖治疗骨质疏松症和骨关节炎作用机制的研究进展[J]. 中国实验方剂学杂志, 2023, 29(10): 264-273. |
| [28] |
谌超, 付桂仙, 杨明晓, 等. Runx2在骨关节炎发生发展中的作用[J]. 中国现代医学杂志, 2022, 32(15): 67-72. |
| [29] |
KHRYSTOFOROVA I, SHOCHAT-CARVALHO C, HARARI R, et al. Zebrafish mutants reveal unexpected role of Lrp5 in osteoclast regulation[J]. Frontiers in Endocrinology, 2022, 13: 985304. |
| [30] |
李兰. 葛根素通过Wnt4/β-catenin信号通路抑制绝经后骨质疏松的机制研究[D]. 右江: 右江民族医学院, 2021.
|
| [31] |
康照宁, 徐林轩, 蔡余力. 单味中药治疗骨质疏松症的机理研究[J]. 中医临床研究, 2022, 14(8): 70-72. |
| [32] |
陶帅, 万长安, 姜宏. 基于数据挖掘的膝骨关节炎内服汤剂用药规律研究[J]. 山西中医, 2022, 38(7): 52-55. |
| [33] |
蒋宁宁. 基于Wnt/β-catenin通路和OPG/RANKL/RANK轴研究二甲双胍联合骨碎补总黄酮抗骨质疏松作用[D]. 长春: 吉林大学, 2023.
|
| [34] |
张莉丽, 张布衣, 余阳. 骨碎补总黄酮上调骨质疏松症模型大鼠Wnt/LRP-5/β-catenin通路表达的研究[J]. 中国骨质疏松杂志, 2023, 29(6): 807-811. |
| [35] |
沈智, 曾景奇, 李益亮, 等. 骨碎补总黄酮对悬尾实验性骨质疏松模型大鼠骨密度及BMP-2 mRNA的影响[J]. 中医药导报, 2019, 25(21): 33-36. |
| [36] |
孙景春, 金辉, 杨雯棋, 等. 骨碎补总黄酮对骨质疏松大鼠骨组织中硬化蛋白表达的影响及其作用机制[J]. 吉林大学学报(医学版), 2020, 46(5): 911-916, 1111. |
| [37] |
GAN J W, DENG X L, LE Y H, et al. The development of naringin for use against bone and cartilage disorders[J]. Molecules, 2023, 28(9): 3716. |
| [38] |
WANG L, ZHANG Y G, WANG X M, et al. Naringin protects human adipose-derived mesenchymal stem cells against hydrogen peroxide-induced inhibition of osteogenic differentiation[J]. Chemico-Biological Interactions, 2015, 242: 255-261. |
| [39] |
张亚龙, 尹文哲, 孙奇峰, 等. 模拟微重力下骨碎补柚皮苷对T细胞干预的成骨细胞BMP-2及OPN蛋白表达的影响[J]. 中医药学报, 2022, 50(11): 25-30. |
| [40] |
陈戟霞. 骨碎补总黄酮对兔不同病变期膝关节骨性关节炎IL-1β、MMP-3、MMP-13水平影响的实验研究[D]. 右江: 右江民族医学院, 2017.
|
| [41] |
金连峰. 骨碎补对骨性关节炎家兔作用的实验研究[J]. 中华中医药学刊, 2016, 34(8): 1953-1957. |
| [42] |
戈兵, 郭开今, 陈宏亮. 骨碎补总黄酮对实验性兔膝骨性关节炎软骨及滑膜的影响[J]. 徐州医学院学报, 2008, 28(12): 835-837. |
| [43] |
胡静, 刘想忠, 石正帅, 等. 柚皮苷对白介素-1β诱导的兔关节软骨细胞炎性反应的调节作用[J]. 中华中医药学刊, 2020, 38(12): 38-41. |
| [44] |
杨豪, 曾范慧. 牛膝多糖调控Wnt/β-catenin通路改善骨质疏松性骨折大鼠骨代谢的研究[J]. 中医学报, 2021, 36(10): 2188-2194. |
| [45] |
余阗, 彭力平, 马笃军, 等. 牛膝总皂苷对实验兔膝骨关节炎滑膜组织的影响[J]. 中国中医骨伤科杂志, 2017, 25(6): 1-5. |
| [46] |
陈庆真. 补肾中药调控ERα-AMPK-Wnt/β-catenin信号通路促进成骨细胞增殖分化的研究[D]. 广州: 广州中医药大学, 2020.
|
| [47] |
CHEN Q, YANG Z H, SUN X Y, et al. Inokosterone activates the BMP2 to promote the osteogenic differentiation of bone marrow mesenchymal stem cells and improve bone loss in ovariectomized rats[J]. Biochemical and Biophysical Research Communications, 2023, 682: 349-358. |
| [48] |
汤样华, 徐灿达, 岳振双, 等. β-蜕皮甾酮抑制IL-1β诱导的关节软骨细胞蜕变的实验研究[J]. 中国中医药科技, 2020, 27(3): 366-369. |
| [49] |
高坤, 张勇, 陈大宇, 等. 牛膝总皂苷干预兔膝骨关节炎滑膜液来源细胞因子的表达[J]. 中国组织工程研究, 2019, 23(33): 5317-5321. |
| [50] |
李天钰. 六种植物中糖聚物的体外促成骨活性及作用机制研究[D]. 广州: 广东药科大学, 2021.
|
| [51] |
郑曲, 张宇, 杨永菊, 等. 牛膝及其活性成分治疗骨关节炎的研究现状[J]. 中国临床药理学杂志, 2023, 39(20): 3032-3036. |
| [52] |
谢高倩, 高玉海, 魏朋, 等. 松脂醇二葡萄糖苷对青年大鼠骨代谢的影响[J]. 中国药理学通报, 2022, 38(12): 1785-1790. |
| [53] |
孙悦. 松脂醇二葡萄糖苷促进大鼠骨髓间充质干细胞成骨性分化及其分子机制研究[D]. 兰州: 兰州理工大学, 2023.
|
| [54] |
吴思敏. 松脂醇二葡萄糖苷对体外培养成骨细胞成骨性分化的影响与机制研究[D]. 兰州: 兰州理工大学, 2021.
|
| [55] |
汤军. 杜仲醇提取物诱导大鼠骨髓间充质干细胞成骨分化中Wnt信号通路研究[D]. 南京: 南京中医药大学, 2013.
|
| [56] |
张贤, 朱丽华, 钱晓伟, 等. 杜仲醇提取物诱导骨髓间充质干细胞成骨分化中的Wnt信号途径[J]. 中国组织工程研究, 2012, 16(45): 8520-8523. |
| [57] |
杨德猛, 王长庚, 胡芯源, 等. 杜仲醇提取物对骨关节炎模型大鼠关节软骨的保护[J]. 中国组织工程研究, 2022, 26(23): 3756-3761. |
| [58] |
楼红侃, 许旻鸣, 方剑利, 等. 基于PI3K/Akt信号通路探讨松脂醇二葡萄糖苷对兔膝骨性关节炎软骨细胞保护机制的研究[J]. 中华中医药学刊, 2023, 41(1): 190-193, 286-289. |
| [59] |
王健, 张驰. 基于Wnt/β-连环素通路探讨补骨脂素对骨质疏松症大鼠的影响[J]. 世界中医药, 2022, 17(12): 1697-1702. |
| [60] |
YU A X, XU M L, YAO P, et al. Corylin, a flavonoid derived from Psoralea Fructus, induces osteoblastic differentiation via estrogen and Wnt/β-catenin signaling pathways[J]. FASEB Journal, 2020, 34(3): 4311-4328. |
| [61] |
WENG Z B, GAO Q Q, WANG F, et al. Positive skeletal effect of two ingredients of Psoralea corylifolia L. on estrogen deficiency-induced osteoporosis and the possible mechanisms of action[J]. Molecular and Cellular Endocrinology, 2015, 417: 103-113. |
| [62] |
WANG X Y, JI Q B, HU W H, et al. Isobavachalcone prevents osteoporosis by suppressing activation of ERK and NF-κB pathways and M1 polarization of macrophages[J]. International Immunopharmacology, 2021, 94: 107370. |
| [63] |
GUO Q, ZHANG M, DONG Y H, et al. Isobavachalcone ameliorates the progression of osteoarthritis by suppressing NF-κB signaling pathway[J]. International Immunopharmacology, 2023, 119: 110102. |
| [64] |
李佳, 朱爱松, 谢晚晴, 等. 关于补肾中药防治骨关节炎分子机制的体外实验研究[J]. 中国骨质疏松杂志, 2016, 22(7): 877-882. |
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China;
3. National Clinical Research Center of Acupuncture and Moxibustion, Tianjin 300381, China;
4. College of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41