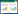1. 南京中医药大学附属苏州市中医医院妇一科, 苏州 215009;
2. 南京中医药大学附属医院, 南京 210029;
3. 南京中医药大学附属苏州市中医医院超声科, 苏州 215009;
4. 南京中医药大学附属苏州市中医医院吴门医派研究院, 苏州 215009
收稿日期:2023-11-15
基金项目:国家自然科学基金项目(82305297);苏州市科技发展计划(医疗卫生科技创新)项目(SKY2021057);苏州市姑苏卫生人才计划科研项目(GSWS2022082);苏州市“科教兴卫”青年科技项目(KJXW2020046);南京中医药大学自然科学基金项目(XZR2020037)
作者简介:徐丹(1989-), 女, 博士, 副主任中医师, 研究方向为妇科内分泌疾病的临床与基础研究.
多囊卵巢综合征(PCOS)是最常见的生殖及代谢障碍性疾病,患病率高达8%~13%[1],是育龄期女性不孕的主要原因之一[2],其病因异质、表现多样、治疗困难,是国内外妇科生殖领域研究的难点和热点。研究显示,44%~70%[3]的PCOS患者合并胰岛素抵抗(IR),IR被认为是PCOS病理生理改变的核心环节之一。IR不仅会促进PCOS雄激素分泌,阻碍卵泡发育,还会明显增加子宫内膜疾病、糖脂代谢紊乱、脂肪肝及远期心血管疾病的发生风险[4]。近年来,随着调整内分泌代谢及促生育策略的日益成熟,PCOS排卵率可高达80%,但累计妊娠率仅为30%~40%[5],且流产率显著增高[6]。此外,即便是辅助生殖技术(ART)很大程度上解决了胚胎质量问题,PCOS妊娠率也依然不令人满意[7]。越来越多的研究[4, 8-10]表明,全身及局部IR可能是导致PCOS生育力低下的深层原因。因此,对延缓PCOS疾病进程、减少代谢并发症、提高妊娠率而言,IR的早重视、早评估、早干预至关重要。目前西医多采用二甲双胍治疗,但胃肠道不良反应较常见[11],且因二甲双胍能够潜在作用于胎盘和胎儿,故其对子代生长发育、代谢、生殖功能及神经心理发育的长期影响受到广泛关注[12-14]。因此,积极研发有效、安全的治疗药物成为相关领域研究的主流方向。中医药治疗PCOS不孕症具有独特优势,且服药安全性高[15-17]。补肾化痰活血方是治疗肾虚痰瘀型PCOS-IR的经验方,由国医大师夏桂成教授的临床验方—化痰促排卵汤化裁而来。本研究采用前瞻性、随机、对照的方法对补肾化痰活血方进行规范性临床研究,以进一步明确补肾化痰活血方临床疗效,以期为其临床推广应用奠定基础,现报道如下。
1 资料与方法
1.1 诊断标准
1.1.1 西医诊断
PCOS诊断标准参照2018年中华医学会妇产科学分会内分泌学组及指南专家组《多囊卵巢综合征中国诊疗指南》[18]制定:1)月经稀发或闭经或不规则子宫出血。2)高雄激素临床表现或高雄激素血症。3)超声下表现为卵巢多囊样改变[一侧或双侧卵巢有12个以上直径为2~9 mm的卵泡和(或)卵巢体积大于10 mL]。1)为必备项,2)和3)两项至少具备1项,同时排除其他原因导致的高雄激素血症者,如Cushing综合征、非典型先天性肾上腺皮质增生、卵巢或肾上腺分泌雄激素肿瘤等;其他原因导致的排卵功能障碍者,如下丘脑-垂体功能低下、甲状腺疾病、高催乳素血症及卵巢功能不全等。
IR诊断标准根据参考文献[19]流行病学调查资料制定。用稳态模型胰岛素抵抗指数(HOMA-IR)评价IR:HOMA-IR=空腹血糖(FBG)×空腹胰岛素(FINS)/22.5,HOMA-IR≥1.66为IR。
不孕症诊断标准参照《妇产科学》[20]中关于女性不孕症的诊断标准。
1.1.2 中医诊断
参照《中药新药临床研究指导原则》[21]及《中医妇科学》第7版[22]教材有关肾虚痰瘀型月经不调的中医诊断标准:1)主证:月经后期甚至闭经,或月经量少,或崩漏不止。2)次证:肥胖,腰膝酸软,胸胁满闷,乏力,畏寒,口腻痰多,大便溏薄,多毛,项背部及阴唇等处皮肤灰褐色色素沉着。3)舌脉:舌质暗红或淡暗,夹有瘀点或紫气,舌体胖大或有齿痕,苔薄白或白腻或黄腻,脉沉细或细弦或细滑。具备主症1项,次症2项或以上,加舌脉即可诊断。
1.2 纳入标准
1)符合上述西医PCOS及中医肾虚痰瘀型月经不调辨证标准。2)符合上述IR诊断标准。3)符合上述不孕症诊断标准。4)年龄20~40岁。5)配偶性功能及精液常规检查基本正常。6)签署知情同意书。
1.3 排除标准
1)子宫、卵巢器质性疾病者。2)其他原因导致的不孕症者。3)月经周期第2~4 d卵巢内见≥10 mm的无回声区者。4)合并有严重肝肾、心脑血管疾病、造血系统功能障碍及精神病者。5)近3个月服用激素类药物或参加其他临床试验者。6)对本研究药物过敏或过敏体质。7)未能遵医嘱规范用药,不能配合完成研究者。
1.4 一般资料
选取2018年9月—2021年3月期间诊治的肾虚痰瘀型PCOS-IR患者62例为研究对象,随机分为治疗Ⅰ组和治疗Ⅱ组,每组各31例。本研究通过医院伦理委员会审批(2020伦研批019)。两组患者在年龄、病程、体质量、身高、身体质量指数(BMI)、中医证候积分、FBG、FINS、HOMA-IR、睾酮(T)、促黄体生成素(LH)、卵泡刺激素(FSH)、LH/FSH、雌二醇(E2)、泌乳素(PRL)比较,差异无统计学意义(P>0.05)。两组具有可比性。见表 1。
表 1 两组患者一般情况资料比较(x±s)
Tab. 1
Comparison of general data of patients between the two groups(x±s)
1.5 治疗方法
1.5.1 治疗Ⅰ组
以基础治疗为前提,包括生活方式干预、降雄激素、诱导排卵及定期心理干预等,给予二甲双胍片(格华止,中美上海施贵宝,规格:0.5 g×20片/盒,批号:H20023370),每次0.5 g,每日3次(随餐服用)。连续治疗3个月经周期或至确认妊娠。
1.5.2 治疗Ⅱ组
以基础治疗为前提(同治疗Ⅰ组),自月经周期第5天起给予补肾化痰活血方,方剂组成为:菟丝子15 g,淫羊藿15 g,熟地黄10 g,陈皮10 g,苍术10 g,茯苓10 g,川芎10 g,当归10 g,香附10 g,甘草6 g等,以上药物由南京中医药大学附属苏州市中医医院药剂科统一制备,煎制过程加水500 mL进行文火水煎40 min,煎煮后取药汁300 mL,每日1剂,分早、晚两次温服,经期停药5 d。连续治疗3个月经周期或至确认妊娠。
1.6 观察指标
1.6.1 人体测量学指标及临床症状
观察两组治疗前后体质量、BMI变化情况,受试者晨起空腹、排便后,穿着薄衣,测量体质量及身高,计算BMI=体质量/身高2。观察两组患者痤疮、多毛、黑棘皮病及中医症状[包括月经不调、腰膝酸软、形体肥胖、神疲乏力、四肢不温、乳房胀痛、纳差少食等(参照国家中医药管理局医政司《24个专业104个病种中医诊疗方案(试行)》制定)]分布构成比及治疗后的改善情况。
1.6.2 妊娠及排卵情况
排卵后14 d测定血清人绒毛膜促性腺激素(HCG)水平,HCG>5.0 mU/mL者2周后行常规二维超声检查,见卵黄囊者确定为临床妊娠[23](包括双妊娠囊和异位妊娠)。临床妊娠率=临床妊娠病例数/组总病例数×100%。妊娠患者随访期间每周行常规二维超声检查,若妊娠囊大小无变化、胚芽缺失或无胎心搏动[24],定义为胚胎停育。胚胎停育率=胚胎停育病例数/组总妊娠病例数×100%。
1.6.3 实验室相关指标
观察两组治疗前后FBG、FINS、HOMA-IR变化情况,受试者禁食8~10 h后,次日清晨空腹抽取静脉血,FBG采用己糖激酶法检测,FINS采用酶联免疫吸附测定(ELISA)法检测,计算HOMA-IR=FINS×FBG/22.5。观察两组治疗前后性激素(T、LH、FSH、E2、PRL)变化情况,受试者月经周期或撤药性出血第2~4天早晨8:00—9:00空腹抽取静脉血,采用化学发光法检测,计算LH/FSH。确认妊娠患者不予复查。
1.6.4 子宫内膜三维超声参数
比较两组治疗后着床期(排卵后6~9 d)子宫内膜三维超声参数[子宫内膜厚度、分型、容积、血管化指数(VI)、血流指数(FI)和血管化-血流指数(VFI)]。受试者排空大小便,取膀胱截石位,进行阴道三维超声检查,测量子宫内膜厚度,根据Apple-baum分型法[25]判断子宫内膜及内膜下血流灌注分型,采用容积模式对子宫内膜进行三维重建,计算子宫内膜容积、VI、FI和VFI。采用GE Voluson E8彩色超声诊断仪,RIG 9-D腔内探头,频率5.0~7.0 MHz。
1.6.5 安全性评价
检测两组治疗前后血常规、肝功能、肾功能,观察并记录服药及随访期间的不适症状(包括腹泻、恶心、呕吐、头晕、腹胀等)。
1.7 统计学方法
采用SPSS 24.0统计软件进行处理,计量资料经正态检验后服从正态分布且方差齐者以均数±标准差(x±s)表示。组内前后比较采用配对t检验,组间比较采用独立样本t检验,不服从正态分布者则采用非参数检验;计数资料用例数及百分比表示,组间比较采用χ2检验。P<0.05表示两组差异有统计学意义。
2 结果
2.1 研究完成情况
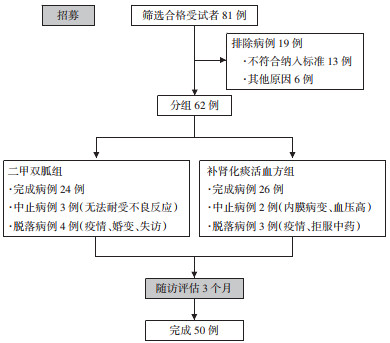
本研究筛选合格受试者81例,排除19例,共纳入肾虚痰瘀型PCOS-IR患者62例,治疗及随访期间中止及脱落12例(治疗Ⅰ组脱落4例、中止3例,治疗Ⅱ组脱落3例、中止2例),最终共纳入完整观察病例50例,其中治疗Ⅰ组24例,治疗Ⅱ组26例。见图 1。
2.2 两组患者治疗前后体质量、BMI及中医证候积分情况比较
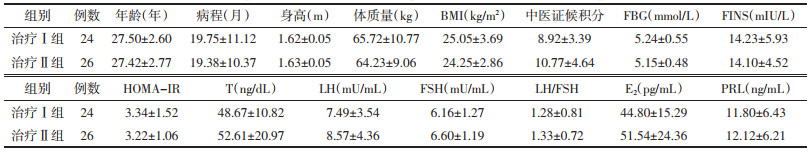
治疗后两组患者体质量、BMI及中医证候积分均下降,差异有统计学意义(P<0.05或P<0.01);与治疗Ⅰ组比较,治疗Ⅱ组患者治疗后中医证候积分改善明显,差异有统计学意义(P<0.01)。见表 2。
表 2 两组治疗前后体质量、BMI及中医证候积分比较(x±s)
Tab. 2
Comparison of body weight, BMI, and traditional Chinese medicine syndrome scores of patients between the two groups before and after treatment(x±s)
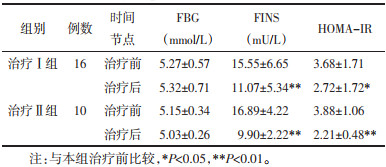
2.3 两组患者治疗前后糖代谢指标比较
确认妊娠的患者未予复查糖代谢指标情况,故治疗Ⅰ组检测16例,治疗Ⅱ组检验10例。治疗后两组患者血清FINS、HOMA-IR水平均显著降低(P<0.01或P<0.05),而FBG水平无明显改变(P>0.05);与治疗Ⅰ组比较,治疗Ⅱ组在降低FBG、FINS、HOMA-IR水平上差异均无统计学意义(P>0.05)。见表 3。
表 3 两组治疗前后糖代谢指标比较(x±s)
Tab. 3
Comparison of glucose metabolism of patients between the two groups before and after treatment(x±s)
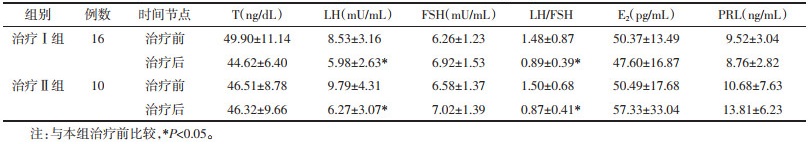
2.4 两组患者治疗前后性激素水平比较
确认妊娠的患者未予复查性激素水平情况,故治疗Ⅰ组检测16例,治疗Ⅱ组检测10例。治疗后两组患者血清LH、LH/FSH水平较明显下降(P<0.05);而FBG水平无明显改变(P>0.05);与治疗Ⅰ组比较,治疗Ⅱ组在改善T、LH、FSH、LH/FSH、E2、PRL水平上差异均无统计学意义(P>0.05)。见表 4。
表 4 两组治疗前后性激素水平比较(x±s)
Tab. 4
Comparison of sex hormone levels of patients between the two groups before and after treatment(x±s)
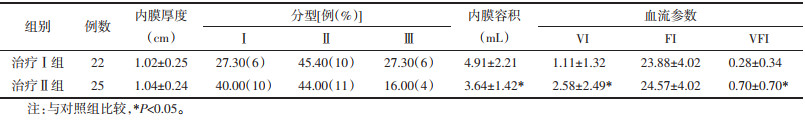
2.5 两组患者治疗后着床期三维超声参数比较
3个治疗周期均无排卵的患者未进行超声参数比较,故治疗Ⅰ组纳入22例,治疗Ⅱ组纳入25例。与治疗Ⅰ组比较(有两次或两次以上检查结果者各指标取其平均值),治疗Ⅱ组患者内膜血流参数VI、VFI水平显著升高(P<0.05)、内膜容积明显减小(P<0.05),余指标比较差异无统计学意义(P>0.05)。见表 5。
表 5 两组治疗后着床期三维超声参数比较(x±s)
Tab. 5
Comparison of three-dimensional ultrasound parameters during implantation period of patients between the two groups after treatment(x±s)
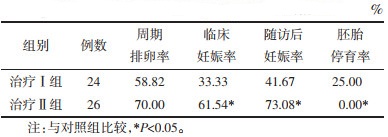
2.6 两组患者治疗后妊娠及排卵情况比较
治疗Ⅱ组周期排卵率70.00%(49/70)高于治疗Ⅰ组58.82%(30/68),但差异无统计学意义(P>0.05);治疗Ⅱ组治疗结束及随访3个月后的临床妊娠率分别为61.54%(16/26)及73.08%(19/26),显著高于治疗Ⅰ组对应时间节点的临床妊娠率[33.33%(8/24)和41.67%(10/24)],而胚胎停育率[0(0/16)]低于治疗Ⅰ组[25.00%(2/8)],差异有统计学意义(P<0.05)。见表 6。
表 6 两组治疗后排卵及妊娠情况比较
Tab. 6
Comparison of pregnancy rate and ovulation rate of patients between the two groups after treatment
2.7 安全性评价
治疗前后两组患者血常规、肝肾功能等均未见明显异常。治疗Ⅰ组有10例患者出现腹泻(3例中度、7例轻度),其中有2例患者同时还伴有纳差、恶心等不适症状,不良反应发生率为41.67%,治疗Ⅱ组有4例患者出现轻度腹泻,不良反应发生率为15.38%(P<0.05)。
3 讨论
多项研究表明,全身及局部IR可能是引起PCOS“低妊娠率、高流产率”的深层原因[4, 8-10]。PCOS卵巢局部存在IR,其会导致血清T水平升高,引起游离脂肪酸的分泌增加,进而刺激胰岛β细胞分泌更多的胰岛素,形成高胰岛素血症,并逐步发展为胰岛素抵抗[26]。除卵巢外,子宫内膜也是胰岛素的重要靶器官之一,子宫内膜正常的葡萄糖代谢能够促进内膜细胞的分化与成熟[27]。研究表明,PCOS子宫内膜上皮细胞胰岛素受体水平显著升高[28],肥胖PCOS大鼠子宫内膜葡萄糖转运蛋白-4(GLUT-4)的表达水平下调,糖代谢水平降低,进而影响子宫内膜腺体组织的成熟[29],提示PCOS子宫内膜局部存在IR,会导致子宫内膜容受性降低。
正常的血管生成、充足的血流灌注,是良好子宫内膜容受性建立的重要前提。分泌期尤其是胚胎植入前后,子宫内膜血管呈现快速、大量的螺旋状生长,并伴随血管扩张及通透性增加,进而为胚胎植入和发育提供必备条件[30]。临床及实验研究表明,PCOS围着床期子宫中血管数量明显减少[31]、子宫内膜血流相关指数显著降低[32]、子宫动脉阻力异常升高[33],证实子宫内膜血管生成及血流灌注不足是影响PCOS子宫内膜容受性建立的关键因素之一[30]。实验研究显示,高胰岛素可引起早孕小鼠子宫内膜蜕膜化血管生成障碍[34],丙酸睾酮会以剂量依赖性方式阻碍PCOS妊娠小鼠子宫内膜血管生成并影响蜕膜化过程[35],表明IR和高雄激素可直接影响子宫内膜血管生成,进而阻碍子宫内膜蜕膜化进程,提示子宫内膜IR通过影响内膜血管生成及功能,进而降低PCOS子宫内膜容受性。
超声作为一种无创、可重复的子宫内膜功能评估方法被临床广泛接受,目前多采用VI、FI、VFI、子宫动脉搏动指数(PI)、阻力指数(RI)等指标评估子宫内膜血管生成及血流灌注情况[36],而经阴道三维超声检查恰好能够精确测量上述指标,因而成为评价子宫内膜容受性的重要手段[37]。因此,本文采用三维超声检测并比较了PCOS-IR患者着床期子宫内膜VI、FI、VFI值的差异,以期观察二甲双胍及补肾化痰活血方对子宫内膜血管生成及血流灌注的影响。
二甲双胍是治疗PCOS-IR的最常用药物之一,但值得关注的是,其胃肠道不良反应发生率高达15%[11]。此外,二甲双胍能够通过胎盘,虽然已有研究表明宫内二甲双胍暴露对于子代的围产结局无明显影响,但可能会改变子代的细胞代谢及正常激素水平[14]。另有研究表明,妊娠早期二甲双胍暴露可能会增加PCOS子代出生后肺动脉瓣闭锁的发生风险[12],并在4岁时具有更高的BMI和超质量/肥胖症患病率[13]。可见,二甲双胍并不适用于育龄期PCOS-IR的长期管理。
中医并无PCOS的病名,根据临床症状可将其划归为“月经病”“不孕”“癥瘕”等病证范畴。课题组通过对吴门医派经典络病理论及夏桂成教授中医女性生殖节律调节理论的深入探讨、融合,结合前期数据挖掘结果[38],总结出“肾虚胞阻、痰瘀阻络”是引起PCOS生殖障碍的基本病机,并创制补肾化痰活血方,方中菟丝子、淫羊藿温通肾阳、助化痰湿,熟地黄滋肾填精、大补阴血,遵循“大凡络虚,通补最宜”之理;陈皮、苍术燥湿化痰以祛其标,茯苓健脾利湿以固其本,旨在使痰湿除、络脉通;川芎、当归行气活血、化瘀通络,旨在推动气血运行以下注胞宫,其中当归为活血养血、通补兼备之品;香附行气解郁、辛香通络,如叶天士所云“攻坚垒,佐以辛香,是络病大旨”;甘草调和诸药。补肾化痰活血方以补为基,寓通于补,使补而不滞;以通为要,通补兼备,使通而不破,补肾以充络、化痰活血以通络,共奏调经助孕种子之效,与PCOS中国诊疗指南高度契合[39]。
本研究结果显示,补肾化痰活血方干预后,在临床体征方面,PCOS-IR患者的体质量、BMI水平明显降低,肥胖及超质量体征显著改善,与二甲双胍效果相当,而体质量的减轻对PCOS疾病的长期管理至关重要;另外,补肾化痰活血方可明显改善PCOS-IR患者的中医证候积分,与二甲双胍相比,优势显著。在实验室检测方面,补肾化痰活血方除与二甲双胍同样具有明显降低PCOS-IR患者FINS、HOMA-IR、LH、LH/FSH水平外,还能显著提高患者着床期子宫内膜血流参数VI、VFI水平,降低子宫内膜血流阻力,增加子宫内膜血流灌注,进而有效提高临床妊娠率、降低胚胎停育率。综上所述,补肾化痰活血方能够显著降低PCOS-IR肥胖体征及胰岛素抵抗水平,调节生殖内分泌紊乱,明显增加着床期子宫内膜血流灌注,改善子宫内膜容受性,进而提高临床妊娠率、降低胚胎停育率,且安全性好,值得临床推广应用,但仍需扩大样本量进行验证,且作用机制仍有待深入挖掘。
Clinical effect of Bushen Huatan Huoxue Decoction treating polycystic ovary syndrome with insulin resistance infertility
1. First Department of Gynecology, Suzhou TCM Hospital Affiliated to Nanjing University of Chinese Medicine, Suzhou 215009, China;
2. Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China;
3. Department of Ultrasound, Suzhou TCM Hospital Affiliated to Nanjing University of Chinese Medicine, Suzhou 215009, China;
4. Academy of Wumen Chinese Medicine, Suzhou TCM Hospital Affiliated to Nanjing University of Chinese Medicine, Suzhou 215009, China
 2024, Vol. 41
2024, Vol. 41