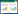文章信息
- 高曌, 孙波, 蔡雅文, 等.
- GAO Zhao, SUN Bo, CAI Yawen, et al.
- 丹参-川芎-红花对颅脑损伤后大鼠抑郁-心脏损伤的多病研究
- A study of Danshen-Chuanxiong-Honghua on comorbidity of depression-heart injury in rats after traumatic brain injury
- 天津中医药, 2024, 41(2): 199-206
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(2): 199-206
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.02.12
-
文章历史
- 收稿日期: 2023-11-04
颅脑损伤(TBI)是一种临床中较常见的脑外伤类型,也被称为“沉默的流行病”。TBI的严重程度根据格拉斯哥昏迷量表(GCS)进行评价:轻度13~15分,中度9~12分,重度≤ 8分,病理学则多将TBI分为原发性TBI与继发性TBI[1]。有研究在脑外伤后2周开始对患者进行追踪测评,用GCS表来评价患者的严重程度,汉密尔顿量表(HADS)评估抑郁水平,以谈话的方式进行评价。结果显示,TBI会引发多种精神疾病,抑郁是TBI后最主要的并发症之一[2]。此外,有研究发现一次脑震荡应激后大鼠,尤其是雄性大鼠即可出现抑郁表现[3],大鼠TBI后4 d出现抑郁样行为[4],还有研究通过评估TBI后24 h大鼠海马新生细胞水平以评估TBI后抑郁发生情况[5]。TBI后的水肿、神经胶质活化和周围免疫细胞浸润等继发性损伤机制导致细胞死亡和神经功能障碍,有医学影像学证实TBI引发抑郁患者颞叶、顶叶和扣带区域与未引发抑郁患者相比体积显著变小[6]。此外,也有研究发现抑郁的发病率与TBI的损伤程度并非正相关,反而是轻度脑损伤(mild TBI)更易引发抑郁。研究发现,mTBI后1年发生抑郁症的患病率为15.3%~18.0%,TBI后1年的抑郁发生率53.1%,在mTBI后8年高达61.0%。TBI患者高发抑郁症的概率范围很广,约为15%~77%[7]。此外,有研究发现严重TBI患者通常伴有心血管功能障碍[8],TBI患者心脏的肌酸激酶同工酶(CK-MB)水平以不同于心肌梗死患者的方式升高[9]。认为TBI可能是一种心脑同病的疾病,并对此进行探究。
研究选择的中药方剂丹参-川芎-红花(丹川红,DCH)是丹参、川芎、红花按2∶1∶1组成的中药药队,其来源是陈可冀院士联合郭世魁老中医创建的中药复方冠心Ⅱ号。该方具有行气活血,祛瘀通络的功效,临床常用于治疗冠心病、胸闷不适等,研究发现该方及其主要吸收成分的阿魏酸(FA)具有通过抑制心肌细胞凋亡和半胱氨酸-天冬氨酸蛋白酶3(Caspase3)活性的方式减少梗死面积,提供了一种心脏保护作用[10]。研究发现,DCH能发挥抗氧化、抗炎、增加冠状动脉流速的作用来有效治疗缺血性心脏病,并能改善心绞痛[11],还有证据表明,DCH可以通过抗炎和神经保护作用有效缓解抑郁症指标,保护心脏免受炎症和细胞凋亡[12]。FA是DCH中用于大脑保护的主要吸收化合物[11],最近的1项研究表明,FA取代白藜芦醇是“法国悖论”的主要原因,即尽管高脂肪饮食,但葡萄酒和葡萄多酚的摄入与冠心病的发病率低有关,也证明FA对心脏有显著的保护作用[13]。本课题组既往通过超高效液相色谱-质谱联用(UPLC-MS/MS)法测得DCH中主要成分FA的质量浓度为(0.232±0.003)mg/mL,而DCH临床治疗TBI患者的剂量为1.5 g/kg(生药/体质量)。大鼠灌胃量为人的6.7倍,故DCH的大鼠灌胃剂量确定为10 g/kg,FA的大鼠灌胃剂量确定为2 mg/kg,大鼠灌胃体积为1 mL/100 g。
本实验的造模方式,CCI(controlled cortical impact)造模是常用的TBI造模方法,通过颅脑损伤仪TBI0310进行打击,对大鼠造成中-轻度TBI[14-15]。有研究发现,TBI后引起的海马损伤是TBI后抑郁发生的重要原因[4, 16],本实验因此选择使用研究最为广泛的海马作为TBI后大鼠抑郁表现的研究对象。目前对于抑郁症的研究常用有强迫游泳测试、慢性轻度压力模型和习得性无助模型[17],但也有研究发现,即使是一次应激创伤也会引发精神病理学的变化,这一新的概念可以了解应激反应的适应与不适应轨迹的决定因素,以此研究抗抑郁药的机制[18]。还有研究表明,抑郁症与树突萎缩和树突棘缺失高度相关,特别是在包括海马在内的与情绪相关的大脑区域[19],因此选择海马神经元树突的密度和长度作为应激后抑郁发生的评价标准并对其改变的发生机制进行探究,同时,将心肌凋亡指标CK-MB和Caspase3作为心脏损伤的评价标准[9-10]。基于上述研究背景,认为DCH和FA可能对TBI后的抑郁-心脏损伤具有调节作用,同时认为可能存在一种共享的途径以调控TBI后的抑郁-心脏损伤共病,并在接下来的实验中对这一共享机制进行验证。
1 材料和方法 1.1 实验动物信息及分组SD大鼠,雄性,体质量约200~280 g;购于南京青紫蓝,产地:上海必凯科翼生物科技有限公司;动物许可证号:SCXK-2018-0006。所有动物的饲养和实验操作都严格遵守均遵循国家实验动物管理条例及南京中医药大学实验动物中心动物饲养和伦理委员会的指导方针,并报送南京中医药大学实验动物伦理委员会备案,实验动物伦理号:201912A017。大鼠在适应性喂养1周后进行TBI急性实验。随机把12只雄性SD大鼠分为4组,每组3只;对照组-假手术组(Sham):不击打直接缝合;模型组(TBI+Vehicle):造模后待苏醒灌胃生理盐水;DCH组:造模后待苏醒灌胃10 g/kg DCH汤剂;FA组:造模后待苏醒灌胃2 mg/kg FA。
1.2 主要仪器及试剂耗材颅脑创伤仪TBI0310Head Impactor(head trauma cont公司,美国),超纯水系统(Millipore实验室设备有限公司,美国),酶标仪全波长检测系统(Tecan TWINFINIE 200,瑞士),Allegra X-30台式高速冷冻离心机(贝克曼库尔特有限公司,美国),HYCD-205冷藏箱(海尔生物医疗公司,中国),-80 ℃超低温冰箱(三洋,日本),旋转蒸发仪(巩义市予华仪器有限责任公司)BSA2202S型十万分之一天平(赛多利斯科学仪器有限公司,德国),Freezone-12L冷冻干燥机(LABCONCO公司,美国),正置荧光显微镜(Zeiss公司,德国),冰冻切片机(Thermo公司,美国),伊文斯蓝、甲酰胺、中性树脂(北京索莱宝科技有限公司,中国),50%/75%/95%/无水乙醇、二甲苯(国药集团化学试剂有限公司,中国),FD快速高尔基染色试剂盒(FD Neuro technologies,inc,美国),5-羟色胺(5-HT)、Ghrelin试剂盒(南京奥青生物技术有限公司,中国),c-Fos试剂盒(Kendall Scientific,美国),脑源性神经营养因子(BDNF,Rabbit,抗体货号:28205-1-AP),Caspase3(Rabbit,抗体货号:ab32351),CK-MB(Rabbit,抗体货号:15137-1-AP),GAPDH(Rabbit,抗体货号:10494-1-AP),辣根过氧化物酶(HRP)[Goat anti-Rabbit IgG(H+L)Secondary Antibody,抗体货号:AWS0002],阿魏酸(南京景竹)。
1.3 中药DCH汤剂、冻干粉制备用天平称量丹参(批号:20032901,长沙湘雅医院,山东)68 g,川芎(批号:200525,长沙湘雅医院,四川)34 g和红花(批号:19040296,长沙湘雅医院,新疆)34 g置于不锈钢锅中,按1∶12加纯水浸泡30 min,用武火煮沸,文火煮30 min。8层纱布过滤,得滤液。再加12倍体积纯水,重复上述方法,合并两次药液。用旋转蒸发仪将药液浓缩。取适量液氮将药液均匀冷冻,放入冻干机冷冻干燥24 h,取下。冻干粉得率(%)=冻干粉质量/中药质量×100%=45.33%。实验前称取冻干粉适量,配成体积适量的浓度为10 g/kg(生药)的DCH药液。
1.4 CCI造模使用异氟烷气体麻醉大鼠,诱导麻醉流量3 mL,麻醉时间3 min。用小动物剃毛机剃去在两后眼角连线到耳部连线部位毛发。麻醉后放上手术台,手术台上垫上保温垫,大鼠固定在立体视框架中,并在维持2%异氟烷吸入的情况下,先将头部皮肤剪开,用干棉球擦破黏膜暴露颅骨。在人字缝右边,前后囟间右侧象限,打开一个骨窗,暴露硬脑膜。在颅脑创伤仪TBI0310Head Impactor上设置好深度速度、停留时间,使用TBI打击造成中-轻度损伤(速度:5 m/s,停留时间:2 000 msec,深度:3 mm)[14-15]。然后将头部伤口缝合,在伤口涂上碘伏,将老鼠放在保温垫上待苏醒后灌胃。造模后存活率100%。
1.5 高尔基染色及分析法大鼠腹腔取血后取出整个脑组织,在双蒸馏水中冲洗血液。使用FD快速高尔基氏染色试剂盒按照要求进行染色。染色结束后室温晾干,在正置荧光显微镜下观察并拍摄图片。使用Image J对神经元照片进行树突棘密度(Spine density)和树突长度的计数分析。树突棘密度是由End-pooint voxels除以Longest Shortest Path计算得出,数据结果通常以树突棘数/10 μm(Spines/10 μm)表示。树突的长度是通过对目标神经元树突描摹后进行测量,其结果为来自一个神经元的树突长度的总和,二值化后获取神经元树突骨骼图。
1.6 制备大鼠血清、海马、心脏样本持续吸入异氟烷麻醉状态下对大鼠进行腹腔取血,取血后断头处死,将脑置于冰盒上,剥离海马、心脏,胃、小肠,用超纯水冲洗干净。吸干表面的液体,放入冻存管中经液氮速冻,后存放于-80 ℃超低温冰箱待检。血液放入离心机,在3 500 r/min离心15 min,离心半径为10 cm,取上清液存于EP管,保存在-80 ℃冰箱。
1.7 ELISA检测对各组大鼠血清、海马和心脏样本处理后,按照ELISA试剂盒的步骤进行检测。指标包括:血清、海马、心脏:c-Fos、Ghrelin;血清:5-HT、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β和IL-6;心脏:内皮型一氧化氮合酶(eNOS)。
1.8 蛋白免疫印迹法(Western blot)检测方法组织蛋白提取后进行电泳,电泳结束后转膜清洗,用1×磷酸盐吐温缓冲液(PBST)配制5%脱脂奶粉,将膜浸入后,室温放置90 min,而后用一抗孵育90 min后4 ℃过夜,二抗室温孵育90 min。ECL显色曝光。指标包括海马:BDNF;心脏:BDNF、CK-MB、Caspase3。
1.9 数据处理及统计学方法所有数据均采用graphpad prism 9软件进行统计分析和作图。计量资料以均值±标准误(Mean±SEM)表示。多组间计量资料的比较采用单因素方差分析(one-way ANOVA),多重比较采用Dunnett’s检验。P < 0.05为差异有统计学意义。
2 实验结果 2.1 TBI应激前后及给药后大鼠海马树突棘密度变化比较TBI应激后Vehicle组树突棘密度显著降低,给药后给药组树突棘密度有所恢复。证明急性应激TBI会导致海马树突棘密度变小,给药后有一定恢复效果。见图 1。
|
| 注:组间比较,****P<0.000 1。 图 1 TBI应激前后及给药后海马树突棘密度对比(树突棘数/10 μm,n=3) Fig. 1 Comparison of dendritic spine density in hippocampus before and after TBI stress and after drug administration (Spines/10 μm, n=3) |
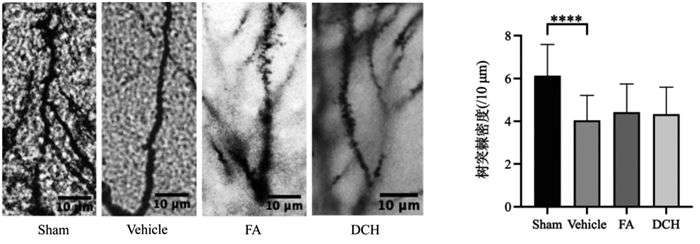
TBI造模后Vehicle组树突长度降低,给药后给药组树突长度有所恢复,证明TBI急性应激会导致海马树突长度变短,给药后有一定恢复效果。见图 2。
|
| 注:组间比较,*P<0.05。 图 2 TBI前后及给药后海马神经元长度比较(50 μm,n=3) Fig. 2 Comparison of hippocampal neuron length before and after TBI and after drug administration(50 μm, n=3) |
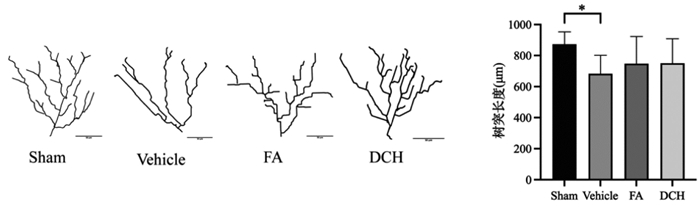
研究发现,炎性因子对海马神经元突触可塑性具有调控的作用,并因此对神经系统疾病产生影响[20]。TBI应激后,与Sham组相比,大鼠血清中炎症因子IL-1β、IL-6、TNF-α均有显著增加(P < 0.000 1),给药DCH和FA后炎性因子水平均显著降低。血清5-HT水平可以反映抑郁发生的情况,TBI后大鼠血清5-HT水平显著降低,给药后水平升高。见图 3。
|
| 注:组间比较,*P<0.05,**P<0.01,****P<0.000 1。 图 3 TBI应激前后及给药后大鼠血清炎性因子水平差异比较(n=3) Fig. 3 Comparison of serum inflammatory factors in rats before and after TBI stress and after drug administration(n=3) |
研究发现eNOS对血管内皮具有重要的保护作用[21],eNOS水平可以反映应激后心脏损伤的程度。大鼠TBI应激后心脏eNOS水平明显降低,在给药后eNOS升高。心肌损伤指标CK-MB和心肌凋亡指标Caspase3均可反映心脏的损伤水平。TBI应激后心脏CK-MB和Caspase3水平明显均明显上升趋势,在给药后有不同程度的下降趋势。见图 4。
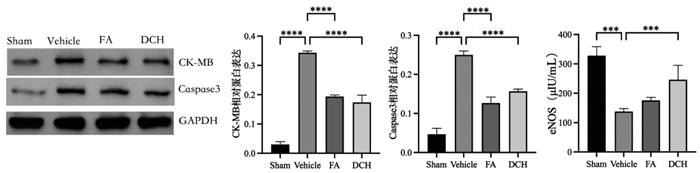
|
| 注:组间比较,***P<0.001,****P<0.000 1。 图 4 TBI应激前后及给药后大鼠心脏eNOS,CK-MB和Caspase3水平差异比较(n=3) Fig. 4 Comparison of eNOS, CK-MB and Caspase3 levels in rat heart before and after TBI stress and after drug administration(n=3) |
TBI应激后大鼠血清、海马、心脏c-Fos表达均呈现明显上升趋势,给药后减少。见图 5。
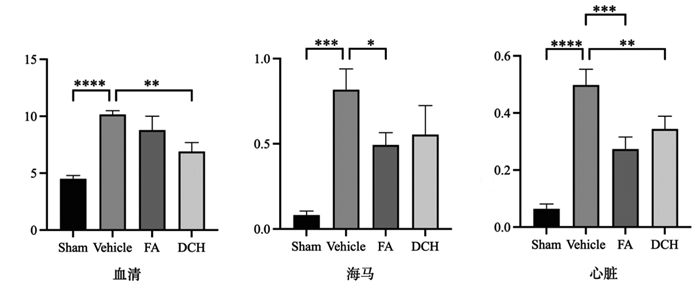
|
| 注:组间比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。 图 5 TBI应激前后及给药后大鼠血清、海马、心脏c-Fos表达(n=3) Fig. 5 Expression of c-Fos in serum, hippocampus and heart of rats before and after TBI stress and after drug administration(n=3) |
TBI应激后大鼠血清、海马、心脏Ghrelin表达,呈现为TBI应激后大鼠海马Ghrelin明显下降,给药后上升。见图 6。
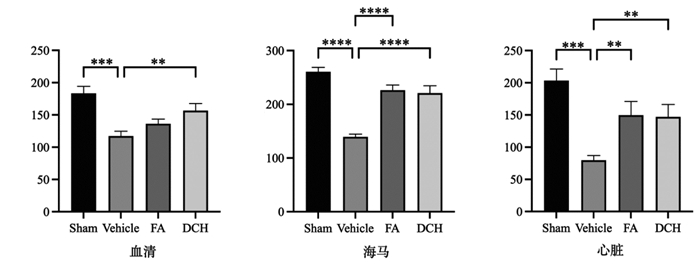
|
| 注:组间比较,**P<0.01,***P<0.001,****P<0.000 1。 图 6 TBI应激前后及给药后大鼠血清、海马、心脏Ghrelin表达(n=3) Fig. 6 Expression of Ghrelin in serum, hippocampus and heart of rats before and after TBI stress and after drug administration(n=3) |
大鼠TBI后海马、心脏中BDNF水平明显降低,在给药后BDNF有不同程度的上升。见图 7。
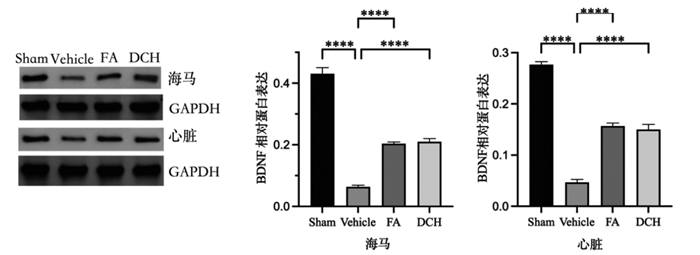
|
| 注:组间比较,****P<0.000 1。 图 7 TBI应激前后及给药后大鼠海马、心脏BDNF表达(n=3) Fig. 7 Expression of BDNF in hippocampus and heart of rats before and after TBI stress and after drug administration(n=3) |
尽管已有研究认识到TBI与心血管病变发生之间具有相关性[22],对于TBI后抑郁-心脏损伤多病发生的机制依旧并不明确,本实验对TBI后抑郁-心脏损伤的机制探究基于多病这一概念。越来越多的医学研究者将目光放在多病这一概念上,有报道对苏黎世大学医院内科急诊患者进行研究[23],发现内科临床住院患者约有70%~90%为多病患者[24]。以冠心病为例,约有83%以上的冠心病患者为多病人群,即同时主要合并有两个及以上的疾病表现[25]。
有研究表明,抑郁症与树突萎缩和树突棘缺失高度相关,特别是在包括海马在内的与情绪相关的大脑区域[26-27],本研究通过对TBI后大鼠海马的精神病理研究,发现TBI应激后大鼠海马树突长度、树突棘密度显著减少,给药DCH和FA后这一情况有所缓解。TBI应激后显著增加的血清促炎性指标(IL-1β、IL-6和TNF-α)也在给药后降低,说明给药后可以通过对突触可塑性发挥作用以发挥抗抑郁作用。此外,心脏eNOS应激后水平下降,心脏损伤指标CK-MB和Caspase3显著上升,给药后逆转,表明给药后心脏损伤问题有改善。上述结果一定程度上体现了DCH和FA的抗抑郁和心脏保护作用。
c-Fos作为信号传导系统的第三信使对细胞的生长、分化和功能活动至关重要,通常通过对不同脑区表达量的分析用来识别神经元的活动情况来描绘在使用精神活性化合物治疗后被调节的神经元回路[28-29]。c-Fos的短暂激活伴随着皮层脑损伤,其表现类似于抑郁症的发展[30],同时还对神经的可塑性产生作用[31]。研究发现,c-Fos的异常高表达可能是高血压病、动脉粥样硬化等心血管疾病的发病原因之一[32]。在本实验对TBI应激及给药前后大鼠血清、海马、心脏均进行了c-Fos水平的检测,发现c-Fos在各个组织的表达具有一致性,即应激后的模型组c-Fos在各个组织的表达量最高,给药后c-Fos表达一定程度上有所减少。在海马中,FA和DCH均显著降低了应激后大鼠的c-Fos水平,一定程度上证明治疗对应激后的脑具有重要的保护作用,缓解了突触可塑性的损伤加重程度,在心脏中也具有缓解应激损伤的作用。
Ghrelin是一种胃肠道分泌生成的生长激素释放肽。有研究认为Ghrelin可以通过与生长激素促分泌激素受体的结合而发挥作用参与调节多种生命活动进程,对许多疾病产生有益影响[33]。Ghrelin可以通过调节海马突触可塑性改善患者的抑郁状态[34],可以改善心脏功能和重塑,预防严重的心律失常,促进心肌梗死后的重塑[35]。本实验对TBI应激及给药前后大鼠血清、海马、心脏均进行了Ghrelin水平的检测,发现Ghrelin在各个组织的表达具有一致性,即TBI后的模型组c-Fos表达量最低,给药后Ghrelin表达一定程度上有所增加。
BDNF是一种脑源性神经营养因子,具有调控神经元突触可塑性的能力,有研究发现,BDNF的上调可能会逆转成人大脑中应激诱导的结构和突触可塑性缺陷[36],在抑郁症患者血液中低水平表达,予抗抑郁药物后明显增加[37]。BDNF在对血管内皮细胞的生长、发育,以及缺血内皮细胞增殖、移行的过程中同样起着重要的作用[38],有研究发现BDNF可以降低氧化应激和细胞凋亡,并通过激活eNOS/一氧化氮(NO)通路,保护心脏免受感染性心功能不全的损害[39]。还有研究发现,Ghrelin可以通过环磷酸腺苷(cAMP)/环磷酸腺苷效应元件结合蛋白(CREB)通路调节BDNF的表达[40]。本实验中,给药后显著增加应激后TBI大鼠的BDNF的表达,可能是通过调节Ghrelin水平,使BNDF表达量增加,对突触可塑性产生影响,减轻了TBI大鼠的抑郁样行为,同时在心脏发挥保护作用。
基于上述研究结果,研究发现TBI后的抑郁-心脏损伤具有多病发作的特征,Ghrelin-BDNF/c-Fos可能是抑郁-心脏损伤的共享途径,其发生机制可能是在TBI应激后,在脑中,海马中Ghrelin水平降低,导致BDNF水平降低,脑保护作用减弱,同时Ghrelin对c-Fos的表达抑制效果减弱,表现为c-Fos表达量剧增后诱导的炎性因子增多,对突触可塑性造成损伤,海马树突长度、树突棘密度减少,抑郁发生。与此同时,在心脏中,应激后Ghrelin减少导致BDNF减少,eNOS减少,心脏保护能力减弱,心脏保护能力减弱,与此同时c-Fos高表达损伤了心肌细胞和内皮细胞,对心脏造成了负面影响。DCH及主要吸收成分FA可能是通过对这一调控途径的调节改善了抑郁-心脏损伤的多病病变,值得进一步研究。
| [1] |
NAUMENKO Y, YURYSHINETZ I, ZABENKO Y, et al. Mild traumatic brain injury as a pathological process[J]. Heliyon, 2023, 9(7): e18342. DOI:10.1016/j.heliyon.2023.e18342 |
| [2] |
AHMED S, VENIGALLA H, MEKALA H M, et al. Traumatic brain injury and neuropsychiatric complications[J]. Indian Journal of Psychological Medicine, 2017, 39(2): 114-121. DOI:10.4103/0253-7176.203129 |
| [3] |
WILSON R J, BELL M R, GIORDANO K R, et al. Repeat subconcussion in the adult rat gives rise to behavioral deficits similar to a single concussion but different depending upon sex[J]. Behavioural Brain Research, 2023, 438(2): 114206. |
| [4] |
LIM S W, SHIUE Y L, LIAO J C, et al. Simvastatin therapy in the acute stage of traumatic brain injury attenuates brain trauma-induced depression-like behavior in rats by reducing neuroinflammation in the hippocampus[J]. Neurocritical Care, 2017, 26(1): 122-132. DOI:10.1007/s12028-016-0290-6 |
| [5] |
COPE E C, MORRIS D R, GOWER-WINTER S D, et al. Effect of zinc supplementation on neuronal precursor proliferation in the rat hippocampus after traumatic brain injury[J]. Experimental Neurology, 2016, 279(5): 96-103. |
| [6] |
BOHMAN L E, RILEY J, MILOVANOVA T N, et al. Microparticles impair hypotensive cerebrovasodilation and cause hippocampal neuronal cell injury after traumatic brain injury[J]. Journal of Neurotrauma, 2016, 33(2): 168-174. DOI:10.1089/neu.2015.3885 |
| [7] |
ANSARI A, JAIN A, SHARMA A, et al. Role of sertraline in posttraumatic brain injury depression and quality-of-life in TBI[J]. Asian Journal of Neurosurgery, 2014, 9(4): 182-188. DOI:10.4103/1793-5482.146597 |
| [8] |
ZYGUN D. Non-neurological organ dysfunction in neurocritical care: Impact on outcome and etiological considerations[J]. Current Opinion in Critical Care, 2005, 11(2): 139-143. DOI:10.1097/01.ccx.0000155356.86241.c0 |
| [9] |
HACKENBERRY L E, MINER M E, REA G L, et al. Biochemical evidence of myocardial injury after severe head trauma[J]. Critical Care Medicine, 1982, 10(10): 641-644. |
| [10] |
HUANG X, QIN F, ZHANG H M, et al. Cardioprotection by Guanxin Ⅱ in rats with acute myocardial infarction is related to its three compounds[J]. Journal of Ethnopharmacology, 2009, 121(2): 268-273. DOI:10.1016/j.jep.2008.10.029 |
| [11] |
ZHANG X H, ZHENG W, WANG T R, et al. Danshen-Chuanxiong-Honghua ameliorates cerebral impairment and improves spatial cognitive deficits after transient focal ischemia and identification of active compounds[J]. Frontiers in Pharmacology, 2017, 8(7): 452. |
| [12] |
ZHANG X H, ZHENG W, XU H L, et al. Pharmacokinetic study of representative anti-oxidative compounds from Denshen-Chuanxiong-Honghua following oral administration in rats[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2017, 1052(5): 82-90. |
| [13] |
HUANG Y K, XU M, LI J F, et al. Ex vivo to in vivo extrapolation of syringic acid and ferulic acid as grape juice proxies for endothelium-dependent vasodilation: Redefining vasoprotective resveratrol of the French paradox[J]. Food Chemistry, 2021, 363(11): 130323. |
| [14] |
ZHANG Y, WANG L, PAN Q L, et al. Selective sphingosine-1-phosphate receptor 1 modulator attenuates blood-brain barrier disruption following traumatic brain injury by inhibiting vesicular transcytosis[J]. Fluids and Barriers of the CNS, 2022, 19(1): 57. DOI:10.1186/s12987-022-00356-6 |
| [15] |
BAO Z Y, FAN L, ZHAO L, et al. Silencing of A20 aggravates neuronal death and inflammation after traumatic brain injury: a potential trigger of necroptosis[J]. Frontiers in Molecular Neuroscience, 2019, 12(9): 222. |
| [16] |
LEDOUX J E. Emotion circuits in the brain[J]. Annual Review of Neuroscience, 2000, 23: 155-184. DOI:10.1146/annurev.neuro.23.1.155 |
| [17] |
YIN X, GUVEN N, DIETIS N. Stress-based animal models of depression: do we actually know what we are doing?[J]. Brain Research, 2016, 1652(12): 30-42. |
| [18] |
MUSAZZI L, TORNESE P, SALA N, et al. Acute or chronic? A stressful question[J]. Trends in Neurosciences, 2017, 40(9): 525-535. DOI:10.1016/j.tins.2017.07.002 |
| [19] |
PRICE R B, DUMAN R. Neuroplasticity in cognitive and psychological mechanisms of depression: an integrative model[J]. Molecular Psychiatry, 2020, 25(3): 530-543. DOI:10.1038/s41380-019-0615-x |
| [20] |
DUMAN R S, AGHAJANIAN G K. Synaptic dysfunction in depression: potential therapeutic targets[J]. Science, 2012, 338(6103): 68-72. DOI:10.1126/science.1222939 |
| [21] |
RIQUELME J A, WESTERMEIER F, HALL A R, et al. Dexmedetomidine protects the heart against ischemia-reperfusion injury by an endothelial eNOS/NO dependent mechanism[J]. Pharmacological Research, 2016, 103(1): 318-327. |
| [22] |
EL-MENYAR A, GOYAL A, LATIFI R, et al. Brain-heart interactions in traumatic brain injury[J]. Cardiology in Review, 2017, 25(6): 279-288. DOI:10.1097/CRD.0000000000000167 |
| [23] |
WHITTY C J M, WATT F M. Map clusters of diseases to tackle multimorbidity[J]. Nature, 2020, 579(7800): 494-496. DOI:10.1038/d41586-020-00837-4 |
| [24] |
BATTEGAY E, CHEETHAM M, HOLZER B M, et al. Multimorbidity management and the physician's daily clinical dilemma[J]. Der Internist, 2017, 58(4): 344-353. DOI:10.1007/s00108-017-0200-9 |
| [25] |
TINETTI M E, FRIED T R, BOYD C M. Designing health care for the most common chronic condition: Multimorbidity[J]. JAMA, 2012, 307(23): 2493-2494. |
| [26] |
CITRI A, MALENKA R C. Synaptic plasticity: Multiple forms, functions, and mechanisms[J]. Neuropsychopharmacology, 2008, 33(1): 18-41. DOI:10.1038/sj.npp.1301559 |
| [27] |
MUSAZZI L, TORNESE P, SALA N, et al. What acute stress protocols can tell us about PTSD and stress-related neuropsychiatric disorders[J]. Frontiers in Pharmacology, 2018, 9(7): 758. |
| [28] |
SAGAR S M, SHARP F R, CURRAN T. Expression of c-fos protein in brain: Metabolic mapping at the cellular level[J]. Science, 1988, 240(4857): 1328-1331. DOI:10.1126/science.3131879 |
| [29] |
SHERWIN E, GIGLIUCCI V, HARKIN A. Regional specific modulation of neuronal activation associated with nitric oxide synthase inhibitors in an animal model of antidepressant activity[J]. Behavioural Brain Research, 2017, 316(1): 18-28. |
| [30] |
HERRERA D G, ROBERTSON H A. Activation of c-fos in the brain[J]. Progress in Neurobiology, 1996, 50(2/3): 83-107. |
| [31] |
BARBACCIA M L. Much excitement about antidepressants, DBI and c-FOS[J]. Pharmacological Research, 2011, 64(4): 333-335. DOI:10.1016/j.phrs.2011.05.018 |
| [32] |
PAN Z W, SUN X L, SHAN H L, et al. microRNA-101 inhibited postinfarct cardiac fibrosis and improved left ventricular compliance via the FBJ osteosarcoma oncogene/transforming growth factor-β1 pathway[J]. Circulation, 2012, 126(7): 840-850. DOI:10.1161/CIRCULATIONAHA.112.094524 |
| [33] |
ANDREWS Z B, LIU Z W, WALLLINGFORD N, et al. UCP2 mediates ghrelin's action on NPY/AgRP neurons by lowering free radicals[J]. Nature, 2008, 454(7206): 846-851. DOI:10.1038/nature07181 |
| [34] |
HUANG H J, CHEN X R, HAN Q Q, et al. The protective effects of Ghrelin/GHSR on hippocampal neurogenesis in CUMS mice[J]. Neuropharmacology, 2019, 155(9): 31-43. |
| [35] |
余天浩, 李瑜辉, 伍灏堃, 等. 血清BDNF和Ghrelin水平与冠心病介入术后并发抑郁症的关系[J]. 中山大学学报(医学版), 2018, 39(5): 717-723. |
| [36] |
AYDEMIR O, DEVECI A, TANELI F. The effect of chronic antidepressant treatment on serum brain-derived neurotrophic factor levels in depressed patients: a preliminary study[J]. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 2005, 29(2): 261-265. |
| [37] |
RICKEN R, ADLI M, LANGE C, et al. Brain-derived neurotrophic factor serum concentrations in acute depressive patients increase during lithium augmentation of antidepressants[J]. Journal of Clinical Psychopharmacology, 2013, 33(6): 806-809. DOI:10.1097/JCP.0b013e3182a412b8 |
| [38] |
李瑞峰, 王栋, 鄢高亮, 等. 脑源性神经营养因子与冠状动脉粥样硬化性心脏病的相关性研究[J]. 东南大学学报(医学版), 2017, 36(5): 772-775. |
| [39] |
ZENG N, XU J M, YAO W F, et al. Brain-derived neurotrophic factor attenuates septic myocardial dysfunction via eNOS/NO pathway in rats[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017(7): 1721434. |
| [40] |
LI Y H, LIU Q X, WANG J S, et al. Ghrelin improves cognition via activation of the cAMP-CREB signalling pathway in depressed male C57BL/6J mice[J]. The International Journal of Neuroscience, 2023, 133(11): 1233-1241. DOI:10.1080/00207454.2021.1928114 |
 2024, Vol. 41
2024, Vol. 41