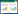文章信息
- 赵倩, 曾利敏, 周丽平, 等.
- ZHAO Qian, ZENG Limin, ZHOU Liping, et al.
- 灯盏细辛注射液通过调节JAK2/STAT3信号通路抗脑卒中大鼠神经损伤的研究
- Study on the effect of Erigeron Breviscapus Injection on neural injury in stroke rats by regulating the JAK2/STAT3 signaling pathway
- 天津中医药, 2024, 41(2): 207-213
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(2): 207-213
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.02.13
-
文章历史
- 收稿日期: 2023-12-15
2. 郑州市第七人民医院检验科, 郑州 450016
脑卒中又称中风、脑血管意外,是一种急性、突发性脑血管疾病。它是由脑血管阻塞或破裂引起的,导致血瘀,阻止血液进入大脑,并引发与脑组织缺氧损伤相关的疾病,包括缺血性脑卒中和出血性脑卒中[1]。缺血性脑卒中主要以脑缺血和神经功能缺损为特征,占卒中总发病率的80%以上[2]。目前的临床治疗集中在静脉溶栓和血管内取栓的快速再灌注,尽管血管再通率不断增加,但仍有近一半的患者在缺血后残疾[3]。Janus激酶2(JAK2)是蛋白酪氨酸激酶家族的成员,可通过多种细胞因子受体传递信号,其被激活时磷酸化信号转导子和转录激活子3(STAT3),进而参与细胞因子的产生、免疫细胞的募集和激活以及适应性反应的启动等活动[4]。研究显示,抑制JAK2/STAT3通路能够抑制NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症体激活,从而改善缺血性脑卒中损伤和神经炎症[5]。灯盏细辛注射液(EBI)是由灯盏花素干燥制成的含黄酮类和咖啡酸类化合物的中药注射剂,具有祛风散寒、活血止痛的功效,主要用于治疗心脏和肝脏疾病[6]。研究显示,EBI也能够降低脑缺血再灌注模型大鼠的脑梗死率,也可以通过维持神经元线粒体形态的稳定性在缺血性卒中中发挥神经保护作用,具有起效快、时效长等特点[7-8]。但其对缺血性脑卒中的神经保护作用机制研究甚少。因此,本研究旨在探索EBI对缺血性脑卒中大鼠神经保护作用的具体机制。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠,8周龄,体质量250~280 g,将大鼠放置在透明的笼子中,在12 h光/12 h暗交替循环,温度(22±2)℃,湿度50%~60%下饲养,所有大鼠均可自由获取食物和水。本研究获得动物伦理委员会批准(批准号2022-039)。
1.2 主要试剂及仪器灯盏细辛注射液(规格:10 mL,云南生物谷药业股份有限公司,国药准字Z53021569);尼莫地平注射液(规格:0.2 mg/mL,上海旭东海普药业有限公司,国药准字H20084238);AG490、Coumermycin A1(CA1,美国Med Chem Express,货号:HY-12000、HY-N7452);2% 2,3,5-三苯基氯化四氮唑(TTC)染色液(北京索莱宝科技有限公司,货号:G3005);苏木精-伊红(HE)染色试剂盒、尼氏(Nissl)染色液(货号:C0105S、C0117,上海碧云天生物技术有限公司);TUNEL细胞凋亡检测试剂盒(货号:40308ES20,上海翌圣生物科技股份有限公司);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)ELISA检测试剂盒(北京伊塔生物科技有限公司,货号:YK-08006、YK-09134);丙二醛(MDA)ELISA检测试剂盒(南京森贝伽生物科技有限公司,货号:SBJ-R0007);Bax、JAK2、p-JAK2、STAT3、p-STAT3兔单抗及B淋巴细胞瘤-2(Bcl-2)、GAPDH兔多抗(英国abcam公司,货号:ab32503、ab108596、ab32101、ab68153、ab32143、ab196495、ab9485);辣根过氧化物酶标记的山羊抗兔(和元李记生物技术有限公司,货号AP31L014);DXS-3倒置生物显微镜(上海帝伦光学仪器有限公司);XK-DG001倒置荧光显微镜(深圳市西尼科光学仪器有限公司);Multiskan FC酶标仪(赛默飞世尔科技);ChemiDoc MP凝胶成像系统(伯乐生命医学有限公司)。
1.3 大鼠脑卒中模型制备将大鼠适应性饲喂1周后,均腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,并固定在立体定位架上,然后将大鼠随机分为假手术组(n=20)和实验组(n=105),实验组大鼠利用大脑中动脉闭塞(MCAO)建立大鼠模型[9]:仔细分离右侧颈总动脉(CCA)、颈外动脉(ICA)和颈内动脉(ECA),在CCA/ECA的分叉处用5-0线进行结扎,在距CCA/ECA分叉约0.5 cm处的CCA上开1个小切口,将尼龙单丝从CCA插入,经过ICA到达大脑中动脉,在动脉夹处结扎CCA以防出血。2 h后,抽出尼龙单丝恢复血流。假手术组大鼠只暴露颈动脉,不进行结扎。手术期间使用加热毯使大鼠保持恒温,手术24 h后对大鼠进行神经功能缺损评分,评分在1~3分之间则视为造模成功。
1.4 分组及给药将造模成功后的大鼠随机分为模型组、尼莫地平组、EBI组、JAK2抑制剂组(AG490组)、EBI+JAK2激动剂组(EBI+CA1组),每组20只。尼莫地平组大鼠按0.5 mg/kg的剂量腹腔注射阳性药物尼莫地平注射液[7],EBI组大鼠按5 mL/kg的剂量腹腔注射EBI[7],JAK2抑制剂组大鼠腹腔注射6 μL、20 nmol/mL的JAK2抑制剂AG490[10],EBI+JAK2激动剂组大鼠在腹腔注射5 mL/kg的EBI 30 min后再注射100 μg/kg的JAK2激动剂CA1[11],假手术组和模型组均以相同方式注射等体积的生理盐水。24 h后对各组大鼠再次进行神经功能缺损评分及后续实验。
1.5 神经功能缺损评分使用Zea-Longa方法对各组大鼠进行神经功能评估。评分标准为0分:表示没有可见的神经缺损;1分:左前爪未能完全伸展,表示轻度神经功能障碍;2分:牵拉尾巴时单向转圈,表示中度神经功能障碍;3分:容易向缺血侧倾倒,表示严重神经功能障碍;4分:意识减退,无法自主行走。
1.6 TTC染色检测大鼠脑梗死面积神经评分结束后,每组选取5只大鼠用1%戊巴比妥钠(40 mg/kg)麻醉后断颈处死,取出完整的脑组织用磷酸盐缓冲溶液(PBS)清洗,取部分脑组织(n=5)固定于4%多聚甲醛中,剩余组织全部置于-80 ℃冰箱中保存。10 min后取部分(n=5)冷冻的脑组织,切成2 mm的冠状切片。将脑切片放入2% TTC溶液中,在37 ℃下孵育20 min,随后弃去TTC溶液,用4%多聚甲醛固定切片24 h,然后进行拍照,并使用Image J软件分析梗死面积。
1.7 HE和Nissl染色检测大鼠脑组织的病理性形态将1.6中固定过夜的脑组织进行石蜡包埋并切成5 μm厚的薄片。随后将石蜡切片分别用二甲苯和梯度乙醇常规脱蜡水化,蒸馏水洗涤后,将切片置于HE染色液或Nissl染色液中染色,30 min后将脑切片用蒸馏水洗涤后,再用梯度乙醇脱水,二甲苯透明,最后用中性树脂封片。使用倒置生物显微镜观察缺血侧神经元损伤情况,并利用Image J软件分析神经元数量,每张切片选取5个区域计算均值。
1.8 TUNEL染色检测大鼠脑组织中神经细胞凋亡情况取1.7中石蜡切片,在二甲苯中脱蜡,在梯度乙醇中水化,然后用蒸馏水清洗后吸干水分。在样本切片上滴加100 μL蛋白酶K工作液,室温孵育20 min,再加入100 μL平衡液孵育10 min。用蒸馏水洗涤后在切片上加入预先配制好的TUNEL反应混合液,37 ℃避光孵育1 h,清洗后加入DAPI进行核染5 min,清洗后用抗荧光猝灭的封片剂进行封片。用荧光显微镜观察染色情况并利用Image J软件计算凋亡率。凋亡率(%)=TUNEL阳性细胞(红色荧光)/总细胞(蓝色荧光)。
1.9 ELISA检测大鼠脑组织中SOD、GSH-Px和MDA的水平取1.6中冻存的脑组织(n=5)置于冰上溶解,洗涤后吸干水分进行称质量,然后加入预冷的PBS研磨成匀浆,在4 ℃下,3 000 r离心10 min,离心半径为10 cm,收集上清液。根据ELISA试剂盒的操作步骤检测待测上清液中SOD、GSH-Px和MDA的水平。
1.10 蛋白免疫印迹法(Western blot)检测大鼠脑组织中Bax、Bcl-2及JAK2、p-JAK2、STAT3、p-STAT3蛋白的表达将剩余的脑组织(n=5)置于冰上溶解,并使用RIPA裂解缓冲液匀浆,在4 ℃下以10 000 r的速度离心10 min,离心半径为10 cm,收集上清液即为提取的蛋白质。用BCA试剂盒检测蛋白浓度,然后在每个泳道加入40 μg蛋白质用SDS-PAGE凝胶分离,并转移至PVDF膜。随后将膜置于含有5%脱脂奶粉的TBST中封闭2 h,TBST洗涤后与一抗(Bax、Bcl-2、STAT3、p-STAT3比例1∶1 000,JAK2、p-JAK2比例1∶5 000,GAPDH比例1∶2 500)在4 ℃下孵育过夜,将膜再次用TBST洗涤后与辣根过氧化物酶标记的山羊抗兔二抗(1∶500)在室温下孵育1 h,最后用ECL试剂盒显色。以GAPDH为内参蛋白,在凝胶成像系统中观察蛋白条带,并利用Image J软件量化蛋白表达。
1.11 统计学方法采用Graphpad prism8.0软件进行数据统计分析,计量资料用均数±标准差(x±s)表示。多组之间比较使用单因素方差分析,组间多重比较使用Tukey事后检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 EBI对各组大鼠神经功能缺损的影响与假手术组相比,模型组大鼠的神经功能缺损评分升高(P < 0.05);与模型组相比,EBI组、尼莫地平组和AG490组大鼠的神经功能缺损评分降低(P < 0.05),且EBI组与尼莫地平组和AG490组的差异均无统计学意义(P > 0.05);与EBI组相比,EBI+CA1组大鼠的神经功能缺损评分升高(P < 0.05)。见表 1。
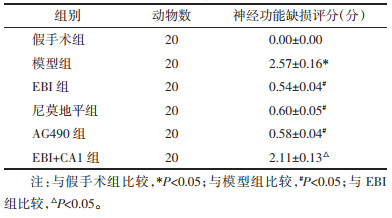
|
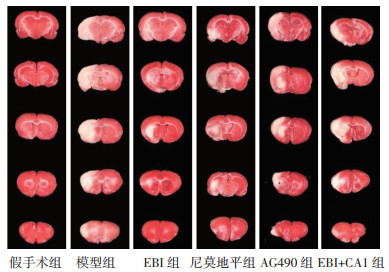
与假手术组相比,模型组大鼠的脑梗死面积增大(P < 0.05);与模型组相比,EBI组、尼莫地平组和AG490组大鼠的脑梗死面积减小(P < 0.05),且EBI组与尼莫地平组和AG490组的差异均无统计学意义(P > 0.05);与EBI组相比,EBI+CA1组大鼠的脑梗死面积增大(P < 0.05)。见图 1、表 2。
|
| 图 1 TTC染色检测各组大鼠脑梗死面积 Fig. 1 Cerebral infarction area detected by TTC staining of rats in each group |
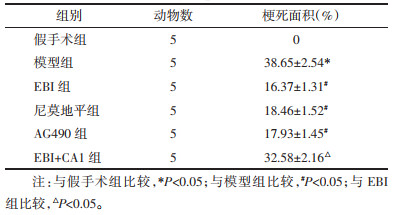
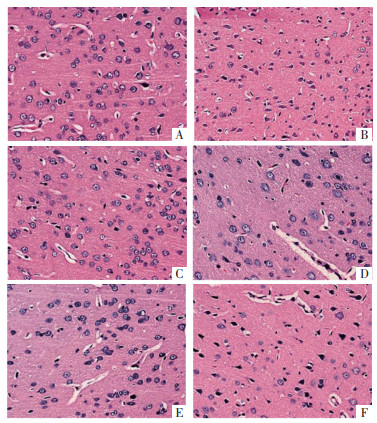
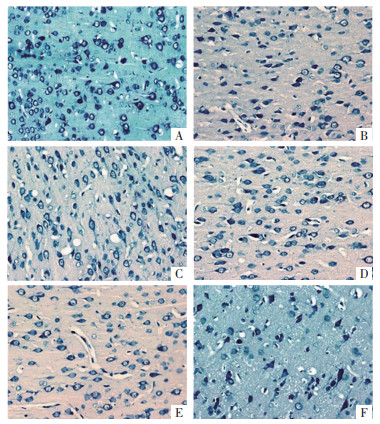
假手术组大鼠神经元排列规则,染色均匀;与假手术组相比,模型组大鼠神经元退化,细胞排列不规则且间隙增大,细胞核缩小,神经元数量减少(P < 0.05);与模型组相比,EBI组、尼莫地平组和AG490组大鼠神经元损伤减轻,细胞排列规则,细胞核形态恢复,神经元数量增加(P < 0.05),且EBI组与尼莫地平组和AG490组的差异均无统计学意义(P > 0.05);与EBI组相比,EBI+CA1组大鼠神经元形态与模型组无显著差异,神经元数量减少(P < 0.05)。见表 3和图 2、图 3。
|
| 注:A,假手术组;B,模型组;C,EBI组;D,尼莫地平组;E,AG490组;F,EBI+CA1组。 图 2 HE染色检测各组大鼠脑组织的病理学形态(×200) Fig. 2 HE staining was used to detect the pathological morphology of brain tissue of rats in each group(×200) |
|
| 注:A,假手术组;B,模型组;C,EBI组;D,尼莫地平组;E,AG490组;F,EBI+CA1组。 图 3 Nissl染色检测各组大鼠神经元数量(×200) Fig. 3 Nissl staining was used to detect the number of neurons in each group(×200) |
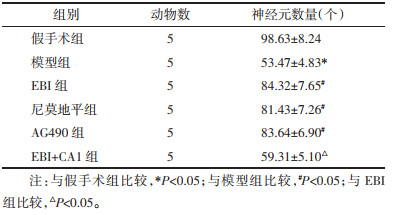
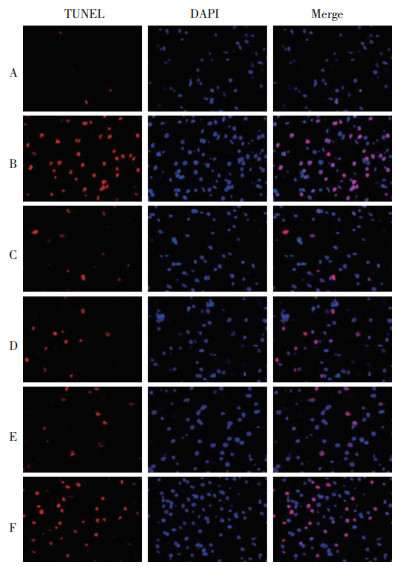
与假手术组相比,模型组大鼠脑组织中神经细胞凋亡率升高(P < 0.05);与模型组相比,EBI组、尼莫地平组和AG490组大鼠脑组织中神经细胞凋亡率降低(P < 0.05),且EBI组与尼莫地平组和AG490组的差异均无统计学意义(P > 0.05);与EBI组相比,EBI+CA1组大鼠脑组织中神经细胞凋亡率升高(P < 0.05),见表 4和图 4。
|
| 注:A,假手术组;B,模型组;C,EBI组;D,尼莫地平组;E,AG490组;F,EBI+CA1组。 图 4 TUNEL染色检测各组大鼠神经细胞凋亡情况(×200) Fig. 4 Detection of neuronal apoptosis in rats of each group by TUNEL staining(×200) |
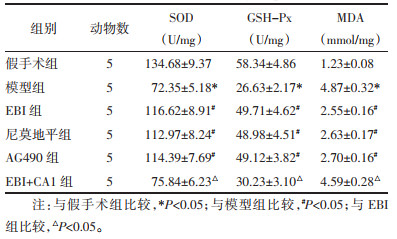
与假手术组相比,模型组大鼠脑组织中MDA水平升高,SOD、GSH-Px水平降低(P < 0.05);与模型组相比,EBI组、尼莫地平组和AG490组大鼠脑组织中MDA水平降低,SOD、GSH-Px水平升高(P < 0.05),且EBI组与尼莫地平组和AG490组的差异均无统计学意义(P > 0.05);与EBI组相比,EBI+CA1组大鼠脑组织中MDA水平升高,SOD、GSH-Px水平降低(P < 0.05),见表 5。
|
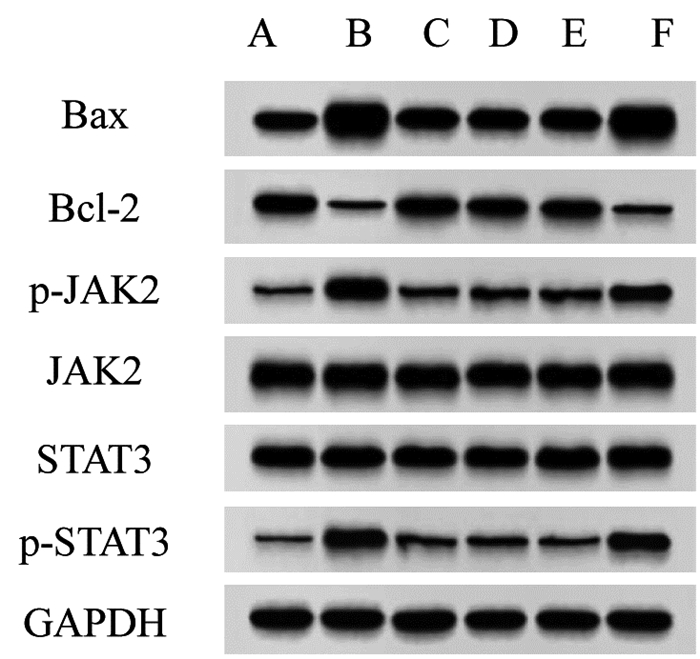
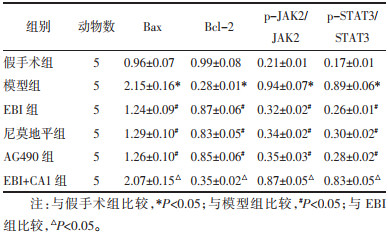
与假手术组相比,模型组大鼠脑组织中Bax表达及p-JAK2/JAK2、p-STAT3/STAT3升高,Bcl-2表达降低(P < 0.05);与模型组相比,EBI组、尼莫地平组和AG490组大鼠脑组织中Bax表达及p-JAK2/JAK2、p-STAT3/STAT3降低,Bcl-2表达升高(P < 0.05),且EBI组与尼莫地平组和AG490组的差异均无统计学意义(P > 0.05);与EBI组相比,EBI+CA1组大鼠脑组织中Bax表达及p-JAK2/JAK2、p-STAT3/STAT3升高,Bcl-2表达降低(P < 0.05)。见图 5和表 6。
|
| 注:A,假手术组;B,模型组;C,EBI组;D,尼莫地平组;E,AG490组;F,EBI+CA1组。 图 5 各组大鼠脑组织中Bax、Bcl-2及JAK2、p-JAK2、STAT3、p-STAT3蛋白表达 Fig. 5 Expression of Bax, Bcl-2, JAK2, p-JAK2, STAT3 and p-STAT3 in brain tissue of rats in each group |
|
缺血性脑卒中是一种常见的急性脑血管疾病,主要是由缺血性血管的短暂或永久闭塞引起,可导致脑组织损伤、梗死甚至残疾[12]。据报道,神经元死亡可发生在缺血性脑卒中后数分钟至数小时内,主要通过细胞凋亡或坏死发生。虽然给予重组组织纤溶酶原激活剂和血管内介入可以恢复血流灌注,但缺血再灌注损伤可能导致神经元活性下降,甚至导致更严重的细胞损伤[13]。目前,溶栓治疗是通过在不可逆的神经元死亡之前向脑组织提供再灌注来改善结果的最有效治疗方法。然而,这种策略只能在发病后较短时间内进行才能有效改变缺血的进程[14]。因此,寻找一种有效的方法来预防缺血性神经元损伤对于脑卒中治疗是非常必要的。本研究利用MCAO法建立缺血性脑卒中大鼠模型,结果显示,模型组大鼠神经缺损评分高于假手术组,脑梗死面积大于假手术组,同时脑组织神经元退化,细胞排列不规则且核缩小,神经元数目低于假手术组,表明大鼠脑卒中模型复制成功。而EBI干预后,大鼠神经缺损评分降低,脑梗死面积减小,神经元损伤减轻,细胞形态恢复,神经元数量增加,且EBI组与阳性药物尼莫地平组无显著差异。揭示了EBI能够减轻缺血性脑卒中大鼠的神经功能障碍,抑制大脑梗死和神经元损伤。
脑缺血后的神经功能损害归因于各种病理生理事件,包括神经细胞凋亡、炎症、免疫功能障碍和血脑屏障损伤,其中神经细胞的凋亡对于缺血性脑卒中的病理生理学至关重要,涉及许多凋亡相关基因,包括抗凋亡蛋白Bcl-2和促凋亡蛋白Bax[10]。本研究通过TUNEL染色和Western blot发现,阳性药物和EBI干预后大鼠脑组织中神经元细胞凋亡率小于模型组,Bax蛋白表达低于模型组,Bcl-2蛋白表达高于模型组,揭示了EBI能够抑制缺血性脑卒中大鼠的神经元凋亡。除此之外,氧化应激也被认为是缺血性脑卒中脑损伤的关键致病机制,在再灌注期间,氧和葡萄糖水平异常升高会加剧氧化应激和由于初始缺血而已经发生的细胞死亡[15]。氧化应激主要是由活性氧的过量产生引起的,该过程会促进脂质过氧化来诱导MDA等活性醛的产生,同时导致SOD、GSH-Px等抗氧化酶表达减少,抗氧化防御系统失衡,引起更严重的氧化应激和神经元损伤[16]。本研究结果显示,阳性药物组和EBI组大鼠脑组织中SOD、GSH-Px活性高于模型组,MDA水平低于模型组,表明EBI能够抑制缺血性脑卒中大鼠的氧化应激损伤,进而减轻神经元损伤。
据报道,JAK2/STAT3信号通路是主要的细胞因子信号通路之一,该通路广泛参与各种疾病的发展,包括免疫反应、细胞凋亡、血管生成、氧化应激和神经炎症等[17]。研究发现,JAK2/STAT3激活会导致脑缺血永久神经元损伤,而干扰JAK2/STAT3信号通路可改善神经功能[18]。因此,本研究探讨了JAK2/STAT3通路在EBI改善脑卒中神经元损伤中的作用,结果显示,EBI组大鼠脑组织中p-JAK2/JAK2、p-STAT3/STAT3水平均低于模型组,且与JAK2抑制剂AG490组无显著差异,揭示了EBI能够抑制脑卒中大鼠中JAK2/STAT3信号通路的激活。接着又利用JAK2激活剂CA1进行回补实验,结果显示,EBI对脑卒中大鼠神经元的保护作用被消除,揭示了EBI对脑卒中大鼠神经元发挥保护作用的具体机制可能与抑制JAK2/STAT3信号通路有关。
综上所述,EBI可能通过抑制JAK2/STAT3信号通路对脑卒中大鼠神经元发挥保护作用。本研究为减轻缺血性脑卒中神经元损伤提供了新的药物和理论依据。
| [1] |
BENJAMIN E J, BLAHA M J, CHIUVE S E, et al. Heart disease and stroke statistics-2017 update: a report from the American heart association[J]. Circulation, 2017, 135(10): e146-e603. |
| [2] |
WANG H, DU Y S, XU W S, et al. Exogenous glutathione exerts a therapeutic effect in ischemic stroke rats by interacting with intrastriatal dopamine[J]. Acta Pharmacologica Sinica, 2022, 43(3): 541-551. DOI:10.1038/s41401-021-00650-3 |
| [3] |
GUAN L F, LEE H, GENG X K, et al. Neuroprotective effects of pharmacological hypothermia on hyperglycolysis and gluconeogenesis in rats after ischemic stroke[J]. Biomolecules, 2022, 12(6): 851. DOI:10.3390/biom12060851 |
| [4] |
YU L, ZHANG Y Y, CHEN Q Q, et al. Formononetin protects against inflammation associated with cerebral ischemia-reperfusion injury in rats by targeting the JAK2/STAT3 signaling pathway[J]. Biomedecine & Pharmacotherapie, 2022, 149(5): 112836. |
| [5] |
ZHU H, JIAN Z H, ZHONG Y, et al. Janus kinase inhibition ameliorates ischemic stroke injury and neuroinflammation through reducing NLRP3 inflammasome activation via JAK2/STAT3 pathway inhibition[J]. Frontiers in Immunology, 2021, 12(7): 714943. |
| [6] |
LIU G L, LIANG Y, XU M, et al. Protective mechanism of Erigeron breviscapus injection on blood-brain barrier injury induced by cerebral ischemia in rats[J]. Scientific Reports, 2021, 11(1): 18451. DOI:10.1038/s41598-021-97908-x |
| [7] |
LIU G L, TANG G M, LIANG W W, et al. PK-PD correlation of Erigeron breviscapus injection in the treatment of cerebral ischemia-reperfusion injury model rats[J]. Journal of Molecular Neuroscience, 2021, 71(2): 302-324. DOI:10.1007/s12031-020-01651-3 |
| [8] |
AN H T, TAO W H, LIANG Y, et al. Dengzhanxixin Injection ameliorates cognitive impairment through a neuroprotective mechanism based on mitochondrial preservation in patients with acute ischemic stroke[J]. Frontiers in Pharmacology, 2021, 12(8): 712436. |
| [9] |
ZHANG Y, LIU Q H, ZHANG T, et al. The therapeutic role of Jingchuan Tablet on ischaemic cerebral stroke via the HIF-1α/EPO/VEGFA signalling pathway[J]. Pharmaceutical Biology, 2022, 60(1): 2110-2123. DOI:10.1080/13880209.2022.2134430 |
| [10] |
HOU Y Y, WANG K, WAN W J, et al. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/AKT/mTOR pathway after stroke in rats[J]. Genes & Diseases, 2018, 5(3): 245-255. |
| [11] |
SHAN Y, WANG L, SUN J Y, et al. Exercise preconditioning attenuates cerebral ischemia-induced neuronal apoptosis, Th17/Treg imbalance, and inflammation in rats by inhibiting the JAK2/STAT3 pathway[J]. Brain and Behavior, 2023, 13(6): e3030. DOI:10.1002/brb3.3030 |
| [12] |
ZHU F H, CHEN H H, XU M F, et al. Cryptotanshinone possesses therapeutic effects on ischaemic stroke through regulating STAT5 in a rat model[J]. Pharmaceutical Biology, 2021, 59(1): 465-471. |
| [13] |
ZHANG K Y, RUI G, ZHANG J P, et al. Cathodal tDCS exerts neuroprotective effect in rat brain after acute ischemic stroke[J]. BMC Neuroscience, 2020, 21(1): 21. DOI:10.1186/s12868-020-00570-8 |
| [14] |
SONG Y S, LEE S H, JUNG J H, et al. TSPO expression modulatory effect of acetylcholinesterase inhibitor in the ischemic stroke rat model[J]. Cells, 2021, 10(6): 1350. DOI:10.3390/cells10061350 |
| [15] |
PATIÑO P, PARADA E, FARRÉ-ALINS V, et al. Melatonin protects against oxygen and glucose deprivation by decreasing extracellular glutamate and Nox-derived ROS in rat hippocampal slices[J]. Neurotoxicology, 2016, 57(12): 61-68. |
| [16] |
SUN M S, JIN H, SUN X, et al. Free radical damage in ischemia-reperfusion injury: an obstacle in acute ischemic stroke after revascularization therapy[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018(1): 3804979. |
| [17] |
WANG Y, KONG X Q, WU F, et al. SOCS1/JAK2/STAT3 axis regulates early brain injury induced by subarachnoid hemorrhage via inflammatory responses[J]. Neural Regeneration Research, 2021, 16(12): 2453-2464. DOI:10.4103/1673-5374.313049 |
| [18] |
SATRIOTOMO I, BOWEN K K, VEMUGANTI R. JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia[J]. Journal of Neurochemistry, 2006, 98(5): 1353-1368. DOI:10.1111/j.1471-4159.2006.04051.x |
2. Department of Laboratory, Zhengzhou Seventh People's Hospital, Zhengzhou 450016, China
 2024, Vol. 41
2024, Vol. 41