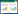文章信息
- 刘爱茹, 李华君, 王立新, 等.
- LIU Airu, LI Huajun, WANG Lixin, et al.
- 清热祛浊胶囊对非酒精性脂肪肝炎小鼠NF-κB/NLRP3信号通路的调控机制研究
- Study on the regulatory mechanism of Qingre Quzhuo Capsule on NF-κB/NLRP3 signaling pathway in mice with non-alcoholic steatohepatitis
- 天津中医药, 2024, 41(2): 214-221
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(2): 214-221
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.02.14
-
文章历史
- 收稿日期: 2023-10-23
非酒精性脂肪肝炎(NASH)又称代谢性脂肪性肝炎,是非酒精性脂肪性肝病(NAFLD)的进一步进展,以脂肪变性、肝细胞气球样化和小叶炎症为特征[1-2]。NASH与炎症和纤维化有关,其终末期可能进展为肝硬化和肝细胞癌[3-6]。据统计,全球范围内NASH约占NAFLD的25%[7-9]。NASH给社会经济和公共卫生带来巨大负担,同时也引起了人们对NASH的重视,因此开发安全有效的药物延缓疾病进展已成为该领域研究的热点之一。
虽然NASH在其流行病学、病理生理学和确定治疗靶点方面取得了稳步进展,但在系统治疗领域仍进展缓慢[10]。临床将调整饮食、增加运动量等手段作为控制体质量和减脂的基础治疗方法,但仍需配合用药进行综合治疗。近年来中药抗NASH的研究[包括降血脂、抗氧化、抗炎、抗纤维化、改善胰岛素抵抗(IR)等方面]越来越深入。中药多靶点综合性治疗NASH可能是其好于西药的一个潜在优点,所以研究中药对NASH的治疗作用成为了新的研究方向[11]。
清热祛浊胶囊(QRQZ)是河北省沧州中西医结合医院院内制剂,临床多用于NAFLD、NASH、肥胖、2型糖尿病等治疗,具有清热利湿、涤痰祛瘀之功效[12]。临床研究表明,该方对NASH疗效显著,然而作用机制尚未明确。本研究以蛋氨酸和胆碱缺乏(MCD)诱导的NASH模型小鼠为研究对象,首先评估QRQZ的治疗作用;其次研究本方对核转录因子-κB(NF-κB)/核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)通路的影响,初步揭示其机制。
1 实验材料 1.1 实验动物60只6~8周龄健康的C57BL/6小鼠,体质量(20±2)g,购于斯贝福(北京)生物技术有限公司[生产许可证号:SYXK(京)2019-0030]。明暗周期为12 h的环境下保持(25±2)℃的恒温,相对湿度为50%±15%,让其自由饮水和进食,所有动物实验已被河北省沧州中西医结合医院批准。
1.2 药品与试剂QRQZ购自沧州中西医结合医院(批号:220308);多烯磷脂酰胆碱胶囊(PPC)购自赛诺菲(北京)制药有限公司(批号:CBJD106);MCD饲料(蔗糖45.53%,碳酸氢钠0.75%,玉米淀粉15%,麦芽糊精5%,纤维素3%,玉米油10%,多种矿物质S10001 3.5%,多种维生素V100011%,蛋氨酸0%,胆碱0%,丙氨酸0.35%,精氨酸1.21%,天冬酰胺0.6%,冬氨酸0.35%,胱氨酸0.35%,谷氨酸0.4%,甘氨酸2.33%,组氨酸0.45%,异亮氨酸0.82%,亮氨酸1.11%,赖氨酸1.8%,苯丙氨酸0.75%,脯氨酸0.35%,丝氨酸0.35%,苏氨酸0.82%,色氨酸0.18%,酪氨酸0.5%,缬氨酸0.82%)购自北京斯贝福有限公司,丙氨酸氨基转移酶(ALT,货号:C009-2-1),天门冬氨酸氨基转移酶(AST,货号:C010-2-1),三酰甘油(TG,货号:A110-1-1),总胆固醇(TC,货号:A111-1-1),超氧化物歧化酶(SOD,货号A001-3-2),谷胱甘肽过氧化物酶(GSH-Px,货号A005-1-2),丙二醛(MDA,货号A003-1-2)试剂盒均购于南京建成生物工程研究所;白细胞介素-1β(IL-1β,货号H002-1-2)、白细胞介素-6(IL-6,货号H007-1-1)、肿瘤坏死因子-α(TNF-α,货号H052-1-2)酶联免疫吸附测定(ELISA)试剂盒购于蓝基生物科技有限公司;NF-κB P65抗体(货号10745-1-AP)、核因子κB抑制蛋白(IκB)抗体(货号10268-1-AP)、β-肌动蛋白(β-actin)抗体(货号20536-1-1AP)均购于proteintech;活化的半胱氨酸天冬氨酸蛋白酶1(cleaved Caspase-1)抗体(货号22915-1-AP)、磷酸化核因子κB抑制蛋白(p-IκB)抗体(货号bs-18128-R)、凋亡相关斑点样蛋白(ASC)抗体(货号bs-1185R)、NLRP3抗体(货号bs-10021R)购于博奥森生物有限公司;磷酸化κB P65(p-NF-κB P65)抗体(货号#3033)购于CST公司;mature白细胞介素-1β(IL-1β)(货号ab283818)购于abcam。
2 实验方法 2.1 高脂饮食诱导NASH小鼠模型建立与分组将小鼠适应性喂养7 d后随机分为正常组、模型组、PPC组、QRQZ低剂量组、QRQZ中剂量组、QRQZ高剂量组,每组10只。除正常组给予正常饮食外,其余5组实验组均给予MCD饮食持续8周。从第5周开始,PPC组每天灌胃给予88 mg/kg的PPC,QRQZ低剂量组、QRQZ中剂量组、QRQZ高剂量组分别给予482 mg/kg、964 mg/kg、1 929 mg/kg的QRQZ,正常组与模型组平行给予等体积的生理盐水作为溶媒对照。清热祛浊胶囊小鼠给药剂量是通过小鼠与人体表面积换算为人等效剂量,清热祛浊胶囊中剂量为人等效剂量,清热祛浊胶囊低剂量为清热祛浊胶囊中剂量的0.5倍,清热祛浊胶囊高剂量为清热祛浊胶囊中剂量的2倍。每7 d称量小鼠体质量并记录。
2.2 生化指标检测将肝脏与生理盐水按质量:体积=1∶9的比例混合后,在冰水浴上超声匀浆完全破碎,用2 500 r/min离心10 min后取上清即为10%肝组织匀浆,离心半径为8.6 cm(下同),按照试剂盒步骤要求检测TG、TC、SOD、MDA、GSH-Px的浓度。
摘眼球取血,将收集到的血液以3 000 r/min离心15 min,收集血清,按照试剂盒说明书检测各组小鼠血清中ALT、AST水平。
2.3 肝组织病理学染色QRQZ干预4周后,取出的新鲜小鼠肝脏组织用4%多聚甲醛固定和-80 ℃冻存,固定不少于48 h,而后再通过梯度乙醇脱水,制备石蜡切片。对切片分别进行苏木精-伊红(HE)染色并在光学显微镜下观察组织的病理学改变。将速冻的新鲜肝组织制作成冰冻切片,经油红O染色后光镜下观察肝组织内脂肪的聚集。
2.4 ELISA检测肝组织IL-1β、IL-6以及TNF-a均使用双抗体一步夹心法ELISA测试。简言之,在包被了捕获抗体的微孔中加入待测样本、标准品与检测抗体,经温浴并彻底洗涤后,加入反应底物显色,经酶标仪测定吸光度后,利用标准品测定结果绘制标准曲线,计算获得每个样本的待测物质浓度。
2.5 实时定量聚合酶链反应(qPCR)检测通过qPCR,从肝脏组织中提取总RNA后,确定NLRP3、ASC、Caspase-1、IL-1B的mRNA的肝脏表达。引物序列见表 1。mRNA的表达相对于Actb。以2-ΔΔCT法计算相对表达量。
采用Western blot法检测肝组织中NF-κB/NLRP3通路相关蛋白信号关键因子IκB、P65、NLRP3、ASC、cleaved Caspase-1、mature IL-1β蛋白水平。在取得的小鼠肝脏组织中加入RIPA裂解缓冲液,进行匀浆离心,提取总蛋白,并用BCA蛋白测定试剂盒测定总蛋白浓度。应用电泳对蛋白进行分离,将其转移至PVDF膜上,在室温下用5%脱脂奶粉封闭2 h并取出。取出后,将不同的兔抗小鼠一抗IκB(稀释比例1∶4 000)、p-IκB(稀释比例1∶4 000)、P65(稀释比例1∶8 000)、p-P65(稀释比例1∶2 000)、NLRP3(稀释比例1∶2 000)、ASC(稀释比例1∶2 000)、cleaved Caspase-1(稀释比例1∶2 000)、mature IL-1β(稀释比例1∶1 000)、β-actin(稀释比例1∶10 000)加入其中,4 ℃孵育过夜。洗膜后加入二抗[羊抗兔免疫球蛋白(IgG)稀释比例按1∶20 000],在室温下孵育2 h,TBST洗膜后,加入ECL化学发光法显影检测,扫描电泳条带图像,以β-actin为内参检测蛋白表达。应用Image J软件计算平均光密度值。
2.7 统计学方法数据统计分析使用SPSS Statistics 19.0软件,对符合正态分布的计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
3 结果 3.1 体质量及肝指数造模给药结束后,与正常组相比,模型组小鼠体质量显著降低,肝指数显著升高(P < 0.01)。与模型组相比,PPC组小鼠体质量显著回升,肝指数显著降低(P < 0.01);QRQZ低剂量组小鼠体质量有所回升(P < 0.05);QRQZ中剂量组小鼠体质量显著回升,肝指数显著降低(P < 0.01);QRQZ高剂量组小鼠体质量显著回升,肝指数显著降低(P < 0.01)。见图 1A~1B。
|
| 注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 图 1 造模给药后各组小鼠体质量及肝指数变化(x±s) Fig. 1 Changes of body weight and liver index of mice in each group after modeling and administration(x±s) |
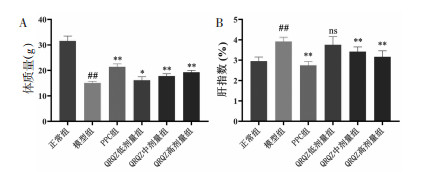
造模给药后,模型组与正常组相比,肝脏TC、TG以及血清ALT、AST含量显著升高(均P < 0.01)。与模型组相比,PPC组(均P < 0.01)、QRQZ低剂量组(P < 0.01或P < 0.05)、QRQZ中剂量组(P < 0.01或P < 0.05)、QRQZ高剂量组(均P < 0.01)小鼠肝脏TC、TG水平以及血清ALT、AST活性显著降低。见图 2。
|
| 注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 图 2 造模给药后各组小鼠的生化指标(x±s) Fig. 2 Biochemical indexes of mice in each group after modeling and administration(x±s) |
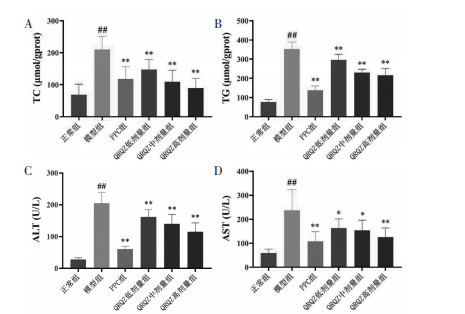
HE结果显示,正常组小鼠肝板排列整齐,结构正常;模型组小鼠出现大量空泡样脂肪变性,肝板排列紊乱以及大量炎细胞浸润;给药组小鼠肝脏脂肪滴空泡比例均显著下降,炎症细胞浸润呈现一定的改善趋势。见图 3A。油红O染色结果显示,模型组肝脏有着极为严重的脂肪样变,巨大的橘红色脂肪滴占据了大部分的面积,核呈蓝色;给药干预后能在不同程度上缓解以上病变。见图 3B。
|
| 图 3 造模给药后各组小鼠病理学的变化(×100) Fig. 3 Pathological changes of mice in each group after modeling and administration(×100) |
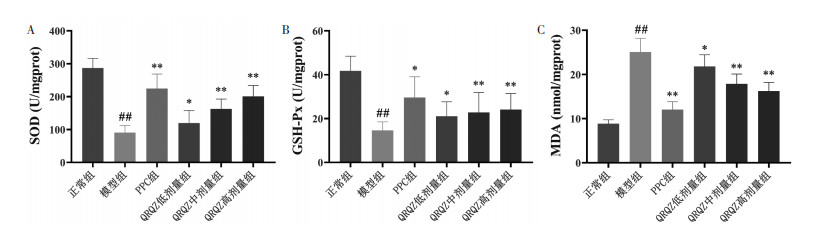
与正常组肝脏相比,模型组肝脏中的SOD和GSH-Px活性下降,而MDA水平上升(P < 0.01)。与模型组肝脏相比,PPC组(P < 0.01或P < 0.05)、QRQZ低剂量组(P < 0.05)、QRQZ中剂量组(P < 0.01)、QRQZ高剂量组(P < 0.01)肝脏中的SOD和GSH-Px活性提升,MDA水平降低。见图 4。
|
| 注:与正常组比较,##P<0.01;与模型组相比,*P<0.05,**P<0.01。 图 4 造模给药后各组小鼠氧化应激的影响(x±s) Fig. 4 Effects of oxidative stress of mice after modeling and administration(x±s) |
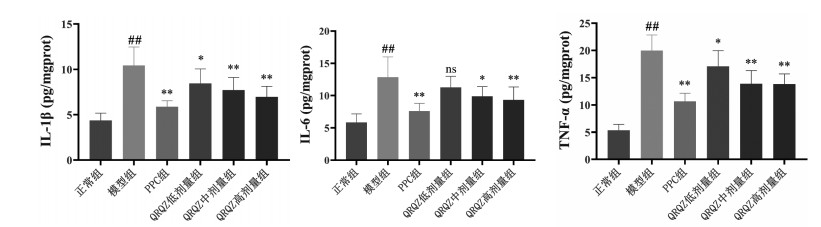
ELISA结果显示,与正常组相比,模型组肝脏中炎症因子IL-1β、IL-6、TNF-α均显著升高(P < 0.01);与模型组相比,PPC组(P < 0.01)肝脏中炎症因子IL-1β、IL-6、TNF-α均有所降低;QRQZ低剂量组(P < 0.05)肝脏中炎症因子IL-1β、TNF-α有所降低,QRQZ中剂量组(P < 0.01或P < 0.05)肝脏中炎症因子IL-1β、IL-6、TNF-α均有所降低;QRQZ高剂量组(P < 0.01)肝脏中炎症因子IL-1β、IL-6、TNF-α均有所降低。见图 5。
|
| 注:与正常组比较,##P<0.01;与模型组相比,*P<0.05,**P<0.01。 图 5 造模给药后各组小鼠肝组织炎症因子水平(x±s) Fig. 5 Levels of inflammatory factors in liver tissue of mice in each group after modeling and administration(x±s) |
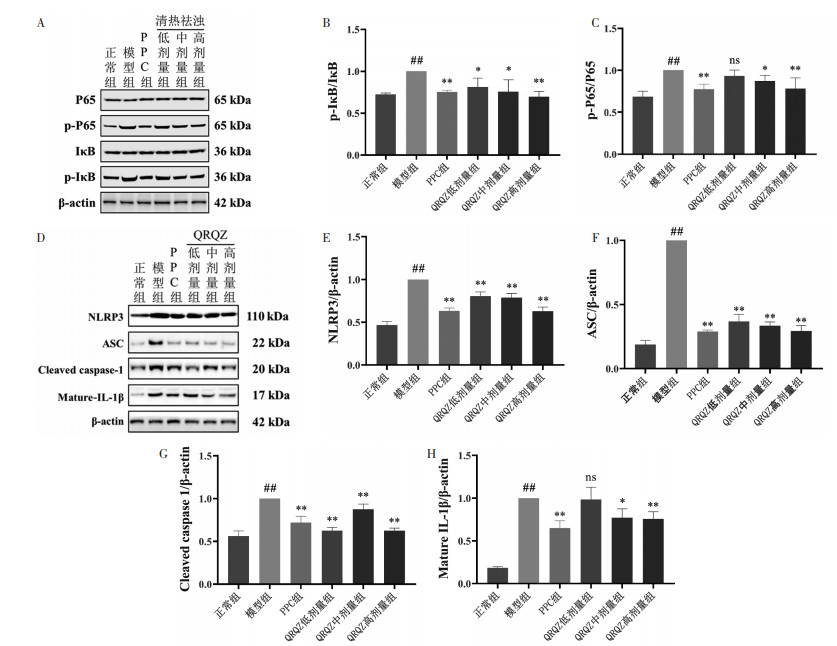
运用Western blot检测了小鼠肝脏中NF-κB信号通路关键因子IκB、p-IκB、P65、p-P65蛋白水平。结果显示,与正常组相比,模型组小鼠肝脏中p-IκB、p-P65水平显著降低(P < 0.01),与模型组相比,PPC组(P < 0.01)小鼠肝脏p-IκB、p-P65水平显著升高;QRQZ低剂量组(P < 0.01)小鼠肝脏p-IκB水平显著升高;QRQZ中剂量组(P < 0.01或P < 0.05)小鼠肝脏p-IκB、p-P65水平显著升高;QRQZ高剂量组(P < 0.01)小鼠肝脏p-IκB、p-P65水平显著升高。见图 6A、6B、6C。同时还检测了小鼠肝脏中NLRP3信号通路关键因子NLRP3、ASC、cleaved Caspase-1、mature-IL-1β蛋白水平。结果显示,与正常组相比,模型组小鼠肝脏中NLRP3、ASC、cleaved Caspase-1、mature-IL-1β水平显著升高(P < 0.01),与模型组相比,PPC组(P < 0.01)小鼠肝脏NLRP3、ASC、cleaved Caspase-1、mature-IL-1β水平显著降低;QRQZ低剂量组(P < 0.01)小鼠肝脏NLRP3、ASC、cleaved Caspase-1水平显著降低、QRQZ中剂量组小鼠(P < 0.01)小鼠肝脏NLRP3、ASC、cleaved Caspase-1、mature-IL-1β水平显著降低;QRQZ高剂量组(P < 0.01)小鼠肝脏NLRP3、ASC、cleaved Caspase-1、mature-IL-1β水平显著降低。见图 6D、6E、6F、6G、6H。
|
| 注:与正常组比较,##P<0.01;与模型组相比,*P<0.05,**P<0.01。 图 6 造模给药后对各组小鼠肝组织NF-κB/NLRP3通路的影响(x±s) Fig. 6 Effect of modeling administration on NF-κB/NLRP3 pathway in liver tissue of mice in each group(x±s) |
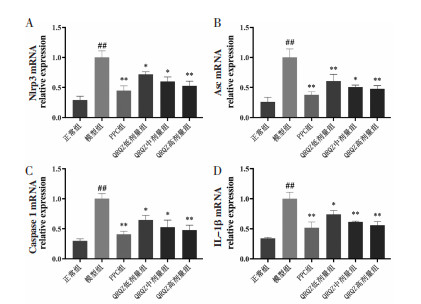
此外研究运用qPCR检测了NLRP3通路的相关基因的表达,结果显示,与正常组相比,模型组小鼠肝组织中肝脏炎症因子NLRP3、ASC、Caspase-1、IL-1β的mRNA相对表达量增加(P < 0.01)。与模型组相比,PPC组(均P < 0.01)、QRQZ低剂量组(P < 0.01或P < 0.05)、QRQZ中剂量组(P < 0.01或P < 0.05)、QRQZ高剂量组(P < 0.01)小鼠肝组织中炎症因子NLRP3、ASC、Caspase-1、IL-1β的mRNA相对表达量均有所降低。见图 7。
|
| 注:与正常组比较,##P<0.01;与模型组相比,*P<0.05,**P<0.01。 图 7 造模给药后各组小鼠肝组织中Nlrp3、Asc、Caspase1、IL-1β基因相对表达量的影响(x±s) Fig. 7 Effect of relative expression of Nlrp3, Asc, Caspase1 and IL-1β genes in liver tissue of mice in each group after modeling and administration(x±s) |
本研究通过MCD饮食诱导NASH模型,并给予QRQZ干预。MCD饮食通过减少小鼠对蛋氨酸和胆碱的摄入,导致极低密度脂蛋白合成减少,脂肪无法得到分解利用,脂肪不断积累,最终形成NASH[13]。NASH模型复制了在人类NASH中观察到的脂肪性肝炎和纤维化的组织学特征,包括脂肪变性、小叶内炎症、肝细胞球囊化等[14]。结果显示,模型组小鼠肝指数增大,血清中ALT和AST水平显著升高,肝脏中TC和TG水平升高,HE和油红O染色显示模型小鼠肝脏有明显的脂肪变性,伴有大量炎细胞浸润,与NASH的病理变化一致,提示造模成功。QRQZ显著改善NASH小鼠的肝功能异常,同时减少肝脂肪沉积。此外,本研究还选用临床上常用于治疗NASH的药物PPC作为阳性对照药物[15],结果显示QRQZ与PPC疗效相近。
氧化应激和炎症之间相互影响,是NASH的主要病理表现[16]。因此,本研究接下来探讨了QRQZ对NASH小鼠氧化应激和炎症反应的影响。本研究发现,模型组小鼠体内氧化应激水平远高于正常组,而经过QRQZ干预后的小鼠抗氧化能力得到了提升。氧化应激指当机体受到外界不良因素刺激时会产生过多的氧自由基,它会打破机体原有的氧化和抗氧化系统间的平衡,进而导致肝组织损伤[17]。同时,氧化应激也能通过激活转录因子NF-κB等多种致炎途径诱发炎症[18]。高水平的ROS会导致细胞内酶活性改变、蛋白质变性、细胞膜结构和功能破坏[19-20]。因此ROS介导的脂质过氧化反应为NASH发病的重要环节[21]。SOD和GSH-Px是机体内的抗氧化酶[22]。SOD能清除脂质过氧化过程中产生的具有高度活性的超氧阴离子,减轻其毒性作用,保护肝细胞结构和功能正常。GSH-Px的主要作用是清除脂质过氧化物,具有抗氧化作用[23]。MDA作为氧化应激损伤的标志物,是氧化应激过程中脂质氧化反应的终产物。MDA可间接显示肝细胞损伤程度,是一种衡量细胞氧化应激水平的重要指标[24]。此外,QRQZ可显著降低炎症因子水平。炎症是一种常见于感染和组织损伤的适应性反应。当炎症诱导剂脂多糖存在时会促使大量的炎症因子过度产生,从而加剧炎症[25]。IL-1β、IL-6、TNF-α均为重要的炎性反应因子,由多种免疫细胞产生,在机体炎性状态下刺激免疫应答,引起免疫性病理损伤[26]。以上结果提示抑制氧化应激与炎症反应可能是QRQZ治疗NASH的机制。
NF-κB/NLRP3信号通路的活化是引起NASH小鼠氧化应激和炎症反应的重要因素,因此本研究接下来研究了QRQZ对NF-κB/NLRP3通路的影响。NF-κB是一种重要的核转录因子,参与炎症反应的发生。生理情况下,胞质中的NF-κB与IκB相互结合并处于抑制状态,脂质沉积导致肝细胞损伤,可使NF-κB的P65亚基及IκB发生磷酸化,之后磷酸化的NF-κB P65与IκB解离,进入细胞核中,促进多种炎症信号相关基因表达。其中NLRP3炎症小体是NF-κB的重要下游信号,入核后的NF-κB P65可促进NLRP3、ASC、Caspase-1、IL-1B基因表达。NLRP3炎症小体是一种含有NLR蛋白和ASC衔接蛋白的多蛋白胞质复合物,也是先天性免疫系统的重要组成部分,它可以介导Caspase-1活化形成cleaved Caspase-1,进而切割IL-1β前体,形成成熟的IL-1β,促进炎症反应的发生[27]。本研究发现,QRQZ干预后可显著下调NF-κB/NLRP3信号通路相关蛋白及基因表达,提示QRQZ可以通过抑制NF-κB/NLRP3信号通路介导的氧化应激和炎症反应缓解NASH小鼠肝脏脂肪变性。
综上所述,QRQZ对NASH小鼠具有治疗作用,其作用机制可能与抑制NF-κB/NLRP3信号通路活化有关。然而,本研究的实验还存在一些局限性,对QRQZ治疗NASH的更深层次作用机制,如代谢组学、分子对接、系统药理学和体外研究等,将会是本研究未来的探索方向。
| [1] |
范建高, 魏来, 等. 非酒精性脂肪性肝病防治指南(2018年更新版)[J]. 实用肝脏病杂志, 2018, 21(2): 177-186. DOI:10.3969/j.issn.1672-5069.2018.02.007 |
| [2] |
孙超, 范建高. 中外非酒精性脂肪性肝病诊疗指南解读[J]. 中国实用内科杂志, 2019, 39(3): 235-238. |
| [3] |
Clarification of the number of references and studies used in review[J]. JAMA, 2015, 314(14): 1521.
|
| [4] |
KUPČOVÁ V, FEDELEŠOVÁ M, BULAS J, et al. Overview of the pathogenesis, genetic, and non-invasive clinical, biochemical, and scoring methods in the assessment of NAFLD[J]. International Journal of Environmental Research and Public Health, 2019, 16(19): 3570. DOI:10.3390/ijerph16193570 |
| [5] |
HARDY T, OAKLEY F, ANSTEE Q M, et al. Nonalcoholic fatty liver disease: pathogenesis and disease spectrum[J]. Annual Review of Pathology, 2016, 11(3): 451-496. |
| [6] |
GEIER A, TINIAKOS D, DENK H, et al. From the origin of NASH to the future of metabolic fatty liver disease[J]. Gut, 2021, 70(8): 1570-1579. DOI:10.1136/gutjnl-2020-323202 |
| [7] |
LONARDO A, BYRNE C D, CALDWELL S H, et al. Global epidemiology of nonalcoholic fatty liver disease: Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64(4): 1388-1389. DOI:10.1002/hep.28584 |
| [8] |
ESTES C, RAZAVI H, LOOMBA R, et al. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease[J]. Hepatology, 2018, 67(1): 123-133. DOI:10.1002/hep.29466 |
| [9] |
ESTES C, ANSTEE Q M, ARIAS-LOSTE M T, et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom and United States for the period 2016-2030[J]. Journal of Hepatology, 2018, 69(4): 896-904. DOI:10.1016/j.jhep.2018.05.036 |
| [10] |
RAZA S, RAJAK S, UPADHYAY A, et al. Current treatment paradigms and emerging therapies for NAFLD/NASH[J]. Frontiers in Bioscience(Landmark Edition), 2021, 26(2): 206-237. DOI:10.2741/4892 |
| [11] |
胡义扬. 中医药治疗非酒精性脂肪性肝病的优势与展望[J]. 世界中医药, 2015, 10(2): 149-152. DOI:10.3969/j.issn.1673-7202(sj).2015.02.002 |
| [12] |
李文东, 王晓蕴, 苏秀海, 等. 清热祛浊胶囊治疗2型糖尿病合并代谢综合征的临床研究[J]. 中华中医药杂志, 2012, 27(12): 3225-3227. |
| [13] |
LI X Y, WANG T X, HUANG X M, et al. Targeting ferroptosis alleviates methionine-choline deficient(MCD)-diet induced NASH by suppressing liver lipotoxicity[J]. Liver International: Official Journal of the International Association for the Study of the Liver, 2020, 40(6): 1378-1394. |
| [14] |
TAKAHASHI Y, SOEJIMA Y, FUKUSATO T. Animal models of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. World Journal of Gastroenterology, 2012, 18(19): 2300-2308. DOI:10.3748/wjg.v18.i19.2300 |
| [15] |
苏红领, 朱玉侠, 高正军, 等. 双环醇与多烯磷脂酰胆碱治疗非酒精性脂肪肝的疗效比较[J]. 中华肝脏病杂志, 2011(7): 552-553. DOI:10.3760/cma.j.issn.1007-3418.2011.07.019 |
| [16] |
CASTELLANI P, BALZA E, RUBARTELLI A. Inflammation, DAMPs, tumor development, and progression: a vicious circle orchestrated by redox signaling[J]. Antioxidants & Redox Signaling, 2014, 20(7): 1086-1097. |
| [17] |
LAURA C, CARLO V, SEBASTIAN C, et al. The importance of redox state in liver damage[J]. Annals of hepatology, 2003, 3(3): 86-92. |
| [18] |
ANDERSON M T, STAAL F J, GITLER C, et al. Separation of oxidant-initiated and redox-regulated steps in the NF-kappa B signal transduction pathway[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(24): 11527-11531. |
| [19] |
展巧稚, 阎文军. Ghrelin对围术期神经认知障碍小鼠术后海马氧化应激及炎性反应的影响[J]. 中国临床新医学, 2022, 15(12): 1158-1163. DOI:10.3969/j.issn.1674-3806.2022.12.11 |
| [20] |
DAS S, MARAS J S, HUSSAIN M S, et al. Hyperoxidized albumin modulates neutrophils to induce oxidative stress and inflammation in severe alcoholic hepatitis[J]. Hepatology, 2016, 65(2): 631-646. |
| [21] |
BERLANGA A, GUIU-JURADO E, PORRAS J A, et al. Molecular pathways in non-alcoholic fatty liver disease[J]. Clinical and Experimental Gastroenterology, 2014, 7(7): 221-239. |
| [22] |
ZHANG Z K, ZHOU Y, CAO J, et al. Rosmarinic acid ameliorates septic-associated mortality and lung injury in mice via GRP78/IRE1α/JNK pathway[J]. The Journal of Pharmacy and Pharmacology, 2021, 73(7): 916-921. DOI:10.1093/jpp/rgaa033 |
| [23] |
OIKONOMOU D, GEORGIOPOULOS G, KATSI V, et al. Non-alcoholic fatty liver disease and hypertension: coprevalent or correlated?[J]. European Journal of Gastroenterology & Hepatology, 2018, 30(9): 979-985. |
| [24] |
MOSTAFA D G, KHALEEL E F, BADI R M, et al. Rutin hydrate inhibits apoptosis in the brains of cadmium chloride-treated rats via preserving the mitochondrial integrity and inhibiting endoplasmic reticulum stress[J]. Neurological Research, 2019, 41(7): 594-608. |
| [25] |
郭静, 尚海, 马丽炎, 等. 芦荟大黄素衍生物AE-YJ通过PI3K-Akt/NF-κB和MAPK/NF-κB途径抑制LPS诱导RAW264.7细胞炎症介质的释放[J]. 中国药理学通报, 2021, 37(12): 1700-1708. |
| [26] |
WANG C J, SONG S Y, ZHANG Y, et al. Inhibition of the Rho/Rho kinase pathway prevents lipopolysaccharide-induced hyperalgesia and the release of TNF-α and IL-1β in the mouse spinal cord[J]. Scientific Reports, 2015, 5: 14553. |
| [27] |
XING Y, YAO X M, LI H, et al. Cutting edge: TRAF6 mediates TLR/IL-1R signaling-induced nontranscriptional priming of the NLRP3 inflammasome[J]. Journal of Immunology, 2017, 199(5): 1561-1566. |
 2024, Vol. 41
2024, Vol. 41