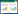文章信息
- 屈凡凡, 沈爱花, 张声生, 等.
- QU Fanfan, SHEN Aihua, ZHANG Shengsheng, et al.
- 基于网络药理学及实验验证探讨清化祛瘀健脾方治疗溃疡性结肠炎的作用机制
- Study on the mechanism of Qinghua Quyu Jianpi Decoction in treating ulcerative colitis based on network pharmacology and experimental verification
- 天津中医药, 2024, 41(2): 234-241
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(2): 234-241
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.02.16
-
文章历史
- 收稿日期: 2023-12-04
2. 北京中医药大学, 北京 100029
溃疡性结肠炎(UC)是以反复发作的腹痛、腹泻、黏液脓血便为主要临床表现的慢性非特异性炎症性疾病[1]。UC属中医“久痢”的范畴,张声生教授临床多用清化祛瘀健脾方治疗脾虚湿热夹瘀型UC,具有良好临床疗效,且本课题组前期针对清化祛瘀健脾方开展了大量的临床与基础研究,证实了清化祛瘀健脾方具有抑制氧化应激、减轻肠道炎症反应的作用[2-4],但其发挥药理作用的深层分子机制尚不十分明确。网络药理学通过构建“疾病-靶点-药物”网络从整体角度分析药物与机体的作用机制,被认为是探索中药复方机制的新视角[5]。文章以网络药理学为切入点,对清化祛瘀健脾方治疗UC的主要靶点进行了预测分析,并采用分子对接法模拟药物关键成分与靶点结合,评估药物与相关基因的作用关系,最后通过动物实验对重要靶点进行验证,以此探讨清化祛瘀健脾方治疗UC的作用机制。
1 材料和方法 1.1 筛选清化祛瘀健脾方的活性成分及靶点从中药系统药理数据库(TCMSP)和中医药综合数据库(TCMID)获取清化祛瘀健脾方中所用中药的化学成分,参考文献设置化合物的类药性(DL)和口服利用度(OB)作为筛选参数,选取OB≥30%,DL≥0.18的药效成分库[6],整理活性成分所涉及的靶点,再通过Uniprot数据库进行靶点基因注释和基因名校正。
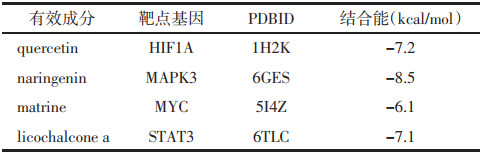
1.2 筛选UC相关基因通过人类基因组注释数据库Genecards、OMIM、PharmGKB、DrugBank和TDD数据库进行检索,筛选UC相关基因,将获取的UC基因与清化祛瘀健脾方的靶点基因取交集,遴选出共享基因,利用R软件制作韦恩图。
1.3 构建有效成分-靶点网络将清化祛瘀健脾方药物活性成分、药物疾病共同基因的对应关系导入网络可视化软件Cytoscape3.9.1,绘制“清化祛瘀健脾方药物活性成分-基因靶点”网络图。
1.4 构建蛋白与蛋白互作(PPI)网络与分析核心靶点将共同基因导入STRING数据库,物种选择为“homo sapiens”,绘制清化祛瘀健脾方治疗UC靶点PPI网络互作图,设置high confidence=0.9作为最低互作分数。使用R软件计算各主要蛋白间的互作次数,并据此找到核心靶点,生成Barplot核心靶点图。
1.5 GO功能与京都基因和基因组百科全书(KEGG)通路富集分析使用R软件对清化祛瘀健脾方与UC的共同靶基因进行GO功能与KEGG通路富集分析,结合文献筛选出清化祛瘀健脾方治疗UC的主要分子功能和信号通路。
1.6 分子对接对上述清化祛瘀健脾方中的活性成分和核心靶基因进行分子对接,从RCSBPDB数据库获取受体蛋白的晶体复合物三维结构文件,然后使用AutoTools移除受体蛋白的原配体,并进行加氢去水分子处理。从PubChem数据库获取主要活性成分的2D化学结构,利用Chem3D软件将其转换为3D结构。结合文献检索到受体蛋白活性位点的结果,使用AutoDock软件进行活性位点的搜索定位。先围绕受体可能的活性位点形成一个范围较大的活性口袋,然后用不同类型的原子作为探针进行扫描,计算格点能量,然后AutoDucks程序对配体在活性口袋内进行构象搜索,最后使用Vina软件将主要活性成分与相对应的核心靶点蛋白进行分子对接,对每个对接位点进行结合自由能(affinity)评分,自由能绝对值越大,分子结合越稳定。选择结合自由能评分最低的对接方式,最后使用Pymol软件绘制分子对接图。
1.7 动物实验验证 1.7.1 造模、分组与给药雄性SPF级C57BL/6小鼠,6~8周龄,体质量20~25 g,购自北京斯贝福实验动物有限公司,饲养于北京市中医研究所屏障级实验动物室。采用公认的葡聚糖硫酸钠(DSS,相对分子质量为36 000~50 000,MP公司,批号S4140) 制备UC小鼠模型。清化祛瘀健脾方由首都医科大学附属北京中医医院草药房提供。24只小鼠均自由摄食、饮水,适应性饲养7 d后随机分为正常组、模型组、中药组(清化祛瘀健脾方)各8只。除正常组外,模型组和中药组予3%葡聚糖硫酸钠(DSS)自由饮用6 d造模,6 d后换成正常饮用水。根据课题组前期研究结果采取临床等剂量为最优剂量[2-3],中药组予每日14.17 g/kg清化祛瘀健脾方灌胃,灌胃容积0.02 mL/g,正常组与模型组每日予等量蒸馏水灌胃。12 d后处死小鼠,取结肠组织进行后续实验检测。
1.7.2 苏木精-伊红(HE)染色观察结肠组织病理学变化将结肠组织固定保存在4%多聚甲醛溶液中24 h后,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片,进行HE染色,观察病理改变,根据Neurath提出的标准进行组织病理评分[7],积分越高表明黏膜炎症越严重。
1.7.3 免疫组织化学染色采用二步免疫组化法检测丝裂原活化蛋白激酶(MAPK)3蛋白表达水平。评分标准如下,根据染色程度评分(0~3分别为无着色、淡黄色、浅褐色、深褐色);根据阳性范围进行评分(1~4分别为0%~25%、26%~50%、51%~75%、76%~100%)。最终评分结果=平均阳性强度分数×平均阳性范围分数。
1.7.4 蛋白质免疫印迹(Western blot)法检测取结肠组织,采用RIPA裂解液提取总蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度。电泳、湿法转至PVDF膜、5%脱脂奶粉室温封闭2 h,加入丝裂原活化蛋白激酶3(MAPK3)抗体,4 ℃孵育过夜。加入HRP标记的山羊抗兔免疫球蛋白(IgG)抗体,孵育后加入ECL发光液显影,采用Image J软件分析条带。以Tubulin抗体为内参。
1.8 统计学方法数据以均数±标准差(x±s)表示,使用Graphpad Prism8软件进行统计分析与图片制作,多组间采用单因素方差分析进行比较,组间多重比较采用LSD法。P < 0.05表示差异有统计学意义。
2 结果 2.1 清化祛瘀健脾方活性成分和潜在靶点在TCMSP数据库和TCMID数据库中,以OB≥30%,DL≥0.18为条件进行筛选,获取药物的有效成分,去除重复的活性成分如berberine(小檗碱),quercetin(槲皮素),for-mononetin(芒柄花黄素)等共获得86个活性成分。汇集每个活性成分所涉及的潜在靶点后,再经Uniprot数据库校正去重,共获得224个潜在靶点。
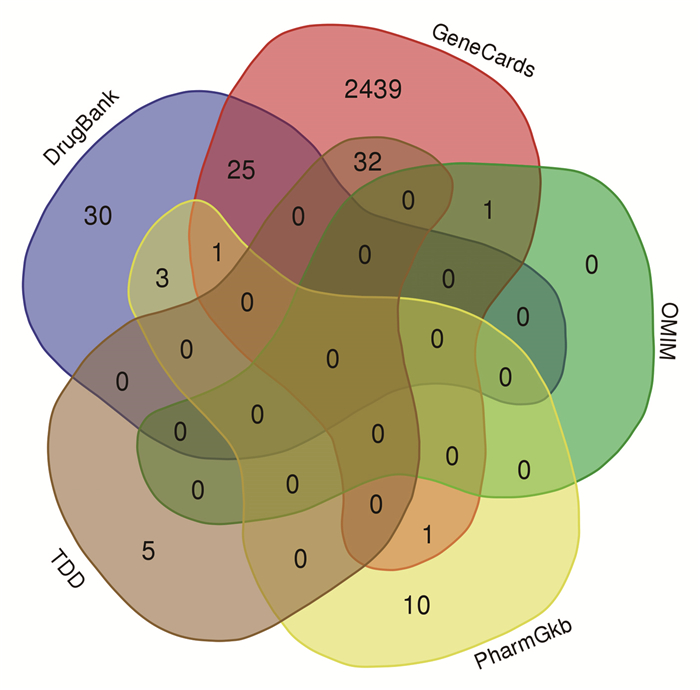
2.2 UC相关基因以“ulcerative colitis”为检索词,在Genecards数据库里以“Relevance score≥1”为筛选条件,共找到2 499个疾病相关基因,在OMIM、PharmGKB、TDD、DrugBank数据库里分别获得1、15、38、59个疾病相关基因,将5个数据库的查询结果合并去重,共得出2 548个UC的靶点基因,韦恩图见图 1。与清化祛瘀健脾方活性成分潜在靶点对比,共有154个共同基因,韦恩图见图 2。
|
| 图 1 疾病靶点韦恩图 Fig. 1 Venn diagram of disease targets |
|
| 图 2 药物与疾病的共同靶点韦恩图 Fig. 2 Venn diagram of the common targets of drugs and diseases |
将生成的成分-靶点关系导入Cytoscape3.9.1软件,绘制清化祛瘀健脾方有效成分-靶点的网络关系图,图中外圈绿色菱形为上述154个共同基因,内部圆形表示清化祛瘀健脾方中能与这些基因反应的有效成分,共244个有效成分。其中治疗靶点最多的有效成分是槲皮素(quercetin),作用靶点为1 232个;其次为山柰酚(kaempferol),作用靶点252个;再次为β-谷甾醇(beta-sitosterol)作用靶点228个,具体见图 3。

|
| 图 3 清化祛瘀健脾方成分-靶点网络图 Fig. 3 Qinghua Quyu Jianpi Decoction component-target network diagram |
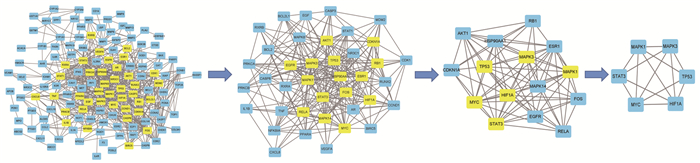
将上述154个共同靶点导入STRING数据库中,选取最低所需的交互分数为0.9的高置信度PPI关系数据,获得PPI网络图,隐藏17个孤立节点,见图 4。图中共有154个节点和659条边,节点的平均Degree为8.56。图中圆形节点表示每个基因蛋白,节点之间的直线代表该直线连接的2个蛋白有相互作用关系(如共表达、蛋白质同源性、基因邻接、基因融合等),线越粗代表作用关系越强。应用R软件得到互作关系排名前40的靶点,并绘制Barplot图。见图 5。
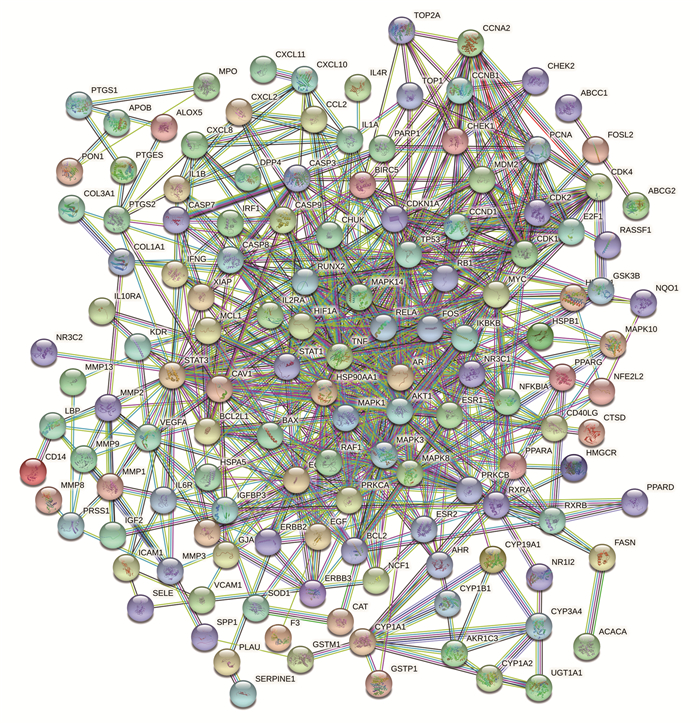
|
| 图 4 PPI网络图 Fig. 4 PPI network diagram |
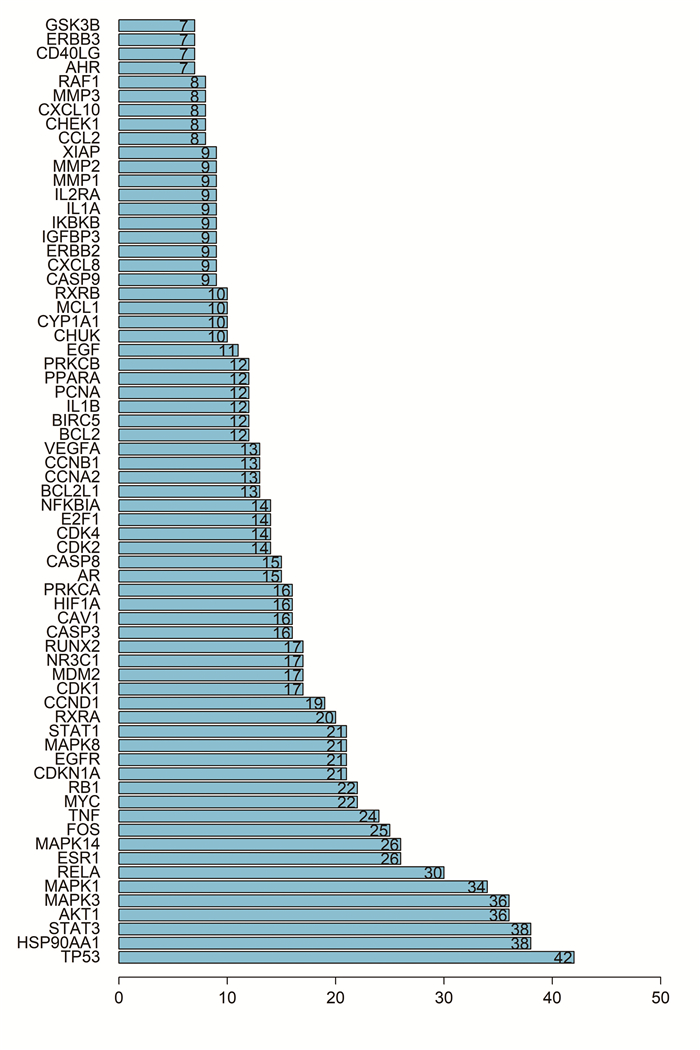
|
| 图 5 Barplot图 Fig. 5 Barplot plot |
使用R软件对清化祛瘀健脾方与UC的共同靶点进行GO分析,筛选出前20个基因的分子功能见图 6,主要为影响DNA转录因子结合及转录因子的活性、细胞因子受体结合、蛋白丝氨酸/苏氨酸激酶活性、泛素样蛋白连接酶结合、蛋白质异二聚化活性、信号受体激活剂的活性等。使用R软件进行KEGG通路分析,筛选出富集基因数较多的前20条通路,见图 7。如AGE-RAGE信号通路、PI3K-Akt信号通路、MAPK信号通路。
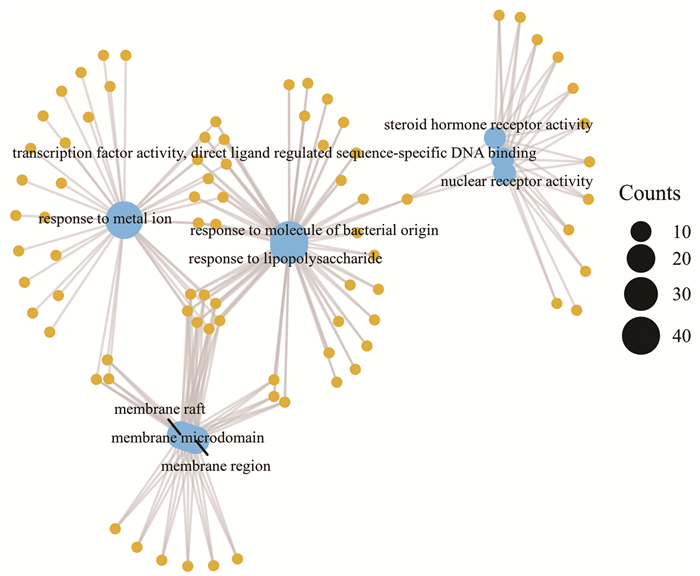
|
| 图 6 作用靶点的GO功能富集分析 Fig. 6 GO functional enrichment analysis of the targets of action |
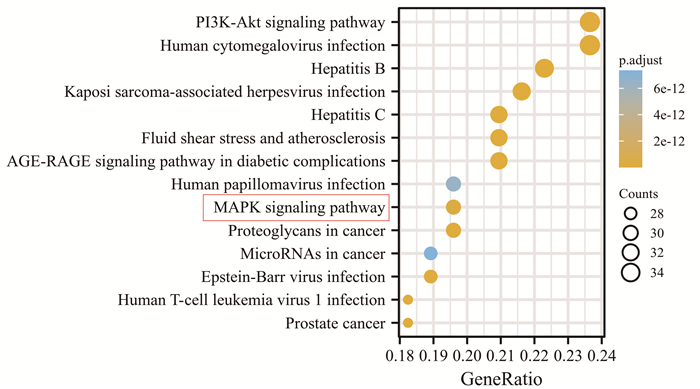
|
| 图 7 KEGG通路富集分析 Fig. 7 KEGG pathway enrichment analysis |
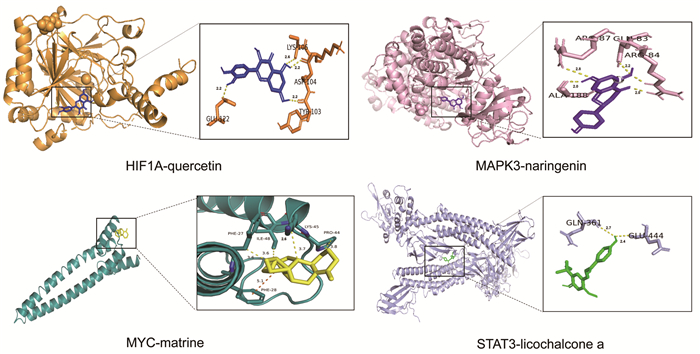
在PPI网络中以Degree排序筛选前6位的核心基因,见图 8。结合文献从核心基因中筛选出与UC密切相关的4个关键基因中文名低氧诱导因子-1(HIF1A)、信号转导及转录激活蛋白3(STAT3)、MYC和MAPK3,与其相互作用的活性成分槲皮素、甘草查尔酮A、苦参碱、柚皮素进行分子对接,具体对接情况见表 1。槲皮素(quercetin)通过氨基酸残基GLU-122、LYS-106、ASP-104、TYR-103和HIF1A靶点蛋白形成4个氢键相互作用,柚皮素(naringenin)通过氨基酸残基ALA-188、ARG-87、ARG-84、GLN-83和MAPK3形成4个氢键相互作用,苦参碱(matrine)通过氨基酸残基PRO-44、LYS-45、ILE-48、PHE-27、PHE-28和MYC靶点蛋白形成5个氢键相互作用,甘草查尔酮A(licochalcone a)通过氨基酸残基GLN-361、GKU-444和STAT3形成2个氢键相互作用,具体对接见图 9。
|
| 图 8 PPI网络核心基因筛选 Fig. 8 Screening of core genes in the PPI network |
|
| 注:quercetin,槲皮素;naringenin:柚皮素,matrine:苦参碱,licochalcone a,甘草查尔酮A。 图 9 分子对接细节图 Fig. 9 Diagram of molecular docking details |
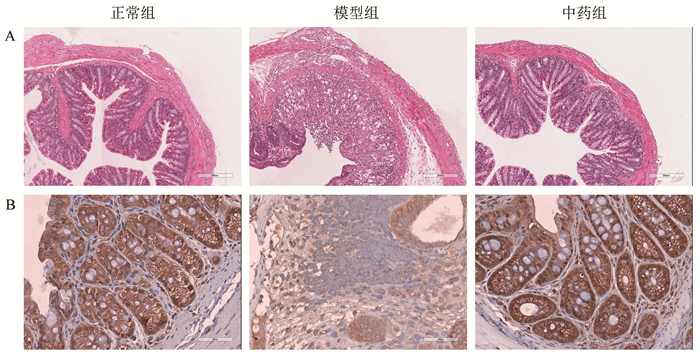
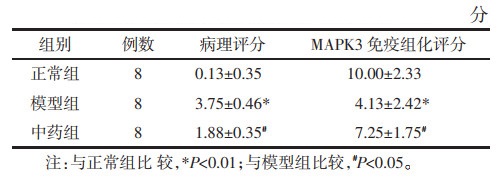
3组小鼠的结肠组织HE染色见图 10A,模型组有大量杯状细胞破坏,局部炎性细胞浸润明显;清化祛瘀健脾方组炎症较模型组缓解,炎性细胞减少,隐窝结构恢复,病理评分较模型组明显降低(P<0.05)。见表 2。
|
| 图 10 结肠组织HE染色(A,×200)和MAPK3免疫组化(B,×400) Fig. 10 HE staining(A, × 200) and MAPK3 immunohistochemical staining(B, × 400) of colon tissue |
|
MAPK3免疫组化情况见图 10B,棕色染色程度为MAPK3的表达水平,模型组MAPK3表达水平较正常对照组低(P<0.01),大多为弱阳性。清化祛瘀健脾方组MAPK3表达水平虽较模型组明显升高(P<0.05),大多为强阳性。见表 2。
2.7.3 Western blot检测根据核心基因和分子对接结果,选择与UC最可能的作用靶点MAPK3进行验证,结果见图 11。与正常组相比,模型组中MAPK3蛋白表达显著下调(P<0.01);与模型组相比,中药组MAPK3蛋白表达显著升高(P<0.01)。结果表明,中药清化祛瘀健脾方可能通过促进MAPK3蛋白的表达,激活MAPK信号通路治疗UC。
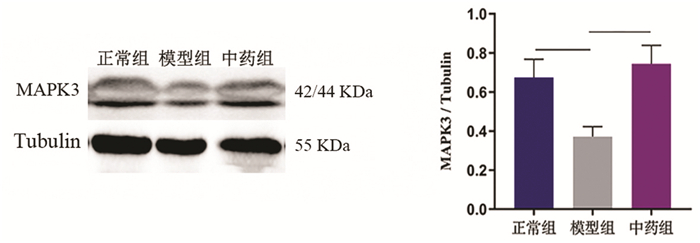
|
| 注:组间比较,**P < 0.01。 图 11 MAPK3蛋白表达情况(x±s) Fig. 11 Expression of MAPK3 protein(x±s) |
溃疡性结肠炎属中医“久痢”的范畴,为本虚标实之证,脾虚为本,湿热瘀毒蕴结于肠道为标。清化祛瘀健脾方选用黄芪等甘温补气之品以培补后天,黄柏等苦寒之药清热化湿止痢,配伍白蔹行清热解毒,消痈散结之功。且本病下痢脓血,故用三七等化瘀止血,活血而不破血,止血而不留瘀,体现“行血则便脓自愈”之意。该方治疗UC的临床疗效已被广泛认可,但具体机制不甚明确,本文应用网络药理学的方法预测治疗UC的关键靶点和信号通路,然后用分子对接的方法对其有效成分和核心靶点结合模拟,最后对重要靶点进行实验验证。
本研究通过网络数据库检索,获得清化祛瘀健脾方86个活性成分和224个潜在靶点,与疾病靶点取交集获得254个共同靶点,借助Cytoscape软件筛选出药物-成分互作关键成分,如槲皮素、山柰酚和β-谷甾醇等。通过构建PPI网络,筛选出互作关系排名前40的靶点,主要包括TP53、90kDa热休克蛋白αA1(HSP90AA1)、STAT3、蛋白激酶Bα(AKT1)、MAPK3等。GO功能富集分析发现主要为影响DNA转录因子及细胞因子受体结合、蛋白丝氨酸/苏氨酸激酶活性、泛素样蛋白连接酶结合、信号受体激活剂的活性等。KEGG分析发现基因主要富集在AGE-RAGE、PI3K-Akt、MAPK通路。为了进一步探讨药物作用的靶点,研究以PPI网络分析中的Degree值排序为基础,结合文献[8-11]从核心基因中筛选出与UC密切相关的4个关键基因HIF1A、STAT3、MYC和MAPK3进行分子对接,探索药物具体的结合靶点。研究发现清化祛瘀健脾方中的活性成分柚皮素通过4个氨基酸残基与MAPK3相互作用,且得到的结合能的绝对值最大,表明它们结合的最稳定。后续对MAPK3蛋白进行动物实验验证,结果显示与模型组小鼠相比,中药组小鼠结肠组织炎症明显减轻,免疫组织化学方法和Western blot方法均表明MAPK3蛋白的表达明显高于模型组。表明MAPK3确为清化祛瘀健脾方治疗UC的靶点之一,这在一定程度上验证了本次网络药理学分析及分子对接结果的可靠性。
MAPK于丝/苏氨酸蛋白激酶超家族,其可以把细胞质的生物信号,传递至细胞核,进而使细胞核的结构和功能发生改变[12]。MAPK信号通路是细胞增殖、分化、凋亡以及正常条件和病理条件下应激反应的关键通路。可分为4个亚族:细胞外调节蛋白激酶(ERK)、p38丝裂原活化蛋白激酶(p38 MAPK)、c-Jun氨基末端激酶(JNK)和细胞外信号调节激酶5(ERK5),分别代表 4条经典的MAPK通路。MAPK家族中研究最为广泛的是ERK1/ERK2激酶(又称:MAPK3)。该通路胞外的生长因子如激活酪氨酸激酶受体(如EGFR),提供接头蛋白的结合位点,招募SOS蛋白到细胞膜上,激活胞内的Ras/Raf激酶。活化的Raf激酶再进一步与下游的MEK1/2结合并使ERK1/2激活。激活的ERK1/2能够继续磷酸化ELK1、ETS、FOS、JUN、MYC和SP1等转录因子,诱导与细胞周期和细胞增殖有关的基因表达;此外,激活的ERK1/2也可以磷酸化多种细胞内的激酶,对细胞的增殖和黏附产生作用[13]。
肠上皮细胞增殖减少和凋亡增加会破坏肠黏膜的完整性和屏障功能,最终导致炎症的发生。阐明如何有效减少结肠上皮细胞凋亡以及如何促进肠道干细胞增殖来修复黏膜组织的分子机制已成为UC治疗的重点[14]。研究结果表明,清化祛瘀健脾方通过上调MAPK3蛋白的表达,激活MAPK通路,促进细胞生长、分化、增殖,促进UC模型小鼠肠道干细胞的增殖、分化,并修复受损肠黏膜。另多项研究报道,MAPK3可以调控肠黏膜上皮细胞增殖及黏膜修复[15-16],与本研究结论一致。
综上,本研究通过网络药理学分析方法,再借以分子对接技术理论模拟配体小分子与靶点蛋白间可能存在的结合关系,并进行了体内实验验证,诠释了中药清化祛瘀健脾方治疗UC的潜在机制。初步证实了清化祛瘀健脾方治疗UC是多成分、多靶点、多通路共同参与,进一步探索更加深入的分子机制有待后续研究验证。
| [1] |
吴开春, 梁洁, 冉志华, 等. 炎症性肠病诊断与治疗的共识意见(2018年·北京)[J]. 中国实用内科杂志, 2018, 38(9): 796-813. |
| [2] |
李玉欣, 赵鲁卿, 张声生, 等. 清热化湿祛瘀方对溃疡性结肠炎小鼠结肠黏膜氧化应激和细胞凋亡的影响[J]. 中华中医药杂志, 2021, 36(3): 1727-1730. |
| [3] |
李玉欣. 清热化湿祛瘀方对UC小鼠结肠黏膜氧化应激和细胞凋亡影响的研究[D]. 北京: 北京中医药大学, 2021.
|
| [4] |
张声生, 杨雪, 赵鲁卿, 等. 清热除湿中药灌肠方治疗溃疡性结肠炎近期疗效的观察[J]. 中国中西医结合消化杂志, 2017, 25(6): 401-405. |
| [5] |
陈海彬, 周红光, 李文婷, 等. 网络药理学: 中药复方作用机制研究新视角[J]. 中华中医药杂志, 2019, 34(7): 2873-2876. |
| [6] |
RITCHIE T J, MACDONALD S J. How drug-like are "ugly" drugs: do drug-likeness metrics predict ADME behaviour in humans?[J]. Drug Discovery Today, 2014, 19(4): 489-495. DOI:10.1016/j.drudis.2014.01.007 |
| [7] |
NEURATH M F, FUSS I, KELSALL B L, et al. Antibodies to interleukin 12 abrogate established experimental colitis in mice[J]. The Journal of Experimental Medicine, 1995, 182(5): 1281-1290. DOI:10.1084/jem.182.5.1281 |
| [8] |
WU M M, WANG Q M, HUANG B Y, et al. Dioscin ameliorates murine ulcerative colitis by regulating macrophage polarization[J]. Pharmacological Research, 2021, 172(10): 105796. |
| [9] |
FOERSTER E G, MUKHERJEE T, CABRAL-FERNANDES L, et al. How autophagy controls the intestinal epithelial barrier[J]. Autophagy, 2022, 18(1): 86-103. DOI:10.1080/15548627.2021.1909406 |
| [10] |
WEI M Q, LI H, LI Q F, et al. Based on network pharmacology to explore the molecular targets and mechanisms of Gegen Qinlian Decoction for the treatment of ulcerative colitis[J]. BioMed Research International, 2020, 2020(11): 5217405. |
| [11] |
WANG B, LIU Y, SUN J H, et al. Exploring the potential mechanism of Xiaokui Jiedu Decoction for ulcerative colitis based on network pharmacology and molecular docking[J]. Journal of Healthcare Engineering, 2021, 2021(12): 1536337. |
| [12] |
CHEN Z X, LIU Q L, ZHU Z W, et al. Toll-like receptor 4 contributes to uterine activation by upregulating pro-inflammatory cytokine and CAP expression via the NF-κB/P38MAPK signaling pathway during pregnancy[J]. Journal of Cellular Physiology, 2020, 235(1): 513-525. DOI:10.1002/jcp.28991 |
| [13] |
LIU F, FENG X X, ZHU S L, et al. Sonic hedgehog signaling pathway mediates proliferation and migration of fibroblast-like synoviocytes in rheumatoid arthritis via MAPK/ERK signaling pathway[J]. Frontiers in Immunology, 2018, 9(12): 2847. |
| [14] |
SABATINO A D, CICCOCIOPPO R, LUINETTI O, et al. Increased enterocyte apoptosis in inflamed areas of Crohn's disease[J]. Diseases of the Colon and Rectum, 2003, 46(11): 1498-1507. DOI:10.1007/s10350-004-6802-z |
| [15] |
SEIDELIN J B, COSKUN M, VAINER B, et al. ERK controls epithelial cell death receptor signalling and cellular FLICE-like inhibitory protein(c-FLIP) in ulcerative colitis[J]. Journal of Molecular Medicine, 2013, 91(7): 839-849. DOI:10.1007/s00109-013-1003-7 |
| [16] |
OLIVER B L, SHA'AFI R I, HAJJAR J J. Transforming growth factor-alpha and epidermal growth factor activate mitogen-activated protein kinase and its substrates in intestinal epithelial cells[J]. Proceedings of the Society for Experimental Biology and Medicine Society, 1995, 210(2): 162-170. DOI:10.3181/00379727-210-43936 |
2. Beijing University of Chinese Medicine, Beijing 100029, China
 2024, Vol. 41
2024, Vol. 41