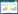文章信息
- 付学敬, 朱琳, 朱明喜, 等.
- FU Xuejing, ZHU Lin, ZHU Mingxi, et al.
- 参芪补肾活血汤改善兔股骨骨折延迟愈合的机制初探
- Study on the mechanism of Shenqi Bushen Huoxue Decoction in improving delayed femoral fracture healing in rabbits
- 天津中医药, 2024, 41(3): 360-365
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(3): 360-365
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.03.16
-
文章历史
- 收稿日期: 2023-09-20
2. 河南中医药大学第三附属医院骨病科, 郑州 450003
成人骨愈合一般指骨组织和功能完全恢复,没有并发症出现,然而,开放性骨折、合并疾病、创伤后大骨缺损、假体松动或肿瘤切除扩大,都可能妨碍组织的完全再生,最终导致骨延迟愈合、不愈合或畸形愈合[1]。此类患者常伴有疼痛、周围关节僵硬、运动功能丧失,严重可能出现残疾[2]。骨延迟愈合形成机制是多因素的,这导致治疗手段困难、复杂且昂贵。目前治疗骨延迟愈合的手段包括手术自体/异体骨移植,骨形态发生蛋白(BMP)负载骨替代物填充和物理复位治疗,所有这些干预措施都存在局限性,存在材料有限、成本高、治疗效果问题和不良反应问题[3-4],因此迫切需要找到更合理有效的治疗方法。
中医将骨延迟愈合归为“骨萎症”“骨痿”“骨痹”等范畴,具有丰富的治疗经验,认为肝肾在骨愈合中占据重要地位,肝肾亏虚会造成骨愈合缓慢甚至不愈合,从而,经络受阻,产生骨痿[5]。参芪活血汤具有清热定惊、平喘利尿、活血止痛、散瘀通经的功效[6],加用补肾中药有利于骨组织愈合。因为BMP与转化生长因子-β1(TGF-β1)在骨损伤修复中发挥重要作用[7-8]。有研究发现,参芪活血汤方中的黄芪等药物对BMP蛋白与TGF-β1均有明显的调节作用,对新生血管也有促进作用,但参芪补肾活血汤是否能通过调节骨组织中BMP蛋白与TGF-β1含量促进骨愈合的效果尚未明确。因此本研究旨在初步探讨参芪补肾活血汤对兔股骨骨折延迟愈合的调节效果,为临床用药提供实验基础。
1 材料与方法 1.1 实验动物新西兰大白兔,40只,清洁级,雄性,体质量2~3 kg,3~4月龄,购自成都达硕实验动物有限公司,生产许可证号:SCXK(川)2020-030。由河南中医药大学实验动物伦理审查委员会审批通过(20230814001)。
1.2 主要试剂参芪补肾活血汤:黄芪20 g,太子参20 g,熟地黄20 g,茯苓20 g,山药20 g,丹参20 g,淫羊藿20 g,煅龙骨30 g,川牛膝15 g,龟板15 g,知母10 g,菟丝子10 g,五味子10 g,川芎10 g,鹿角片5 g,药材由河南中医药大学第三附属医院药剂科提供,药材加水煎制2遍,合并滤液后浓缩制成浓度为含生药1 g/mL,冷藏备用。
BMP-2、BMP-7、TGF-β1、血管内皮生长因子(VEGF)和β-actin抗体均购自艾博抗(上海)贸易有限公司;总核糖核酸(RNA)提取试剂盒、RNA逆转录试剂盒购自北京索莱宝科技有限公司;所有引物均由生工生物工程(上海)股份有限公司提供;DAB试剂盒购自北京中杉金桥生物有限公司。
1.3 主要仪器TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司);BA210 Digital数码三目摄像显微镜(厦门麦克奥迪实业集团有限公司);Halo 101-WL-HALO-1数据图像分析系统(美国Indica labs公司)。
1.4 模型构建[9]与动物分组给药将30只新西兰大白兔以3%戊巴比妥钠(1 mL/kg)从耳缘静脉注射麻醉,取俯卧位。在大腿中段外侧处作一个长约4 cm的纵向切口,钝性分离皮肤,尽可能暴露兔股骨干,显露股骨,然后分别于股骨近端及远端钉入两枚1.5 mm外固定架螺钉,安装外固定架,保证4枚螺钉在同一水平面上,同时外固定架牢固可靠。用线锯离断股骨,模型组与参芪补肾活血汤各组均截取10 mm骨皮质,去除内外骨膜及骨髓;对照组仅离断股骨,保留内外骨膜及骨髓,不做其他处理。为避免截骨过程中产生的热量灼伤软组织,截骨过程中需反复大量生理盐水冲洗截骨部位。截骨完成后,模型组与参芪补肾活血汤各组保持骨折断端1 mm的间隙,空白组保持骨折断端接触,不做其他处理。腿部伤口彻底止血后使用0.9%氯化钠注射液及5%碘伏原液反复冲洗,最后进行闭合、缝合与包扎。术后将大白兔于清洁级环境下分笼饲养,自由活动。术后1周内注射青霉素40×104 U预防感染,1次/日,并用5%碘伏原液进行手术切口消毒并常规换药预防感染,2次/日。造模后8周将骨延迟愈合动物进行分组,随机分为模型组、参芪补肾活血汤高剂量组(10 mL/kg)与参芪补肾活血汤低剂量组(5 mL/kg),剂量参考临床上成人用量进行计算确定,另取健康动物作为空白组,每组10只,参芪补肾活血汤各组灌胃水煎液,空白组与模型组灌胃等量生理盐水,每天1次,于给药4周后处死动物进行后续指标检测。
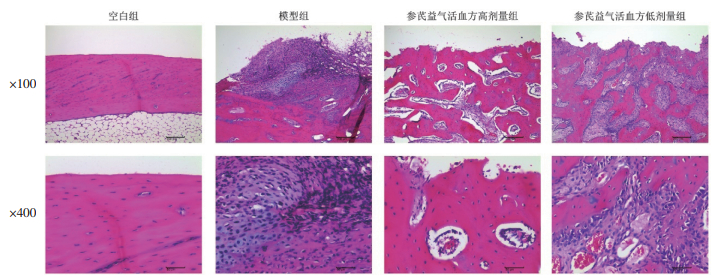
1.5 骨组织病理学检测收集各组动物愈伤处股骨组织(空白组取相同位置骨组织),固定24 h后置于15%的乙二胺四乙酸(EDTA)中进行脱钙,然后使用95%乙醇与二甲苯脱水,最后使用石蜡进行包埋,切片。使用苏木精-伊红(HE)染液对切片染色,在显微镜下拍照观察,并参照文献[10]根据骨愈合组织学分级标准进行评分。
1.6 逆转录实时定量聚合酶链反应(RT-qPCR)收集各组动物血清,使用总RNA提取与逆转录试剂盒进行RNA提取与逆转录(操作步骤见试剂盒说明书),以β-actin为内参基因,采用2-ΔΔCT法计算BMP-2、BMP-7、TGF-β1和VEGF相对表达水平。引物序列BMP-2:上游5’-GAGAAAAGCGTCAAGCGAAAC-3’:下游5’-AGTAAAAGGCGTGATACCCCG-3’;BMP-7:上游5’-TCGGCACCCATGTTCATGC-3’,下游5’-GAGGAAATGGCTATCTTGCAGG-3’;TGF-β1:上游5’-CTGAGCCACGGAGAGGAAATAG-3’,下游5’-GAGCAGGAAGGGTCGGTTC;VEGF:上游5’-GCAGACCAAAGAAAGACAG-3’,下游5’-TTGCAGGAACATTTACACG-3’;β-actin:上游5’-TGGCTCTAACAGTCCGCCTAG-3’,下游5’-AGTGCGACGTGGACATCCG-3’。
1.7 免疫组织化学将各组动物的股骨组织切片进行抗原修复、阻断内源性过氧化物酶等一系列操作后,进行DAB显色,最后使用中性树胶封片,在显微摄像系统对切片进行图像采集,每张切片先于100倍下观察全部组织,再分别采集200倍及400倍显微图像,共采集4张。使用Halo数据分析系统计算每张图像阳性面积占比。观察股骨组织中BMP-2、BMP-7、TGF-β1和VEGF蛋白的表达情况。
1.8 统计分析使用SPSS 22.0进行数据分析。采用Shapiro-Wilk法检验所有数据均符合正态性。计量资料用均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
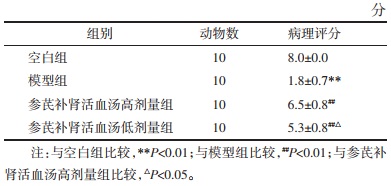
2 结果 2.1 各组动物新生股骨组织病理学观察结果各组新生骨组织病理结果见图 1。空白组:骨组织由致密的皮质骨和其包围的骨髓腔组成,结构较完整;骨表面未见缺损,较平滑;骨板较完整,骨板内横向穿越的小管,称为穿通管,见小血管和神经通过,未见明显骨小梁。模型组:骨组织之间可见明显骨损伤区域,损伤区纤维组织增生少,纤维骨痂未见形成;损伤区深部骨小梁出现少量,骨髓腔内纤维组织较少,少见软骨细胞形成。参芪补肾活血汤高剂量组:骨组织结构较完整;骨表面局部缺损,未见明显纤维组织增生或炎性细胞浸润;损伤区周围可见骨小梁显著增多,部分骨髓腔见少量纤维组织;其他未见明显病理改变。参芪补肾活血汤低剂量组:骨组织之间可见骨损伤区域,损伤区见较多纤维组织增生;损伤区浅层较多成骨骨痂形成,骨小梁轻度增多,部分骨髓腔见少量纤维组织以及较多浆液性物质渗出;其他未见明显病理改变。与空白组比较,模型组病理评分降低(P<0.01);与模型组比较,参芪补肾活血汤高、低剂量组病理评分升高(P<0.01);与参芪补肾活血汤高剂量组相比,参芪补肾活血汤低剂量组病理评分降低(P<0.05),结果见表 1。
|
| 图 1 各组动物股骨组织病理学观察结果(HE染色) Fig. 1 Pathological observation of femur tissue in each group(HE staining) |
|
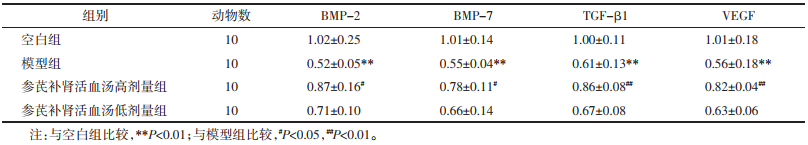
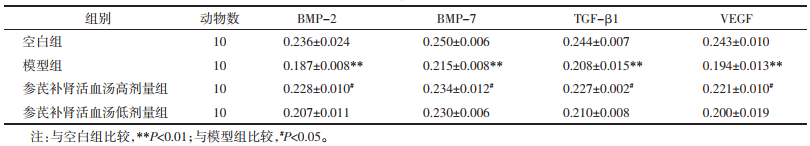
与空白组比较,模型组BMP-2、BMP-7、TGF-β1和VEGF表达水平下降(P<0.01);与模型组比较,参芪补肾活血汤高剂量组BMP-2、BMP-7、TGF-β1和VEGF表达水平升高(P<0.05,P<0.01),低剂量组各项指标有升高趋势,但差异无统计学意义(P>0.05);与参芪补肾活血汤高剂量组比较,参芪补肾活血汤低剂量组各项指标有降低趋势,但差异无统计学意义(P>0.05),结果见表 2。
|
与空白组比较,模型组骨组织中BMP-2、BMP-7、TGF-β1和VEGF蛋白表达水平下降(P<0.01);与模型组比较,参芪补肾活血汤高剂量组BMP-2、BMP-7、TGF-β1和VEGF蛋白表达水平升高(P<0.05),低剂量组各项指标有升高趋势,但差异没有统计学意义(P>0.05);与参芪补肾活血汤高剂量组比较,参芪补肾活血汤低剂量组各项指标有降低趋势,但差异没有统计学意义(P>0.05)结果见表 3,图 2。
|

|
| 图 2 各组动物股骨组织中BMP-2、BMP-7、TGF-β1和VEGF蛋白表达情况(DAB,×400) Fig. 2 Protein expression of BMP-2, BMP-7, TGF-β1 and VEGF in femoral tissue of animals in each group(DAB, ×400) |
骨是一种动态组织,其发育和维持受到负重活动所产生的生物力学刺激的严重影响。骨折后,骨组织具有再生和恢复关键生物力学功能的内在能力。大约5%的骨缺损患者在最初治疗后未能有效愈合,且仍保持机械不稳定[11]。骨延迟愈合的病理生理学仍然知之甚少,虽然如不适当的机械固定等情况可以通过主动复位进行治疗,但在其他大多数情况下难以开展针对治疗,包括感染、血管化不良和其他疾病诱导等[12]。本实验采用在啮齿类动物中创建一个临界大小的节段骨缺损来完成骨延迟愈合模型,在造模8周发现兔股骨组织尚未完全愈合,符合骨延迟愈合的特征。由于参芪补肾活血汤具有益气补血、补肝强肾、强壮筋骨的作用,灌胃给药4周后发现参芪补肾活血汤能有效促进兔股骨组织愈合,组织病理学检测显示参芪补肾活血汤刺激了骨延迟愈合区域的血管生成,诱导纤维组织生成并减少炎症反应,但其可能涉及的机制还需进行下一步研究。
TGF-β1是TGF-β超家族成员之一,通过增强细胞外基质重构、增加软骨和愈伤组织的形成来促进骨组织愈合[13]。经研究发现,在人骨折愈合过程中体内TGF-β1水平会升高,因此TGF-β1水平降低可以用于预测与评估骨折延迟愈合和不愈合[14]。BMP是TGF-β超家族成员和强大的骨诱导分子,另一项研究表明,骨延迟愈合患者中出现BMP-2表达缺失的情况[15],因此体内BMP水平可以反映骨组织愈合周期是否正常进行。重组人BMP的成骨诱导作用已在动物模型和临床试验中被证实可以用于骨折修复、危急骨缺损的愈合和脊柱融合[16]。其中,BMP-2和BMP-7已被临床应用于骨延迟愈合和骨折[17],但直接移植BMP-2在临床应用中面临的最大挑战是不良反应,包括过度炎症、异位骨化和不规则骨形成,这会导致疼痛和患者预后不理想[18]。近年来有研究表明,骨延迟愈合应用BMP-7治疗效果更好[19]。本研究检测了骨延迟愈合动物中的BMP-2、BMP-7、TGF-β1基因与蛋白发现这些指标的表达水平下降,与上述研究的结果基本一致,使用参芪补肾活血汤后,BMP-2、BMP-7、TGF-β1的基因与蛋白表达均出现明显升高,而没有出现异常上升的情况,这说明与直接移植重组BMP-2和BMP-7不同,参芪补肾活血汤不会造成过度成骨诱导,使异位与不规则骨化几率下降。VEGF是血管生成最重要的介质,机体在骨折后2周,血清中VEGF水平会显著增加,有研究发现,骨折处组织血管生成缓慢甚至不生成是导致延迟愈合或者失败的重要原因[20]。近年来,多项研究发现VEGF和BMP-2在骨愈合方面具有协同作用。BMP家族蛋白能增加成骨细胞中VEGF的表达,在体外研究中证实了通过BMP信号通路刺激血管生成[21]。因此,本研究在发现参芪补肾活血汤对BMP与TGF-β1有调节作用后,同时对血清中VEGF与组织中VEGF蛋白表达水平进行检测,发现骨延迟愈合动物中VEGF的基因与蛋白均呈现下降趋势,而灌胃参芪补肾活血汤后能改善这一状况,说明参芪补肾活血汤促进骨组织愈合机制可能是通过调节BMP与TGF-β1水平从而诱导骨缺损组织血管生成。
参芪补肾活血汤方中的黄芪、太子参作为君药,具有补中益气的功效,淫羊藿、牛膝、菟丝子等具有强壮筋骨之效,熟地黄补血、丹参健脾、五味子养阴固精,多药合用,对骨延迟愈合具有积极的作用效果。现代药理学研究表明,丹参多酚对血管内皮细胞活动有刺激作用,可用于促进骨折愈合[22];淫羊藿苷促进大鼠骨折创伤后骨重建[23],对大鼠骨折处血管形成也有促进作用[24]。本研究表明参芪补肾活血汤不仅能增加BMP-2与BMP-7等骨诱导分子含量,诱导TGF-β1生成促进骨组织修复,还能促进骨缺损处血管形成,为骨组织愈合提供基础。在本研究中,中药方剂高剂量与低剂量仅在病理层面上出现了疗效不同,在BMP与TGF-β1相关指标中并没有出现统计学差异,有可能是因为中药复方有多种药用成分,在未确定是何种成分在骨延迟愈合中发挥主导作用的情况下,复方剂量的增减所呈现的疗效差异是有局限性的,而且复方疗效也与个体差异相关,只要复方剂量处于安全范围内,结果可信度都是可以保证的,因此,进一步明确参芪补肾活血汤何种成分在骨延迟愈合占主导地位就是今后研究的重点,同时促进股骨延迟愈合的相关机制仍需进一步探讨。
| [1] |
DEININGER C, WAGNER A, HEIMEL P, et al. Enhanced BMP-2-mediated bone repair using an anisotropic silk fibroin scaffold coated with bone-like apatite[J]. International Journal of Molecular Sciences, 2021, 23(1): 283. DOI:10.3390/ijms23010283 |
| [2] |
CHEN H, JI X R, ZHANG Q, et al. Effects of calcium sulfate combined with platelet-rich plasma on restoration of long bone defect in rabbits[J]. Chinese Medical Journal, 2016, 129(5): 557-561. DOI:10.4103/0366-6999.176981 |
| [3] |
VON RÜDEN C, MORGENSTERN M, HIERHOLZER C, et al. The missing effect of human recombinant bone morphogenetic proteins BMP-2 and BMP-7 in surgical treatment of aseptic forearm nonunion[J]. Injury, 2016, 47(4): 919-924. DOI:10.1016/j.injury.2015.11.038 |
| [4] |
BIGLARI B, YILDIRIM T M, SWING T, et al. Failed treatment of long bone nonunions with low intensity pulsed ultrasound[J]. Archives of Orthopaedic and Trauma Surgery, 2016, 136(8): 1121-1134. DOI:10.1007/s00402-016-2501-1 |
| [5] |
于艳丽. 参芪补肾活血方治疗糖尿病性骨质疏松的临床疗效[J]. 中西医结合心血管病电子杂志, 2020, 8(33): 3, 5. |
| [6] |
余智智, 李玮, 姚旭洁. 参芪活血汤联合温针灸治疗中风后遗症临床研究[J]. 新中医, 2020, 52(18): 129-131. |
| [7] |
BRAZIL D P, CHURCH R H, SURAE S, et al. BMP signalling: agony and antagony in the family[J]. Trends in Cell Biology, 2015, 25(5): 249-264. DOI:10.1016/j.tcb.2014.12.004 |
| [8] |
BALOOCH G, BALOOCH M, NALLA R K, et al. TGF-β regulates the mechanical properties and composition of bone matrix[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(52): 18813-18818. |
| [9] |
张志天, 王淑民, 赵景新, 等. 股骨延迟愈合外固定模型兔的建立与评估[J]. 中国组织工程研究, 2017, 21(20): 3190-3195. |
| [10] |
NILSSON O S, URIST M R, DAWSON E G, et al. Bone repair induced by bone morphogenetic protein in ulnar defects in dogs[J]. The Journal of Bone and Joint Surgery British Volume, 1986, 68(4): 635-642. DOI:10.2106/00004623-198668040-00031 |
| [11] |
SEBBAG E, FELTEN R, SAGEZ F, et al. The world-wide burden of musculoskeletal diseases: a systematic analysis of the World Health Organization Burden of Diseases Database[J]. Annals of the Rheumatic Diseases, 2019, 78(6): 844-848. DOI:10.1136/annrheumdis-2019-215142 |
| [12] |
CHENG A, KRISHNAN L, PRADHAN P, et al. Impaired bone healing following treatment of established nonunion correlates with serum cytokine expression[J]. Journal of Orthopaedic Research, 2019, 37(2): 299-307. DOI:10.1002/jor.24186 |
| [13] |
LYONS F G, GLEESON J P, PARTAP S, et al. Novel microhydroxyapatite particles in a collagen scaffold: a bioactive bone void filler[J]. Clinical Orthopaedics and Related Research, 2014, 472(4): 1318-1328. DOI:10.1007/s11999-013-3438-0 |
| [14] |
SARAHRUDI K, THOMAS A, MOUSAVI M, et al. Elevated transforming growth factor-beta 1(TGF-β1) levels in human fracture healing[J]. Injury, 2011, 42(8): 833-837. DOI:10.1016/j.injury.2011.03.055 |
| [15] |
HARA Y, GHAZIZADEH M, SHIMIZU H, et al. Delayed expression of circulating TGF-β1 and BMP-2 levels in human nonunion long bone fracture healing[J]. Journal of Nippon Medical School, 2017, 84(1): 12-18. DOI:10.1272/jnms.84.12 |
| [16] |
KANEZAKI S, MIYAZAKI M, ISHIHARA T, et al. Enhancement of the effects of intermittent parathyroid hormone(1-34) by bone morphogenetic protein in a rat femoral open fracture model[J]. Journal of Orthopaedic Surgery and Research, 2019, 14(1): 403. DOI:10.1186/s13018-019-1470-9 |
| [17] |
WANG C Z, WANG Y H, LIN C W, et al. Combination of a bioceramic scaffold and simvastatin nanoparticles as a synthetic alternative to autologous bone grafting[J]. International Journal of Molecular Sciences, 2018, 19(12): 4099. DOI:10.3390/ijms19124099 |
| [18] |
VANTUCCI C E, KRISHAN L, CHENG A, et al. BMP-2 delivery strategy modulates local bone regeneration and systemic immune responses to complex extremity trauma[J]. Biomaterials Science, 2021, 9(5): 1668-1682. DOI:10.1039/D0BM01728K |
| [19] |
MOGHADDAM A, ZIETZSCHMANN S, BRUCKNER T, et al. Treatment of atrophic tibia non-unions according to "diamond concept": results of one- and two-step treatment[J]. Injury, 2015, 46: S39-S50. |
| [20] |
STREET J, BAO M, DEGUZMAN L, et al. Vascular endothelial growth factor stimulates bone repair by promoting angiogenesis and bone turnover[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(15): 9656-9661. |
| [21] |
HAUBRUCK P, KAMMERER A, KORFF S, et al. The treatment of nonunions with application of BMP-7 increases the expression pattern for angiogenic and inflammable cytokines: A matched pair analysis[J]. Journal of Inflammation Research, 2016, 9: 155-165. DOI:10.2147/JIR.S110621 |
| [22] |
董旺超, 杭柏亚, 蒋为芳. 丹参多酚酸盐联合帕瑞昔布钠治疗对急性闭合创伤骨折患者疼痛及炎症因子的影响[J]. 湖北中医药大学学报, 2023, 25(1): 68-70. |
| [23] |
郑国洪, 孙斌, 王洁琼, 等. 淫羊藿苷通过上调Runx2促进踝关节骨折大鼠骨重建及抑制破骨细胞形成[J]. 广州中医药大学学报, 2023, 40(2): 444-449. |
| [24] |
武通, 陈东宁, 许占江. 基于VEGF/VEGFR-2信号通路研究淫羊藿苷促进大鼠胫骨干骨折愈合的作用机制[J]. 浙江中医药大学学报, 2021, 45(3): 282-288, 293. |
2. Department of Orthopedics, Third Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450003, China
 2024, Vol. 41
2024, Vol. 41