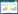文章信息
- 余玲, 杨洋, 段程慧, 等.
- YU Ling, YANG Yang, DUAN Chenghui, et al.
- 麝香保心丸调节PINK1/Parkin信号通路对糖尿病视网膜病变大鼠的影响
- Effect of Shexiang Baoxin Pill on regulating PINK1/Parkin signaling pathway in diabetic retinopathy rats
- 天津中医药, 2024, 41(3): 366-371
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(3): 366-371
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.03.17
-
文章历史
- 收稿日期: 2023-10-09
目前糖尿病已经成为全球公共卫生问题,未来中国糖尿病患者数量将位居世界第一[1]。而糖尿病视网膜病变(DR)是由糖尿病引起的主要微血管并发症之一,也是世界上最常见的导致视力丧失的疾病之一,严重影响患者的正常生活。目前对于DR的治疗方式有基本治疗、激光治疗、切除术治疗、药物治疗等多种手段,其中基本治疗、激光治疗、手术治疗都有一定的治疗效果,但仍存在一定的缺陷及风险,药物治疗相对科学、保守,但是中、西药治疗各有优劣,两者相结合成为治疗DR的重要方向。研究发现线粒体自噬与DR相关,在高糖环境下,视网膜细胞线粒体受损,激活线粒体自噬,导致线粒体能量损失加重,从而引起糖尿病视网膜病变[2]。而PTEN诱导激酶蛋白1(PINK1)/细胞质E3-泛素连接酶(Parkin)信号通路是线粒体自噬的关键通路,参与线粒体自噬过程。研究显示,胰高血糖素样肽-1(GLP-1)类似物可以通过抑制PINK1、Parkin的表达减少线粒体自噬,从而对视网膜神经细胞起到神经保护作用[3]。所以抑制线粒体自噬可能是治疗DR的有效靶点。麝香保心丸是临床治疗常用的中成药,具有芳香温通、益气强心之效,另外发现麝香保心丸可以改善糖尿病微循环障碍,降低血液黏度,改善红细胞聚集度,减轻因糖尿病引起的毛细血管损坏[4]。有研究显示,糖尿病肾病(DN)和DR均是糖尿病并发症,而尿微量蛋白/肌酐比值与糖尿病并发症密切相关,麝香保心丸可以降低尿微量蛋白/肌酐比值,预防DR、糖尿病[5]。目前还没有关于麝香保心丸针对DR的研究,本研究主要探索麝香保心丸对DR大鼠线粒体自噬及PINK1/Parkin信号通路的影响,以期为DR的治疗提供参考。
1 材料与方法 1.1 主要材料体质量(200±20)g无特定病原体(SPF)级健康雄性大鼠,90只,购于湖北贝恩特生物科技有限公司[SCXK(鄂)2021-0027]。麝香保心丸(SBP,Z31020068)购于上海和黄药业有限公司。雷帕霉素(S1039)购于美国Selleck公司。苏木精-伊红(HE)染色试剂盒(G11120)购于北京Solarbio公司;链脲佐菌素(STZ)购于美国Sigma公司;血管内皮生长因子(VEGF,PV960)、高迁移率族蛋白1(HMGB1,PH406)酶联免疫吸附实验(ELISA)试剂盒购于上海碧云天公司;选择性自噬接头蛋白sequestosome-1(SQSTM1/P62,sc-48402)、微管相关蛋白轻链3Ⅱ(LC3-Ⅱ,sc-398822)、PINK1(sc-517353)、Parkin(sc-32282)抗体购于美国Santa Cruz Biotechnology公司。
1.2 方法 1.2.1 DR模型制备适应性饲养大鼠1周,除正常组大鼠外所有大鼠给予高脂饲料喂养14 d,然后采用一次性尾静脉注射STZ 50 mg/kg建立糖尿病模型[6]。于STZ注射72 h后测定大鼠空腹血糖(FPG),选取FPG≥16.7 mmoL/L的大鼠作为糖尿病大鼠。继续饲养1周后,随机选择5只大鼠进行HE染色观察视网膜病理变化,视网膜发生病变则表明建模成功。正常组大鼠正常饲料喂养,尾静脉注射等量的生理盐水。
1.2.2 分组处理将大鼠随机分为正常组(Control组)、模型组(DR组)、麝香保心丸低剂量组(SBP-L组)、麝香保心丸高剂量组(SBP-H组)、麝香保心丸高剂量+雷帕霉素组(SBP-H+RAP组)[7-8],每组18只。SBP-L组:造模成功后麝香保心丸25 mg/kg灌胃;SBP-H组:造模成功后麝香保心丸50 mg/kg灌胃;SBP-H+RAP组:造模成功后麝香保心丸50 mg/kg灌胃及雷帕霉素1 mg/kg灌胃;正常组和模型组灌胃与SBP-L组、SBP-H组等量的生理盐水,正常组、模型组、SBP-L组、SBP-H组灌胃与SBP-H+RAP组灌胃雷帕霉素等量的生理盐水。麝香保心丸用生理盐水配置成混悬液进行灌胃,每天给药1次,连续12周。
1.2.3 血糖血脂水平检测末次给药结束后,用采血针对大鼠腹主动脉取血,血糖仪检测FPG水平,全自动生化分析仪检测总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)水平。
1.2.4 HE染色取血结束后,各组分别随机选择6只大鼠处死并摘取右侧眼球,去除角膜、晶状体、玻璃体,取出视网膜组织,生理盐水漂洗、滤纸吸干,放入4%多聚甲醛固定,脱水、二甲苯透明,石蜡包埋切片,以备用。再将石蜡切片脱蜡复水,HE染色,脱水、透明、封片,光学显微镜观察各组大鼠视网膜病变情况。
1.2.5 ELISA取腹主动脉血,离心半径15 cm,3 000 r/min,离心10 min后取上清液,按照ELISA试剂盒说明书检测血清中VEGF水平。
1.2.6 线粒体形态观察每组随机选取6只大鼠视网膜组织,加入戊二醛溶液固定细胞,脱水、包埋,醋酸铀-柠檬酸铅双染色,脱水、透明、封片,透射电镜观察线粒体形态。
1.2.7 免疫组织化学取1.2.4制作的石蜡切片,脱蜡复水,加SQSTM1/P62、LC3-Ⅱ一抗,4 ℃孵育过夜,加二抗在室温下孵育1 h。DAB显色,苏木精复染,冲洗后脱水,二甲苯透明、封片,显微镜观察拍照,并用Image J软件分析。
1.2.8 蛋白免疫印迹选择各组剩余的6只大鼠,断颈处死,迅速取出大鼠的右侧眼球,去除角膜、晶状体、玻璃体,取出视网膜组织,生理盐水漂洗干净后置于离心管中,加入RIPA裂解液裂解,电泳,并转聚偏二氟乙烯(PVDF)膜,含有5%脱脂奶粉封闭液封闭。加入一抗,4 ℃下孵育过夜,洗膜,加二抗室温孵育2 h,洗膜,加ECL孵育1 min,采集图像并分析蛋白条带灰度值。
1.3 统计学方法采用SPSS 25.0软件进行分析,实验数据以均数±标准差(x±s)表示,各组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果 2.1 麝香保心丸对大鼠血糖血脂水平影响与Control组比较,DR组FPG、TC、TG、LDL-C水平显著升高(P<0.05);与DR组比较,SBP-L组、SBP-H组FPG、TC、TG、LDL-C水平显著降低(P<0.05);与SBP-L组比较,SBP-H组FPG、TC、TG、LDL-C水平显著降低(P < 0.05);与SBP-H组比较,SBP-H+RAP组FPG、TC、TG、LDL-C水平显著升高(P<0.05)。见表 1。
|
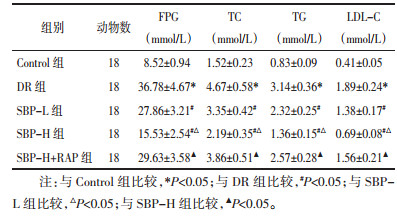
Control组视网膜结构层次清晰,细胞排列整齐有序;与Control组比较,DR组视网膜结构破坏严重,细胞排列紊乱,水肿明显,细胞间隙变宽;与DR组比较,SBP-L组、SBP-H组视网膜细胞结构破坏减少,细胞排列逐渐整齐,细胞水肿减轻,细胞形态趋于正常;与SBP-H组比较,SBP-H+RAP组视网膜细胞结构破坏加重,细胞排列紊乱,水肿明显。见图 1。
|
| 图 1 HE染色观察各组大鼠视网膜病理形态 Fig. 1 HE staining was used to observe the pathological morphology of retina of rats in each group |
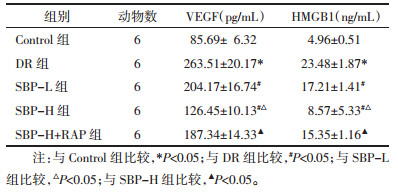
与Control组比较,DR组VEGF、HMGB1水平显著升高(P<0.05);与DR组比较,SBP-L组、SBP-H组VEGF、HMGB1水平显著降低(P<0.05);与SBP-L组比较,SBP-H组VEGF、HMGB1水平显著降低(P < 0.05);与SBP-H组比较,SBP-H+RAP组VEGF、HMGB1水平显著升高(P<0.05)。见表 2。
|
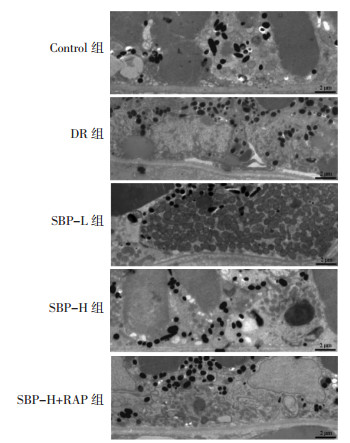
Control组线粒体呈梭形,嵴保存完整;与Control组比较,DR组线粒体结构遭到破坏,线粒体肿胀明显,形态异常;与DR组比较,SBP-L组、SBP-H组线粒体形态趋于正常,肿胀减轻;与SBP-L组比较,SBP-H组视网膜细胞线粒体结构改善更明显;与SBP-H组比较,SBP-H+RAP组线粒体肿胀加重,形态异常。见图 2。
|
| 图 2 透射电镜观察各组大鼠视网膜细胞线粒体结构 Fig. 2 Mitochondrial structure of retinal cells of rats in each group observed by transmission electron microscopy |
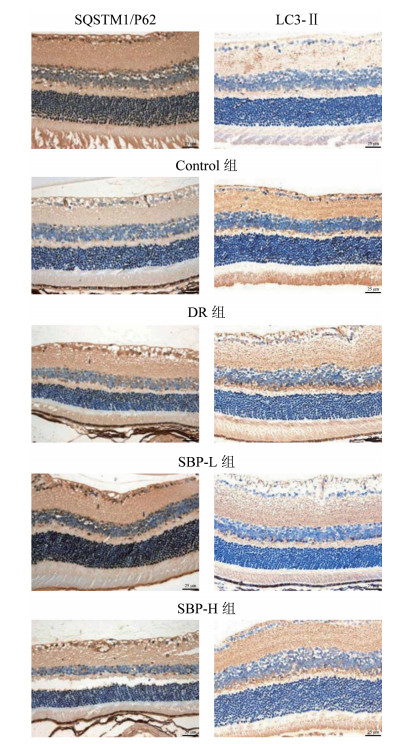
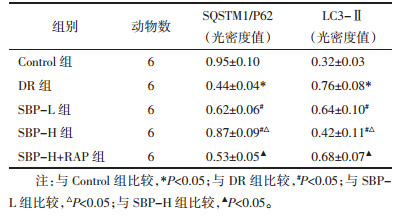
与Control组比较,DR组SQSTM1/P62蛋白表达水平显著降低,LC3-Ⅱ蛋白表达水平显著升高(P<0.05);与DR组比较,SBP-L组、SBP-H组SQSTM1/P62蛋白表达水平依次显著升高,LC3-Ⅱ蛋白表达水平显著降低(P<0.05);与SBP-L组比较,SBP-H组SQSTM1/P62表达显著升高,LC3-Ⅱ表达显著降低(P < 0.05);与SBP-H组比较,SBP-H+RAP组SQSTM1/P62蛋白表达水平显著降低,LC3-Ⅱ蛋白表达水平显著升高(P<0.05)。见图 3、表 3。
|
| 图 3 免疫组化检测各组大鼠SQSTM1/P62、LC3-Ⅱ蛋白表达水平 Fig. 3 Immunohistochemical detection of SQSTM1/P62, LC3-Ⅱ protein expression levels of rats in each group |
|
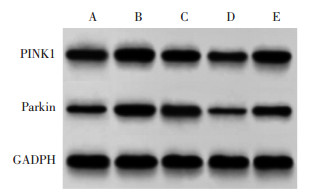
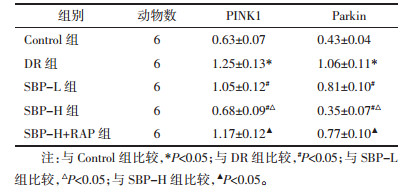
与Control组比较,DR组PINK1、Parkin蛋白表达水平显著升高(P<0.05);与DR组比较,SBP-L组、SBP-H组PINK1、Parkin蛋白表达水平依次显著降低(P<0.05);与SBP-L组比较,SBP-H组PINK1、Parkin蛋白表达显著降低(P < 0.05)。与SBP-H组比较,SBP-H+RAP组PINK1、Parkin蛋白表达水平显著升高(P<0.05)。见图 4、表 4。
|
| 注:A,Control组;B,DR组;C,SBP-L组;D,SBP-H组;E,SBP-H+RAP组。 图 4 蛋白免疫印迹法检测各组大鼠PINK1、Parkin蛋白表达 Fig. 4 Western Blot analysis of PINK1 and Parkin protein expression of rats in each group |
|
DR主要是由于高血糖及胰岛素信号通路缺陷造成多种病理性并发症,从而导致视网膜微血管缺陷及神经视网膜功能障碍[9]。其中高血糖是引起DR根本原因。研究显示麝香保心丸具有降血糖、血脂功效[10]。本研究发现麝香保心丸可以降低DR大鼠体内FPG、TC、TG、LDL-C水平,保护视网膜细胞结构破坏,减轻细胞水肿,稳定细胞形态。另外,VEGF是血管内皮细胞特异的促有丝分裂素,特异性地作用于视网膜血管内皮细胞,高糖可引起VEGF过表达,从而增加血管的渗透性,导致血管异常生长,而抑制VEGF的表达可以保护视网膜内皮细胞,防止微血管发生病变[11-12]。HMGB1作为晚期炎症因子,参与炎症反应、细胞凋亡、血管新生等过程,高糖刺激视网膜血管内皮细胞中HMGB1过表达,抑制HMGB1表达可以减轻DR,保护视网膜内皮细胞[13]。本研究结果显示,麝香保心丸可以降低VEGF、HMGB1水平,说明麝香保心丸可以保护视网膜内皮细胞,可以用于治疗糖尿病引起的视网膜病变。
自噬是一种基因调控的程序性细胞代谢过程,它可以将对细胞有害无用的蛋白质及受损功能失调的细胞器转移到溶酶体,然后进行功能性降解以维持细胞稳态[11]。线粒体自噬也是自噬的一种,可以降解受损的线粒体及调控线粒体总体质量,从而调控细胞稳态。然而在能量需求高的细胞中,过度的线粒体自噬可能导致剩余线粒体能量的损失,从而引起细胞死亡[12]。研究显示,降低线粒体自噬,可以缓解线粒体形态恶化,防止糖尿病患者视网膜神经性退变[13]。另外有研究显示,抑制LC3的表达,促进SQSTM1/P62的表达可以抑制脑组织的自噬水平,从而缓解脑组织损伤,降低脑组织凋亡程度[14]。LC3是自噬相关蛋白标志物,自噬发起时,胞浆型LC3-Ⅰ可以酶解一小段多肽形成自噬体LC3-Ⅱ,LC3-Ⅱ/Ⅰ比值大小可用于评估自噬水平高低。SQSTM1/P62是一种与LC3-Ⅱ相互作用的衔接蛋白,在自噬的过程中可以被降解[15]。本研究显示,DR大鼠SQSTM1/P62蛋白表达水平降低,LC3-Ⅱ蛋白表达水平升高,线粒体自噬能力增强,麝香保心丸可以上调SQSTM1/P62表达,下调LC3-Ⅱ蛋白表达,抑制DR大鼠线粒体自噬。
PINK1/Parkin信号通路是迄今为止研究最多的线粒体自噬机制之一,也是神经退行性疾病中研究最广泛的自噬机制之一[16]。PINK1是一种丝氨酸/苏氨酸激酶,负责激活并将Parkin从细胞质转运到受损的线粒体。Parkin是一种胞质E3-泛素连接酶,主要位于胞浆[17]。当线粒体受损时,PINK1迅速聚集在线粒体外膜,促使Parkin磷酸化,然后与SQSTM1、LC3B反应将泛素化线粒体传递到自噬小体中,形成线粒体自噬小体,从而清除受损的线粒体[18-20]。有研究显示,黄芪丹参汤通过抑制PINK1/Parkin介导的线粒体自噬保护糖尿病引起的肾损伤[21]。另外有研究显示,PTEN-L可以抑制PINK1/Parkin信号通路从而减少线粒体自噬,达到维持线粒体稳态目的[22]。本研究发现,DR大鼠PINK1、Parkin表达上调,线粒体自噬能力增强,麝香保心丸可以下调PINK1、Parkin表达,降低线粒体自噬能力,从而保护DR,自噬激活剂可逆转麝香保心丸的作用,证明麝香保心丸可以通过抑制PINK1/Parkin信号通路抑制DR大鼠线粒体自噬。
综上所述,麝香保心丸可以通过抑制PINK1/Parkin信号通路抑制DR大鼠线粒体自噬。但本研究尚存在局限性,线粒体自噬具有双重作用机制,在DR中发挥的作用机制还尚不明确,需要进一步验证。
| [1] |
LIN X L, XU Y F, PAN X W, et al. Global, regional, and national burden and trend of diabetes in 195 countries and territories: an analysis from 1990 to 2025[J]. Scientific Reports, 2020, 10(1): 14790. DOI:10.1038/s41598-020-71908-9 |
| [2] |
DEVI T S, YUMNAMCHA T, YAO F Y, et al. TXNIP mediates high glucose-induced mitophagic flux and lysosome enlargement in human retinal pigment epithelial cells[J]. Biology Open, 2019, 8(4): bio038521. |
| [3] |
ZHOU H R, MA X F, LIN W J, et al. Neuroprotective role of GLP-1 analog for retinal ganglion cells via PINK1/parkin-mediated mitophagy in diabetic retinopathy[J]. Frontiers in Pharmacology, 2021, 11: 589114. DOI:10.3389/fphar.2020.589114 |
| [4] |
李智慧, 李瑞东. 麝香保心丸对糖尿病微循环的影响[J]. 内蒙古中医药, 2018, 37(2): 18-19. |
| [5] |
费震宇, 徐玫, 陈宇明, 等. 麝香保心丸对2型糖尿病患者尿微量白蛋白/肌酐比值的影响[J]. 上海医药, 2020, 41(10): 23-25. |
| [6] |
杨梓超, 王育良, 左晶. 蒲黄提取物对糖尿病视网膜病变大鼠的保护作用[J]. 国际眼科杂志, 2021, 21(3): 406-410. |
| [7] |
刘小燕, 王远征, 李航旭, 等. 麝香保心丸对糖尿病大鼠周围神经病变的治疗作用[J]. 辽宁医学院学报, 2015, 36(1): 10-11, 107. |
| [8] |
哈利, 王琴, 杨烨. 雷帕霉素灌胃对糖尿病大鼠视网膜的保护作用及机制[J]. 山东医药, 2023, 63(2): 38-41, 46. |
| [9] |
AMOAKU W M, GHANCHI F, BAILEY C, et al. Diabetic retinopathy and diabetic macular oedema pathways and management: UK consensus working group[J]. Eye, 2020, 34(1): 1-51. DOI:10.1038/s41433-019-0577-x |
| [10] |
卢翠莲. 麝香保心丸联合瑞舒伐他汀治疗对老年冠心病患者血脂、血管内皮功能及外周血microRNA-126和microRNA-137表达的影响[J]. 中国动脉硬化杂志, 2020, 28(2): 158-162. |
| [11] |
汤中, 蒋亦龙, 彭辉灿. 原花青素对高糖环境下人视网膜内皮细胞增殖及VEGF表达的影响[J]. 中南医学科学杂志, 2020, 48(2): 155-159. |
| [12] |
李庆航, 李亚男, 张婷娉, 等. miR-140-5p抑制VEGF表达对糖尿病大鼠视网膜病变的保护作用[J]. 河北医药, 2023, 45(1): 11-14, 20. |
| [13] |
张梦瑶, 牛姝, 蔡静, 等. miR-140-5p靶向HMGB1/IκB-α轴对糖尿病大鼠视网膜病变的影响[J]. 基础医学与临床, 2023, 43(4): 615-620. |
| [14] |
ROSA M D, DISTEFANO G, GAGLIANO C, et al. Autophagy in diabetic retinopathy[J]. Current Neuropharmacology, 2016, 14(8): 810-825. DOI:10.2174/1570159X14666160321122900 |
| [15] |
侯文文, 石焕琦, 张真, 等. 自噬抑制剂3-MA对高糖诱导的人视网膜色素上皮细胞增生的抑制作用[J]. 中华实验眼科杂志, 2017, 35(1): 5-9. |
| [16] |
JIANG S, SUN J, MOHAMMADTURSUN N, et al. Dual role of autophagy/mitophagy in chronic obstructive pulmonary disease[J]. Pulmonary Pharmacology & Therapeutics, 2019, 56: 116-125. |
| [17] |
李浩东, 徐虹, 范永新, 等. ATG12对缺氧缺血性脑病小鼠神经细胞凋亡和自噬的影响[J]. 中华细胞与干细胞杂志(电子版), 2019, 9(3): 154-159. |
| [18] |
TRUBAN D, HOU X, CAULFIELD T R, et al. PINK1, parkin, and mitochondrial quality control: what can we learn about Parkinson' s disease pathobiology?[J]. Journal of Parkinson's Disease, 2017, 7(1): 13-29. DOI:10.3233/JPD-160989 |
| [19] |
MILLER S, MUQIT M M K. Therapeutic approaches to enhance PINK1/Parkin mediated mitophagy for the treatment of Parkinson' s disease[J]. Neuroscience Letters, 2019, 705: 7-13. DOI:10.1016/j.neulet.2019.04.029 |
| [20] |
YOO S M, JUNG Y K. A molecular approach to mitophagy and mitochondrial dynamics[J]. Molecules and Cells, 2018, 41(1): 18-26. |
| [21] |
LIU X H, LU J D, LIU S Q, et al. Huangqi-Danshen Decoction alleviates diabetic nephropathy in db/db mice by inhibiting PINK1/Parkin-mediated mitophagy[J]. American Journal of Translational Research, 2020, 12(3): 989-998. |
| [22] |
WANG L M, CHO Y L, TANG Y C, et al. PTEN-L is a novel protein phosphatase for ubiquitin dephosphorylation to inhibit PINK1-Parkin-mediated mitophagy[J]. Cell Research, 2018, 28(8): 787-802. DOI:10.1038/s41422-018-0056-0 |
 2024, Vol. 41
2024, Vol. 41