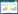文章信息
- 郑鸿铭, 胡芝凡, 黄梦芬, 等.
- ZHENG Hongming, HU Zhifan, HUANG Mengfen, et al.
- 基于数据挖掘和网络药理学研究中药复方治疗重症肌无力的用药规律及作用机制
- Administration rule and mechanism of traditional Chinese medicine compound in the treatment of myasthenia gravis: a study based on data mining and network pharmacology
- 天津中医药, 2024, 41(3): 372-385
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(3): 372-385
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.03.18
-
文章历史
- 收稿日期: 2023-08-28
2. 广州中医药大学第一附属医院脾胃病科, 广州 510000
重症肌无力是由自身抗体介导的,累及神经肌肉接头突触的获得性自身免疫疾病[1]。本病可累及全身骨骼肌,常表现为上睑下垂、复视、构音障碍、吞咽困难、呼吸困难等症状,具有病程长、病情重、易复发等特点,住院病死率可达到14.69‰[2]。目前西医治疗以胆碱酯酶抑制剂、免疫抑制剂、糖皮质激素、生物制剂、免疫球蛋白、血浆置换、切除胸腺等治疗为主,然而长期用药可能会导致乙酰胆碱受体破坏、胆碱能危象、免疫力低下等问题,血浆置换及免疫球蛋白等治疗也存在着较大的经济负担等问题[3-5]。中医药治疗重症肌无力方面有着丰富的临床经验及研究基础,具有疗效持久,经济负担小,不良反应少等优势,其在重症肌无力治疗中的地位越发得到重视。中药复方专利及中药复方临床研究作为众多临床医师长期实践总结的经验,具有较强的实用性及可重复性[6-7]。因此本研究通过数据挖掘探讨中国专利公布公告数据库、中国知网及万方数据库中的中药复方治疗重症肌无力的用药规律,并通过网络药理学分析核心药物组合治疗重症肌无力的作用机制,以期能为中药复方治疗重症肌无力提供组方及研究思路。
1 材料与方法 1.1 治疗重症肌无力中药复方检索检索国家知识产权局中国专利公布公告数据库(http://epub.cnipa.gov.cn/)截止至2023年4月20日的专利数据,检索专利类型为“发明授权”及“发明公布”,在文本名称及摘要说明中分别以“中药and重症肌无力”“草药and重症肌无力”进行查询,同时以“中医药” “中医”“法”“方”“重症肌无力”及“痿证”作为检索主题词,检索中国知网及万方数据库从建库以来至2023年4月20日所有有关中药复方治疗重症肌无力的期刊论文及学位论文,根据严格的纳入、排除标准对查询及检索结果进行录入整理。
1.2 纳入与排除标准 1.2.1 中药复方纳入标准专利中药复方:1)检索国家知识产权局中国专利公布公告数据库获取的用于治疗重症肌无力的口服中药复方专利,不限制药物剂型,不限制眼肌型及全身型。2)专利适应证中包含重症肌无力的口服中药复方。3)专利摘要内容中说明可治疗重症肌无力的中药复方。
文献中药处方:1)研究对象:用于治疗重症肌无力的中药复方,药味组成明确,不限制药物剂型,不限制眼肌型及全身型,所纳入研究中的患者均确诊为重症肌无力,诊断标准参照《中国重症肌无力诊断和治疗指南》[4]。2)研究类型:随机对照试验、队列研究、描述性研究。3)结局指标:纳入研究具有临床疗效评定等结局指标,结局明确中药复方对重症肌无力有治疗效果。4)以同一中药复方组成进行不同研究时仅保留一次。
1.2.2 中药复方排除标准专利中药复方:1)非口服或仅可外用治疗重症肌无力的中药复方专利。2)专利处方药物在专利摘要中未说明或未完全展示。3)用于重症肌无力并发症治疗的中药复方专利。4)仅含中药提取物或中西药合并使用的复方专利。5)以不同制剂类型相同处方内容重复发表的专利。
文献中药处方:1)不以重症肌无力为唯一治疗对象。2)研究类型无法确认以及动物实验、综述、专家共识、会议报道等。3)无法获取全文或药物组方不明确。
1.3 中药复方数据录入与规范将筛选后符合纳入标准的中药复方录入Excel 2016,数据规范化处理参照2020年版《中华人民共和国药典》及《中华本草》。对中药名称进行统一规范,如“山芋肉”规范为“山茱萸”,“丹皮”规范为“牡丹皮”,规范道地名称,如“淮山”录入为“山药”。数据录入由两名研究人员分别独立进行,对录入结果不一致处查询原专利内容及文献内容后讨论统一。
1.4 中药复方数据分析将规范化录入后的中药复方数据导入R语言(4.2.0版本),利用itemFrequency函数统计高频中药,进行可视化处理,利用apriori函数分析关联规则,设置最小支持度为0.22,最小置信度为0.8,然后利用plot函数对绘制点图、分组矩阵图及网状图对关联规则进行可视化处理;利用Excel 2016对录入中药的四气五味、归经进行统计分析绘制雷达图,利用IBM SPSS Modeler软件进行复杂网络分析,利用SPSS进行系统聚类分析,绘制聚类分析谱系图,根据统计结果对用药规律进行分析。
1.5 核心药对的网络药理学分析综合高频药物统计、关联规则分析、聚类分析及中医药理论,获得核心药物组合进行网络药理学分析,通过中药系统药理学数据库与分析平台(TCMSP)数据库(https://old.tcmsp-e.com/index.php)检索核心药物组合药物成分及其作用的蛋白质靶点,以口服生物利用度≥30%,药物相似度≥0.18作为筛选条件,利用Uniprot(Universal Protein)蛋白质数据库(https://www.uniprot.org/)将筛选获得的蛋白质靶点信息进行规范化处理,从人类基因数据库、疾病相关的基因与突变位点数据库(DisGeNET)、药物数据库(Drugbank)、在线人类孟德尔遗传数据库(OMIM)、TTD数据库获取重症肌无力相关靶点,利用R语言ggplot2包将筛选获得的药物组合靶点与重症肌无力靶点取交集,绘制韦恩图。将交集靶点提交至STRING(https://cn.string-db.org/)平台进行蛋白质互作网络(PPI)分析,利用Cytoscape 3.7.0 Network Analysis分析并可视化PPI网络模型,利用Metascape数据库对核心药物组合与重症肌无力靶点共同靶点进行基因本体(GO)及京都基因和基因组百科全书(KEGG)富集分析,利用气泡图可视化分析结果。
1.6 分子对接根据中药复方药物组合活性成分-重症肌无力-通路网络及PPI网络模型获取的核心药物成分及靶点信息,利用Chem3D MM2进行能量最小化结构优化,利用PyMOL软件移除水分子、配体、无机盐等,通过Autodock软件对筛选出的核心药物成分及核心靶点进行分子对接预测,利用PyMOL对对接结果进行可视化处理,并通过R语言pheatmap包绘制结合能热图。
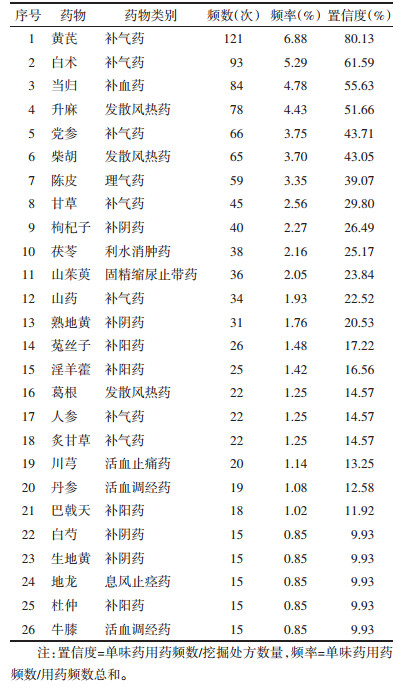
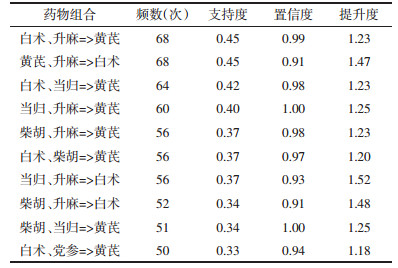
2 结果 2.1 中药复方的数据挖掘 2.1.1 高频中药类别及频数、频率分析根据纳入、排除标准筛选后共纳入专利63条,文献162篇,共涉及中药复方151条,其中复方专利处方60条,文献报道中药复方91条,中药352味,共计用药频数1 759次,通过R 4.2.0统计高频中药得到高频中药(使用频率≥10%,即使用频数≥15次)共26味,其中黄芪(121次,80.13%)、白术(93次,61.59 %)、当归(84次,55.63%)、升麻(78次,51.66%)、党参(66次,43.71%),柴胡(65次,43.05%),高频中药类别及频数、置信度、频率见表 1。
|
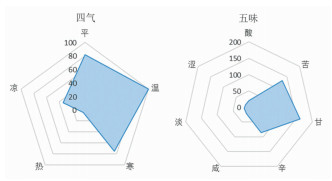
处方纳入的352味中药的四气以温性药(115次,34.3%)为主,其次是平性药(92次,27.5%);五味以甘味(179次,34.7%)为主,其次为苦味(154次,29.8%),四气五味雷达图见图 1。归经以肝经(161次,22.0%)为主,其次为肾经(120次,16.4%),归经旭日图见图 2。
|
| 图 1 四气五味雷达图 Fig. 1 The radar map for four natures and five flavors of drugs |

|
| 图 2 归经旭日图 Fig. 2 Sunburst chart of channel tropism |
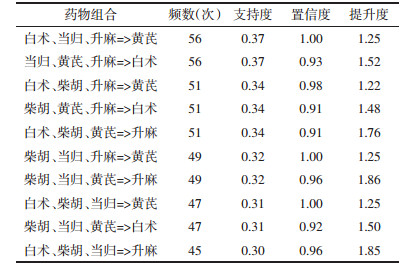
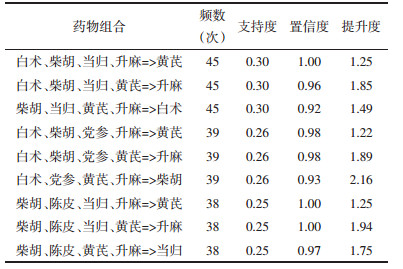
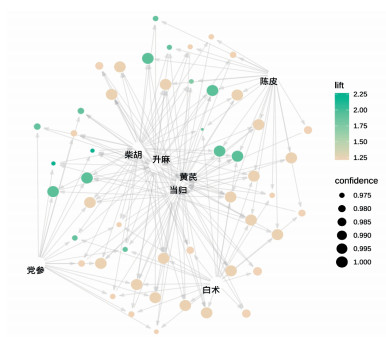
使用IBM SPSS Modeler 18.0对纳入的352味中药进行复杂网络分析,复杂网络图见图 3,线条越粗表示支持度越大,使用R 4.2.0 Apriori函数进行关联规则分析,设置最小支持度0.25,最小置信度0.9,共筛选得出中药复方治疗重症肌无力核心药对76项,包括中药7味:柴胡、当归、黄芪、党参、白术、升麻、陈皮。结果按支持度降序排序,见表 2-表 5,其中白术= > 黄芪频数最高,为87次,绘制高频药物关联规则网状图,箭头代表相互关联,点大小代表置信度,点颜色越深代表提升度越高,见图 4。

|
| 图 3 复方中药治疗重症肌无力复杂网络图 Fig. 3 Association network display of TCMs in treatment of myasthenia gravis |
|
|
|
|
| 图 4 高频药物关联规则网状图 Fig. 4 Network diagram of high frequency TCMs association rules |
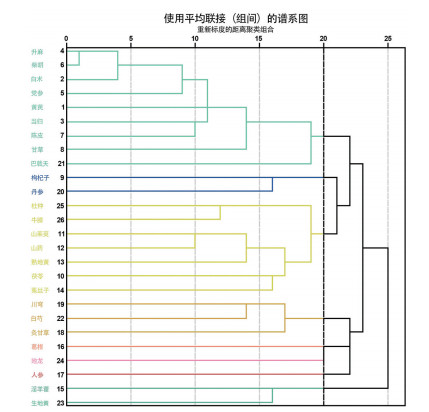
利用SPSS 25.0对34味治疗重症肌无力中药复方中的高频中药进行系统聚类分析,最小聚类数设置为5,最大聚类数设置为10,测量区间采用皮尔森(Pearson)相关性,见图 5。设置Pearson相关性为20,可分为7类,T1:升麻、柴胡、白术、党参、黄芪、当归、陈皮、甘草、巴戟天;T2:枸杞子、丹参;T3:杜仲、牛膝、山茱萸、山药、熟地黄、茯苓、菟丝子;T4:川芎、白芍、炙甘草;T5:葛根、地龙;T6:人参;T7:淫羊藿、生地黄。
|
| 图 5 高频药物聚类分析 Fig. 5 Cluster analysis of high-frequency TCMs |
综合高频药物统计、关联规则分析、聚类分析及中医药理论,最终选择核心药物组合“柴胡-当归-黄芪-党参-白术-升麻”进一步探索中药复方治疗重症肌无力的作用机制。筛选后获取的柴胡、当归、黄芪、党参、白术、升麻活性成分各17、2、20、21、7、17个,根据已发表文献补充未预测到的活性成分及相应靶点,去除重复项后,最终纳入药物活性成分55个,去除重复项后,最终纳入活性成分靶点257个。从Genecards、DisGeNET、Drugbank、OMIM、TTD数据库获取重症肌无力相关靶点各839、336、14、33、7个,合并去除重复项后获得疾病靶点995个。
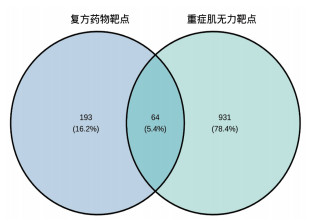
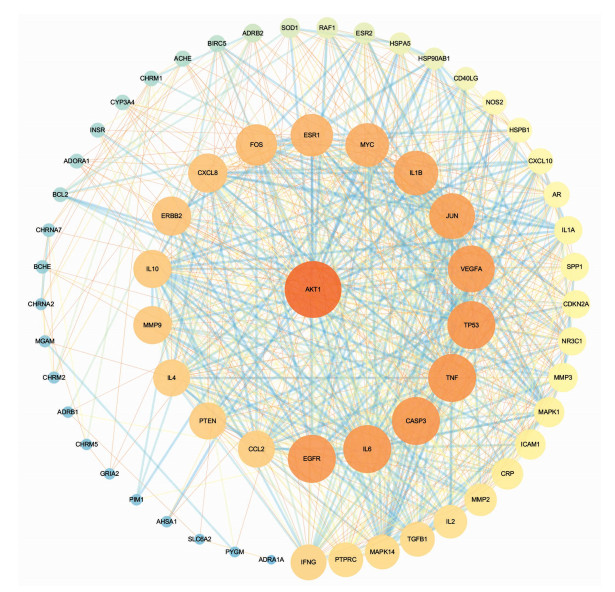
2.2.2 中药复方药物组合—重症肌无力靶点PPI网络构建利用R语言ggplot2包将筛选获得的“柴胡-当归-黄芪-党参-白术-升麻”药物组合靶点与重症肌无力靶点取交集,获得共同靶点64个,绘制韦恩图见图 6。PPI网络模型中节点大小代表连接度,边的粗细代表相互作用强度,见图 7。64个靶点共存在776项相互关联,其中节点平均连接度为24.25,平均介度为0.013,平均紧密度为0.587,连接度、介度、紧密度均大于平均值的核心靶点有14个,按连接度从大到小排列依次为蛋白激酶B1(AKT1)、表皮生长因子受体(EGFR)、原癌基因FOS(FOS)、原癌基因JUN(JUN)、原癌基因MYC(MYC)、白细胞介素6(IL-6)、肿瘤坏死因子(TNF)、胱天蛋白酶3(CASP3)、白细胞介素-1β(IL-1β)、C反应蛋白(CRP)、肿瘤抑制蛋白(TP53)、血管内皮生长因子(VEGFA)、雌激素受体(ESR1)、酪氨酸激酶受体2(ERBB2),提示这些靶点可能为“柴胡-当归-黄芪-党参-白术-升麻”治疗重症肌无力的关键靶点。
|
| 图 6 药物组合-重症肌无力靶点韦恩图 Fig. 6 Venn diagram of drug combination and myasthenia gravis targets |
|
| 图 7 药物组合-重症肌无力靶点PPI网络图 Fig. 7 PPI network of drug combination and myasthenia gravis targets |
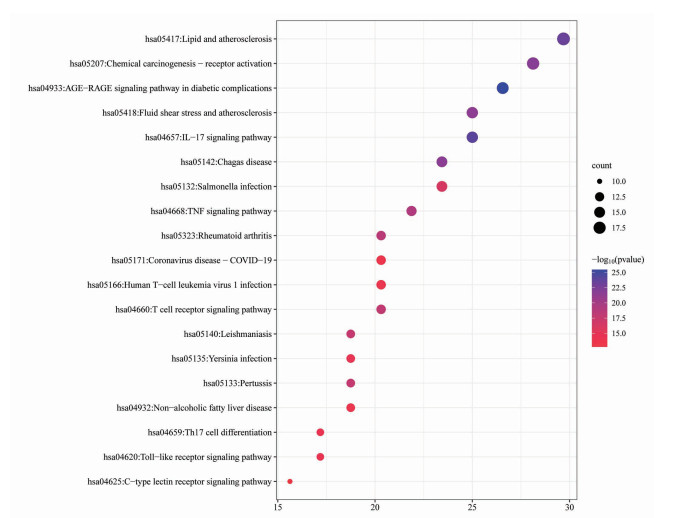
利用Metascape数据库对“柴胡-当归-黄芪-党参-白术-升麻”药物组合与重症肌无力靶点共同靶点进行GO富集分析,包括分子功能(MF)、生物过程(BP)及细胞成分(CC)并进行KEGG富集分析,设定P<0.01,选取P值排名前20位的功能信息,绘制气泡图进行可视化处理。KEGG富集分析结果显示,“柴胡-当归-黄芪-党参-白术-升麻”药物组合参与治疗重症肌无力的信号通路主要包括白细胞介素-17(IL-17)信号通路、TNF信号通路、T细胞受体(TCR)信号通路、Toll样受体(TLR)信号通路、辅助性T细胞17(Th17)细胞分化信号通路、C-型凝集素受体(CLR)信号通路,详见图 8。
|
| 图 8 KEGG富集分析气泡图 Fig. 8 Bubble diagram of KEGG enrichment analysis |
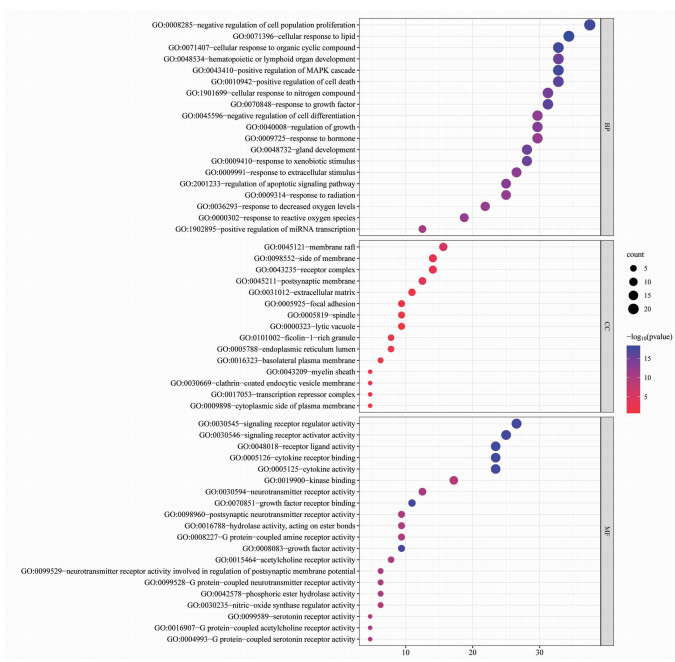
GO富集分析结果显示相关靶点参与的生物过程主要包括蛋白质磷酸化正向调节、丝裂原活化蛋白激酶(MAPK)级联正向调控、对生长因子的响应、对激素的反应、对活性氧的反应等;主要参与的细胞成分包括膜筏、突触后膜、受体复合体、基底外侧质膜等,主要参与分子功能包括磷酸酯水解酶活性、作用于酯键的水解酶活性、血清素受体活性、G蛋白偶联血清素受体活性、神经递质受体活性参与突触后膜电位的调节、G蛋白偶联乙酰胆碱受体活性、突触后神经递质受体活性等,详见图 9。
|
| 图 9 GO富集分析气泡图 Fig. 9 Bubble diagram of GO enrichment analysis |
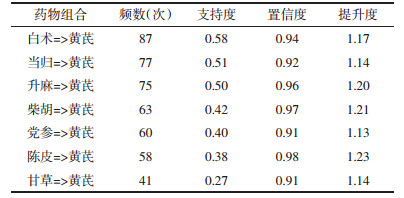
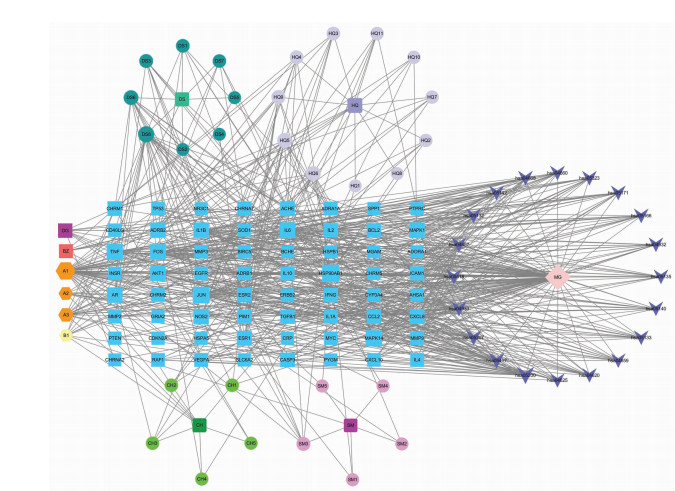
利用Cytoscape 3.7.0构建“药物组合活性成分—重症肌无力—通路”网络图,见图 10,结果提示共124个节点,产生662项关联,55个药物活性成分的平均连接度为8.2,平均介度为0.007,平均紧密度为0.384,连接度越大表示相互作用的靶点越多,提示该药物活性成分在“活性成分-重症肌无力-通路网络”中处于核心位置,按连接度降序排列筛选出核心药物活性成分见表 6,包括槲皮素、木犀草素、山柰酚、7-甲氧基-2-甲基异黄酮、7-O-甲基异微凸剑叶莎醇、甲氧异黄酮、异鼠李素、β-谷甾醇、豆甾醇、毛蕊异黄酮、3β-乙酰氧基苍术酮、大豆黄素、(6aR,11aR)- 3-羟基-9,10-二甲氧基紫檀烷、齿阿米醇等。
|
| 注:蓝色矩形代表靶点,圆形代表代表药物活性成分,正六边形代表多个药物共有成分,核心药物成分包括槲皮素、木犀草素、山柰酚、7-甲氧基-2-甲基异黄酮、7-O-甲基异微凸剑叶莎醇、异鼠李素、甲氧异黄酮、β-谷甾醇、豆甾醇及毛蕊异黄酮,V形代表通路,菱形代表重症肌无力,其中节点的越大代表连接度越大。 图 10 药物组合活性成分—重症肌无力—通路网络图 Fig. 10 Network diagram of drug combination-myasthenia gravis-pathway |
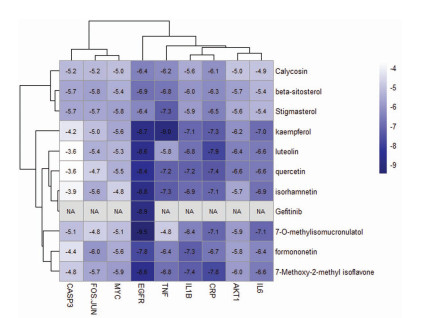
利用Autodock软件对“药物组合活性成分—重症肌无力—通路”网络及PPI网络中筛选出的连接度大于平均连接度的核心药物成分(共10个)及前10位核心靶点进行分子对接预测,得到药物关键活性成分与核心靶点结合能结果,见图 11,最低结合能越低代表结合能力越强,对接结果提示,平均分子对接结合能为-6.23 kcal/mol,提示核心药物成分与核心靶点对接稳定,结合能最低的分子对接为7-O-甲基异微凸剑叶莎醇与EGFR,其分子对接图见图 12。EGFR抑制剂吉非替尼与EGFR靶点的分子对接见图 13。
|
| 图 11 分子对接结合能热图 Fig. 11 Heat map of molecular docking binding energy |

|
| 图 12 7-O-甲基异微凸剑叶莎醇与EGFR分子对接图 Fig. 12 Molecular docking diagram of 7-O-methylisomucronulatol and EGFR |
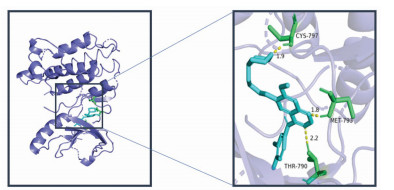
|
| 图 13 吉非替尼与EGFR分子对接图 Fig. 13 Molecular docking diagram of Gefitinib and EGFR |
中医典籍中暂无“重症肌无力”病名,现代医家根据其临床表现,将其归为“痿证”“瘖痱”“虚劳病”等范畴[8]。《黄帝内经·素问》中最早阐述了痿证的病因病机“五脏使人痿……肺主身之皮毛,心主身之血脉,肝主身之筋膜,脾主身之肌肉,肾主身之骨髓,故肺热叶焦,则皮毛虚弱急薄,著则生痿躄也”[9]。目前重症肌无力的中医辨证分型尚无统一的标准,各个医家对本病辨治也存在不同的学术思想。国医大师邓铁涛教授提出重症肌无力“脾胃虚损,五脏相关”理论,辨证为脾胃虚损证,治疗上“重补脾胃,益气升陷,兼治五脏”[10]。中国中医科学院周绍华教授将重症肌无力分为肝肾亏虚、中气不足、脾肾阳虚、元气衰败4型[11]。刘亚军等[12]通过回顾性分析发现重症肌无力归以脾气虚弱证、肝肾不足证及脾肾两虚证多见。刘小斌教授[13]提出多病因致病理论,重症肌无力发病可归于先天禀赋不足,或后天失调,或情志失司等所致,治疗上以峻补脾胃、益气升陷为治疗大法,兼以补益肝肾。本研究通过对中国专利公布公告数据库、中国知网及万方数据库的检索,纳入治疗重症肌无力中药处方60条,中药352味。数据分析结果发现重症肌无力中药复方所使用的药物多归肝、肾经,重症肌无力患者常见眼肌受累,肝开窍于目,肝虚则目不得精气濡养,故可见复视、眼睑下垂等症状,肝主藏血并主一身之筋膜,血海不足则濡润经脉难以为继,故出现晨轻暮重的波动性疲劳[14]。肾为先天之本。《黄帝内经·素问》曰:“肾者作强之官,伎巧出焉。”肾虚则伎巧不出,痿软不用,可见补益肝肾是重症肌无力治疗中的重要方法[15]。重症肌无力病机以虚损为主,根据数据挖掘结果分析中药复方纳入中药多为补气药、补阴药及补阳药,符合重症肌无力虚损的病机,性味多以甘温为主,温药可以温补肾阳以固先天之本,甘味药具有补益和中之作用,且甘能入脾,脾主身之肌肉,甘温之药能健脾益气,补益脾胃以充后天之本,先后天同调达到治疗重症肌无力的目的。
关联分析共筛选得出中药复方治疗重症肌无力核心药对76项,包括中药7味:柴胡、当归、黄芪、党参、白术、升麻、陈皮,其中白术= > 黄芪、当归= > 黄芪频数较高。系统聚类分析结果可分为7类,分别体现出中医气血阴阳并补、活血通经、舒筋通络、补益肝肾、温肾助阳等治法,T1聚类方升麻、柴胡、白术、党参、黄芪、当归、陈皮、甘草、巴戟天以补中益气汤加巴戟天,重补脾胃,益气升陷,兼以补肾助阳;T3聚类杜仲、牛膝、山茱萸、山药、熟地黄、茯苓、菟丝子聚类方为经方六味地黄丸加减,体现补肾填精以固先天之本的治疗思想;T4聚类川芎、白芍、炙甘草为四物汤加减,体现重症肌无力治疗中补血以润宗筋的治疗思想;T6聚类单药人参补脾益气,生津养血,上述聚类结果契合了重症肌无力虚损为本的病机,体现了重症肌无力治疗上重视补益虚损,益气升陷,养血荣筋,注重肝肾、脾胃先后天同调的特点。
重症肌无力属于“痿证”范畴,早在《素问·痿论》中便提出“治痿独取阳明”的观点。脾胃为后天之根本,为水谷精微化生之源。《脾胃论》有言:“夫脾胃者,仓廪之官也,属土以滋众脏,安谷以济百骸,故胃于中宫,职司南政,旺于四季,体应四肢。”[16]补中益气汤出自《内外伤辨惑论》,是补中益气、升阳举陷的千古名方。明代《保婴撮要》中记载“若胃气亏损,眼睫无力而不能开者,用补中益气汤”[17]。多项临床研究也证实补中益气汤治疗重症肌无力具有良好的临床疗效,体现了从阳明论治痿证的学术思想[18-20]。本研究综合高频药物统计、关联规则分析、聚类分析及中医药理论后得出治疗重症肌无力的核心药物组合“柴胡-当归-黄芪-党参-白术-升麻”,与补中益气汤组方思路相符合,重症肌无力患者脾胃虚损,清阳不升,气陷于下,故见眼睑下垂,核心药物组合中柴胡、升麻可升阳举陷,恢复中焦升降之功能,使得气机通利,气血得以荣养宗筋,脾得以升清。《医学衷中参西录》提出当归能生血活血,又能宣通气分,使气分各有所归,而黄芪既能补气,又能升气,核心药物组合中当归、黄芪两者相伍,补血以载气,补气以生血,气血互生,气得以壮,血得以旺,使重症肌无力患者筋脉得以濡养,中气得以升提[21]。党参、白术补益脾胃,又可辅助黄芪以补中益气,脾胃得以健运,则气血生化得其源,配以当归则可辅以补血和营。脾胃亏虚之病机贯穿重症肌无力发展与转归的始终,整体核心药物组合组方体现补益脾胃以充后天之本,气血双补以荣养筋脉,符合“治痿独取阳明”的中医经典理论。
3.2 核心药物组合“柴胡-当归-黄芪-党参-白术-升麻”治疗重症肌无力的网络药理学研究网络药理学分析结果提示“柴胡-当归-黄芪-党参-白术-升麻”药物组合的主要活性成分包括槲皮素、木犀草素、山柰酚、7-甲氧基-2-甲基异黄酮、7-O-甲基异微凸剑叶莎醇、甲氧异黄酮、异鼠李素、β-谷甾醇、豆甾醇、毛蕊异黄酮、3β-乙酰氧基苍术酮、大豆黄素、齿阿米醇等。其中当归中含有的β-谷甾醇及党参、升麻、柴胡含有的豆甾醇属于植物甾醇化合物,研究表明β-谷甾醇可选择性地抑制CD4阳性细胞(Th1)活性并促进辅助型T细胞2(Th2)偏倚,Th1细胞和Th2细胞的细胞间平衡失常与重症肌无力的发生发展密切相关,纠正Th1/Th2失衡可能为重症肌无力治疗的关键之一[22-24]。豆甾醇可影响调节T细胞(CD4+CD25+)的增殖水平,而胸腺来源的CD4+CD+25Tr免疫调节细胞数量及功能的异常可通过主动调节的方式影响重症肌无力等自身免疫病的发生发展,重症肌无力症状未控制时CD4+CD+25Tr细胞百分率明显降低,因此推测豆甾醇可影响调节T细胞来治疗重症肌无力[22, 25-26]。白术中的3β-乙酰氧基苍术酮为网络药理学预测治疗重症肌无力的活性成分之一,研究表明苍术酮可通过核因子-κB(NF-κB)通路抑制炎症,抑制炎症因子白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的释放,从而进一步参与重症肌无力自免过程[27]。柴胡、黄芪中的槲皮素、党参中的木犀草素等活性成分属于黄酮类化合物,1项对128种黄酮类化合物的研究表明,黄酮类化合物具有乙酰胆碱酯酶抑制活性及抗氧化活性等[28]。重症肌无力最主要的自身抗体为乙酰胆碱受体抗体(AChRAb),可分为毒蕈碱型受体(M受体-G蛋白偶联型受体)和烟碱型受体(N受体-离子通道型受体),主要存在于突触后膜,重症肌无力患者中AChRAb阳性率可达85%[29-30]。研究发现槲皮素可以浓度依赖的方式竞争性抑制乙酰胆碱酯酶,减少乙酰胆碱水解以增加突触间隙的乙酰胆碱水平,此外槲皮素还具有抗氧化应激、抗炎及免疫调节等广泛的药理作用,可以降低(IL-1β、IL-6及TNF-α等的表达,从而减轻神经炎症及凋亡神经元细胞死亡[31-37]。异鼠李素可抑制IL-6、TNF-α等炎症因子的释放以抑制炎症反应,并能增强神经突触可塑性,用于多种神经系统疾病,其衍生物也具有抗乙酰胆碱酯酶活性潜力[38-40]。实验证明山柰酚可以降低促炎因子TNF-α、IL-1β表达从而起到抗炎的作用,Beg等[41-42]研究发现,山柰酚可降低阿尔兹海默症果蝇的氧化应激及乙酰胆碱酯酶活性。木犀草素可通过抑制活性氧(ROS)/硫氧还蛋白互作蛋白(TXNIP)/ NOD样受体热蛋白结构域相关蛋白3(NLRP3)信号通路激活,降低血清白细胞介素-18(IL-18)、IL-1β及TNF-α水平,减轻炎症反应与氧化应激[43]。黄芪中的黄芪总皂苷成分,虽然非本药物核心组合的核心药物成分(连接度=5),但最新研究表明其可通过调控细胞因子分泌的水平,如抑制IL-1β表达等起到神经保护及修复的作用,其在重症肌无力治疗中的作用机制可进一步深入研究[44]。网络药理学分析结果及上述研究阐明了核心药物组合“柴胡-当归-黄芪-党参-白术-升麻”治疗重症肌无力具有多成分的特点,为研究中药复方治疗重症肌无力的物质基础提供了参考。
PPI网络提示,核心活性成分主要作用于AKT1、EGFR、FOS、JUN、MYC、IL6、TNF、CASP3、IL1B、CRP、TP53等靶点,对疾病药物共同靶点的KEGG富集分析结果提示,核心药物组合主要通过IL-17信号通路、TNF信号通路、T细胞受体信号通路、Toll样受体信号通路、Th17细胞分化信号通路及C-型凝集素受体信号通路发挥对重症肌无力的治疗作用。肌肉特异性酪氨酸肌酶(MuSK)在突触成熟、乙酰胆碱受体(AChR)聚集及维持神经肌肉结构中发挥着重要作用,约1%~4%重症肌无力患者血清中可检测出MuSK抗体[4, 45]。研究表明AChR+和MuSK + MG中血清中微小核糖核酸(miRNA)表达水平与健康对照组存在统计学差异,其中MuSK +MG相关的血清miRNA(miR-151a-3p、miR-423-5p)与FOS、JUN蛋白的结合位点最多,相关转录激活因子AP-1(AP-1)转录因子(FOS、JUN等)参与了重症肌无力相关自身免疫通路[46-47]。CASP3可调节Ⅱ型干扰素(IIFN)信号通路,激活JAK激酶(JAK)信号传感器和信号传导及转录激活蛋白(STAT)途径激活子,导致干扰素刺激基因(ISGs)的转录,从而校准宿主防御,并限制组织损伤和防止自身免疫[48-49]。
多项研究表明,TNF信号通路与重症肌无力的发病相关,TNF-γ可诱导T细胞及B细胞活化增殖,并产生抗乙酰胆碱受体抗体,破坏神经肌肉接头功能,TNF-α可正性调节T细胞及B细胞的增殖分化,不同程度重症肌无力患者血清中TNF-α含量均高于正常对照组[50-53]。Interfinger等[54]研究发现系统性产生TNF的CD103+Th细胞是重症肌无力的特征性Th细胞亚群,且与临床疾病严重程度之间存在显著的负相关关系。体内IL-1β与TNF-α相互诱导产生,IL-1β的过表达会促进TNF-α表达水平,因而IL-1β通过影响TNF信号通路也可参与重症肌无力自免过程[55]。研究发现Akt1可通过调控磷脂酰肌醇激酶(PI3K)/Akt/NF-κB信号通路减轻细胞炎症反应,抑制Akt1表达后TNF-α、IL-6蛋白的表达水平显著升高,可通过影响干扰素水平及细胞因子参与到重症肌无力的发病过程中[56]。对重症肌无力患者血清炎症介质水平及其压力性损伤程度相关性的研究中发现,患者血清超敏C反应蛋白(hs-CRP)、TNF-α、IL-6、IL-1β水平均与压力性损伤程度呈正相关[57]。
胸腺相关重症肌无力约占重症肌无力的10%~15%,研究表明自身免疫调节因子(Aire)表达水平与胸腺瘤相关重症肌无力存在关联[4, 58]。Bian等[59]对于98例胸腺瘤患者的研究表明,胸腺切除后患者TP53水平下降,考虑TP53为胸腺瘤预后因素,参与胸腺瘤相关重症肌无力。EGFR为表皮生长因子受体,在胸腺瘤及胸腺癌中高表达,研究发现胸腺瘤患者中EGFR高表达者共患重症肌无力几率更高[60-61]。对胸腺瘤及肿瘤差异基因表达的研究发现,胸腺组织中c-MYC基因表达阳性率高于对照组[62]。因此推测中药复方成分治疗胸腺相关型重症肌无力可通过EGFR、TP53、MYC等相关靶点。分子对接结果提示药物组合关键活性成分与EGFR靶点的对接结合能最低,结合能力最强,其中7-O-甲基异微凸剑叶莎醇与EGFR分子对接最低结合能为-9.5 kcal/mol(见图 12),研究表明[63]EGFR抑制剂吉非替尼对胸腺瘤具有良好的治疗作用,吉非替尼与EGFR分子对接最低结合能为-8.9 kcal/mol(见图 13),提示药物组合关键活性成分与EGFR结合稳定,“柴胡-当归-黄芪-党参-白术-升麻”可能通过靶向EGFR治疗胸腺相关型重症肌无力。
Th17细胞是一种CD4+T细胞亚群,以特异性分泌高水平IL-17为特征,Th17可分泌IL-17、IL-22、IL-6及TNF-α等细胞因子,参与Th1/Th2细胞因子的调节,促进B细胞合成并分泌大量自身免疫性抗体,加速重症肌无力的发病[64-65]。p38α MAPK可通过整合树突状细胞中的多种信号调节介导自身免疫的辅助T细胞分化为程序化树突状细胞依赖的Th17细胞[66]。Toll样受体(TLR)参与非特异性免疫,可影响固有免疫细胞活化,表达和分泌TNF-α、IL-12、IL-6等促炎因子,并影响Treg细胞向Th17分化,动物实验也证明阻断TLR9信号可减轻实验性自身免疫性重症肌无力(EMAG)小鼠重症肌无力的症状[67-68]。Aricha等[69]研究发现,注射抗IL-6抗体可下调EMAG小鼠Th17相关基因表达。C型凝集素受体(CLR)在树突状细胞的摄取糖蛋白、呈递抗原信息过程中发挥重要作用,从而调节自身免疫、感染等,CLR与TLR的相互作用也参与了对DC功能的调控[70-71]。上述研究提示核心药物成分可能通过靶向IL-6、参与MAPK调控等作用于IL-17信号通路、Th17细胞分化、T细胞受体信号通路、C型凝集素受体信号通路从而用于治疗重症肌无力。GO富集分析结果提示核心药物组合可能通过参与MAPK级联正向调控、腺发育、对激素及活性氧的反应等生物过程,作用于突触后膜等细胞成分,影响G蛋白偶联乙酰胆碱受体活性、突触后神经递质受体活性等分子功能治疗重症肌无力。
上述研究结果共同提示了复方药物组合“柴胡-当归-黄芪-党参-白术-升麻”治疗重症肌无力具有多成分,多靶点共同作用的特点。分子对接结果显示核心药物成分与主要靶点的平均分子对接结合能为-6.23 Kcal/mol<-5.0 Kcal/mol,结合活性均较强,说明核心药物成分与核心靶点对接稳定。
综上所述,本研究通过对中药复方治疗重症肌无力的数据挖掘,揭示了重症肌无力先天禀赋不足,后天失调的病因,治疗上重视补益虚损,养血荣筋,注重肝肾、脾胃先后天同调的用药规律,并总结出治疗重症肌无力的核心中药复方药物组合“柴胡-当归-黄芪-党参-白术-升麻”,并通过网络药理学发现核心药物组合可能是通过槲皮素、木犀草素、山柰酚、7-甲氧基-2-甲基异黄酮、7-O-甲基异微凸剑叶莎醇、异鼠李素、甲氧异黄酮、β-谷甾醇、豆甾醇及毛蕊异黄酮等化合物与主要靶点AKT1、EGFR、FOS、JUN、MYC、IL-6、TNF、CASP3、IL-1β、CRP的作用,并由IL-17信号通路、TNF信号通路、T细胞受体信号通路、Toll样受体信号通路、Th17细胞分化及C-型凝集素受体信号通路,通过参与腺发育,对激素及活性氧的反应等生物过程,作用于突触后膜等细胞成分,影响G蛋白偶联乙酰胆碱受体活性、突触后神经递质受体活性等分子功能,从而起到对重症肌无力的治疗作用,可为后续中药复方治疗重症肌无力的机制研究提供思路与参考。
| [1] |
NARAYANASWAMI P, SANDERS D B, WOLFE G, et al. International consensus guidance for management of myasthenia gravis: 2020 update[J]. Neurology, 2021, 96(3): 114-122. DOI:10.1212/WNL.0000000000011124 |
| [2] |
CHEN J S, TIAN D C, ZHANG C, et al. Incidence, mortality, and economic burden of myasthenia gravis in China: a nationwide population-based study[J]. The Lancet Regional Health Western Pacific, 2020, 5: 100063. DOI:10.1016/j.lanwpc.2020.100063 |
| [3] |
张修铭. 邓铁涛诊治重症肌无力治未病思想及临床用药相关规律[D]. 广州: 广州中医药大学, 2019.
|
| [4] |
常婷. 中国重症肌无力诊断和治疗指南(2020版)[J]. 中国神经免疫学和神经病学杂志, 2021, 28(1): 1-12. |
| [5] |
张艳. 静脉注射免疫球蛋白与血浆置换治疗重症肌无力的研究[J]. 当代医学, 2019, 25(6): 49-50. |
| [6] |
黄锦桢, 陈团团, 张唤唤, 等. 基于国家专利的中药复方调治肝癌用药规律及作用机制研究[J]. 现代中药研究与实践, 2022, 36(5): 76-81. |
| [7] |
刘旭. 中药复方可专利性问题研究[D]. 郑州: 中原工学院, 2022.
|
| [8] |
万迁迁, 郑昱. 李东垣《兰室秘藏》学术思想[J]. 长春中医药大学学报, 2018, 34(3): 409-411. |
| [9] |
王冰. 黄帝内经素问: 二十四卷[M]. 上海: 商务印书馆, 1955.
|
| [10] |
邓中光, 邱仕君, 邓铁涛. 邓铁涛对重症肌无力的认识与辨证论治[J]. 中国医药学报, 1993, 8(2): 41-43. |
| [11] |
洪霞, 郭春莉, 宁侠, 等. 周绍华治疗重症肌无力经验[J]. 中医杂志, 2016, 57(13): 1093-1095. |
| [12] |
刘亚军, 满运军, 王佳, 等. 重症肌无力中医辨证与西医分型及疗效探讨[J]. 北京中医药, 2009, 28(3): 206-208. |
| [13] |
黄琳文, 李景濠, 翁森辉, 等. 基于数据挖掘探讨刘小斌教授治疗重症肌无力的用药规律[J]. 时珍国医国药, 2022, 33(1): 228-231. |
| [14] |
刘洋. 中医理论创新琐谈(一): 以肝藏血主筋论治重症肌无力为例[J]. 中国中医基础医学杂志, 2017, 23(2): 272-274. |
| [15] |
王淑辉, 王海萍. HLA与重症肌无力的遗传易感性[J]. 国外医学·神经病学神经外科学分册, 2003, 30(4): 333-336. |
| [16] |
李东垣. 脾胃论[M]. 北京: 人民卫生出版社, 2005.
|
| [17] |
薛铠, 薛己. 保婴撮要[M]. 北京: 中国中医药出版社, 2016.
|
| [18] |
王华伟, 杨盼盼, 马勇, 等. 补中益气汤加味治疗重症肌无力60例[J]. 中医临床研究, 2016, 8(1): 62-63. |
| [19] |
张玉芬. 补中益气汤治疗重症肌无力的临床观察[J]. 实用中西医结合临床, 2013, 13(5): 44-45. |
| [20] |
董婷, 李静, 杨文明, 等. 补中益气汤治疗重症肌无力临床研究[J]. 中国中医急症, 2011, 20(2): 212-213, 236. |
| [21] |
张锡纯. 医学衷中参西录[M]. 2版. 石家庄: 河北科学技术出版社, 2002.
|
| [22] |
LE C F, KAILAIVASAN T H, CHOW S C, et al. Phytosterols isolated from Clinacanthus nutans induce immunosuppressive activity in murine cells[J]. International Immunopharmacology, 2017, 44: 203-210. DOI:10.1016/j.intimp.2017.01.013 |
| [23] |
YANG H, ZHANG Y, WU M H, et al. Suppression of ongoing experimental autoimmune myasthenia gravis by transfer of RelB-silenced bone marrow dentritic cells is associated with a change from a T helper Th17/Th1 to a Th2 and FoxP3+ regulatory T-cell profile[J]. Inflammation Research, 2010, 59(3): 197-205. DOI:10.1007/s00011-009-0087-6 |
| [24] |
MASUDA M, TANAKA S, NAKAJIMA K, et al. Clinical implications of the type 1/type 2 balance of helper T cells and P-glycoprotein function in peripheral T lymphocytes of myasthenia gravis patients[J]. European Journal of Pharmacology, 2010, 627(1/2/3): 325-331. |
| [25] |
QI G Y, GU S S, LIU P, et al. Effects of combined traditional Chinese medicine with immunosuppressive agents for patients with myasthenia gravis[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(10): 19044-19050. |
| [26] |
秦炯. 重症肌无力的免疫发病机制及相关治疗进展[J]. 临床儿科杂志, 2007, 25(2): 85-87. |
| [27] |
李静, 金伦喆, 金洪光. 白术提取物苍术酮对脂多糖诱导的BV2细胞神经炎性影响及相关机制研究[J]. 天然产物研究与开发, 2020, 32(5): 826-830, 758. |
| [28] |
URIARTE-PUEYO I, CALVO M I. Flavonoids as acetylcholinesterase inhibitors[J]. Current Medicinal Chemistry, 2011, 18(34): 5289-5302. DOI:10.2174/092986711798184325 |
| [29] |
MERIGGIOLI M N, SANDERS D B. Autoimmune myasthenia gravis: Emerging clinical and biological heterogeneity[J]. The Lancet Neurology, 2009, 8(5): 475-490. DOI:10.1016/S1474-4422(09)70063-8 |
| [30] |
MASUDA T, MOTOMURA M, UTSUGISAWA K, et al. Antibodies against the main immunogenic region of the acetylcholine receptor correlate with disease severity in myasthenia gravis[J]. Journal of Neurology, Neurosurgery, and Psychiatry, 2012, 83(9): 935-940. DOI:10.1136/jnnp-2012-302705 |
| [31] |
刘彦芳, 秦莉, 张达, 等. 槲皮素的生物学活性研究进展[J]. 国际眼科杂志, 2009, 9(5): 941-943. |
| [32] |
ANAND D A, ARULMOLI R, PARASURAMAN S. Overviews of biological importance of quercetin: a bioactive flavonoid[J]. Pharmacognosy Reviews, 2016, 10(20): 84-89. DOI:10.4103/0973-7847.194044 |
| [33] |
周霄楠, 韩超, 宋鹏琰, 等. 木犀草素和槲皮素体外抗炎作用研究[J]. 动物医学进展, 2017, 38(10): 56-61. |
| [34] |
CARULLO G, CAPPELLO A R, FRATTARUOLO L, et al. Quercetin and derivatives: useful tools in inflammation and pain management[J]. Future Medicinal Chemistry, 2017, 9(1): 79-93. DOI:10.4155/fmc-2016-0186 |
| [35] |
KHAN H, ULLAH H, ASCHNER M, et al. Neuroprotective effects of quercetin in Alzheimer's disease[J]. Biomolecules, 2019, 10(1): 59. DOI:10.3390/biom10010059 |
| [36] |
ABDALLA F H, SCHMATZ R, CARDOSO A M, et al. Quercetin protects the impairment of memory and anxiogenic-like behavior in rats exposed to cadmium: possible involvement of the acetylcholinesterase and Na+, K+-ATPase activities[J]. Physiology & Behavior, 2014, 135: 152-167. |
| [37] |
KHAN M T, ORHAN I, SENOL F S, et al. Cholinesterase inhibitory activities of some flavonoid derivatives and chosen xanthone and their molecular docking studies[J]. Chemico-Biological Interactions, 2009, 181(3): 383-389. DOI:10.1016/j.cbi.2009.06.024 |
| [38] |
陈伟明, 熊旭明. 异鼠李素对LPS诱导下THP-1细胞炎症因子释放的影响[J]. 广州医药, 2017, 48(5): 9-13. |
| [39] |
OLENNIKOV D N, KASHCHENKO N I, CHIRIKOVA N K, et al. Isorhamnetin and quercetin derivatives as anti-acetylcholinesterase principles of marigold (Calendula officinalis) flowers and preparations[J]. International Journal of Molecular Sciences, 2017, 18(8): 1685. DOI:10.3390/ijms18081685 |
| [40] |
XU S L, CHOI R C, ZHU K Y, et al. Isorhamnetin, a flavonol aglycone from Ginkgo biloba L., induces neuronal differentiation of cultured PC12 cells: potentiating the effect of nerve growth factor[J]. Evidence-Based Complementary and Alternative Medicine, 2012, 2012: 278273. |
| [41] |
BEG T, JYOTI S, NAZ F, et al. Protective effect of kaempferol on the transgenic Drosophila model of Alzheimer's disease[J]. CNS & Neurological Disorders Drug Targets, 2018, 17(6): 421-429. |
| [42] |
GAO W Q, WANG W, PENG Y, et al. Antidepressive effects of kaempferol mediated by reduction of oxidative stress, proinflammatory cytokines and up-regulation of AKT/β-catenin cascade[J]. Metabolic Brain Disease, 2019, 34(2): 485-494. DOI:10.1007/s11011-019-0389-5 |
| [43] |
曲海新, 袁二伟, 郭卫平, 等. 木犀草素抑制ROS/TXNIP/NLRP3信号通路激活对小鼠急性呼吸窘迫综合征的改善作用[J]. 吉林大学学报(医学版), 2022, 48(3): 676-683. |
| [44] |
刘建春, 张红珍, 李俊莲, 等. 黄芪总皂苷对实验性自身免疫性脑脊髓炎小鼠的神经保护及修复机制研究[J]. 中华中医药杂志, 2021, 36(11): 6700-6704. |
| [45] |
张德敏, 莫雪安. 肌肉特异性酪氨酸激酶抗体、血清阴性能否解释重症肌无力[J]. 中国实用神经疾病杂志, 2006, 9(3): 71-72. |
| [46] |
鲁婷. 基于Meta分析和网络药理学探讨健脾益肾举陷汤干预重症肌无力(痿证)的疗效[D]. 武汉: 湖北中医药大学, 2022.
|
| [47] |
FIORILLO A A, HEIER C R, HUANG Y F, et al. Estrogen receptor, inflammatory, and FOXO transcription factors regulate expression of myasthenia gravis-associated circulating microRNAs[J]. Frontiers in Immunology, 2020, 11: 151. DOI:10.3389/fimmu.2020.00151 |
| [48] |
NING X H, WANG Y T, JING M, et al. Apoptotic caspases suppress type Ⅰ interferon production via the cleavage of cGAS, MAVS, and IRF3[J]. Molecular Cell, 2019, 74(1): 19-31.e7. DOI:10.1016/j.molcel.2019.02.013 |
| [49] |
AHMED D, CASSOL E. Role of cellular metabolism in regulating type Ⅰ interferon responses: implications for tumour immunology and treatment[J]. Cancer Letters, 2017, 409: 20-29. DOI:10.1016/j.canlet.2017.08.037 |
| [50] |
谢琰臣, 孙兆林, 李海峰. 干扰素-γ在重症肌无力发病机制中的作用[J]. 现代神经疾病杂志, 2002, 2(6): 364-367. |
| [51] |
ZHANG G X, NAVIKAS V, LINK H. Cytokines and the pathogenesis of myasthenia gravis[J]. Muscle & Nerve, 1997, 20(5): 543-551. |
| [52] |
严晓艺. 中医药治疗重症肌无力的临床研究现状及疗效评价研究[D]. 北京: 北京中医药大学, 2017.
|
| [53] |
GAJDOS P, CHEVRET S, CLAIR B, et al. Clinical trial of plasma exchange and high-dose intravenous immunoglobulin in myasthenia gravis[J]. Annals of Neurology, 1997, 41(6): 789-796. DOI:10.1002/ana.410410615 |
| [54] |
INGELFINGER F, KRISHNARAJAH S, KRAMER M, et al. Single-cell profiling of myasthenia gravis identifies a pathogenic T cell signature[J]. Acta Neuropathologica, 2021, 141(6): 901-915. DOI:10.1007/s00401-021-02299-y |
| [55] |
MANICOURT D H, TRIKI R, FUKUDA K, et al. Levels of circulating tumor necrosis factor alpha and interleukin-6 in patients with rheumatoid arthritis. Relationship to serum levels of hyaluronan and antigenic keratan sulfate[J]. Arthritis and Rheumatism, 2014, 36(4): 490-499. |
| [56] |
胡万祥. 丝胶蛋白靶向Akt1调控PI3K/Akt/NF-κB信号通路保护STZ致损伤INS-1细胞的机制研究[D]. 承德: 承德医学院, 2022.
|
| [57] |
王紫薇, 蔡榕. 重症肌无力患儿血清炎性介质水平及其与压力性损伤程度的相关性[J]. 安徽医学, 2020, 41(10): 1205-1207. |
| [58] |
LIU Y M, ZHANG H, ZHANG P, et al. Autoimmune regulator expression in thymomas with or without autoimmune disease[J]. Immunology Letters, 2014, 161(1): 50-56. DOI:10.1016/j.imlet.2014.04.008 |
| [59] |
BIAN D L, ZHAO L T, ZHANG X L, et al. Immunohistochemistry biomarker TP53 expression predicts the survival of thymomas[J]. Gland Surgery, 2020, 9(2): 291-299. DOI:10.21037/gs.2020.03.01 |
| [60] |
刘子雄, 潘铁成, 胡敏. 胸腺瘤上皮生长因子受体的表达及其临床意义[J]. 肿瘤, 2003, 23(6): 502-504. |
| [61] |
YOH K, NISHIWAKI Y, ISHⅡ G, et al. Mutational status of EGFR and KIT in thymoma and thymic carcinoma[J]. Lung Cancer, 2008, 62(3): 316-320. DOI:10.1016/j.lungcan.2008.03.013 |
| [62] |
石锋. 胸腺瘤组织中c-myc和PTEN基因的表达[J]. 中国医学创新, 2015, 12(32): 43-46. |
| [63] |
MARCHEVSKY A M, WALTS A E. PD-L1, PD-1, CD4, and CD8 expression in neoplastic and nonneoplastic thymus[J]. Human Pathology, 2017, 60: 16-23. DOI:10.1016/j.humpath.2016.09.023 |
| [64] |
李红岩, 侯振江, 刘建凤, 等. Th17/Treg细胞及其细胞因子在神经系统自身免疫性疾病中的研究进展[J]. 医学综述, 2021, 27(5): 889-895, 900. |
| [65] |
MASUDA M, MATSUMOTO M, TANAKA S, et al. Clinical implication of peripheral CD4+CD25+ regulatory T cells and Th17 cells in myasthenia gravis patients[J]. Journal of Neuroimmunology, 2010, 225(1/2): 123-131. |
| [66] |
HUANG G H, WANG Y Y, CHI H B. Regulation of TH17 cell differentiation by innate immune signals[J]. Cellular & Molecular Immunology, 2012, 9(4): 287-295. |
| [67] |
郭鹏, 张含, 李长菲, 等. Toll样受体通路调节Tregs功能的研究进展[J]. 生物工程学报, 2020, 36(9): 1701-1712. |
| [68] |
CUFI P, DRAGIN N, WEISS J M, et al. Implication of double-stranded RNA signaling in the etiology of autoimmune myasthenia gravis[J]. Annals of Neurology, 2013, 73(2): 281-293. DOI:10.1002/ana.23791 |
| [69] |
ARICHA R, FEFERMAN T, FUCHS S, et al. Ex vivo generated regulatory T cells modulate experimental autoimmune myasthenia gravis[J]. Journal of Immunology, 2008, 180(4): 2132-2139. DOI:10.4049/jimmunol.180.4.2132 |
| [70] |
TSAI J J, WANG H C, CHIU C L, et al. The effect of Dermatophagoides pteronyssinus group 7 allergen (Der p 7) on dendritic cells and its role in T cell polarization[J]. Immunobiology, 2016, 221(11): 1319-1328. DOI:10.1016/j.imbio.2016.04.002 |
| [71] |
邓捷文, 郭振红. C型凝集素受体CLR对树突状细胞功能的调控效应[J]. 中国免疫学杂志, 2018, 34(5): 794-801. |
2. Department of Gastroenterology, The First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510000 China
 2024, Vol. 41
2024, Vol. 41