文章信息
- 李娟, 石海平, 李维民.
- LI Juan, SHI Haiping, LI Weimin.
- 桃叶珊瑚苷调节RhoA/ROCK信号通路对胶质母细胞瘤细胞活力和上皮间质转化的影响
- Impacts of aucubin on viability and epithelial mesenchymal transformation of glioblastoma cells by regulating RhoA/ROCK signaling pathway
- 天津中医药, 2024, 41(3): 386-392
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(3): 386-392
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.03.19
-
文章历史
- 收稿日期: 2023-09-21
2. 遂宁市中心医院神经中心一病区, 遂宁 629000
胶质母细胞瘤(GBM)是中枢神经系统最常见恶性肿瘤,是胶质瘤中侵袭性最强的类型,预后较差,治疗方案较少[1]。上皮间质转化(EMT)使细胞获得高迁移和侵袭能力,是肿瘤恶性进展的关键步骤,由此参与GBM的发生发展,还会导致GBM耐药性的产生[2]。目前,GBM的主要治疗方法包括手术、化疗、放疗和联合治疗,然而由于其强侵袭性和耐药性,相当大比例的GBM肿瘤会复发,总生存率仍然很低。因此,发现新的治疗药物和探索新的干预靶点可能对接受GBM治疗的患者具有重要意义。桃叶珊瑚苷(AU)是一种环烯醚萜化合物,具有抗氧化、抗衰老、抗炎、抗纤维化、抗癌、神经保护等多种生物活性,其结构式见图 1[3]。已有研究发现,AU发挥对乳腺癌[4]、肝细胞癌[5]等多种肿瘤细胞的抑制作用。Ras同源基因家族成员A(RhoA)是Rho家族中研究最多的三磷酸鸟苷(GTP)酶成员之一,以激活GTP的形式激活下游效应分子,影响细胞骨架。Rho相关卷曲螺旋蛋白激酶(ROCK)是RhoA活性的主要介导者,ROCK的激活可通过调节肌球蛋白轻链激酶磷酸化,导致肌动蛋白骨架重排并伴随细胞迁移,最终导致EMT的发生[6]。RhoA/ROCK信号通路与多种肿瘤发生发展有关,其中抑制GBM中RhoA/ROCK信号传导可抑制肿瘤细胞的迁移和侵袭以及肌动蛋白重排[7]。但AU对GBM细胞活力和EMT的影响,以及其对RhoA/ROCK信号通路的调控作用尚不清楚,本研究对此进行探讨。
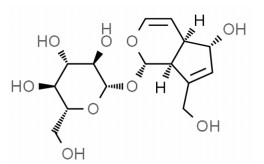
|
| 图 1 AU结构式 Fig. 1 AU structural formula |
人GBM细胞系:T98、U251、LN299、U87购自美国菌种保藏中心细胞库。24只雌性裸鼠BALB/c小鼠,4周龄,体质量为15~18 g,购自武汉贝赛模式生物科技有限公司,生产许可证号:SCXK(鄂)2022-0029。
1.1.2 主要试剂与仪器AU(纯度 > 95%,成都曼思特生物科技有限公司);Y-27632(美国MedChemExpress公司);Dulbecco改良的Eagle’s培养基(DEME)高糖培养基(北京伊塔生物科技有限公司);细胞计数器试剂盒(CCK-8)试剂盒(上海酶研生物科技有限公司);膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)试剂盒、二抗(武汉伊莱瑞特生物科技公司);Transwell小室(康宁生命科学有限公司);Matrigel胶(北京索莱宝科技有限公司);一抗基质金属蛋白酶(MMP)2、MMP9、波形蛋白(Vimentin)、上皮钙黏蛋白(E-cadherin)、神经钙黏蛋白(N-cadherin)、RhoA、ROCK1、ROCK2和甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Abcam公司)。酶标仪(瑞士Tecan公司);流式细胞仪(德国Miltenyi Biotec公司);显微镜(日本Olympus公司);电泳仪(美国Bio-rad公司)。
1.2 方法 1.2.1 细胞培养将T98、U251、LN299、U87细胞置于含有10%胎牛血清(FBS)和青霉素-链霉素的DEME高糖培养基中,在37 ℃和5% CO2的培养箱中培养48 h,待细胞融合至70%以上时,胰蛋白酶消化。
1.2.2 CCK-8检测细胞活力将T98、U251、LN299、U87细胞以4×103个/孔接种到96孔板中,培养24 h后用0、2.5、5、10、25、50、100 μmol/L浓度的AU处理,每孔加入10 μL CCK-8溶液37 ℃孵育1 h,用酶标仪在450 nm波长处测量吸光度,计算细胞活力。
1.2.3 细胞分组将U87细胞随机分为对照组、AU低浓度组、AU中浓度组、AU高浓度组、Y-27632(ROCK抑制剂)组、AU高浓度+Y-27632组。其中AU低、中、高浓度组参照1.2.2中的结果,选用10、25、50 μmol/L浓度的AU处理;Y-27632组用5 mmol/L浓度的Y-27632处理[8];AU高浓度+Y-27632组用50 μmol/L浓度的AU和5 mmol/L浓度的Y-27632共同处理。
1.2.4 各组细胞活力测定将各组U87细胞加入96孔板中,每孔加入10 μL CCK-8溶液37 ℃孵育1 h,于450 nm波长处测量吸光度,计算细胞活力。
1.2.5 各组细胞凋亡情况将各组U87细胞重悬于100 μL结合缓冲液中,按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书,加入5 μL Annexin V-FITC和5 μL PI,混匀,室温染色15 min,上流式细胞仪检测细胞凋亡。
1.2.6 各组细胞迁移和侵袭将各组U87细胞1×105个/mL(100 μL)用含0.5% FBS的DMEM培养基接种于24孔板中铺有Matrigel胶的Transwell上室,下室加入含10% FBS的DMEM培养基,培养24 h后,用棉签擦去上室的细胞。将贴壁细胞用2%多聚甲醛固定,然后用0.1%结晶紫溶液染色,迁移实验与上述步骤相似,Transwell小室未涂Matrigel胶。每个小室随机选取5个视野,在显微镜下计数迁移、侵袭细胞数量并拍照。
1.2.7 蛋白免疫印迹法(Western Blot)检测蛋白表达将各组U87细胞在RIPA缓冲液中裂解、离心,定量蛋白浓度,分离并转移到聚偏二氟乙烯膜上,5%无脂奶粉封闭,加入一抗MMP2、MMP9、N-cadherin、Vimentin、E-cadherin、RhoA、ROCK1、ROCK2和GAPDH(1∶1 000)进行检测。用辣根过氧化物酶标记的二抗检测结合的抗体,并使用增强的化学发光试剂盒进行可视化,采用Image J软件分析数据。
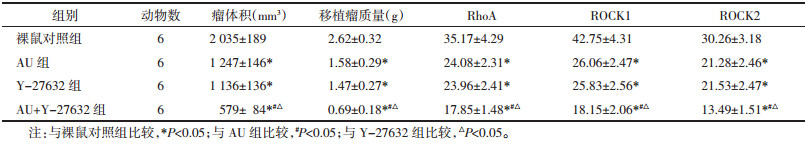
1.2.8 裸鼠移植瘤实验将BALB/c小鼠于恒温23 ℃、湿度60%、12 h光暗循环环境下适应性饲养1周,自由进食和饮水。将5×106个U87细胞注射于小鼠背部皮下,随机分为裸鼠对照组、AU组、Y-27632组、AU+Y-27632组,每组6只。注射后第7天,AU组小鼠腹腔注射AU 10 mg/kg[5],Y-27632组小鼠腹腔注射Y-27632 10 mg/kg[9],AU+Y-27632组腹腔注射AU 10 mg/kg和Y-27632 10 mg/kg,每日1次,连续2周。处死小鼠切除肿瘤组织,测量肿瘤质量与体积,免疫组化法检测移植瘤组织RhoA、ROCK1、ROCK2蛋白表达。
1.3 统计学方法数据使用GraphPad 8.0进行统计分析,所有数据均以均数±标准差(x±s)表示。多组均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05为差异具有统计学意义。
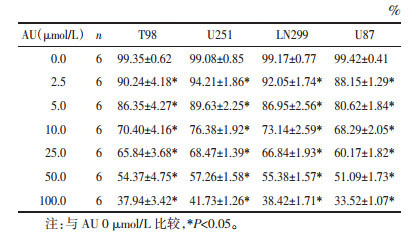
2 结果 2.1 AU对GBM细胞活力的影响CCK-8结果显示,与0 μmol/L比较,T98、U251、LN299、U87细胞活力随着AU浓度的升高而逐渐降低(P < 0.05),见表 1。半抑制浓度(IC50)分别为76.47、81.37、78.25、70.09 μmol/L。因此,选择U87作为后续实验细胞,选择浓度10、25、50 μmol/L作为AU后续实验浓度。见表 1。
|
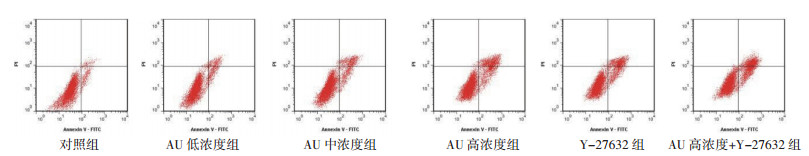
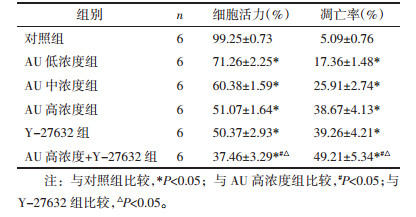
与对照组比较,AU低、中、高浓度组和Y-27632组U87细胞活力显著下降,凋亡率显著升高(P < 0.05),其中高浓度AU和Y-27632组共同处理的U87细胞活力和凋亡率变化更显著(P < 0.05)。见图 2和表 2。
|
| 图 2 AU对U87细胞凋亡的影响 Fig. 2 Effect of AU on apoptosis of U87 cell |
|
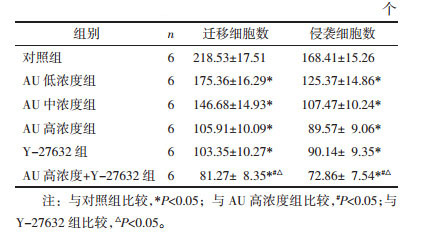
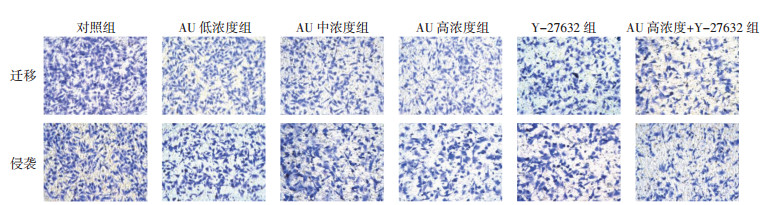
与对照组比较,AU低、中、高浓度组和Y-27632组迁移和侵袭细胞数显著下降(P < 0.05),其中高浓度AU和Y-27632组共同处理的细胞迁移和侵袭细胞数下降更显著(P < 0.05)。见图 3和表 3。
|
| 图 3 AU对U87细胞迁移、侵袭的影响(×200) Fig. 3 Effect of AU on migration and invasion of U87 cell (×200) |
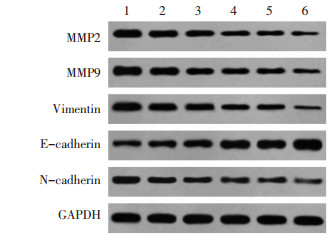
与对照组比较,AU低、中、高浓度组和Y-27632组MMP2、MMP9、N-cadherin、Vimentin表达显著下降,E-cadherin表达显著上升(P < 0.05),其中高浓度AU和Y-27632组共同处理的U87细胞蛋白表达变化更显著(P < 0.05)。见图 4和表 4。
|
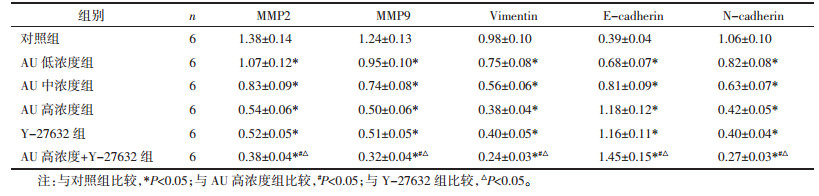
| 注:1,对照组;2,AU低浓度组;3,AU中浓度组;4,AU高浓度组;5,Y-27632组;6,AU高浓度+Y-27632组。 图 4 AU对U87细胞中MMP2、MMP9、Vimentin、E-cadherin、N-cadherin蛋白表达的影响 Fig. 4 Effect of AU on expression of MMP2, MMP9, Vimentin, E-cadherin, N-cadherin in U87 cell |
|
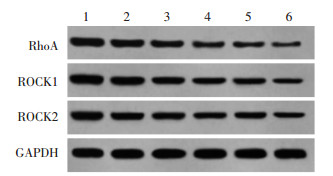
与对照组比较,AU低、中、高浓度组和Y-27632组RhoA、ROCK1、ROCK2蛋白表达显著下降(P < 0.05),其中高浓度AU和Y-27632组共同处理的U87细胞RhoA/ROCK信号通路蛋白下降更显著(P < 0.05)。见图 5和表 5。
|
| 注:1,对照组;2,AU低浓度组;3,AU中浓度组;4,AU高浓度组;5,Y-27632组;6,AU高浓度+Y-27632组。 图 5 AU对U87细胞中RhoA、ROCK1、ROCK2蛋白表达的影响 Fig. 5 Effect of AU on expression of RhoA, ROCK1, ROCK2 in U87 cell |
|
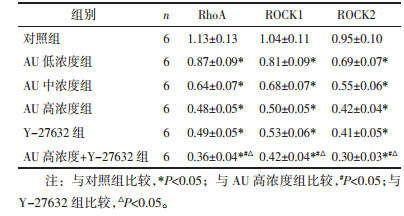
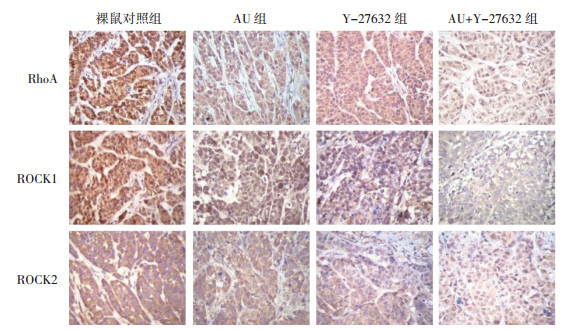
与裸鼠对照组比较,AU组和Y-27632组移植瘤质量、体积和RhoA、ROCK1、ROCK2蛋白表达显著降低(P<0.05),其中AU+Y-27632组降低更显著(P<0.05)。见图 6、图 7和表 6。
|
| 图 6 AU对裸鼠移植瘤生长情况的影响 Fig. 6 Effect of AU on the growth of transplanted tumor in nude mice |
|
| 图 7 AU对裸鼠肿瘤组织RhoA、ROCK1、ROCK2表达的影响(×200) Fig. 7 Effect of AU on RhoA, ROCK1 and ROCK2 expression in tumor tissue of nude mice(×200) |
|
GBM是成人最常见的原发性脑肿瘤之一,约占中枢神经系统原发性肿瘤的50%~70%,由治疗后易复发导致预后不良[10]。因此,深入了解GBM的恶性行为及其分子机制是寻求胶质瘤有效治疗的关键研究。
AU作为从杜仲、车前草、地黄等植物中提取出的化合物,广泛分布于多个器官,表现出抗肿瘤细胞增殖、侵袭和减少化学毒性的作用[11]。据报道,AU能够抑制肺癌细胞增殖、侵袭[12]。AU还能抑制乳腺癌肿瘤生长,缓解乳腺癌引起的肠道紊乱[4],并通过抑制肝细胞癌中程序性死亡配体1表达来增强顺铂的抗肿瘤活性[5]。因此,猜测AU是作为治疗GBM的潜在药物。本研究发现,AU处理后GBM细胞活力、迁移、侵袭能力显著下降,凋亡率上升,移植瘤质量、体积下降。提示AU能够抑制GBM细胞增殖、迁移和侵袭,对GBM有治疗作用。增殖和转移是肿瘤发展和进展的重要因素,EMT是加速癌症转移的重要原因[13]。肿瘤细胞的EMT样过程包括E-cadherin等细胞黏附蛋白的减少,N-cadherin、Vimentin等间质标志物的升高,导致细胞间黏附减少和极性丧失,促进肿瘤的侵袭和迁移[14-15]。因此,抑制GBM细胞的EMT过程与靶向胶质瘤的治疗相结合可能是其成功治疗的关键。
多项研究表明,间充质转化、细胞运动和细胞外基质重塑会促进GBM的侵袭和转移,与GBM的预后不良密切相关[16]。MMPs能通过降解细胞外基质促进肿瘤转移,MMPs对多种恶性肿瘤的侵袭和转移至关重要,MMP2、MMP9已被证明可以促进GBM的增殖和转移[17-18]。因此,为了改善GBM患者的预后,有效抑制GBM的侵袭和转移至关重要。本研究发现,AU能够抑制MMP2、MMP9、N-cadherin、Vimentin蛋白表达,促进E-cadherin表达,提示AU可能通过抑制GBM细胞的迁移、侵袭和EMT,抑制GBM进展。
细胞迁移伴随着微丝细胞骨架的重塑,Rho GTPase家族在调节与细胞迁移相关的细胞骨架重构方面起着至关重要的作用[19]。RhoA激活ROCK(包括ROCK1、ROCK2),提高肌球蛋白轻链磷酸化,增加肌球蛋白活化,进而促进动作电位聚合和细胞运动,参与细胞骨架蛋白、细胞形态、迁移以及细胞中各种增殖和转录活性的调节[20-21]。RhoA/ROCK信号通路参与调节癌症的增殖和迁移,激活RhoA/ROCK1信号通路,能够促进直肠癌细胞迁移[22];激活RhoA/ROCK途径,能够促进非小细胞肺癌的增殖和迁移能力[23]。此外,RhoA/ROCK信号通路参与GBM的发生发展,研究表明,GBM细胞通过激活RhoA/ROCK途径侵入周围组织,能够促进癌细胞转移[24]。以上研究表明,RhoA/ROCK信号通路的激活可能是肿瘤发病的关键机制。因此,抑制GBM中RhoA/ROCK1信号通路的激活可能是治疗GBM的关键机制。本研究结果显示,Y-27632组RhoA、ROCK1、ROCK2蛋白表达下降,提示RhoA/ROCK信号通路参与GBM细胞增殖、迁移、侵袭、EMT及肿瘤生长。而不同浓度AU处理后GBM细胞及肿瘤组织中RhoA、ROCK1、ROCK2蛋白表达下降,猜测AU可能通过抑制RhoA/ROCK信号通路,抑制GBM的发生发展。为进一步证明此结论,本研究在AU的基础上与ROCK抑制剂Y-27632联合处理GBM细胞及裸鼠移植瘤,发现两者联合处理GBM细胞的增殖、迁移和侵袭进一步下降,凋亡进一步升高,对肿瘤的抑制更显著。因此,AU可能通过抑制RhoA/ROCK信号通路抑制GBM细胞的增殖、迁移、侵袭、EMT及移植瘤生长。
综上所述,AU能抑制GBM细胞活力、迁移侵袭和EMT,促进细胞凋亡,其作用机制可能与抑制RhoA/ROCK信号通路有关。本研究为治疗GBM提供了新的方法和思路,但AU对除本研究中的GBM细胞的影响及药物与通路之间的具体关系还需进一步研究。
| [1] |
MINNITI G, NIYAZI M, ALONGI F, et al. Current status and recent advances in reirradiation of glioblastoma[J]. Radiation Oncology, 2021, 16(1): 36. DOI:10.1186/s13014-021-01767-9 |
| [2] |
SETLAI B P, HULL R, REIS R M, et al. MicroRNA interrelated epithelial mesenchymal transition(EMT) in glioblastoma[J]. Genes, 2022, 13(2): 244. DOI:10.3390/genes13020244 |
| [3] |
ZENG X C, GUO F, OUYANG D S. A review of the pharmacology and toxicology of aucubin[J]. Fitoterapia, 2020, 140: 104443. DOI:10.1016/j.fitote.2019.104443 |
| [4] |
SHAO M, KUANG Z Y, WANG W L, et al. Aucubin exerts anticancer activity in breast cancer and regulates intestinal microbiota[J]. Evidence-Based Complementary and Alternative Medicine, 2022, 2022: 4534411. |
| [5] |
GAO Z X, ZHANG Z S, QIN J, et al. Aucubin enhances the antitumor activity of cisplatin through the inhibition of PD-L1 expression in hepatocellular carcinoma[J]. Phytomedicine, 2023, 112: 154715. DOI:10.1016/j.phymed.2023.154715 |
| [6] |
DOKUMACIOGLU E, DUZCAN I, ISKENDER H, et al. RhoA/ROCK-1 signaling pathway and oxidative stress in coronary artery diseasepatients[J]. Brazilian Journal of Cardiovascular Surgery, 2022, 37(2): 212-218. |
| [7] |
YU G Y, WANG Z T, ZENG S L, et al. Paeoniflorin inhibits hepatocyte growth factor-(HGF-) induced migration and invasion and actin rearrangement via suppression of c-met-mediated RhoA/ROCK signaling in glioblastoma[J]. BioMed Research International, 2019, 2019: 9053295. |
| [8] |
BARRETO N, CABALLERO M, BONFANTI A P, et al. Spider venom components decrease glioblastoma cell migration and invasion through RhoA-ROCK and Na+/K+-ATPase β2:potential molecular entities to treat invasive brain cancer[J]. Cancer Cell International, 2020, 20(1): 576. DOI:10.1186/s12935-020-01643-8 |
| [9] |
WANG W J, HE Q J, LI C E, et al. Research on the mechanism and prevention of hypertension caused by apatinib through the RhoA/ROCK signaling pathway in a mouse model of gastric cancer[J]. Frontiers in Cardiovascular Medicine, 2022, 9: 873829. DOI:10.3389/fcvm.2022.873829 |
| [10] |
SCHAFF L R, MELLINGHOFF I K. Glioblastoma and other primary brain malignancies in adults: a review[J]. JAMA, 2023, 329(7): 574-587. DOI:10.1001/jama.2023.0023 |
| [11] |
KARTINI K, IRAWAN M A, SETIAWAN F, et al. Characteristics, isolation methods, and biological properties of aucubin[J]. Molecules, 2023, 28(10): 4154-4176. DOI:10.3390/molecules28104154 |
| [12] |
梅凡, 姚峰, 朱磊, 等. 桃叶珊瑚苷对肺癌细胞增殖、侵袭的抑制作用及对TGF-β1/SOX7通路的影响[J]. 湖北中医药大学学报, 2021, 23(4): 10-14. |
| [13] |
LUO Y, CAO H, LEI C, et al. ST6GALNAC1 promotes the invasion and migration of breast cancer cells via the EMT pathway[J]. Genes Genomics, 2023, 45(11): 1367-1376. DOI:10.1007/s13258-023-01445-y |
| [14] |
PU B, ZHANG X, YAN T F, et al. MICAL2 promotes proliferation and migration of glioblastoma cells through TGF-β/p-Smad2/EMT-like signaling pathway[J]. Frontiers in Oncology, 2021, 11: 735180. DOI:10.3389/fonc.2021.735180 |
| [15] |
WANG Z, LI Y, LIU M, et al. 3BDO inhibits the proliferation, epithelial-mesenchymal transition (EMT), and stemness via suppressing survivin in human glioblastoma cells[J]. J Cancer, 2022, 13(4): 1203-1213. DOI:10.7150/jca.66674 |
| [16] |
KHAN A B, LEE S, HARMANCI A S, et al. CXCR4 expression is associated with proneural-to-mesenchymal transition in glioblastoma[J]. International Journal of Cancer, 2023, 152(4): 713-724. DOI:10.1002/ijc.34329 |
| [17] |
SHI G H, ZHANG Z. Rap2B promotes the proliferation and migration of human glioma cells via activation of the ERK pathway[J]. Oncology Letters, 2021, 21(4): 314. DOI:10.3892/ol.2021.12575 |
| [18] |
YUN E J, KIM D, HSIEH J T, et al. Stanniocalcin 2 drives malignant transformation of human glioblastoma cells by targeting SNAI2 and matrix metalloproteinases[J]. Cell Death Discov, 2022, 8(1): 308-315. DOI:10.1038/s41420-022-01090-6 |
| [19] |
YANG Y T, LI L Y, HE H, et al. Numb inhibits migration and promotes proliferation of colon cancer cells via RhoA/ROCK signaling pathway repression[J]. Experimental Cell Research, 2022, 411(2): 113004. DOI:10.1016/j.yexcr.2021.113004 |
| [20] |
MAO Y, JIANG X, GUO P, et al. ZXDC enhances cervical cancer metastasis through IGF2BP3-mediated activation of RhoA/ROCK signaling[J]. iScience, 2023, 26(8): 107447. DOI:10.1016/j.isci.2023.107447 |
| [21] |
LU W Z, CHEN Z W, WEN J Y. RhoA/ROCK signaling pathway and astrocytes in ischemic stroke[J]. Metabolic Brain Disease, 2021, 36(6): 1101-1108. DOI:10.1007/s11011-021-00709-4 |
| [22] |
ZHANG H, XU C X, JIANG F, et al. A three-genes signature predicting colorectal cancer relapse reveals LEMD1 promoting CRC cells migration by RhoA/ROCK1 signaling pathway[J]. Frontiers in Oncology, 2022, 12: 823696. DOI:10.3389/fonc.2022.823696 |
| [23] |
XU N, LIU F L, WU S D, et al. CHD4 mediates proliferation and migration of non-small cell lung cancer via the RhoA/ROCK pathway by regulating PHF5A[J]. BMC Cancer, 2020, 20(1): 262. DOI:10.1186/s12885-020-06762-z |
| [24] |
VIDAL V, GUTIERREZ O, TALAMILLO A, et al. Glioblastoma invasion factor ODZ1 is induced by microenvironmental signals through activation of a Stat3-dependent transcriptional pathway[J]. Scientific Reports, 2021, 11(1): 16196. DOI:10.1038/s41598-021-95753-6 |
2. Department of First Ward of Nerve Center, Suining Central Hospital, Suining 629000, China
 2024, Vol. 41
2024, Vol. 41