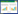文章信息
- 卫博文, 刘维, 张淑敏, 等.
- WEI Bowen, LIU Wei, ZHANG Shumin, et al.
- 白芍总苷治疗原发性干燥综合征的疗效及安全性Meta分析
- Meta-analysis of efficacy and safety of primary Sjögren's syndrome treated by total glucosides of paeony
- 天津中医药, 2024, 41(4): 458-466
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 458-466
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.12
-
文章历史
- 收稿日期: 2023-11-28
2. 国家中医针灸临床医学研究中心, 天津 300193
原发性干燥综合征(pSS)是一种慢性全身性自身免疫性疾病,其病理特征是外分泌腺的淋巴细胞浸润,临床上典型症状为眼干和口干、疲劳和关节疼痛[1]。pSS的全球发病率和患病率分别为每10万人6.92例[95%CI(4.98,8.86)]和每10万人60.82例[95%CI(43.69,77.94)][2],在中国的患病率约为0.29%~0.77%[3]。pSS的发病机制尚不明确,但一般认为外分泌腺B淋巴细胞和T淋巴细胞浸润是pSS的主要特征[4],其引起的外分泌腺特征、关节疼痛和疲劳等症状,可能导致淋巴瘤等严重并发症[5]。因此,探索pSS的中西医结合防治方案对改善患者干燥症状、缓解疲劳和关节疼痛、提高生活质量具有重要意义。
白芍总苷(TGP)是从芍药的根茎中提取的活性化合物,其主要成分含有芍药苷、芍药素、白芍药苷、羟基芍药苷和苯甲酰芍药苷[6],具有镇痛、抗炎、免疫调节和抗氧化功能[7-8]。近年来,TGP被广泛用于治疗pSS,已有研究[9]表明,TGP可以缓解其主要症状,改善外分泌腺功能,并能够调节Th1/Th2细胞因子平衡,降低肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)等炎症因子的表达水平。本研究系统评价TGP治疗pSS的疗效及安全性,为临床开发及使用TGP治疗pSS提供循证医学证据。
2019年Feng等[10]报告了1项关于TGP治疗pSS的有效性和安全性的系统评价。然而,研究仅纳入了2018年11月之前的文章,包括1篇干预措施不明确的试验[11]。因此,本研究旨在根据最新发表的文章更新和重新系统地评价TGP治疗pSS的有效性和安全性。
1 资料与方法 1.1 纳入标准 1.1.1 研究类型所有公开发表的TGP治疗pSS的随机对照试验(RCTs),无论是否采用盲法,语种限中、英文。
1.1.2 研究对象符合2002年修订的pSS国际分类(诊断)标准的患者[12]。患者性别、年龄及病程等无限制,无合并疾病。
1.1.3 干预措施以验证TGP治疗pSS有效性为主要目的,治疗组TGP单用或联用西药;对照组单用西药或空白对照,2组西药保持一致。疗程至少3个月。
1.1.4 结局指标主要结局指标:1)Schirmer试验;2)唾液流率。次要结局指标:1)类风湿因子(RF);2)C反应蛋白(CRP);3)红细胞沉降率(ESR);4)血清γ球蛋白;5)ESSPRI;6)免疫球蛋白(Ig)G;7)IgA;8)IgM;9)有效率;10)不良反应。
1.2 排除标准诊断不明确、或无相关结局指标的研究、会议论文摘要;数据无法有效提取或重复发表的研究;设计不严谨的研究。
1.3 检索策略计算机检索中国知网(CNKI)、维普数据库(VIP)、中国生物医学文献数据库(CBM)、万方数据库(Wanfang)、PubMed、EMBASE、Cochrane,检索时限均从建库至2022年10月29日。中文检索词包括“白芍总苷”“白芍总甙”“帕夫林”“干燥综合征”“舍格伦综合征”,英文检索词包括"total glucosides of paeony""TGP""Pafulin""Pa Fu Lin" "Baishao Zonggan""Bai Shao Zong Gan""Baishaozonggan""Baishao Zongdai""Bai Shao Zong Dai" "Baishaozongdai""paeoniflorin""Sjögren's syndrome""SS""Sjogrens Syndrome""Syndrome,Sjogren's""Sjogren Syndrome""Sicca Syndrome""Syndrome,Sicca"。本研究采用主题词和同义词相结合的方式,根据各数据库特征进行检索,并追溯纳入研究的参考文献,以补充获取相关文献。
1.4 文献筛选及资料提取2名研究者独立进行文献筛选并交叉核对,若有分歧,加入第3名研究者讨论解决。完成文献筛选后,提取文章信息:1)纳入文章的基本信息:文献题目、第一作者及发表年份等;2)研究对象特征:诊断标准、患者年龄、性别比、基线可比性等;3)干预措施:治疗组和对照组药物、剂量、疗程等;4)结局指标及测量数据:Schirmer试验、唾液流率、不良反应等。
1.5 纳入研究的方法学质量与偏倚风险评价2名评价者按照Cochrane Handbook5.3.0[13]偏倚风险评估工具独立对纳入文献的质量进行评估,若有分歧,加入第3名研究者讨论解决。评价内容包括:1)随机方法;2)分配隐藏;3)受试者盲法;4)测量盲法;5)数据完整性;6)选择性报告;7)其他偏倚等,对每个条目按“low risk”“unclear risk”“high risk”进行评判。
1.6 统计分析采用RevMan5.4软件对纳入研究进行Meta分析,以评估TGP单用或联用西药治疗pSS的差异。二分类数据采用相对危险度(RR),连续性变量采用标准均数差(MD),设置95%置信区间(CI)。当研究间异质性低(I2≤50%)时,采用固定效应模型;当研究间异质性较高(I2 > 50%)时,进行亚组分析和敏感性分析,尽量寻找异质性来源,并采用随机效应模型。
2 结果 2.1 文献筛选流程及结果经检索,共获得368篇相关文献,剔除重复后根据纳排标准,最终纳入10篇[14-23]。文献筛选流程见图 1。
|
| 图 1 文献筛选流程 Fig. 1 Article screening process |
10项RCTs共纳入受试者874例,其中治疗组504例,TGP单用或联用硫酸羟氯喹(HCQ)或甲氨蝶呤(MTX)等免疫抑制剂(IS)治疗;对照组370例,予安慰剂(PBO)或IS治疗,疗程3~9个月,有4项[14-15, 19-20]研究获得相关医院伦理审批,9项[14-18, 20-23]研究报告了不良事件。其中纳入研究基本信息见表 1。
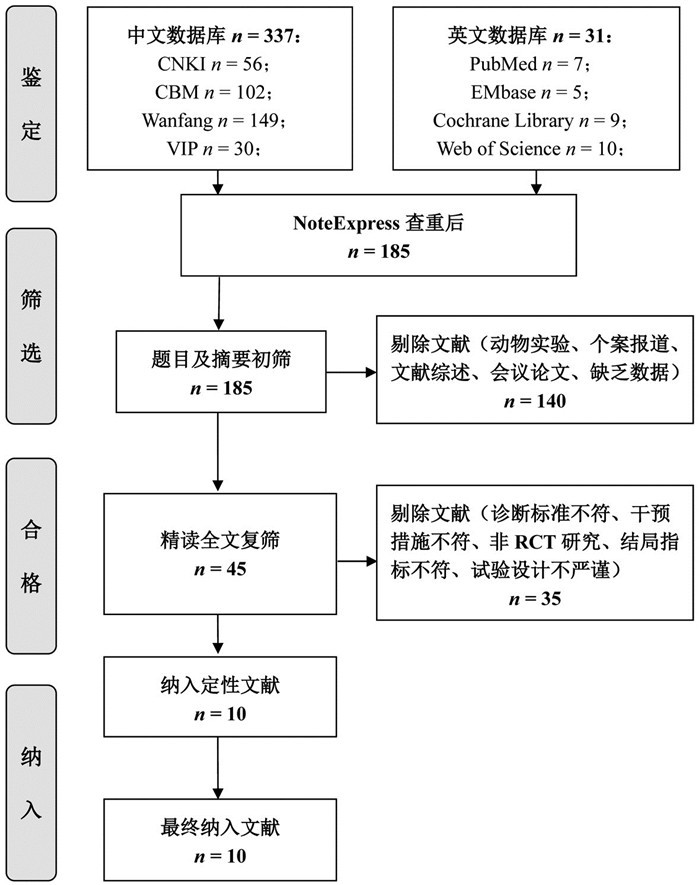
纳入的10项RCTs均提及随机,其中2项[19-20]采用随机数字表法,其余项未说明随机方法;3项研究[14-15, 22]提及分配隐藏和盲法;3项研究[15, 17, 23]出现病例脱落情况,2项研究[14, 19]未报告主要结局指标,偏倚风险评估结果见图 2。
|
| 图 2 纳入研究产生偏倚风险的项目所占比例 Fig. 2 Percentage of projects included articles that produced a risk of bias |
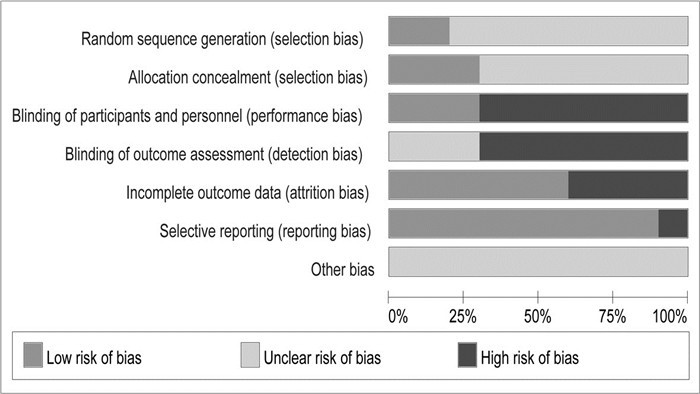
2篇文献[14, 22]报告了Schirmer试验,共334例患者。研究间同质性较好(P=0.54,I2=0%),故采用固定效应模型。结果显示,与PBO相比,TGP治疗能明显提高患者的泪液分泌功能,差异有统计学意义[MD=1.31,95%CI(0.74,1.88),P < 0.000 01],见图 3A。
|
| 图 3 TGP与PBO的森林图(随访减去基线) Fig. 3 Forest plots of TGP vs. PBO(follow-up minus baseline) |
3篇文献[14-15, 22]报告了唾液流率,共387例患者。研究间同质性一般(P=0.13,I2=50%),故采用固定效应模型。结果显示,与PBO相比,TGP治疗能明显提高患者的唾液流率,差异有统计学意义[MD=0.12,95%CI(0.02,0.21),P=0.02],见图 3B。
2.4.3 ESR2篇文献[14-15]报告了ESR,共357例患者。研究间同质性较好(P=0.92,I2=0%),故采用固定效应模型。结果显示,与PBO相比,TGP治疗能明显降低患者的ESR,差异有统计学意义[MD=-7.30,95%CI(-16.64,1.24),P=0.000 4],见图 3C。
2.4.4 ESSPRI3篇文献[14-15, 22]报告了ESSPRI,共387例患者。研究间同质性较差(P=0.005,I2=81%),故采用随机效应模型。结果显示,与PBO相比,TGP治疗能明显降低患者的ESSPRI,差异有统计学意义[MD=0.19,95%CI(-0.51,0.89),P=0.59],见图 3D。
2.4.5 不良反应3篇文献[14-15, 22]报告了不良反应,共387例患者。研究间同质性较好(P=0.64,I2=0%),故采用固定效应模型。结果显示,与PBO相比,TGP治疗能明显提高患者的不良反应发生率,差异有统计学意义[MD=5.19,95%CI(1.93,13.93),P=0.001),见图 3E。
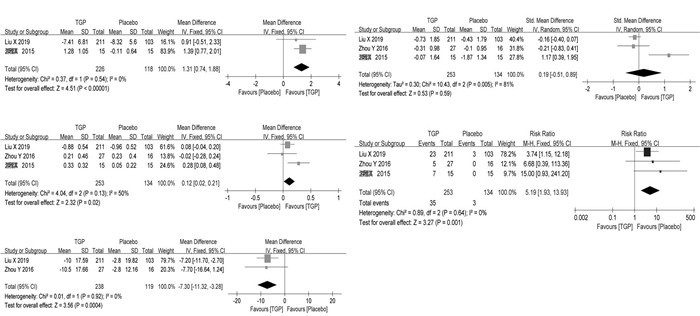
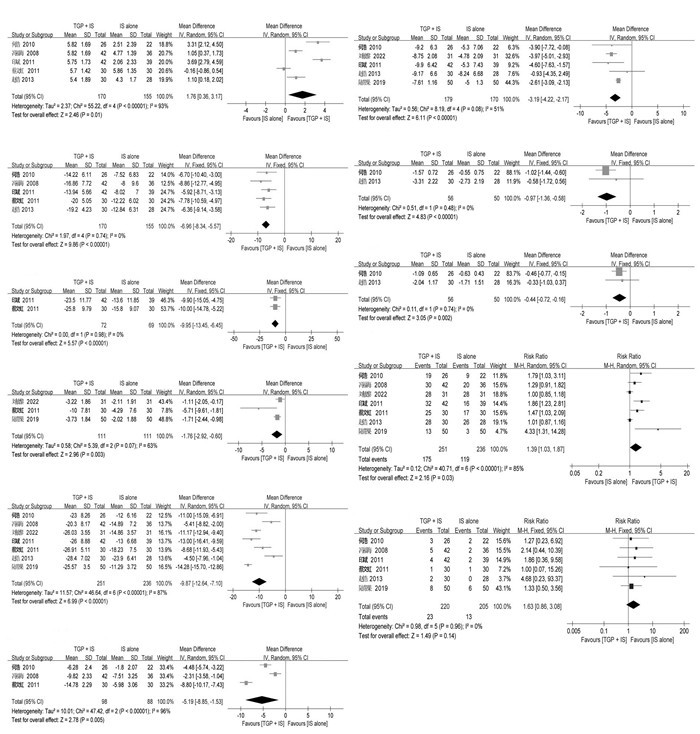
2.5 TGP+IS与单独IS的Meta分析 2.5.1 Schirmer试验5篇文献[16-18, 21, 23]报告了Schirmer试验,共325例患者。研究间同质性较差(P < 0.000 01,I2=93%),故采用随机效应模型。结果显示,与单用IS相比,TGP治疗能明显提高患者的泪液分泌功能,差异有统计学意义[MD=1.10,95%CI(0.36,3.17),P=0.01],见图 4A。
|
| 图 4 TGP+IS与单独IS的森林图(随访减去基线) Fig. 4 Forest plots of TGP+IS vs. IS alone(follow-up minus baseline) |
5篇文献[16-18, 21, 23]报告了唾液流率,共325例患者。研究间同质性较好(P=0.74,I2=0%),故采用固定效应模型。结果显示,与单用IS相比,TGP治疗能明显提高患者的唾液流率,差异有统计学意义[MD=-6.96,95%CI(-8.34,-5.57),P < 0.000 01],见图 4B。
2.5.3 RF2篇文献[16, 21]报告了RF,共141例患者。研究间同质性较好(P=0.98,I2=0%),故采用固定效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的RF,差异有统计学意义[MD=-9.95,95%CI(-13.45,-6.45),P < 0.000 01],见图 4C。
2.5.4 CRP3篇文献[16, 19-20]报告了CRP,共222例患者。研究间同质性较差(P=0.07,I2=63%),故采用随机效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的CRP,差异有统计学意义[MD=-1.76,95%CI(-2.92,-0.60),P=0.003],见图 4D。
2.5.5 ESR7篇文献[16-21, 23]报告了ESR,共487例患者。研究间同质性较差(P < 0.000 01,I2=87%),故采用随机效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的ESR,差异具有统计学意义[MD=-9.87,95%CI(-12.64,-7.10),P < 0.000 01],见图 4E。
2.5.6 血清γ球蛋白3篇文献[16-18]报告了血清γ球蛋白,共186例患者。研究间同质性较差(P < 0.000 01,I2=96%),故采用随机效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的血清γ球蛋白,差异具有统计学意义[MD=-5.19,95%CI(-8.85,-1.53),P=0.005],见图 4F。
2.5.7 IgG5篇文献[18-21, 23]报告了IgG,共349例患者。研究间同质性较差(P=0.08,I2=51%),故采用随机效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的IgG,差异有统计学意义[MD=-3.19,95%CI(-4.22,-2.17),P < 0.000 01],见图 4G。
2.5.8 IgA2篇文献[18, 23]报告了IgA,共106例患者。研究间同质性较好(P=0.48,I2=0%),故采用固定效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的IgA,差异有统计学意义[MD=-0.97,95%CI(-1.36,-0.58),P < 0.000 01],见图 4H。
2.5.9 IgM2篇文献[18, 23]报告了IgM,共106例患者。研究间同质性较好(P=0.74,I2=0%),故采用固定效应模型。结果显示,与单用IS相比,TGP治疗能明显降低患者的IgM,差异有统计学意义[MD=-0.44,95%CI(-0.72,-0.16),P=0.002],见图 4I。
2.5.10 有效率7篇文献[16-21, 23]报告了有效率,共487例患者。研究间同质性较差(P < 0.000 01,I2=85%),故采用随机效应模型。结果显示,与单用IS相比,TGP治疗能明显提高有效率,差异有统计学意义[MD=1.39,95%CI(1.03,1.87),P=0.03],见图 4J。
2.5.11 不良反应6篇文献[16-18, 20-21, 23]报告了不良反应,共425例患者。研究间同质性较好(P=0.96,I2=0%),故采用固定效应模型。结果显示,与单用IS相比,TGP治疗能提高不良反应发生率,但差异无统计学意义[MD=1.63,95%CI(0.86,3.08),P=0.14],见图 4K。
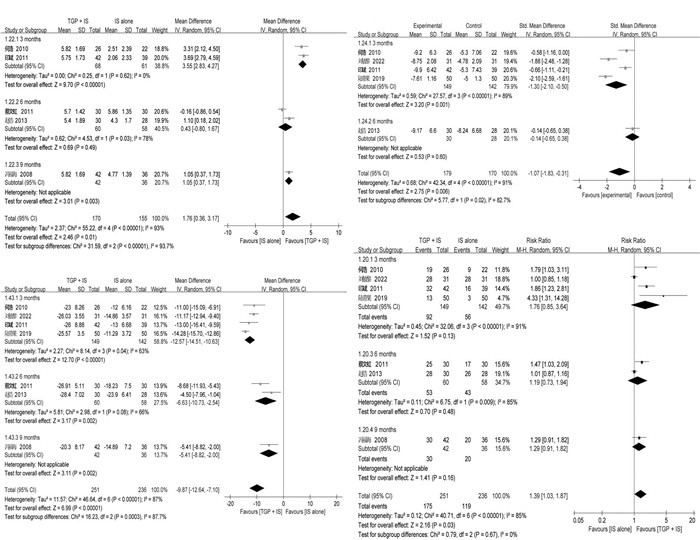
同时,由于Schirmer试验、ESR、IgG及有效率的高异质性,笔者根据不同的干预持续时间进行了亚组分析。经亚组分析,Schirmer试验3个月亚组的异质性被消除,表明TGP+IS比单用IS更有利(P < 0.000 01)。然而,优势在3个亚组之间有所不同,并随着时间的推移逐渐减弱,3个月[MD=3.55,95%CI(2.83,4.27),I2=0%,P < 0.000 01]显著优于9个月[MD=1.05,95%CI(0.37,1.73),P=0.003]和6个月[MD=0.43,95%CI(-0.80,1.67),I2=78%,P=0.49],见图 5A。
|
| 图 5 基于TGP+IS与单独IS干预持续时间的亚组分析(随访减去基线) Fig. 5 Subgroup analysis based on intervention duration of TGP+IS vs. IS alone(follow-up minus baseline) |
3篇文献[14-15, 22]报告了不良事件(AE),见表 2。单用TGP与PBO相比,AE差异有统计学意义(P=0.001),TGP组共260例患者,其中19例出现腹泻,2例胃肠道不适,2例轻度头晕,2例白细胞减少,3例肝功能异常,未观察到严重的不良事件。
6篇文献[16-18, 20-21, 23]报告了AE,见表 2。TGP+IS和单独IS相比,AE差异不显著(P=0.14)。在接受TGP+IS的受试者中,主要的不良反应为腹泻和视力模糊。同时,单独接受IS的受试者出现皮疹、视力下降和转氨酶异常等症状。两项试验[17, 23]报道,TGP+IS组各有1例患者因严重腹泻而退出研究。
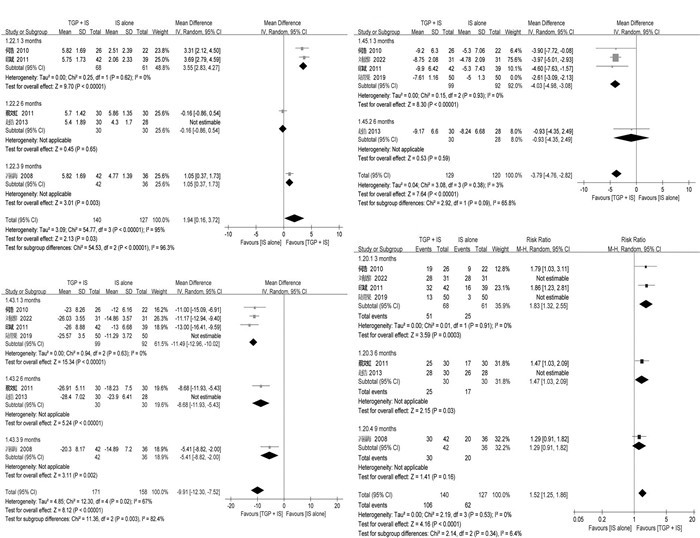
2.7 敏感性分析鉴于亚组分析后ESR、IgG和有效率的异质性仍然很高,笔者进一步进行了敏感性分析(图 6),发现其异质性来源可能主要是TGP与不同的IS联用,这解释了删除有关醋酸泼尼松的研究[19-20]后,3个月亚组的异质性都被消除(I2=0%)。
|
| 图 6 基于TGP+IS与单独IS干预时间的敏感性分析(随访减去基线) Fig. 6 Sensitivity analysis based on intervention duration of TGP+IS vs. IS alone(follow-up minus baseline) |
在Feng等[10]发表的Meta分析中,比较了TGP+IS与PBO或单用IS的疗效差异,发现TGP在改善外分泌功能(Schirmer试验和唾液流率),降低炎症指数(ESR和CRP)和免疫球蛋白(IgM和IgG)方面优越。然而,他们仅检索了2018年11月之前的文章,并且纳入的1项研究[11]干预措施不明确。
本研究纳入了10项包含TGP对比PBO和TGP+IS对比IS的试验,也通过亚组分析和敏感性分析进一步处理了异质性。比较单用TGP和PBO的结果,在改善Schirmer试验、唾液流率和ESR中疗效显著,但也观察了不良反应情况。TGP+IS在Schirmer试验、唾液流率、调节RF、CRP、ESR、血清γ球蛋白、IgG、IgA、IgM水平及有效率等方面疗效与单用IS有明显差异。此外,这些疗效可能根据疗程和联用IS的不同而有所差异。
无论是TGP单用还是联用IS,都可以显著改善外分泌腺分泌功能(Schirmer试验和唾液流率)。与单用HCQ相比,TGP+HCQ可以显著改善泪液分泌功能,但6个月的疗效反而较3个月差,表明其疗效会随着疗程的延长而减弱。相反,TGP与MTX联用6个月与单用MTX相比没有显著差异,但疗程延长至9个月时疗效较MTX好。目前的研究[24-25]发现HCQ和MTX对泪液分泌功能没有明显的影响,因此推测TGP联用HCQ可能更有利于改善泪腺分泌功能,或两者可能发生协同作用,而联用MTX可能具有拮抗作用,并且这种协同和拮抗作用都可能随着时间的推移而降低。有研究[26-27]表明HCQ可有效改善口干症状,增加pSS患者的唾液流率,然而尚未有研究显示MTX可以有效改善唾液流率和口干症状。鉴于TGP与HCQ或MTX联用合并分析时I2=0%,笔者推测TGP能够改善唾液流率,作用与HCQ相当,但两者联用时未能形成作用叠加。
TGP联用IS的情况下,ESR、RF和CRP都得到了显著改善,且单用TGP也有效降低ESR水平,笔者推断TGP可能具有增强MTX或HCQ抗炎活性的协同作用。当TGP联用IS时,血清γ球蛋白和免疫球蛋白(IgG,IgA和IgM)显著改善。最近研究[27]表明,HCQ可以显著降低pSS患者的免疫球蛋白水平,并且MTX也被认为具有减少免疫球蛋白的作用。然而,亚组分析表明,TGP+IS改善免疫指标的作用可能随着时间的推移而降低。
ESSDAI和ESSPRI是评估疾病活动和症状感知的指标,可作为pSS研究的终点[28]。纳入TGP+IS对比IS的3项试验提到ESSPRI,但没有显著差异。虽然TGP+IS与单用IS的数据表明TGP可显著提高有效率,但各研究评估方法不一致,需要进一步研究和论证。安全性方面,有9项研究报道了试验中的不良反应,最常见的是腹泻,但无需治疗逐渐缓解,并且TGP单用时没有发生严重的不良反应,因此临床上使用TGP具有较好的安全性。
局限性:1)只有10项试验符合纳入标准,且都在中国实施。2)纳入试验的方法学质量普遍偏低:8项研究只提到了随机,未提及具体随机方法,7篇文章没有报告分配隐藏方法。7项试验在受试者盲法和结局评估方面存在高偏倚风险,3项试验在不完整的结局数据中存在高偏倚风险。3)TGP的不同疗程及与不同的IS联用引起异质性偏高,尽管进行亚组分析及敏感性分析,也未能完全消除异质性。4)纳入文献的干预措施疗效评价指标不一致,且一些结局指标仅在较少的文献中报道甚至未被报道。因此,迫切需要高质量、大规模RCT来评估TGP对pSS患者的有效性和安全性。
综上所述,TGP治疗pSS时可以有效提高临床疗效,在改善外分泌功能(Schirmer试验和唾液流率),降低炎症指数(ESR、RF和CRP)和免疫球蛋白(IgG、IgA和IgM)方面疗效显著,改善血清γ球蛋白、ESSPRI等指标均具有一定优势,同时其不良反应少且症状较轻,安全性较好。但由于纳入文献数量不多,质量偏低,还需更多高质量和大样本的RCT进一步证实。
| [1] |
MARIETTE X, CRISWELL L A. Primary Sjögren's syndrome[J]. The New England Journal of Medicine, 2018, 378(10): 931-939. DOI:10.1056/NEJMcp1702514 |
| [2] |
QIN B D, WANG J Q, YANG Z X, et al. Epidemiology of primary Sjögren's syndrome: A systematic review and meta-analysis[J]. Annals of the Rheumatic Diseases, 2015, 74(11): 1983-1989. DOI:10.1136/annrheumdis-2014-205375 |
| [3] |
中华医学会风湿病学分会. 自身免疫性肝病诊断和治疗指南[J]. 中华风湿病学杂志, 2011, 15(8): 556-558. DOI:10.3760/cma.j.issn.1007-7480.2011.08.011 |
| [4] |
NEGRINI S, EMMI G, GRECO M, et al. Sjögren's syndrome: A systemic autoimmune disease[J]. Clinical and Experimental Medicine, 2022, 22(1): 9-25. DOI:10.1007/s10238-021-00728-6 |
| [5] |
RAMOS-CASALS M, BRITO-ZERÓN P, BOMBARDIERI S, et al. EULAR recommendations for the management of Sjögren's syndrome with topical and systemic therapies[J]. Annals of the Rheumatic Diseases, 2020, 79(1): 3-18. DOI:10.1136/annrheumdis-2019-216114 |
| [6] |
WANG C, YUAN J, WU H X, et al. Total glucosides of paeony inhibit the inflammatory responses of mice with allergic contact dermatitis by restoring the balanced secretion of pro-/anti-inflammatory cytokines[J]. International Immunopharmacology, 2015, 24(2): 325-334. DOI:10.1016/j.intimp.2014.12.026 |
| [7] |
ZHANG L L, WEI W. Anti-inflammatory and immunoregulatory effects of paeoniflorin and total glucosides of paeony[J]. Pharmacology & Therapeutics, 2020, 207(3): 107452. |
| [8] |
ZHANG W, DAI S M. Mechanisms involved in the therapeutic effects of Paeonia lactiflora Pallas in rheumatoid arthritis[J]. International Immunopharmacology, 2012, 14(1): 27-31. DOI:10.1016/j.intimp.2012.06.001 |
| [9] |
WANG Y N, ZHANG Y, WANG Y, et al. The beneficial effect of total glucosides of paeony on psoriatic arthritis links to circulating Tregs and Th1 cell function[J]. Phytotherapy Research, 2014, 28(3): 372-381. DOI:10.1002/ptr.5005 |
| [10] |
FENG Z, ZHANG B Q, ZHU Y M, et al. The effectiveness and safety of total glucosides of paeony in primary Sjögren's syndrome: A systematic review and meta-analysis[J]. Frontiers in Pharmacology, 2019, 10(5): 550. |
| [11] |
刘怡, 邓昊. 帕夫林胶囊联合甲氨蝶呤治疗干燥综合征的临床分析[J]. 中华全科医学, 2016, 14(2): 230-231, 278. |
| [12] |
VITALI C, BOMBARDIERI S, JONSSON R, et al. Classification criteria for Sjögren's syndrome: A revised version of the European criteria proposed by the American-European Consensus Group[J]. Annals of the Rheumatic Diseases, 2002, 61(6): 554-558. DOI:10.1136/ard.61.6.554 |
| [13] |
Higgins J, Green S E. Cochrane handbook for systematic reviews of interventions version 5.1.0. the cochrane collaboration(Eds)[J]. Naunyn-schmiedebergs Archives of Pharmacology, 2011, 2(5): S38. |
| [14] |
LIU X, LI X M, LI X P, et al. The efficacy and safety of total glucosides of peony in the treatment of primary Sjögren's syndrome: A multi-center, randomized, double-blinded, placebo-controlled clinical trial[J]. Clinical Rheumatology, 2019, 38(3): 657-664. DOI:10.1007/s10067-018-4315-8 |
| [15] |
ZHOU Y B, JIN L, KONG F F, et al. Clinical and immunological consequences of total glucosides of paeony treatment in Sjögren's syndrome: A randomized controlled pilot trial[J]. International Immunopharmacology, 2016, 39(10): 314-319. |
| [16] |
蔡文虹. 白芍总苷治疗干燥综合征的临床观察[J]. 当代医学, 2011, 17(36): 10-11. DOI:10.3969/j.issn.1009-4393.2011.36.006 |
| [17] |
冯福海, 张二中. 白芍总苷治疗干燥综合征42例[J]. 中医研究, 2008, 21(12): 35-37. DOI:10.3969/j.issn.1001-6910.2008.12.016 |
| [18] |
何浩. 白芍总苷联合羟氯喹治疗干燥综合征临床观察[J]. 湖北中医杂志, 2010, 32(11): 30-31. |
| [19] |
刘敏黎, 宋冬明, 王方明, 等. 硫酸羟氯喹联合白芍总苷在原发性干燥综合征患者中的应用效果[J]. 健康必读, 2022(23): 171-172. |
| [20] |
陆带果, 王璐瑶, 王贵红, 等. 白芍总苷胶囊联合硫酸羟氯喹治疗干燥综合征的临床效果[J]. 中国医药导报, 2019, 16(36): 115-118. |
| [21] |
印斌. 帕夫林联合硫酸羟基氯喹治疗非系统受累干燥综合征临床观察[J]. 中国医学创新, 2011, 8(35): 20-21. |
| [22] |
游雅淇. 王伟钢教授治疗干燥综合征的临床经验总结及白芍总苷治疗干燥综合征的临床疗效初探[D]. 北京: 北京中医药大学, 2015.
|
| [23] |
赵浩, 赵福涛. 白芍总苷联合羟基氯喹治疗原发性干燥综合征临床研究[J]. 河南中医, 2013, 33(4): 530-531. |
| [24] |
SKOPOULI F N, JAGIELLO P, TSIFETAKI N, et al. Methotrexate in primary Sjögren's syndrome[J]. Clinical and Experimental Rheumatology, 1996, 14(5): 555-558. |
| [25] |
WANG S Q, ZHANG L W, WEI P, et al. Is hydroxychloroquine effective in treating primary Sjögren's syndrome: A systematic review and meta-analysis[J]. BMC Musculoskeletal Disorders, 2017, 18(1): 186. DOI:10.1186/s12891-017-1543-z |
| [26] |
RIVIÈRE E, PASCAUD J, TCHITCHEK N, et al. Salivary gland epithelial cells from patients with Sjögren's syndrome induce B-lymphocyte survival and activation[J]. Annals of the Rheumatic Diseases, 2020, 79(11): 1468-1477. DOI:10.1136/annrheumdis-2019-216588 |
| [27] |
WANG X, ZHANG T, GUO Z Z, et al. The efficiency of hydroxychloroquine for the treatment of primary Sjögren's syndrome: A systematic review and meta-analysis[J]. Frontiers in Pharmacology, 2021, 12(9): 693796. |
| [28] |
SEROR R, THEANDER E, BRUN J G, et al. Validation of EULAR primary Sjögren's syndrome disease activity(ESSDAI) and patient indexes(ESSPRI)[J]. Annals of the Rheumatic Diseases, 2015, 74(5): 859-866. DOI:10.1136/annrheumdis-2013-204615 |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China
 2024, Vol. 41
2024, Vol. 41