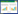文章信息
- 蔡丽, 张凌凌, 赵艳青, 等.
- CAI Li, ZHANG Lingling, ZHAO Yanqing, et al.
- 神经复元方对H2O2诱导的大鼠海马神经元损伤后雄激素受体活化的影响
- Study on the effects of the Shenjing Fuyuan Decoction on the androgen receptor in H2O2 -induced hippocampal neuron injury in rats
- 天津中医药, 2024, 41(4): 490-494
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 490-494
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.16
-
文章历史
- 收稿日期: 2023-11-28
脑卒中后抑郁(PSD)表现为卒中后出现的以情绪低落、消极悲观、意志缺乏、易怒、淡漠、失眠、焦虑甚至有自杀倾向的症状,是脑卒中后常见的并发症。中国发病率约为29.0%~37.9%[1]。PSD严重影响卒中患者神经功能缺损的恢复,极大地增加了患者的致残率、复发率和病死率,已经成为卒中复发的独立危险因素[2]。阐明PSD发病机制对预防PSD发生、增强PSD治疗效果、提高患者生活质量、减轻家庭和社会负担等均具有重要意义。前期研究证实神经复元方对改善PSD患者抑郁症状有较好疗效[3-4],其修复海马神经元损伤可能是通过激活脑源性神经营养因子(BDNF)/酪氨酸激酶受体B(TrkB)信号通路实现[5-6]。BDNF与TrkB结合形成BDNF/TrkB信号通路,是海马神经前体细胞正常分化所必须。美国国立精神卫生研究所的流行病学调查表明,女性抑郁症的患病率高达8%,将近男性抑郁症的2倍,性激素与抑郁症存在密切关系[8]。有研究发现雄激素受体(AR)缺乏会加重慢性轻度应激型抑郁小鼠的抑郁样行为,AR能够调节BDNF的表达[9]。且有研究表明,长链非编码RNA(lncRNA GAS5)参与了BDNF/TrkB信号通路的调控[10]。药物靶点网络分析提示神经复元方多种有效成分作用于AR,因此本实验拟验证AR是否为神经复元方治疗PSD的重要作用靶蛋白,探讨神经复元方是否通过激活AR活性治疗PSD。
1 材料与方法 1.1 实验动物SPF级健康雄性Sprague-Dawley(SD)大鼠,8周龄,斯贝福生物有限公司提供,饲养于温度20~26 ℃,湿度40%~70%的SPF级环境中,自由饮食摄水,进行适应性饲养7 d;出生24 h内SD新生鼠。所有实验操作经上海市中医医院实验动物伦理委员会批准并指导进行(伦理批件号:2021036)。操作期间充分考虑动物的利益,善待动物,减少动物的应激、痛苦和伤害,尊重动物生命,采取痛苦最少的方法处置动物。
1.2 主要试剂神经复元方药,采用单味中药配方颗粒冲调而成,由江苏省江阴市天江药业有限公司生产提供,全方由熟地黄15 g,制黄精15 g,广郁金9 g,石菖蒲12 g,丹参9 g等7味药物组成。氟西汀(国药准字H20073985,山西仟源医药集团股份有限公司),H2O2(H112519,阿拉丁生化科技股份有限公司),NeurobasalTM-A培养基(10888022,Gibco公司),即用型DAPI染液(KGA215-50,江苏凯基生物技术股份有限公司),一抗:MAP-2(17490-1-AP,Proteintech公司,1/200),二抗:山羊抗兔IgG cy3(AS007,ABclonal公司,1/200),超纯RNA提取试剂盒(CW0581M,CWBIO公司),HiScript Ⅱ Q RT SuperMix for qPCR逆转录试剂盒(+gDNA wiper,R223-01,Vazyme公司),Gsafe Red plus核酸染料(GK20002,GlpBio公司),RIPA细胞裂解液(C1053,北京普利莱基因技术有限公司),BCA蛋白定量试剂盒(E-BC-K318-M,Elabscience公司),封闭专用脱脂奶粉(P1622,北京普利莱基因技术有限公司),牛血清白蛋白(BSA,A8020,索莱宝)及AR相关抗体等。
1.3 主要仪器高速台式冷冻离心机(H1750R,湖南湘仪实验室仪器开发有限公司),荧光显微镜(CKX53,Olympus公司),多功能酶标分析仪(SuPerMax3100,上海闪谱生物科技有限公司),实时荧光PCR仪[CFX ConnectTM实时,伯乐生命医学产品(上海)有限公司],超高灵敏度化学发光成像系统仪[Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司],荧光显微镜(CKX53),低温高速离心机(5424R,Eppendorf),电热恒温水浴锅(HH-11-2,上海助蓝仪器科技有限公司),全自动酶标仪(SuPerMax 3100,上海闪普),蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂),恒温摇床(TC-100B,上海领成生物科技有限公司),全自动化学发光图像分析系统(Tanon-5200,上海天能科技有限公司)及移液枪、单道可调移液器等。
1.4 实验方法 1.4.1 大鼠海马神经元细胞分离培养前1 d将培养板用0.01%多聚赖氨酸包被过夜。次日吸除包被液,并用磷酸盐缓冲溶液(PBS)清洗1~2遍晾干后放置于培养箱中备用。取新生24 h之内的SD大鼠,雌雄不限,75%酒精全身消毒,断头处死。无菌条件下分层剪开头皮、颅骨,用弯镊拉开脑区视野,小心取出全脑,以脑中线为起点,小心拨开大脑颞叶皮层,暴露出新月状海马回,小心取出海马组织,置于预冷的PBS中。将组织挑出放置含D-PBS的培养皿中,尽可能剔除血管、神经、结缔组织。将海马体块仔细剪碎,将组织碎块移入离心管中,反复吹打,静置,去除上清,取沉淀。加入胶原酶I(0.1%)置于37 ℃恒温水浴锅消化30 min。加入DMEM/F12完全培养液终止消化(体积比1∶3),1500 r/min离心5 min(离心半径8 cm),去除上清。取沉淀,加入胰蛋白酶消化5~15 min。加入完全培养液终止,用吸管轻轻吹打数次分散细胞,经100目筛网过滤。1 500 r/min离心5 min(离心半径8 cm),弃上清液,用适量的DMEM/F12培养液重悬。将细胞悬液铺于T25瓶中,差贴,共3次(30 min),将上清液转移至另一个T25瓶,放于恒温培养箱中培养4~7 d。将上述贴壁细胞用胰酶消化1~2 min,离心,差贴1次,每次30 min,然后将差贴后的细胞上清液转移至新的瓶中培养。
1.4.2 免疫荧光取原代分离的大鼠海马神经元细胞,用4%多聚甲醛(P1110,Solarbio公司)固定30 min,0.5% Triton X-100通透20 min,经5% BSA在37 ℃下封闭30 min后,分别用抗体MAP-2(17490-1-AP,Proteintech公司,1∶200)、p-AR(AF8407,Affinity,1∶200)和AR(22089-1-AP,Proteintech公司,1∶200)在4 ℃下孵育过夜。洗涤后滴加荧光二抗IgG cy3(AS007,ABclonal公司,1∶200),在复染DAPI(KGA215-50,江苏凯基生物技术股份有限公司)后封片,在荧光显微镜(CKX53,Olympus公司)下观察。利用免疫荧光(IF)鉴定海马神经元细胞,检测AR、p-AR表达情况。
1.4.3 含药血清制备SPF级雄性SD大鼠适应性饲养7 d后,随机分为空白血清组(Blank serum)和含药血清组(Drug serum)。将72 g的神经复元方颗粒加纯水配成48 mL,配制成浓度为1.5 g/mL的药剂。含药血清组给予神经复元方配制液灌胃处理,每日1次,持续5 d,给药剂量10 mL/kg。对照组予等体积生理盐水灌胃,不予药物处理,持续5 d。最后一次给药结束后1 h,分别麻醉后腹主动脉采血,分离血清。
1.4.4 CCK8检测确定血清浓度配制浓度为0%、5%、10%、15%、20%、30%的空白血清完全培养液和含药血清完全培养液,于-20 ℃冰箱保存备用。将生长状态良好的大鼠海马神经元细胞接种于96孔板,分作空白血清组(Blank serum)和含药血清组(Drug serum)予以不同浓度完全培养液培养24 h。将待测的96孔板细胞换成相同的培养基,每孔100 μL,更换新鲜培养基。向各孔中加入10 μL CCK-8(Cell Counting Kit-8)细胞增殖检测试剂盒试剂(KGA317,KeyGen Biotec公司),于培养箱中孵育2 h,在450 nm波长下用多功能酶标分析仪,测定各孔吸光度值,计算IC50。确定空白血清组和含药血清组的最佳血清浓度。
1.4.5 原代细胞分组与处理细胞铺6孔板和6 cm皿,与细胞传代方法相同,将细胞进行稀释,6孔板每孔约2×105~10×105个细胞,6 cm皿每孔约5×105~2×106个细胞,均匀的铺到细胞培养板中,做好标记,放置培养箱中培养,待细胞完全贴壁后进行实验。将原代细胞分作空白血清组、损伤模型+空白血清组、损伤模型+含药血清组、损伤模型+氟西汀组等4组予以处理。空白血清组(Blank serum)细胞使用空白血清孵育48 h;含药血清组(Drug serum)细胞使用含药血清孵育48 h;损伤模型+空白血清组(H2O2+Blank serum)细胞使用100 μmol/L的H2O2(H112519,阿拉丁生化科技股份有限公司)预处理1 h后加入空白血清孵育48 h;损伤模型+含药血清组(H2O2+Drug serum)细胞使用100 μmol/L的H2O2预处理1 h后加入含药血清孵育48 h;损伤模型+氟西汀组(H2O2+Fluoxetine)细胞使用100 μmol/L的H2O2预处理1 h后加入氟西汀孵育48 h。
1.4.6 实时荧光定量PCR检测采用Trizon试剂裂解各组细胞,超纯RNA提取试剂盒提取总RNA,利用紫外可见分光光度计测定RNA的浓度和纯度(OD260/OD280),通过HiScript Ⅱ Q RT SuperMix for qPCR逆转录试剂盒将RNA逆转录合成cDNA,ChamQ Universal SYBR qPCR Master Mix加样,采用实时荧光PCR仪进行荧光定量PCR,即QPCR检测。反应步骤如下:预变性95 ℃,10 min;变性95 ℃,10 s;退火58℃,30 s;延伸72 ℃,30 s;40个循环。LncRNA以GAPDH作为内参,基因相对表达量根据2-ΔΔCt法计算。引物序列如下表 1所示。利用实时荧光定量检测各组AR、p-AR及lncRNA GAS5表达情况。
各组细胞弃去培养基,加入RIPA裂解液裂解细胞,提取总蛋白。采用高速离心机4 ℃下,12 000 r/min离心10 min,离心半径8 cm,取上清液,BCA蛋白定量试剂盒对总蛋白进行定量。对蛋白样品进行变性后,进行十二烷基苯磺酸钠凝胶电泳(SDS-PAGE)1 h,后用300 mA恒流转膜1.5 h。PVDF膜(IPVH00010,Millipore公司)用脱脂奶粉封闭后,一抗β-Actin(HC201,TransGen Biotech公司,1∶2 000)、AR(66747-1-lg,Proteintech公司,1∶1 000)和p-AR(AF8407,Affinity公司,1∶1 000)4 ℃孵育过夜,次日PVDF膜室温分别孵育二抗HRP conjugated Goat Anti-Mouse IgG(H+L)(GB23301,Servicebio公司,1∶2 000)和HRP conjugated Goat Anti-Rabbit IgG(H+L)(GB23303,Servicebio公司,1∶2 000)2 h,用发光液(RJ239676,ThermoFisher公司)浸湿PVDF膜,置于全自动化学发光图像分析系统(Tanon-5200,上海天能科技有限公司)中进行显影。利用Western bolt检测各组细胞中AR、p-AR的表达情况。
1.4.8 统计学方法应用SPSS 20.0软件进行统计分析。所有实验重复3次,定量数据采用均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用S-N-K法。检验水准α=0.05。
2 结果 2.1 原代大鼠海马神经元细胞鉴定通过免疫荧光鉴定大鼠海马神经元细胞,如图 1所示,DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的MAP-2红光,结果显示细胞鉴定呈阳性,为大鼠海马神经元细胞。
|
| 图 1 大鼠海马神经元细胞免疫荧光鉴定结果 Fig. 1 IF identification of rat hippocampal neurons |
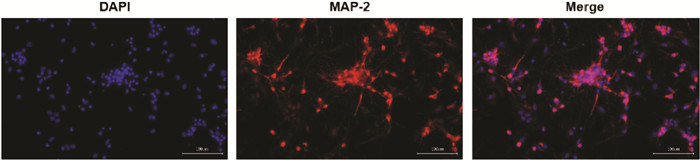
如图 2所示,空白血清组和含药血清组与0%相比,随着血清浓度的增加,细胞增殖能力逐渐增加,在20%时达到最高,在30%时又略有降低。综合结果选择20%的空白血清和含药血清浓度进行实验。
|
| 注:与0%比较,*P<0.05。 图 2 CCK-8检测空白血清和含药血清对细胞增殖的影响(x±s) Fig. 2 CCK-8 assay of the effect of blank serum and drug-containing serum on cell proliferation(x±s) |
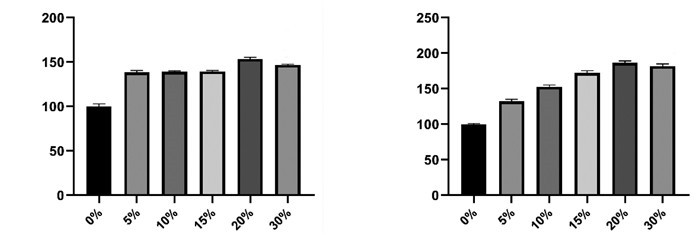
利用Western blot和免疫荧光确定空白血清、含药血清和氟西汀处理损伤模型细胞后磷酸化及非磷酸化AR蛋白变化情况。如图 3A所示,与空白血清组相比,损伤模型组的AR、p-AR蛋白表达显著下降;与损伤模型组相比,损伤模型+含药血清组、损伤模型+氟西汀两组中的组的AR、p-AR蛋白表达显著上升。如图 3B所示,与空白血清组相比,损伤模型组的AR、p-AR核内表达数显著下降;与损伤模型组相比,损伤模型+含药血清组、损伤模型+氟西汀两组中的组的AR、p-AR核内表达数显著上升。
|
| 注:A,Western blot结果;B,免疫荧光结果;与Blank serum组比较,*P<0.05;与H2O2+Blank serum组比较,#P<0.05。 图 3 Western blot和免疫荧光中各组AR、p-AR蛋白表达结果 Fig. 3 Expression results of AR and p-AR proteins in each group by Western blot and immunofluorescence |
PSD是卒中后常见的并发症之一,被认为与炎症、神经元损伤和神经递质失衡等有关。文献研究表明,AR的基因多态性与抑郁症之间存在联系,血浆中睾酮浓度降低及AR基因中CAG片段的长度改变都有可能作为抑郁症的预测指标[11]。AR缺乏会加重慢性轻度应激型抑郁小鼠的抑郁样行为,AR能够调节BDNF的表达[12]。此外,研究证实AR与PSD之间存在关系,AR可以影响脑胶质细胞和神经元的功能,并参与神经发育、神经保护和智力活动的调节[13-15]。AR可以影响神经炎症和神经元存活,从而参与PSD的发生和发展。AR激活可以促进神经环路形成和神经发生,从而对神经元的生存和保护起到积极的作用,预防PSD发生。本研究利用Western blot和免疫荧光检测空白血清、含药血清和氟西汀处理损伤模型细胞后磷酸化及非磷酸化AR蛋白变化情况,发现空白组相比,损伤模型组的AR、p-AR蛋白表达显著下降。与损伤模型组相比,含药血清组和氟西汀组的AR、p-AR蛋白表达显著上升。表明神经复元方对H2O2诱导的SD大鼠海马神经元损伤有一定的修复作用,能够促进AR活化,提示AR可能为神经复元方治疗PSD的重要靶蛋白,但是否通过AR介导激活BDNF/TrkB通路达到治疗效果还需进一步深化研究。
| [1] |
谢晓彬, 张卫. 卒中后抑郁病因机制研究进展[J]. 中医临床研究, 2020, 12(5): 145-148. |
| [2] |
吕淑珍, 詹焱. 脑卒中后抑郁发病及相关影响因素分析[J]. 医药前沿, 2020, 10(3): 26-27. |
| [3] |
蔡丽, 刘毅, 陆小青, 等. 神经复元方治疗缺血性卒中后抑郁临床研究[J]. 陕西中医, 2019, 40(11): 1523-1527. |
| [4] |
张凌凌, 金如锋, 英洪友, 等. 神经复元方治疗脑梗死恢复期病人125例临床疗效观察[J]. 中西医结合心脑血管病杂志, 2018, 16(23): 3419-3421. DOI:10.12102/j.issn.1672-1349.2018.23.005 |
| [5] |
蔡丽, 董耀荣, 李文涛, 等. 神经复元方对原代大鼠海马神经元BDNF/TrKB信号通路影响的研究[J]. 陕西中医, 2020, 41(6): 720-723, 727. |
| [6] |
蔡丽, 刘毅, 李文涛, 等. 神经复元方对卒中后抑郁大鼠BDNF/TrkB表达及海马神经元突触可塑性的影响[J]. 世界中医药, 2021, 16(4): 597-602. |
| [7] |
何明, 马飞月. 卒中后抑郁影响因素及其与脑源性神经营养因子基因多态性的关系研究[J]. 实用心脑肺血管病杂志, 2019, 27(5): 29-35. |
| [8] |
ROHR U D. The impact of testosterone imbalance on depression and women's health[J]. Maturitas, 2002, 41(4): 25-46. |
| [9] |
HUNG Y Y, HUANG Y L, CHANG C, et al. Deficiency in androgen receptor aggravates the depressive-like behaviors in chronic mild stress model of depression[J]. Cells, 2019, 8(9): 1021. DOI:10.3390/cells8091021 |
| [10] |
QIAO H P, GAO W S, HUO J X, et al. Long non-coding RNA GAS5 functions as a tumor suppressor in renal cell carcinoma[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2013, 14(2): 1077-1082. DOI:10.7314/APJCP.2013.14.2.1077 |
| [11] |
PANIZZON M S, BREE K, HSIEH T C, et al. Genetic variation in the androgen receptor modifies the association between testosterone and vitality in middle-aged men[J]. The Journal of Sexual Medicine, 2020, 17(12): 2351-2361. DOI:10.1016/j.jsxm.2020.08.016 |
| [12] |
SANKAR J S, HAMPSON E. Testosterone levels and androgen receptor gene polymorphism predict specific symptoms of depression in young men[J]. Gender Medicine, 2012, 9(4): 232-243. DOI:10.1016/j.genm.2012.05.001 |
| [13] |
李梦婷, 张冲. 雄激素受体对中枢神经系统疾病的影响研究进展[J]. 中国病理生理杂志, 2019, 35(8): 1555-1559. |
| [14] |
张国栋, 洪鑫, 王晓峰. 雄激素受体在缺血性卒中后神经保护中的作用机制[J]. 中国老年学杂志, 2021, 41(10): 2212-2216. |
| [15] |
杨鸽, 杨兆鹏. 雄激素受体与卒中后精神障碍[J]. 临床脑科学杂志, 2019, 7(8): 20-23. |
 2024, Vol. 41
2024, Vol. 41