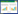文章信息
- 杨帆, 张晓云, 高俊侠, 等.
- YANG Fan, ZHANG Xiaoyun, GAO Junxia, et al.
- 加减补阳还五汤通过SIRT1途径激活自噬改善糖尿病肾病小鼠肾组织损伤
- Modified Buyang Huanwu Decoction improves renal tissue damage in diabetic kidney disease mice by activating autophagy through SIRT1 pathway
- 天津中医药, 2024, 41(4): 495-502
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 495-502
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.17
-
文章历史
- 收稿日期: 2023-10-09
糖尿病肾病(DKD)是糖尿病患者的严重肾脏并发症[1-2]。尽管开展了广泛的预防和治疗工作,DKD仍然是终末期肾病的主要原因,也是全世界的公共卫生负担[3]。因此,迫切需要识别其新的病理生理机制和开发新的治疗策略。
近期研究表明,自噬下调在DKD的发生发展中起重要作用[4-5]。自噬是一种细胞循环过程,涉及受损细胞器和蛋白质的自我降解和重建[6]。在DKD中,肾组织固有细胞自噬功能受损,无法去除异常和错误折叠蛋白质、受损的细胞器及代谢废物,从而导致肾脏组织学病变[4-5]。
中医药在防治糖尿病及其并发症中疗效确切且具有优势。研究发现气虚血瘀是DKD的主要病机之一[7]。补阳还五汤是益气化瘀通络的经典代表方剂。临床研究表明以补阳还五汤为基础的加减方治疗DKD方面疗效显著[8-9]。而且DKD发展过程中产生的“瘀血”等病理产物似与自噬功能受损、待降解产物堆积的病理现象相类似[10],因此益气化瘀通络是治疗DKD的关键。本研究拟以db/db小鼠模拟DKD的发病过程,探讨加减补阳还五汤对DKD小鼠肾组织自噬的影响,并探讨其可能的作用机制。
1 材料与方法 1.1 实验动物健康雄性SPF级db/m和db/db小鼠(11~12周龄)购自江苏常州卡文斯实验动物有限公司,合格证号SCXK(苏)2021-0013。其中db/m小鼠体质量(25±5)g、db/db小鼠体质量(45±5)g,将所有小鼠饲养于恒温恒湿及12 h光照/黑暗循环的动物房中,并可自由饮食进水。所有动物实验均经所在机构动物伦理委员批准进行(伦理编号:DWLL202203117),并遵循实验动物伦理准则。
1.2 实验药物黄芪(批号0093253)、生地黄(批号0101963)、丹参(批号8080971)、川芎(批号8122561)、当归(批号0093103)、水蛭(批号8081351)、地龙(批号7125701)购自广东一方药业有限公司(佛山);中药配方颗粒是以中药饮片为原材料,采用现代工艺经过提取、分离、浓缩、干燥、制粒而成,且符合2021年版《中药配方颗粒质量控制与标准制定技术要求》的规定。
1.3 主要试剂尿微量白蛋白试剂盒(mALB,批号H127-1-2)购自南京建成生物工程研究所;半胱氨酸蛋白酶-3(Caspase-3)抗体(批号ab184787)、B细胞淋巴瘤因子2(Bcl-2)抗体(批号ab32124)、BCL-2相关X蛋白(Bax)抗体(批号ab32503)、自噬相关蛋白7(Agt7)抗体(批号ab133528)、沉默信息调节因子1(SIRT1)抗体(批号ab110304)、LC3B抗体(批号ab48394)、自噬受体蛋白p62(P62)抗体(批号ab91526)、Bcl-2同源结构域蛋白抗体(Beclin1)抗体(批号ab62557)、WT1抗体(批号ab89901)、podocin抗体(批号ab181143)、nephrin抗体(批号ab216341)购自美国Abcam公司;β-actin抗体(批号AF0003)、BCA蛋白浓度测定试剂盒(批号P0009)购自上海Beyotime公司;Servicebio® RT First Strand cDNA Synthesis Kit(批号G3330)、2×SYBR Green qPCR Master Mix(High ROX,批号G3321)、ECL化学发光试剂盒(批号G2014)、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号GB23303)、RIPA蛋白裂解液(批号G2002)、蛋白酶抑制剂和磷酸化酶抑制剂(批号G2007)、引物购自武汉赛维尔生物科技有限公司。
1.4 主要实验仪器全自动生化分析仪(日本HITACHI株式会社),DYCZ-24DN型电泳仪(北京六一仪器厂),Imag Quant LAS4000全自动凝胶成像系统(美国通用GE公司),数码显微镜(日本Olympus公司),WSE-4040型半干转膜仪系统(日本ATTO公司),MICROM-340E石蜡切片机(德国Zeiss公司),BP310P精密电子天平(德国Sartorius公司),Stepone plus荧光定量PCR仪(美国ABI公司),Centrifuge5417R型低温离心机(德国Eppendorf公司)。
2 实验方法 2.1 实验分组适应性喂养1周后,将检测尿蛋白均阳性的db/db小鼠随机分为模型组、中药组,每组8只,另外选择8只db/m小鼠作为对照组。各组小鼠继续饲喂小鼠常规维持饲料至实验结束,并观察小鼠的一般状态。
2.2 干预措施加减补阳还五汤(黄芪30 g、川芎12 g、生地黄30 g、当归15 g、丹参15 g、地龙15 g、水蛭6 g),该药物用量为临床治疗有效剂量,根据《中药药理研究方法学》确定给药量计算公式为临床用量×等效剂量系数(按体表面积计算),故给药剂量为每日16.0 g/kg(按所含原药材量计算),按比例将中药颗粒混合均匀后,配制成4 g/mL的混悬液,溶媒为蒸馏水,对照组及模型组给予等体积的蒸馏水,每日1次灌胃,连续给药8周。给药期间观察小鼠一般状态。
2.3 标本收集在实验结束时收集各组小鼠尿液,并保存于-80 ℃冰箱中待测;并将小鼠禁食不禁水12 h,给予麻醉后剥离股动脉穿刺取血,然后将小鼠脱颈椎处死,剪开腹腔,取下肾脏并分离肾包膜,将肾组织纵向剖开,并于冰上用生理盐水充分洗涤,一部分保存于-80 ℃冰箱,用于后续蛋白质免疫印迹法(Western blot)检测蛋白表达,另一部分在4%多聚甲醛中固定,用于后续病理形态学观察。
2.4 观察指标 2.4.1 各组小鼠mALB测定采用ELISA法测定各组小鼠尿mALB含量,将小鼠尿标本以3 000 r/min,4 ℃离心15 min后取上清,离心半径10 cm,按照试剂盒的操作说明测定各组小鼠尿mALB浓度。
2.4.2 各组小鼠血液生化指标测定采用全自动血生化分析仪测定血液生化指标,将各组小鼠血液置于生化分析仪上测定血糖(FBG)、糖化血红蛋白(HBA1c)、总胆固醇(TC)、三酰甘油(TG)、尿素氮(BUN)、肌酐(Scr)水平。
2.4.3 各组小鼠肾脏病理形态学观察取适量分离固定完成的小鼠肾组织,石蜡包埋并切片(4 μm),脱蜡透明,苏木精染色、氨水返蓝后,分别进行苏木精-伊红(HE)和Masson染色,再次脱水透化并封片,光学显微镜下观察肾组织病理形态学变化。并应用图像分析软件对肾组织病理切片中的胶原沉积量进行半定量分析。
2.4.4 qRT-PCR检测WT1、nephrin及podocin的mRNA表达取小鼠肾组织100 mg匀浆后,加入1 mL的Trizol提取总RNA,并用分光光度计检测其纯度及浓度。然后根据反转录试剂盒说明将RNA反向转录成cDNA。然后加入引物后进行实时定量反转录聚合酶连锁反应(qRT-PCR)扩增反应,反应条件为95 ℃预变性10 min,95 ℃变性10 s、58 ℃退火15 s、72 ℃延伸10 s,40个循环重复,以GAPDH为内参基因,结果采用2-ΔΔCt法计算,引物见表 1。
取分离得到的50 mg小鼠肾脏组织,置于微型离心管(EP)管中加入RIPA裂解液及蛋白酶抑制剂充分研磨,并在冰上裂解30 min。10 000 r/min,4 ℃离心10 min,离心半径10 cm,吸取上清。按照BCA试剂盒说明操作测定待测样品的蛋白质量浓度。用上样缓冲液稀释待测的蛋白样品并在沸水中变性5 min。将适量蛋白样品经凝胶电泳分离转移至PVDF膜上,封闭洗涤后,分别加入SIRT1(1∶850)、P62(1∶850)、LC3B(1∶800)、Beclin1(1∶600)、Agt7(1∶600)、Bcl-2(1∶750)、Caspase-3(1∶750)、Bax(1∶750)、β-actin(1∶2 000)抗体,冰箱4 ℃孵育过夜后取出TBST洗膜,然后用HRP标记的山羊抗兔IgG二抗孵育1 h,TBST洗膜,ECL发光液显色,使用Image Quant LAS4000凝胶成像系统中拍摄,Image J软件分析目的蛋白灰度值。
2.4.6 免疫组化检测WT1、nephrin及podocin表达取石蜡切片分别用二甲苯及乙醇脱蜡水化后用蒸馏水冲洗。然后在切片滴加3% H2O2除去内源性的过氧化物酶,磷酸盐缓冲溶液(PBS)冲洗,置于0.1 mmol/L枸橼酸缓冲液中,微波炉加热进行抗原修复。冷却后向切片滴加10%的山羊血清进行封闭。用吸水纸吸干组织切片周围的山羊血清,滴加一抗(WT1稀释比例1∶100;nephrin稀释比例1∶200;podocin稀释比例1∶200),湿盒内4 ℃孵育过夜。取出切片,PBS冲洗后滴加生物素标记山羊抗兔IgG的二抗,然后滴加辣根酶标记链霉卵白素工作液,DAB显色,显微镜下观察,用自来水冲洗切片终止染色,苏木精复染,梯度脱水,中性树胶封片,显微镜下拍照。
2.5 统计学方法采用SPSS 26.0软件进行数据分析,GraphPad Prism 8.0.2软件进行柱状图制作,数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LST-t检验,P<0.05为差异具有统计学意义。
3 结果 3.1 各组小鼠一般情况对照组小鼠体活泼好动,反应灵敏,毛色顺滑光亮;模型组小鼠出现多尿、多饮、多食,行动缓慢,反应迟钝,神情呆滞,毛色枯槁无光泽,部分小鼠肾脏化脓感染;中药干预后上述情况有明显改善,反应迅速,活动量增加,毛色有光泽。
3.2 各组小鼠血糖血脂比较如表 2所示,与对照组相比,模型组小鼠FBG、HBA1c、TG、TC均升高(P<0.01);与模型组相比,中药组小鼠FBG、HBA1c无明显变化(P>0.05),TG、TC明显降低(P<0.01)。

|
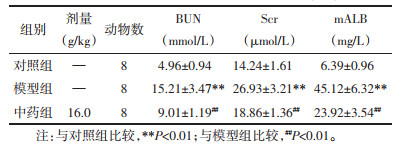
如表 3所示,与对照组相比,模型组小鼠BUN、Scr及mALB均升高(P<0.01);与模型组相比,中药组小鼠BUN、Scr及mALB均降低(P<0.01)。
|
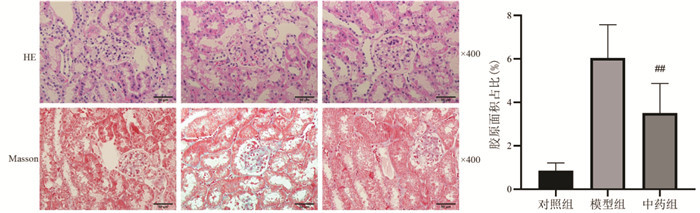
如图 1所示,对照组小鼠肾组织结构完整,未见异常病理学改变;模型组小鼠肾小球肥大,基底膜变厚,系膜细胞及基质增生,囊腔狭窄,部分球囊黏连,肾小管上皮细胞肿胀、空泡变性、脱落,间质炎性细胞浸润,间质纤维化。中药干预后小鼠肾脏病理改变减轻,炎症浸润减少,系膜细胞及基质增生减低。Image Pro Plus6.0半定量分析结果显示对照小鼠肾脏胶原沉积较少,而模型组小鼠肾脏胶原沉积明显增加(P<0.01),经中药干预后,DKD小鼠肾脏胶原纤维明显减少(P<0.01)。
|
| 注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。 图 1 加减补阳还五汤对DKD小鼠肾组织病理变化的影响(x±s,n=6) Fig. 1 Effects of modified Buyang Huanwu Decoction on renal histopathology in DKD mice(x±s, n=6) |
如图 2所示,与对照组相比,模型组小鼠肾组织P62升高,SIRT1、Agt7、LC3B-Ⅱ/LC3B-Ⅰ、Beclin-1降低(P<0.01);与模型组相比,中药组小鼠肾组织P62降低,SIRT1、Agt7、LC3B-Ⅱ/LC3B-I、Beclin-1升高(P<0.05或P<0.01)。

|
| 注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 2 加减补阳还五汤对DKD小鼠肾组织自噬相关蛋白表达的影响(x±s,n=3) Fig. 2 Effect of modified Buyang Huanwu Decoction on the autophagy-related proteins in renal tissue of DKD mice(x±s, n=3) |
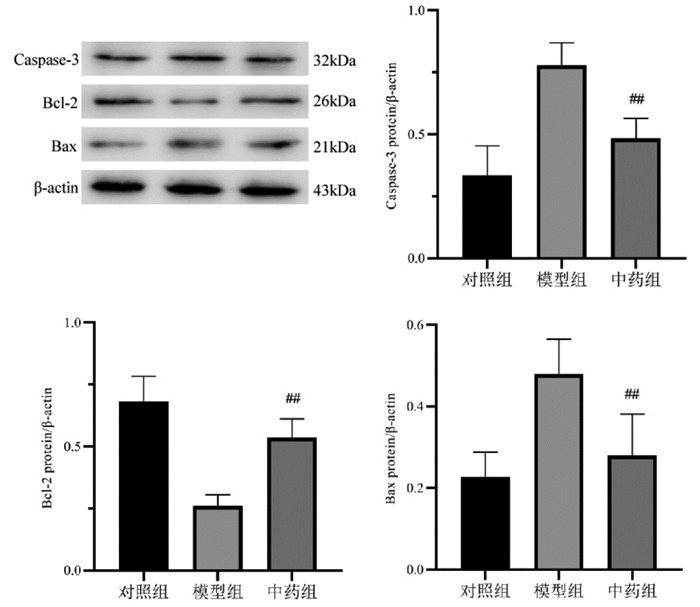
如图 3所示,与对照组相比,模型组小鼠肾组织Bcl-2降低、Caspase-3、Bax升高(P<0.01);与模型组相比,中药组小鼠肾组织Bcl-2升高、Caspase-3、Bax降低(P<0.01)。
|
| 注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。 图 3 加减补阳还五汤对DKD小鼠肾组织凋亡相关蛋白表达的影响(x±s,n=3) Fig. 3 Effect of modified Buyang Huanwu Decoction on the apoptosis-related proteins in renal tissue of DKD mice(x±s, n=3) |
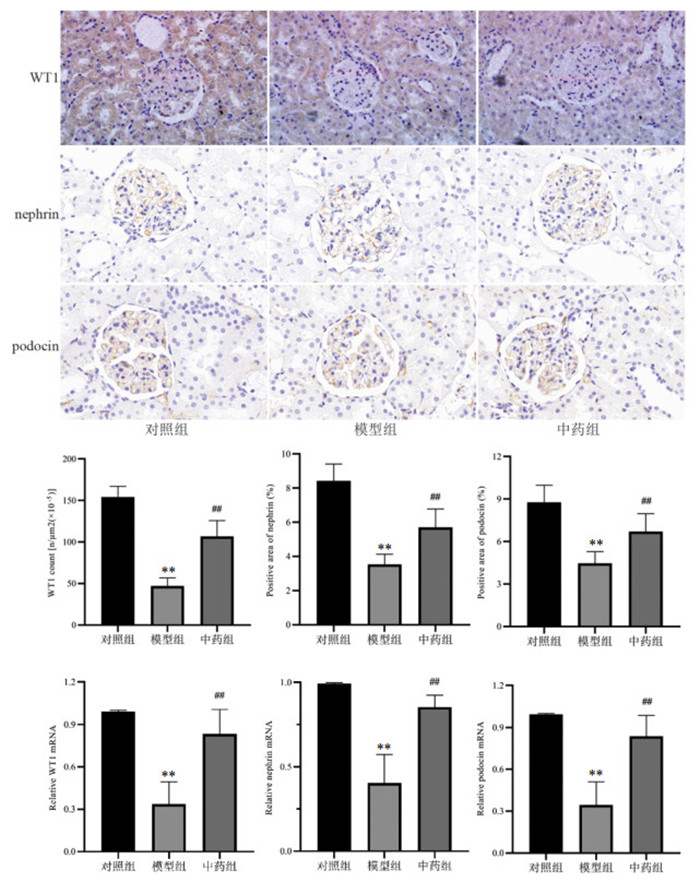
如图 4所示,与对照组相比,模型组小鼠肾组织WT1、nephrin和podocin的蛋白及mRNA表达均降低(P<0.01);与模型组相比,中药组小鼠肾组织WT1、nephrin和podocin的蛋白及mRNA的表达均升高(P<0.01)。
|
| 注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。 图 4 加减补阳还五汤对DKD小鼠肾组织WT1、nephrin和podocin的蛋白及mRNA的影响(x±s,n=3) Fig. 4 Effect of modified Buyang Huanwu Decoction on the proteins and mRNA of WT1, nephrin and podocin in renal tissue of DKD mice(x±s, n=3) |
加减补阳还五汤是在清代河北玉田名医的经典名方补阳还五汤的基础上进行化裁而成。方中以黄芪大补脾胃之元气,令气旺血行,瘀去络通,是为君药;生地黄滋阴补肾填精,肾精足肾气生,肾气化则水湿行,为臣药。丹参、当归甘温质润,养血活血,化瘀而不伤血,同时伍以川芎辛散温通,上行头目,中开郁结,下行血海,旁通络脉,助丹参、当归活血祛瘀;久病入络,故再以水蛭、地龙逐瘀通络、散结消癥,另外二药味咸寒,尚可清病邪久留之郁热,共为佐使之药。诸药合用补气而不壅滞,活血又不伤正,如此则气旺、瘀消、湿化、络通,诸症向愈。该中药复方的组方配伍正契合了DKD气虚血瘀的核心病机[7]。现代研究也发现益气化瘀中药能够改善糖脂代谢,保护血管内皮,抗炎、抗氧化应激,调节自噬,改善微循环,恢复凝血及纤溶系统平衡[7]。本研究发现加减补阳还五汤能够降低DKD小鼠血脂及mALB水平,保护肾功能,但对血糖水平无明显影响,说明其具有独立于血糖的肾脏保护机制。
自噬是一种细胞内降解系统,通过在包括饥饿、缺氧和内质网应激在内的应激条件下去除受损蛋白质和细胞器来维持细胞内稳态[11]。因此,自噬是维持细胞稳态所必需的[12]。最近的证据表明,自噬参与多种疾病的发生发展,包括传染病、炎症性肠病和神经退行性疾病[13]。此外,自噬缺陷也与DKD的发病机制有关,抑制自噬会加重肾脏纤维化[4-5]。自噬活性的激活和恢复可能是延缓DKD进展的肾脏保护策略[14]。Beclin-1作为自噬标记蛋白之一[15],是自噬小体形成的必需分子,可将自噬相关蛋白定位于吞噬泡[16]。LC3也是自噬标记蛋白,LC3前体被半胱氨酸蛋白酶裂解生成LC3B-Ⅰ。当自噬体形成时,LC3B-Ⅰ可与自噬体膜上的磷脂酰乙醇胺共价结合转变为LC3B-Ⅱ[17]。另外,自噬底物P62作为泛素化蛋白,位于自噬小体形成位点,是泛素化蛋白质、细胞器和微生物的受体,可将被清除的物质与底物受体相结合,其表达水平与自噬呈负相关[18]。故可通过检测Beclin-1、P62的水平及LC3B-Ⅰ向LC3B-Ⅱ的转化来评估自噬水平。本研究发现模型组小鼠肾组织P62蛋白升高,Beclin-1蛋白、LC3B-Ⅱ/LC3B-Ⅰ比值降低,表明肾组织细胞自噬受损。应用中药干预后,逆转了上述相关蛋白的表达。这表明加减补阳还五汤可以改善DKD小鼠肾组织自噬受损,促进自噬底物降解,从而发挥肾脏保护作用。
SIRT1是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖性脱乙酰酶[19]。SIRT1在DKD的发病机制和发展中起着至关重要的作用[20],临床数据表明,SIRT1的基因多态性影响患者对DKD的易感性。此外,SIRT1的上调减轻了各种糖尿病实验模型和高糖或晚期糖基化终产物刺激的肾细胞(包括足细胞、系膜细胞和肾近端小管细胞)的病理损伤。作用机制方面,SIRT1通过去乙酰化调节细胞代谢和自噬,抗炎、抗凋亡和氧化应激,从而对细胞起到保护作用[20]。SIRT1作为自噬的重要调节因子,当处于饥饿等能量缺乏状态时,NAD+含量增加从而激活SIRT1通路,通过与自噬相关基因Atg5、Atg7和Atg8形成复合体,直接使其脱乙酰化,激活自噬,因此它与自噬的发生存在紧密联系[21]。本研究发现模型组大鼠SIRT1明显下调,应该中药干预后SIRT1表达增加。
细胞凋亡在DKD的进展过程中也发挥着重要作用[22]。正常情况下,促凋亡和抗凋亡信号通路在同一条件下共存,保持动态平衡,保证环境的稳定。最近的研究表明,自噬可以通过与凋亡过程中的关键蛋白(包括Bcl-2家族成员、自噬蛋白和Caspase)相互作用来调节细胞凋亡[23]。首先,Beclin-1可以与Bcl-2结合,从而抑制自噬[23]。相反,Beclin-1从Bcl-2复合物中解离以及Beclin-1或Bcl-2的磷酸化促进自噬[24]。此外,Caspase-3对Beclin-1的切割使自噬失活并促进细胞凋亡[25]。在这项研究中,笔者观察DKD小鼠肾组织促凋亡蛋白Caspase-3表达增加,同时抗凋亡蛋白Bcl-2的表达减少,应用中药干预后逆转了Caspase-3、Bcl-2的表达。
足细胞作为终末分化细胞,再生及修复能力有限,因而足细胞损伤被认为是肾小球滤过屏障的永久性病变[26]。足细胞在基础状态下保持较高的自噬率来维持自身稳定,而足细胞特异性缺失自噬调节因子的小鼠会出现早期蛋白尿、进行性肾小球硬化和肾功能衰竭[27]。此外,足细胞密度的下降与尿白蛋白排泄率呈正相关关系[26]。肾小球内足细胞数量和密度的减少导致基底膜裸露,肾小球毛细血管塌陷,足突与肾小球包曼氏囊壁发生粘连、玻璃样病变,最终导致肾小球硬化[28]。因此,足细胞损伤是导致DKD中蛋白尿及肾小球硬化的关键因素。WT1表达于足细胞核,是成熟足细胞的特异性标志蛋白,可作为足细胞计数的标记物[29]。另外,nephrin和podocin是足细胞裂孔膜上的跨膜糖蛋白,对维持足细胞结构和功能的完整性具有重要作用,其表达的下调表明足细胞功能受损,肾小球滤过膜的通透性增加[30]。本研究发现,DKD小鼠足细胞相关蛋白podocin、nephrin表达降低,WT1表达也下降,说明足细胞数量和密度的减少,而应用中药后逆转了这一趋势。
综上所述,本研究发现,加减补阳还五汤可增强DKD小鼠肾脏细胞自噬,并抑制其凋亡,保护足细胞,进而发挥肾脏保护作用。其中SIRT1途径可能是其促进自噬的潜在途径。
| [1] |
KOYE D N, MAGLIANO D J, NELSON R G, et al. The global epidemiology of diabetes and kidney disease[J]. Advances in Chronic Kidney Disease, 2018, 25(2): 121-132. DOI:10.1053/j.ackd.2017.10.011 |
| [2] |
SAEEDI P, PETERSOHN I, SALPEA P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:Results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Research and Clinical Practice, 2019, 157(11): 107843. |
| [3] |
THOMAS M C, COOPER M E, ZIMMET P. Changing epidemiology of type 2 diabetes mellitus and associated chronic kidney disease[J]. Nature Reviews Nephrology, 2016, 12(2): 73-81. DOI:10.1038/nrneph.2015.173 |
| [4] |
YANG D Y, LIVINGSTON M J, LIU Z W, et al. Autophagy in diabetic kidney disease: Regulation, pathological role and therapeutic potential[J]. Cellular and Molecular Life Sciences, 2018, 75(4): 669-688. DOI:10.1007/s00018-017-2639-1 |
| [5] |
YANG C, CHEN X C, LI Z H, et al. SMAD3 promotes autophagy dysregulation by triggering lysosome depletion in tubular epithelial cells in diabetic nephropathy[J]. Autophagy, 2021, 17(9): 2325-2344. DOI:10.1080/15548627.2020.1824694 |
| [6] |
KOCH E A T, NAKHOUL R, NAKHOUL F, et al. Autophagy in diabetic nephropathy: A review[J]. International Urology and Nephrology, 2020, 52(9): 1705-1712. DOI:10.1007/s11255-020-02545-4 |
| [7] |
胡艳红, 杨静, 修成奎, 等. 益气活血方治疗糖尿病血管病变的研究进展[J]. 中国实验方剂学杂志, 2020, 26(8): 1-12. |
| [8] |
费佳, 马源, 朱辟疆. 朱辟疆辨治糖尿病肾病经验[J]. 山东中医药大学学报, 2019, 43(2): 167-170. |
| [9] |
肖遥, 赵进喜. 赵进喜治疗糖尿病肾病经验[J]. 中华中医药杂志, 2018, 33(1): 159-162. |
| [10] |
周梦琪, 郑慧娟, 田蕾, 等. 糖尿病肾病肾间质纤维化"肾络癥瘕聚散消长"病机内涵[J]. 中医学报, 2022, 37(2): 293-298. |
| [11] |
KUME S, MAEGAWA H. Lipotoxicity, nutrient-sensing signals, and autophagy in diabetic nephropathy[J]. JMA Journal, 2020, 3(2): 87-94. |
| [12] |
MIZUSHIMA N, LEVINE B, CUERVO A M, et al. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451(7182): 1069-1075. DOI:10.1038/nature06639 |
| [13] |
TAKABATAKE Y, KIMURA T, TAKAHASHI A, et al. Autophagy and the kidney: Health and disease[J]. Nephrology Dialysis Transplantation, 2014, 29(9): 1639-1647. DOI:10.1093/ndt/gft535 |
| [14] |
XIE J Y, YUAN Y, YAO G, et al. Nucleoporin 160(NUP160) inhibition alleviates diabetic nephropathy by activating autophagy[J]. Bioengineered, 2021, 12(1): 6390-6402. DOI:10.1080/21655979.2021.1968777 |
| [15] |
HILL S M, WROBEL L, RUBINSZTEIN D C. Post-translational modifications of Beclin 1 provide multiple strategies for autophagy regulation[J]. Cell Death and Differentiation, 2019, 26(4): 617-629. DOI:10.1038/s41418-018-0254-9 |
| [16] |
KANG R, ZEH H J, LOTZE M T, et al. The Beclin 1 network regulates autophagy and apoptosis[J]. Cell Death and Differentiation, 2011, 18(4): 571-580. DOI:10.1038/cdd.2010.191 |
| [17] |
RUNWAL G, STAMATAKOU E, SIDDIQI F H, et al. LC3-positive structures are prominent in autophagy-deficient cells[J]. Scientific Reports, 2019, 9(1): 10147. DOI:10.1038/s41598-019-46657-z |
| [18] |
ICHIMURA Y, WAGURI S, SOU Y S, et al. Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy[J]. Molecular Cell, 2013, 51(5): 618-631. DOI:10.1016/j.molcel.2013.08.003 |
| [19] |
YANG N, LIU C, WANG D W, et al. Metformin alleviates nerve injury in stroke rats by regulating SIRT1/PGC-1α pathway through miR-29c[J]. Chinese Journal of Pathophysiology, 2021, 37(1): 78-83. |
| [20] |
WANG W N, SUN W X, CHENG Y L, et al. Role of sirtuin-1 in diabetic nephropathy[J]. Journal of Molecular Medicine, 2019, 97(3): 291-309. DOI:10.1007/s00109-019-01743-7 |
| [21] |
修成奎, 付莹坤, 王强, 等. 人参-三七-川芎提取物对过氧化氢诱导内皮细胞衰老SIRT1自噬通路的机制研究[J]. 中国中药杂志, 2021, 46(23): 6216-6223. |
| [22] |
ZHENG G S, TAN Y M, SHANG Y Y, et al. CIDEC silencing attenuates diabetic nephropathy via inhibiting apoptosis and promoting autophagy[J]. Journal of Diabetes Investigation, 2021, 12(8): 1336-1345. DOI:10.1111/jdi.13534 |
| [23] |
KAUSHAL G P, CHANDRASHEKAR K, JUNCOS L A, et al. Autophagy function and regulation in kidney disease[J]. Biomolecules, 2020, 10(1): 100. DOI:10.3390/biom10010100 |
| [24] |
KLIONSKY D J, ABDELMOHSEN K, ABE A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy(3rd edition)[J]. Autophagy, 2016, 12(1): 1-222. |
| [25] |
ZHU Y S, ZHAO L X, LIU L, et al. Beclin 1 cleavage by caspase-3 inactivates autophagy and promotes apoptosis[J]. Protein & Cell, 2010, 1(5): 468-477. |
| [26] |
LIU N, XU L Q, SHI Y F, et al. Podocyte autophagy: A potential therapeutic target to prevent the progression of diabetic nephropathy[J]. Journal of Diabetes Research, 2017, 2017(4): 3560238. |
| [27] |
LIN T N, WU V C C, WANG C Y. Autophagy in chronic kidney diseases[J]. Cells, 2019, 8(1): 61. |
| [28] |
TANG F J, HAO Y R, ZHANG X, et al. Effect of echinacoside on kidney fibrosis by inhibition of TGF-β1/Smads signaling pathway in the db/db mice model of diabetic nephropathy[J]. Drug Design, Development and Therapy, 2017, 11(9): 2813-2826. |
| [29] |
郭丽琴, 陈孝文, 刘华锋. 足细胞标志蛋白及足细胞疾病[J]. 中国中西医结合肾病杂志, 2008, 9(2): 173-176. |
| [30] |
JIANG L N, CUI H, DING J. Smad3 signalling affects high glucose-induced podocyte injury via regulation of the cytoskeletal protein transgelin[J]. Nephrology, 2020, 25(9): 659-666. |
 2024, Vol. 41
2024, Vol. 41