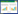文章信息
- 祁纪鸽, 张孝莹, 王丽雯, 等.
- QI Jige, ZHANG Xiaoying, WANG Liwen, et al.
- UHPLC-MS/MS同时测定清感童饮中6种有效成分在大鼠体内血药浓度及药代动力学研究
- Simultaneous determination of six active ingredient in Qinggan Tongyin by UHPLC-MS/MS and pharmacokinetics in rats
- 天津中医药, 2024, 41(4): 503-509
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 503-509
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.18
-
文章历史
- 收稿日期: 2023-11-09
2. 天津中医药大学组分中药国家重点实验室,天津 301617
“清感饮”系列制剂,由张伯礼院士团队根据多年的经验及疫情防控经验所研制,对呼吸系统感染性疾病的预防有较好的疗效,包括“清感春饮”“清感夏饮”“清感秋饮”“清感冬饮”以及“清感童饮”等[1-2]。其中,清感童饮是根据四时邪气的特点和儿童体质特征而研制,由炒牛蒡子、薏苡仁、桔梗、赤芍、紫苏叶、连翘、焦山楂、甘草、菊花、薄荷等中药组成,其中牛蒡子和连翘为主药。清感童饮可用于预防儿童咽炎、气管炎、支气管炎、流行性感冒以及呼吸系统感染性疾病,具有疏风止咳、宣肺利咽等功效,对流行性感冒及其他呼吸系统感染性疾病的预防和治疗均有较好的疗效。目前,对于清感童饮整方进行的药理、药效研究非常少。据文献报道,连翘苷是连翘中主要活性成分之一,具有抗炎、抗肥胖、抗肿瘤、抗菌、保肝、抗病毒、抗氧化等药理作用[3-4]。芍药苷是从芍药中分离出的一种化合物,具有解热、抗炎、降血糖、解痉、保护神经、抗肿瘤、抗抑郁等药理作用[5]。菊花中芹菜素等成分具有抗炎、抗肿瘤、降糖、抗病毒、抗动脉硬化、保肝以及免疫调节等药理作用[6]。木犀草素是菊花中分离出的一种黄酮类化合物,有抗炎、抗菌、抗氧化、抗病毒、降糖、降脂、抗肿瘤等药理作用[7-9]。甘草次酸是中药甘草中甘草酸的三萜苷元成分具有抗炎、抗病毒、保肝、抗肿瘤、抗氧化等多种药理作用[10-12]。
目前尚未有清感童饮整方的药代动力学相关研究,而对于其中有效成分的体内过程研究大部分是针对单独的成分在体内的药代动力学,6种有效成分各个成分在复方中的药代动力学研究较少[13-16],各成分之间是否会发生相互反应也并不明确。
本实验选取甘草次酸、连翘苷、芍药苷、木犀草素、芹菜素、连翘酚苷A等成分作为研究对象,建立了一种快速UHPLC-MS/MS检测方法,同时测定大鼠血浆中6种成分,并将该方法应用于清感童饮的大鼠血浆药代动力学研究,分析药代动力学特征,明确其在体内过程,探究清感童饮入血成分及其血药浓度与时间的变化规律,为清感童饮体内过程提供初步研究。
1 材料 1.1 实验动物SD大鼠,雄性,体质量180~220 g,来自北京通利华实验动物技术有限公司[许可证书号SCXK(北京)2016-0006]。动物饲养于天津中医药大学实验动物中心,环境温度(22±2)℃,相对湿度50%±10%,黑暗光照循环12 h,允许食物和水自发进食。动物实验经天津中医药大学实验动物伦理委员会批准(许可号:TCM-LAEC2020030)。
1.2 药品与试剂清感童饮(批号:20200802;甘草次酸、木犀草素、芹菜素、芍药苷、连翘酚酯A、连翘酚的含量分别为0.95、720.90、985.40、4 321.25、20 213.25 μg/g),由天津中医药大学附属保康医院提供。甘草次酸(批号:20041002),木犀草素(批号:20121604),芹菜素(批号:20042801),连翘酚苷A(批号:21022605),连翘苷(批号:21022608),均购自成都格利普生物科技有限公司。芍药苷(批号:200309011),槲皮苷(批号:19091104)购自成都普菲德生物技术有限公司;以上对照品纯度均≥98%。甲醇(色谱纯,德国Merck公司);乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,瑞士Fluka);乙酸乙酯(分析纯,天津津东天正);肝素钠(天津生物化学制药有限公司);实验用水为屈臣氏饮用水。
1.3 仪器AB QTRAP 4500三重四极杆质谱仪系统(美国AB SCIEX公司);LEAGENO MICRO 21R小型离心机(美国Thermo SCIENTIFIC);MS205DU电子分析天平(瑞士METTLER);Vortex-Genie2涡旋仪(美国Scientific Industries);超纯水机(美国Millipore);UC-6100超声清洗仪(天津Amerithch);EYEL4 CVE-3000低温离心浓缩仪(日本京东理化);MULTIFFUGE X3R离心机(美国Thermo SCIENTIFIC)。
2 方法与结果 2.1 色谱条件WELCN Ultimate XB-C18色谱柱(2.1 mm×100 mm,3 μm);流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱(0~2 min,20% B;2~3 min,20%~26% B;3~5 min,26%~34% B;5~7 min,34%~40% B;7~10 min,40%~60% B;10~15 min,60% B;15~15.01 min,60%~20% B;15.01~17 min,20% B);流速0.2 mL/min,进样量3 μL,柱温40 ℃。
2.2 质谱条件采用电喷雾电离源(ESI),正、负离子模式同时扫描。离子喷雾电压分别设置为4.5 KV(ESI+)或4.5 KV(ESI-);离子源温度设置为500 ℃;离子源气体Ⅰ、气体Ⅱ和气帘气体分别设置为40、50和10 psi;在正离子模式(ESI+)下分析连翘酯酚A、连翘酚、和槲皮苷(IS),在负离子模式(ESI-)下分析甘草次酸、木犀草素、芹菜素、芍药苷;检测方式:多反应检测(MRM)模式;6种待测分析物和内标的质谱参数见表 1。

|
分别精密称取甘草次酸、木犀草素、芹菜素、芍药苷、连翘酚酯A、连翘酚标准品适量至10 mL容量瓶中,加入甲醇充分溶解定容,配成1 mg/mL对照品储备液,于4 ℃冰箱中保存备用。
2.3.2 内标溶液配制精密称取槲皮苷标准品适量至10 mL容量瓶中,加入甲醇充分溶解定容,配成1 ng/mL内标储备液,于-20 ℃冰箱中保存,临用前取内标储备液适量,用甲醇稀释为100 ng/mL的内标溶液。
2.4 给药及血浆样品的采集为兼顾动物福利,减少每只大鼠的取血点,选取SD幼龄大鼠16只,大鼠随机分为两组,每组8只,进行交替取血,适应性饲养3 d后,给药前12 h禁食不禁水。本实验剂量选取临床最大给药量的1/3,16 g生药/kg,相当于临床使用124.4倍。给药按照大鼠的体质量每kg给药10 mL,单次灌胃给药清感童饮复方,分别在给药前(0 h)以及给药后0.083、0.25、0.5、0.75、1、1.5、2、4、6、8、12、24、48 h于大鼠眼眶静脉取血,置于涂有肝素钠的离心管中,3 500 r/min离心10 min,离心半径8.5 cm,分离血浆,于-80 ℃冰箱储存,直至分析。
2.5 血浆样品处理方法吸取100 μL含药血浆样本,加入10 μL内标(100 ng/mL槲皮苷),1 mL乙酸乙酯,涡旋3 min,8 000 r/min离心10 min,吸取上清1 mL,放入低温浓缩机挥干后,加入100 μL流动相50%乙腈复溶,涡旋3 min,14 000 r/min离心10 min,离心半径8.5 cm,吸取上清液于UHPLC-MS/MS进样分析。
2.6 方法学考察 2.6.1 专属性分别取大鼠空白血浆,空白血浆加对照品和内标,给药后的大鼠血浆样品加内标,按2.5项操作,并按2.1项和2.2项下的条件进行UHPLC-MS/MS分析,分别得到空白血浆色谱图;空白血浆加对照品色谱图;给药后血浆样品色谱图,见图 1,结果显示各待测成分未受到血浆中杂质及内源性物质的干扰,且待测成分与内标可实现完全分离,表明所建立的方法专属性良好。

|
| 注:A,空白血浆;B,空白血浆加对照品;C,清感童饮含药血浆样品色谱图;1.甘草次酸;2.木犀草素;3.芹菜素;4.芍药苷;5.连翘酚苷 A;6.连翘苷;7.槲皮苷(IS);6 号成分的峰为第 2 个峰。 图 1 大鼠血浆中主要入血成分及内标(IS)的MRM色谱图 Fig. 1 MRM chromatograms of 6 active ingredients and IS |
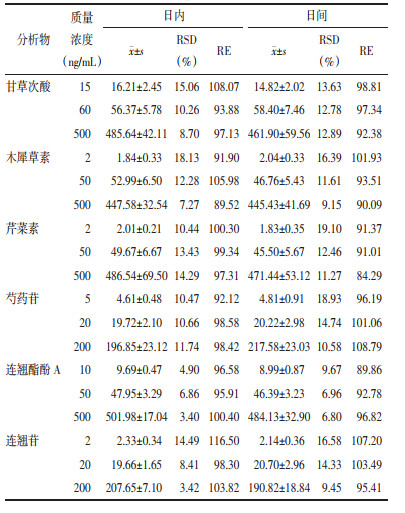
分别取对照品100 μL加入离心管,挥干后各加入100 μL大鼠空白血浆后,按2.5项下进行处理,每条标准曲线包含7个浓度。分别以各成分质量浓度(ng/mL)为横坐标(X),相应样品峰面积与内标峰面积比值为纵坐标(Y),采用加权最小二乘法进行回归运算,权重为1/X2,绘制标准曲线。结果表明,各化合物在相应范围内线性关系良好(r>0.99)符合生物样本分析方法的要求。各待测成分的标准曲线方程,相关系数,线性范围及定量限见表 2。
|
按2.6.2项下分别配置6种成分大鼠血浆低、中、高3个浓度的质量控制样品(QC),每个浓度平行配置5个样品,按“2.5项”操作,考察日内精密度。每个浓度平行制备5份样品,连续测定3 d,考察日间精密度。通过相对误差(RE%)描述准确度,以相对标准偏差(RSD%)评估精密度。血浆中的6种成分在质控浓度下的日内、日间准确度RE、RSD值如表 3。结果表明该方法的准确度和精密度均在可接受的范围内,6种化合物在大鼠血浆样品中的测定方法准确可信,精密度准确度良好。
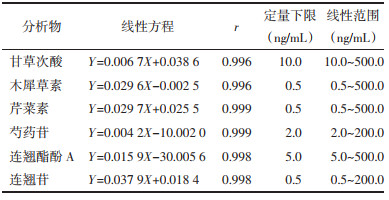
按2.6.2项下分别配制低、中、高3个浓度的QC样品100 μL,挥干后,加内标,空白血浆,乙酸乙酯,处理后进样,测得相应峰面积A;取空白血浆,加乙酸乙酯,取上清挥干后,加入QC样品,加内标,取上清挥干,复溶进样,测得相应峰面积B;取QC样品,加内标,取上清挥干后,复溶进样,测定相应峰面积C。提取回收率=A/B×100%;基质效应=B/C×100%。结果表明,血浆中的甘草次酸、木犀草素、芹菜素、芍药苷、连翘酚苷A与连翘苷的提取回收率在86.03%~114.52%,基质效应在85.10%~109.54%,见表 4,表明大鼠血浆中的内源性物质对待测成分的检测影响较小,且血浆中样品的提取回收率符合测定的要求。
|
取空白血浆100 μL,按2.5项下操作处理挥干后,分别加入高、中、低浓度的样品,涡旋挥干后,在自动进样器中放置6 h,考察其短期稳定性;3 d内进行3次冻融循环(样品在-80 ℃冷冻24 h后,在室温下完全解冻30 min),考察其冻融循环稳定性;-80 ℃放置7 d,考察其长期稳定性,每个浓度的样品平行配制5份。结果见表 5,样品中在上述3种储存条件下的低浓度RSD均小于19.32%,中高浓度RSD均小于14.03%,符合生物样品测定要求。
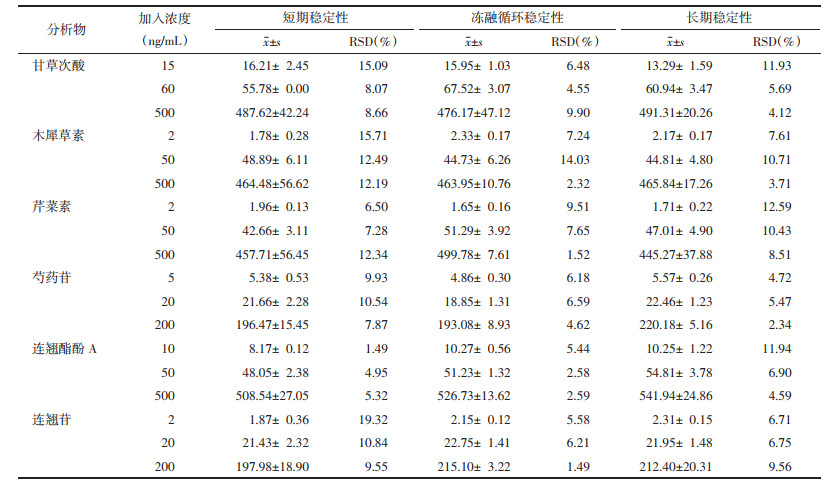
|
大鼠单次灌胃清感童饮后,采用建立的UHPLC-MS/MS分析方法测定6种待测成分各时间点的血药浓度。其平均血药浓度-时间曲线图如图 2。采用DAS3.0软件进行非房室模型拟合,计算达峰时间(Tmax),最大血药浓度(Cmax),血药浓度-时间曲线下面积(AUC),消除半衰期(t1/2z),平均驻留时间(MRT)等药动学参数,结果见表 6。
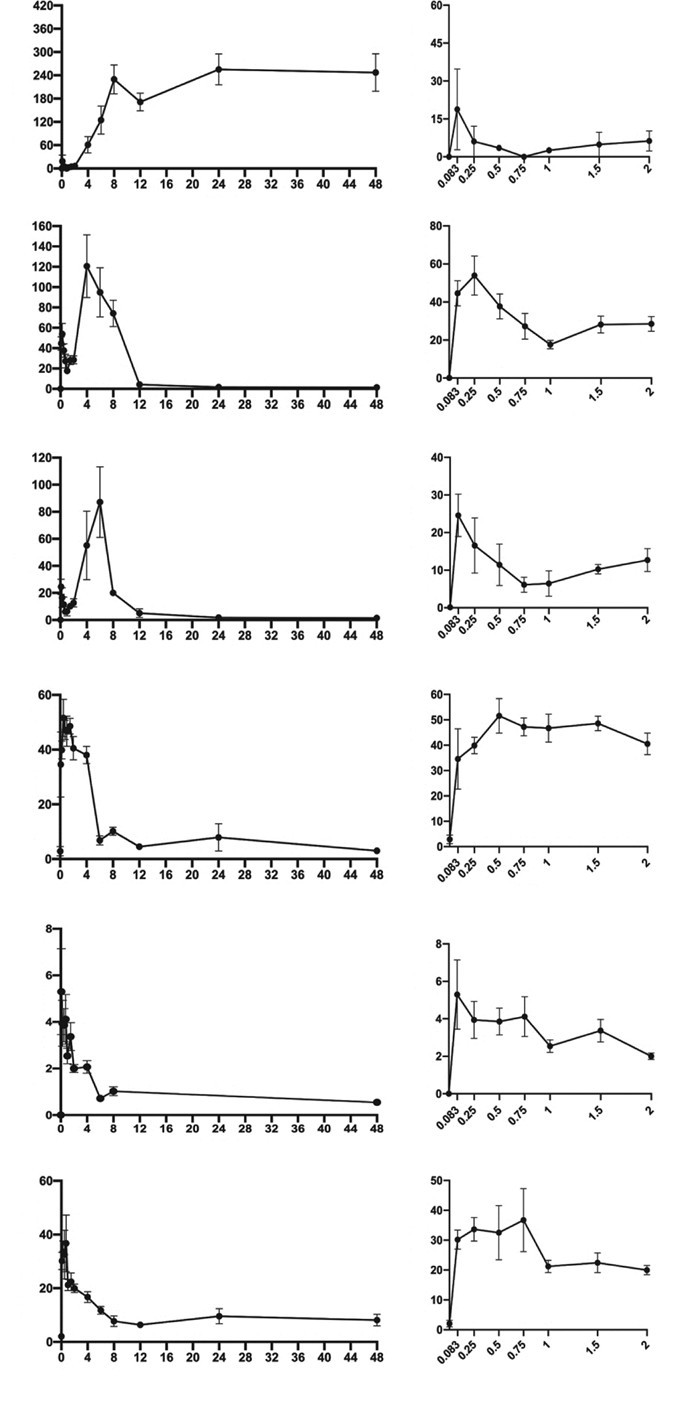
|
| 图 2 大鼠灌胃清感童饮后6种成分的血药浓度-时间曲线(x±s,n=8) Fig. 2 Blood concentration-time curves of 6 components after gavage of Qinggan Tongyin in rats(x±s, n=8) |

|
本课题组在对清感童饮复方进行提取,并对其供试品中17种成分进行含量测定,结果显示,连翘酚酯A、牛蒡苷、绿原酸、野黄芩苷、没食子酸、迷迭香酸、芍药内脂苷、连翘苷含量较高。给大鼠灌胃16 g生药/kg剂量的清感童饮后,在0~24 h内,在大鼠含药血浆中能检测到含量较高的有6种成分,分别为甘草次酸、木犀草素、芹菜素、芍药苷、连翘酚酯A、连翘酚,其中甘草次酸含量最高,这可能是药物发挥作用的重要成分,其余各成分在大鼠含药血浆中含量均低于定量限。
本实验建立了1种快速UHPLC-MS/MS检测方法,同时测定大鼠血浆中6种成分的分析方法,对此方法进行了验证。并将该方法应用于血浆药代动力学研究,测定了6种成分在大鼠体内的血药浓度,并计算药代动力学参数。
3.1 前处理方法、流动相、内标物的选择在实验前期对样品前处理方法、色谱条件的选择、内标的选择都进行了优化调整。样品前处理方法考察了蛋白沉淀法[17]和有机溶剂萃取两种方法,经考察发现乙酸乙酯处理后的血浆中各成分检测限均低于使用甲醇沉淀法处理,并可以检测到更多成分,所以最终选用乙酸乙酯萃取法处理大鼠血浆;色谱条件选择水-乙腈系统,但部分成分响应较低,在水相中加入0.1%甲酸后峰形、峰高的响应值均有一定改善;内标物选择了与血浆中含量较高的两种成分木犀草素和连翘酚酯A结构相近的化合物分别是槲皮苷和野黄芩苷,经过对比槲皮苷无内源性干扰,响应较为稳定,故选用槲皮苷作为所有成分的内标物。
3.2 药代动力学结果药代动力学结果显示,大鼠灌胃给药清感童饮后,6种成分按达峰时间(Tmax)由快到慢排列,依次为连翘酚酯A > 连翘苷 > 芍药苷 > 木犀草素 > 芹菜素 > 甘草次酸。其中芍药苷、连翘苷、连翘酚酯A的Tmax在0.44~0.56 h,表明这几种成分在体内的吸收速率较快;甘草次酸的Cmax为(318.09±121.06)μg/L,AUC0-t为(9 738.83±3 146.61)(h·μg)/L,MRT0-t为(23.19±1.16)h,在血浆中的暴露水平明显高于其他成分,但清感童饮复方中甘草次酸含量并不高,有研究表明[18]甘草酸在体内脱去两分子葡萄糖醛酸后可转化为甘草次酸,并且甘草酸在体内主要以甘草次酸形式存在,推测有其他成分如甘草酸等在体内代谢为甘草次酸,使其在体内暴露水平升高,且消除较慢;图 2显示芹菜素、木犀草素出现了双峰现象,推测该成分可能存在肝肠循环现象,该现象对药物在体内的暴露有重要意义[19];药代动力学结果显示,甘草次酸、木犀草素、连翘酚酯A、芍药苷的含量较高,是主要的入血成分,值得关注的是,课题组前期实验发现,炒牛蒡子作为清感童饮的君药,在清感童饮复方中含量高,但入血后暴露水平较低,文献报道[20]牛蒡子苷在体内主要转化为牛蒡子苷元,但牛蒡子苷元入血后暴露水平也较低,推测清感童饮中某些成分阻碍其暴露,具有深入研究其药效机制的必要。
本研究采用UHPLC-MS/MS建立了测定大鼠灌胃清感童饮后血浆中6种主要活性组分血药浓度的方法,经方法学考察符合生物样品测定的要求,并对上述6种成分大鼠体内药动学特征进行了研究,阐述了6种成分在大鼠血浆中的药代参数情况,为清感童饮的进一步开发提供研究基础。
| [1] |
任明, 付鲲, 周胜元, 等. "清感饮"系列制剂临床应用专家共识[J]. 天津中医药, 2020, 37(11): 1201-1204. DOI:10.11656/j.issn.1672-1519.2020.11.01 |
| [2] |
昝树杰, 雒明池, 王凯, 等. "清感饮"组方思路及新冠肺炎特色探讨[J]. 天津中医药大学学报, 2022, 41(2): 144-147. |
| [3] |
ZHOU C Y, LU M Y, CHENG J L, et al. Review on the pharmacological properties of phillyrin[J]. Molecules, 2022, 27(12): 3670. DOI:10.3390/molecules27123670 |
| [4] |
LI C, YAO Z H, QIN Z F, et al. Isolation and identification of phase I metabolites of phillyrin in rats[J]. Fitoterapia, 2014, 97: 92-97. DOI:10.1016/j.fitote.2014.05.011 |
| [5] |
车娅莉, 张文武, 尚立宏, 等. 芍药苷研究进展[J]. 中兽医医药杂志, 2021, 40(4): 47-51. |
| [6] |
付海洋, 姜良勇, 齐亚军, 等. 芹菜素药理作用的研究进展[J]. 国际药学研究杂志, 2020, 47(10): 787-792, 797. |
| [7] |
王琪, 李坤伟, 周长征. 木犀草素的药理作用及制剂研究进展[J]. 北京联合大学学报, 2022, 36(1): 59-63. |
| [8] |
赵长祺, 郭志义. 木犀草素的药理作用研究进展[J]. 承德医学院学报, 2015, 32(2): 148-150. |
| [9] |
王继双, 何焱, 张文静, 等. 木犀草素的药理作用研究进展[J]. 生命科学, 2013, 25(6): 560-565. |
| [10] |
SALOMATINA O V, MARKOV A V, LOGASHENKO E B, et al. Synthesis of novel 2-cyano substituted glycyrrhetinic acid derivatives as inhibitors of cancer cells growth and NO production in LPS-activated J-774 cells[J]. Bioorganic & Medicinal Chemistry, 2014, 22(1): 585-593. |
| [11] |
李玉山. 甘草次酸的药理作用及制备工艺研究进展[J]. 化学与黏合, 2015, 37(6): 458-463. |
| [12] |
智信, 陈晓, 苏佳灿. 甘草次酸药理作用研究进展[J]. 现代中西医结合杂志, 2019, 28(25): 2847-2850. |
| [13] |
韩彬. 芍药苷药代动力学研究进展[J]. 内蒙古中医药, 2016, 35(8): 137-139. |
| [14] |
张宇, 常佩亮, 夏薇, 等. 反高效液相色谱法研究芹菜素在大鼠体内的药代动力学及组织分布[J]. 中华疾病控制杂志, 2009, 13(1): 79-82. |
| [15] |
岑少婷, 丘娜. 连翘苷的大鼠血浆药物代谢动力学研究[J]. 按摩与康复医学, 2022, 13(17): 77-80. |
| [16] |
张军, 陈玟, 居文政, 等. LC-MS/MS法测定人血浆中甘草次酸及其临床药代动力学研究[J]. 中国药理学通报, 2011, 27(9): 1313-1316. |
| [17] |
CHEN X Q, WEI L T, PU X P, et al. Pharmacokinetics and tissue distribution study of 15 ingredients of Polygonum chinense Linn extract in rats by UHPLC-MS/MS[J]. Biomedical Chromatography, 2021, 35(2): e4975. DOI:10.1002/bmc.4975 |
| [18] |
温静. 四逆散抗肝损伤药效物质基础与配伍机理研究[D]. 沈阳: 沈阳药科大学, 2012.
|
| [19] |
孙莎莎, 陈冰. 肝肠循环对霉酚酸药动学作用及其影响因素研究进展[J]. 中国药师, 2022, 25(4): 688-692. |
| [20] |
尤文雅, 张亚昆, 赵逍遥, 等. 中药牛蒡子主要活性成分微生物转化研究进展[J]. 药学进展, 2020, 44(2): 112-118. |
2. State Key Laboratory for Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41