文章信息
- 陈晓婷, 潘保朝, 王元松, 等.
- CHEN Xiaoting, PAN Baochao, WANG Yuansong, et al.
- 藏红花素抑制铁死亡改善糖尿病肾病的机制研究
- Mechanism of crocin treatment on improving diabetic nephropathy by inhibiting ferroptosis
- 天津中医药, 2024, 41(4): 510-516
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 510-516
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.19
-
文章历史
- 收稿日期: 2014-01-11
糖尿病肾病(DN)是2型糖尿病(T2DM)的常见并发症,主要与体内长期的高糖环境导致的肾脏结构和功能损害有关,已成为全球终末期肾脏疾病的主要原因[1]。DN发病隐匿、患病率高且后期预后较差[2]。目前治疗DN主要以降血糖、降血压、调血脂、减少尿蛋白为主[3],治疗手段局限且不良反应明显[4]。而随着中国DN发病率逐年升高,开发安全可靠的药物用于DN的早期干预及后期治疗迫在眉睫。
中医药在DN的治疗中具有巨大的优势[5]。槲皮素可能通过靶向丝裂原活化蛋白激酶(MAPK)信号传导在T2DM中具有治疗作用[6]。桔梗皂苷D可以通过抑制肾脏氧化应激和炎症反应,缓解DN肾损伤[7]。酸枣仁皂苷A和薯蓣皂苷均能通过激活线粒体自噬,抑制肾脏氧化应激和细胞死亡,从而缓解肾损伤[8-9]。
藏红花素(CRO)是传统中药藏红花的主要活性成分,具有抗炎、抗氧化等多种作用[10],有研究发现,CRO能够通过抑制氧化应激和炎症反应发挥缓解DN肾损伤的作用[11-12],但其治疗DN的作用机制尚不明晰。本研究通过建立DN小鼠模型,研究CRO对DN小鼠的治疗作用,并从脂质过氧化和铁死亡角度研究CRO治疗DN的作用机制。
1 材料 1.1 动物SPF级健康雄性C57BL/6小鼠[北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2019-0008],体质量20~22 g,5只小鼠一笼饲养于24 ℃,50%相对湿度,明暗周期12 h的室内,小鼠可以自由进食饮水。
1.2 药品与试剂铁死亡抑制剂Fer-1(货号:HY-100579,MCE);藏红花素(货号:17304,美国Sigma);BCA法微量蛋白检测试剂盒(货号:W041-1-1,南京建成生物工程研究所);牛血清白蛋白(货号:BSA,W071-1-1,南京建成生物工程研究所);Masson染液(货号:D026-1-3)、苏木素-伊红(HE)染液(货号:D006-1-4)、肌酐(Cr)测定试剂盒(货号:C011-2-1)、尿素氮(BUN)测试盒(货号:C013-2-1)、尿蛋白定量(UPQ)测试盒(货号:C035-2-1)、丙二醛(MDA)测定试剂盒(货号:A003-1-2)、活性氧(ROS)测定试剂盒(货号:E004-1-1)、4-羟基壬烯醛(4-HNE)测试盒(货号:H268-1-2)、总铁(Fe)测试盒(货号:A039-2-1)均购自南京建成生物工程研究所;TUNEL(Terminal deoxynucleotidyl transferase dUTP nick end labeling)染色试剂盒(货号:C1082)购自碧云天;一抗:前列腺六跨膜上皮抗原3(STEAP3,货号:K001723P)、转铁蛋白(TF,货号:K002787P)、重链铁蛋白(FTH1,货号:K108517P)、轻链铁蛋白(FTL,货号:K002972P)、谷胱甘肽过氧化物酶4(GPX4,货号:K113159P);二抗:羊抗兔IgG-HRP(货号:SE134)均购自北京索莱宝科技有限公司;总RNA提取试剂盒(货号:#DP419)、cDNA反转录试剂盒(货号:#KR116-02)、SYBR扩增试剂盒(货号:#P205-02)均购自天根生化科技(北京)有限公司。
1.3 仪器SpectraMax M3多功能酶标仪(美谷分子仪器有限公司);5427R高速台式冷冻离心机(艾本德中国有限公司);PowerPAC Basic电泳仪和ChemiDoc XRS凝胶成像自动分析仪(Bio-Rad公司);LEPGEN-96荧光定量PCR仪(北京乐普)。
2 方法 2.1 造模、分组与给药造模:60只小鼠适应性喂养1周,高脂饮食(HFD)继续喂养8周,之后开始造模。造模方法如下:禁食不禁水12 h后,腹腔注射链脲霉素(STZ)30 mg/kg。正常组腹腔注射等体积的1% 柠檬酸钠缓冲液。72 h后尾静脉采血测定随机血糖,以随机血糖≥ 16.7 mmol/L为T2DM成模标准。之后继续喂养,每周检测小鼠24 h尿蛋白定量(24 h-UPQ)。以随机血糖水平≥16.7 mmol/L、24 h-UPQ≥20 mg作为DN模型标准。
分组:造模结束后,随机平均分为正常组、模型组、铁死亡抑制剂组(Fe-1)、低剂量CRO组(CROL)、中剂量CRO组(CROM)、高剂量CRO组(CROH)6组。
给药与取样:正常组与模型组每天灌胃0.2 mL生理盐水,Fe-1组每天灌胃10 mg/kg Ferrostatin-1,CROL、CROM和CROH组每天分别灌胃5、10、20 mg/kg CRO,CRO剂量根据之前报道设计[12]。连续给药8周后,使用代谢笼收集各组小鼠24 h尿液样本。通过目内眦取血获得血液样本。安乐死后打开腹腔,收集左侧肾脏固定于4%多聚甲醛中,右侧肾脏冷冻保存。
2.2 肾功能与脂质过氧化相关指标检测将收集的24 h尿液在4 000×g离心10 min,随后分离上清液,使用试剂盒24 h-UPQ的含量。血液4 000×g离心15 min,收集血清,使用试剂盒测定Cr、BUN水平。取部分冷冻的肾组织1∶9与生理盐水混合匀浆,4 000×g离心20 min后收集上清液,使用试剂盒测定脂质过氧化相关指标MDA、ROS、4-HNE水平,使用试剂盒测定肾组织Fe水平,同时检测组织匀浆中总蛋白浓度对样本进行均一化处理。
2.3 病理学染色取出用4%多聚甲醛溶液固定好的肾脏组织脱水、包埋并切片(4 μm),然后分别进行HE、Masson和TUNEL染色,观察肾脏组织病理形态与纤维化情况。
2.4 实时荧光定量反转录聚合酶连锁反应(RT-qPCR)检测铁死亡相关基因表达按照总RNA提取试剂盒的方法从肾组织及细胞中提取总RNA,之后反转录获得cDNA,最后使用qPCR测定目的基因的mRNA表达量。引物序列见表 1,使用2-ΔΔCT法基于Actb计算目标mRNA相对表达量。
取30 mg肾组织提取总蛋白,BCA法测定蛋白浓度。提取的蛋白质通过SDS-PAGE分离后电转到PVDF膜。使用5%脱脂奶粉溶液封闭膜2 h,随后用目的蛋白的抗体在4 ℃下孵育过夜。用TBST清洗3次孵育后的膜,然后用HRP标记的二抗在室温下培养2 h,再次洗膜后经ECL化学发光显影,最后使用Image J软件对条带进行量化分析。
2.6 统计学分析采用Excel 2022以及SPSS Pro在线数据分析平台进行数据分析,实验数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异具有统计学意义。
3 结果 3.1 CRO对DN小鼠的治疗作用肾功能检测结果显示,与正常组相比,模型组DN小鼠血清中Cr、BUN水平以及24 h-UPQ含量显著升高;与模型组相比,Fe-1组以及CROL、CROM、CROH组DN小鼠血清Cr、BUN水平均有不同程度的降低,Fe-1组和CROH组DN小鼠24 h-UPQ含量显著降低(图 1A-1C)。HE和Masson染色结果发现,与正常组相比,模型组出现肾小球肥大、系膜基质增生和肾小球基底膜增厚等病变,Fe-1组以及CROL、CROM、CROH组DN小鼠肾脏病理损伤均有不同程度的好转(图 1D,1E)。

|
| 注:正常组(Control)、模型组(Model)、铁死亡抑制剂组(Fe-1)、低剂量CRO组(CROL)、中剂量CRO组(CROM)、高剂量CRO组(CROH);与正常组比较,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01,n=10。 图 1 CRO对DN小鼠血清Cr、BUN、24 h-UPQ以及HE、Masson染色的影响 Fig. 1 Effects of CRO on serum Cr, BUN, 24 h-UPQ, HE, and Masson staining in DN mice |
与正常组比较,模型组DN小鼠肾组织MDA、ROS、4-HNE水平显著提高;与模型组比较,Fe-1组以及CROL、CROM、CROH组DN小鼠肾组织MDA、ROS、4-HNE水平显著降低(图 2A-2C)。

|
| 注:A,MDA的结果;B,ROS的结果;C,4-HNE的结果;D,TUNEL染色;E,TUNEL染色定量结果;正常组(Control)、模型组(Model)、铁死亡抑制剂组(Fe-1)、低剂量CRO组(CROL)、中剂量CRO组(CROM)、高剂量CRO组(CROH);与正常组比较,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01;图A-C,n=10;图D、图E,n=3。 图 2 CRO对DN小鼠脂质过氧化及细胞死亡的影响 Fig. 2 Effects of CRO on lipid peroxidation and apoptosis in DN mice |
肾组织TUNEL染色结果显示,与正常组相比,模型组肾组织中出现大量绿色荧光,表明肾组织发生细胞死亡。与模型组相比,Fe-1组以及CROL、CROM、CROH组肾组织中荧光阳性反应明显减弱(图 2D,2E)。
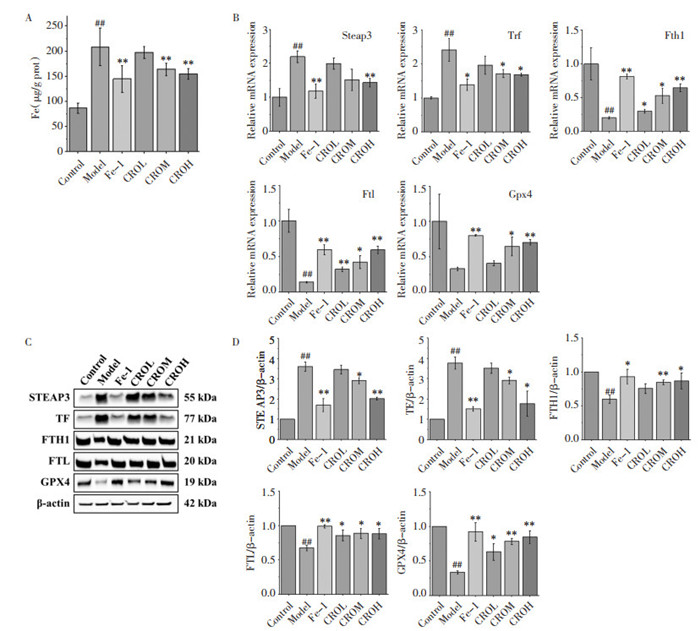
3.3 CRO对DN小鼠铁死亡的影响对肾组织Fe水平检测发现,与正常组相比,模型组肾组织Fe水平明显升高,与模型组相比,Fe-1组以及CROM、CROH组肾组织Fe水平出现不同程度降低(图 3A)。
|
| 注:A,肾组织Fe水平;B,RT-qPCR结果;C,Western blot结果;D,Western blot定量结果;正常组(Control)、模型组(Model)、铁死亡抑制剂组(Fe-1)、低剂量CRO组(CROL)、中剂量CRO组(CROM)、高剂量CRO组(CROH);与正常组比较,#P < 0.05,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01;图A-D,n=3。 图 3 CRO对DN小鼠铁死亡的影响 Fig. 3 Effects of CRO on ferroptosis in DN mice |
RT-qPCR结果显示,与正常组相比,模型组DN小鼠肾组织Steap3、Trf mRNA表达明显升高,Fth1、Ftl、Gpx4 mRNA表达明显降低;与模型组相比,Fe-1组以及CROL、CROM、CROH组DN小鼠肾组织Steap3、Trf mRNA表达出现不同程度降低,Fth1、Ftl、Gpx4 mRNA表达出现不同程度升高(图 3B)。
Western blot结果显示,与正常组相比,模型组DN小鼠肾组织中STEAP3与TF蛋白表达明显升高,FTH1、FTL以及GPX4蛋白表达明显降低;与模型组相比,Fe-1组以及CROL、CROM、CROH组DN小鼠肾组织中STEAP3与TF蛋白表达不同程度降低,FTH1、FTL以及GPX4蛋白表达不同程度升高(图 3C,3D)。
4 讨论HFD饮食联合STZ注射诱导是一种经典的DN模型造模方法,造模成功后可以表现出与人类DN相似的症状[13]。HFD饮食可诱发小鼠的胰岛素抵抗,STZ注射后可使小鼠胰腺β细胞坏死引发胰岛素分泌功能丧失,两者联合使用可引发肾脏功能性病变与损伤[14]。24 h-UPQ、Cr、BUN是评估DN的敏感指标,主要反映肾小球滤过功能受损情况,水平升高提示肾功能减退[15-17]。本研究中DN小鼠肾脏出现严重病变,主要表现为肾小球和肾小管上皮细胞肥大,基底膜增厚等,与上述症状相当,提示造模成功。Fe-1与CRO治疗后有效地改善了上述DN症状,但其作用机制尚不清楚,需要进一步研究。
有研究表明,脂质过氧化在DN发展中起到了重要的作用[18]。因此,本研究接下来检测了MDA、ROS、4-HNE等指标以便研究CRO对DN小鼠脂质过氧化的影响。在高糖环境中,机体产生的ROS明显升高,细胞膜脂质双层中的ω-6多不饱和脂肪酸如亚油酸及花生四烯酸在ROS的作用下发生脂质过氧化[19-20],产生MDA以及4-HNE等醛基产物,影响细胞的信号转导及基因表达[21-22]。极低浓度的MDA和4-HNE可参与机体的正常生理活动,而当其浓度升高时则可通过多种途径产生细胞毒性作用,导致细胞死亡[23-24]。本研究发现,CRO干预可降低DN小鼠MDA、ROS、4-HNE水平,抑制脂质过氧化,减少肾组织细胞死亡,进而缓解DN肾损伤。
研究表明,过量脂质过氧化物的产生会导致细胞发生铁死亡[25]。铁死亡与DN发展有着非常密切的联系。1项回顾性研究显示,与健康人群相比,DN患者的肾小管上皮细胞显示出更高的铁沉积和转铁蛋白表达[26]。而另1项体外实验表明,铁死亡激动剂(如RSL3)能够诱导肾小管细胞死亡,促进DN进程[27]。因此,本研究检测了铁死亡相关因子(Fe水平、STEAP3、TF、FTH1、FTL和GPX4)的表达以探究CRO对DN小鼠铁死亡的影响。铁死亡主要与铁代谢紊乱、GPX4抗氧化以及脂质过氧化有关[28]。生理状态下,Fe3+经由TF进入细胞内,并被STEAP3还原成Fe2+,Fe2+可以与铁蛋白(FTH1/FTL)结合储存于细胞内,也可被氧化成Fe3+通过膜转铁蛋白转出细胞,参与体内铁循环,维持机体铁稳态[29-30]。有研究表明,高血糖会导致铁过载,当铁过载时,高浓度的Fe2+发生芬顿反应,产生ROS造成细胞膜氧化损伤,最终导致细胞铁死亡[31]。本研究发现,模型组DN小鼠肾组织Fe水平显著高于正常组,这可能与其STEAP3与TF显著升高以及FTH1与FTL显著降低有关,而CRO干预改善了上述指标,减轻了DN小鼠肾组织铁死亡。此外,GPX4是已知的唯一能够直接清除脂质过氧化物的酶,在铁死亡的过程中发挥核心调控的作用,敲除GPX4相关基因或使用GPX4抑制剂(如RSL3)将会诱导细胞铁死亡[32]。本研究发现,CRO可上调GPX4表达,进而清除ROS,抑制脂质过氧化,减轻细胞铁死亡,最终缓解DN肾损伤。为了进一步确定CRO治疗DN的作用机制,本研究选取铁死亡抑制剂Fe-1作为阳性对照,结果表明,CRO发挥了与Fe-1相近的治疗作用。
综上所述,CRO可以通过抑制脂质过氧化并减轻细胞铁死亡发挥对DN小鼠肾脏的保护作用。
| [1] |
SAMSU N. Diabetic nephropathy: Challenges in pathogenesis, diagnosis, and treatment[J]. BioMed Research International, 2021, 2021(7): 1497449. |
| [2] |
SELBY N M, TAAL M W. An updated overview of diabetic nephropathy: Diagnosis, prognosis, treatment goals and latest guidelines[J]. Diabetes, Obesity & Metabolism, 2020, 22(Suppl 1): 3-15. |
| [3] |
RODRIGUEZ F, LEE D J, GAD S S, et al. Real-world diagnosis and treatment of diabetic kidney disease[J]. Advances in Therapy, 2021, 38(8): 4425-4441. DOI:10.1007/s12325-021-01777-9 |
| [4] |
HU Q C, CHEN Y, DENG X Y, et al. Diabetic nephropathy: Focusing on pathological signals, clinical treatment, and dietary regulation[J]. Biomedecine & Pharmacotherapie, 2023, 159(1): 114252. |
| [5] |
NIE Q X, CHEN H H, HU J L, et al. Dietary compounds and traditional Chinese medicine ameliorate type 2 diabetes by modulating gut microbiota[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(6): 848-863. DOI:10.1080/10408398.2018.1536646 |
| [6] |
ZU G X, SUN K Y, LI L, et al. Mechanism of quercetin therapeutic targets for Alzheimer disease and type 2 diabetes mellitus[J]. Scientific Reports, 2021, 11(1): 22959. DOI:10.1038/s41598-021-02248-5 |
| [7] |
吴浩, 符丽珍, 赵勇, 等. 桔梗皂苷D通过介导PI3K/Akt/mTOR信号通路调节氧化应激改善糖尿病肾病模型大鼠肾损伤[J]. 中国药理学与毒理学杂志, 2022, 36(3): 170-176. DOI:10.3867/j.issn.1000-3002.2022.03.002 |
| [8] |
ZHONG Y J, LUO R L, LIU Q, et al. Jujuboside A ameliorates high fat diet and streptozotocin induced diabetic nephropathy via suppressing oxidative stress, apoptosis, and enhancing autophagy[J]. Food and Chemical Toxicology, 2022, 159(11): 112697. |
| [9] |
ZHONG Y J, LIU J Y, SUN D J, et al. Dioscin relieves diabetic nephropathy via suppressing oxidative stress and apoptosis, and improving mitochondrial quality and quantity control[J]. Food & Function, 2022, 13(6): 3660-3673. |
| [10] |
YARIBEYGI H, NOROOZADEH A, MOHAMMADI M T, et al. Crocin improves oxidative stress by potentiating intrinsic anti-oxidant defense systems in pancreatic cells during uncontrolled hyperglycemia[J]. Journal of Pharmacopuncture, 2019, 22(2): 83-89. DOI:10.3831/KPI.2019.22.010 |
| [11] |
YARIBEYGI H, MOHAMMADI M T, REZAEE R, et al. Crocin improves renal function by declining Nox-4, IL-18, and p53 expression levels in an experimental model of diabetic nephropathy[J]. Journal of Cellular Biochemistry, 2018, 119(7): 6080-6093. DOI:10.1002/jcb.26806 |
| [12] |
ALTINOZ E, ONER Z, ELBE H, et al. Protective effects of saffron(its active constituent, crocin) on nephropathy in streptozotocin-induced diabetic rats[J]. Human & Experimental Toxicology, 2015, 34(2): 127-134. |
| [13] |
HUANG W, MAN Y, GAO C L, et al. Short-chain fatty acids ameliorate diabetic nephropathy via GPR43-mediated inhibition of oxidative stress and NF-κB signaling[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020(8): 4074832. |
| [14] |
JU Y H, SU Y, CHEN Q Q, et al. Protective effects of Astragaloside Ⅳ on endoplasmic reticulum stress-induced renal tubular epithelial cells apoptosis in type 2 diabetic nephropathy rats[J]. Biomedecine & Pharmacotherapie, 2019, 109(1): 84-92. |
| [15] |
BELLOMO R, KELLUM J A, RONCO C. Acute kidney injury[J]. Lancet, 2012, 380(9843): 756-766. DOI:10.1016/S0140-6736(11)61454-2 |
| [16] |
LEVEY A S, JAMES M T. Acute kidney injury[J]. Annals of Internal Medicine, 2017, 167(9): ITC66-ITC80. DOI:10.7326/AITC201711070 |
| [17] |
HUANG Y, LIU W H, LIU J F, et al. Association of urinary sodium excretion and diabetic kidney disease in patients with type 2 diabetes mellitus: A cross-sectional study[J]. Frontiers in Endocrinology, 2021, 12(10): 772073. |
| [18] |
MARJANI A. Lipid peroxidation alterations in type 2 diabetic patients[J]. Pakistan Journal of Biological Sciences, 2010, 13(15): 723-730. DOI:10.3923/pjbs.2010.723.730 |
| [19] |
SCHNEIDER C, TALLMAN K A, PORTER N A, et al. Two distinct pathways of formation of 4-hydroxynonenal. Mechanisms of nonenzymatic transformation of the 9- and 13-hydroperoxides of linoleic acid to 4-hydroxyalkenals[J]. The Journal of Biological Chemistry, 2001, 276(24): 20831-20838. DOI:10.1074/jbc.M101821200 |
| [20] |
王彦江, 谢席胜, 冯胜刚. 氧化应激与糖尿病肾病足细胞损伤的研究进展[J]. 中国中西医结合肾病杂志, 2011, 12(7): 651-653. DOI:10.3969/j.issn.1009-587X.2011.07.031 |
| [21] |
YANG Y S, SHARMA R, SHARMA A, et al. Lipid peroxidation and cell cycle signaling: 4-hydroxynonenal, a key molecule in stress mediated signaling[J]. Acta Biochimica Polonica, 2003, 50(2): 319-336. DOI:10.18388/abp.2003_3689 |
| [22] |
TSIKAS D. Assessment of lipid peroxidation by measuring malondialdehyde(MDA) and relatives in biological samples: Analytical and biological challenges[J]. Analytical Biochemistry, 2017, 524(10): 13-30. |
| [23] |
CHAUDHARY P, SHARMA R, SHARMA A, et al. Mechanisms of 4-hydroxy-2-nonenal induced pro- and anti-apoptotic signaling[J]. Biochemistry, 2010, 49(29): 6263-6275. DOI:10.1021/bi100517x |
| [24] |
AYALA A, MUÑOZ M F, ARGÜELLES S. Lipid peroxidation: Production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal[J]. Oxidative Medicine and Cellular Longevity, 2014, 2014(5): 360438. |
| [25] |
YAN W C, WANG D X, WAN N, et al. Living cell-target responsive accessibility profiling reveals silibinin targeting ACSL4 for combating ferroptosis[J]. Analytical Chemistry, 2022, 94(43): 14820-14826. DOI:10.1021/acs.analchem.2c03515 |
| [26] |
ZHAO L J, ZOU Y T, ZHANG J L, et al. Serum transferrin predicts end-stage Renal Disease in Type 2 Diabetes Mellitus patients[J]. International Journal of Medical Sciences, 2020, 17(14): 2113-2124. DOI:10.7150/ijms.46259 |
| [27] |
WANG Y, BI R, QUAN F, et al. Ferroptosis involves in renal tubular cell death in diabetic nephropathy[J]. European Journal of Pharmacology, 2020, 888(9): 173574. |
| [28] |
张钦媛, 金智生, 姜晓雪, 等. 铁死亡对糖尿病及其并发症影响及中药干预进展[J]. 中国实验方剂学杂志, 2023, 1-10. |
| [29] |
PLAYS M, MÜLLER S, RODRIGUEZ R. Chemistry and biology of ferritin[J]. Metallomics: Integrated Biometal Science, 2021, 13(5): mfab021. DOI:10.1093/mtomcs/mfab021 |
| [30] |
DONG H, QIANG Z Z, CHAI D D, et al. Nrf2 inhibits ferroptosis and protects against acute lung injury due to intestinal ischemia reperfusion via regulating SLC7A11 and HO-1[J]. Aging, 2020, 12(13): 12943-12959. DOI:10.18632/aging.103378 |
| [31] |
ZHAO T T, GUO X J, SUN Y. Iron accumulation and lipid peroxidation in the aging retina: Implication of ferroptosis in age-related macular degeneration[J]. Aging and Disease, 2021, 12(2): 529-551. DOI:10.14336/AD.2020.0912 |
| [32] |
URSINI F, MAIORINO M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4[J]. Free Radical Biology & Medicine, 2020, 152: 175-185. |
 2024, Vol. 41
2024, Vol. 41