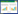文章信息
- 王越, 张敏, 谢明水.
- WANG Yue, ZHANG Min, XIE Mingshui.
- 18β-甘草次酸通过调控PIM1对宫颈癌细胞及裸鼠移植瘤自噬与凋亡的影响
- Effects of 18β-glycyrrhetinic acid on autophagy and apoptosis of cervical cancer cells and transplanted tumor in nude mice by regulating PIM1
- 天津中医药, 2024, 41(4): 517-525
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 517-525
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.20
-
文章历史
- 收稿日期: 2023-11-09
2. 随州市疾病预防控制中心, 随州 441300
宫颈癌是女性四大最常见的肿瘤类型之一,仅在2020年,全球就有60.4万宫颈癌新发病例,34.2万人死于宫颈癌[1],对女性健康构成巨大威胁。目前,多数早期宫颈癌患者可通过根治手术或放化疗治愈[2-3]。但对于高风险局部晚期及复发转移的患者,常用同步放化疗常引起恶心、呕吐、腹泻等不良反应[4-5],且导致患者生存时间短,效果差,副作用大,预后较差[6]。寻找宫颈癌有效治疗靶点和药物非常重要。在多种实体瘤高表达的原癌基因PIM1编码蛋白可以抑制肿瘤细胞凋亡,促进肿瘤细胞增殖[7],与患者的不良预后相关,已成为癌症的候选治疗靶点[8]。在宫颈癌中,PIM1显著过表达,且宫颈癌患者中PIM1水平的升高与肿瘤大小的增加、转移几率的增加呈正相关,抑制PIM1能促进宫颈癌细胞凋亡[9]。常见的PIM1抑制剂主要为小分子化合物,中药方面的抑制剂研究较少[10]。随着中医药的发展,大量研究证实中药辅助肿瘤治疗能控制改善临床症状、调节免疫、减少不良反应[11],发掘新的中药PIM1抑制剂将对于宫颈癌的治疗有重要意义。
甘草作为传统中药,能补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药[12]。《本草纲目》称之“普治百邪,得王道之化”[13]。甘草主要活性成分为甘草酸,口服后甘草酸在胃肠道中不可逆地转化为18β-甘草次酸[14]。18β-GA具有抗病毒[15]、抗炎[16-17]、抗肿瘤[18-19]等作用。用于肿瘤治疗不仅副作用小[18, 20],对肝脏和心血管还有一定的保护作用[14]。然而,18β-GA对宫颈癌的治疗作用机制尚不十分明确。本课题组前期实验发现18β-GA可明显抑制宫颈癌Hela细胞PIM1蛋白的表达。本文以18β-GA作用于宫颈癌Hela细胞与Hela细胞移植瘤裸鼠,运用分子对接、细胞实验与动物实验探究18β-GA作用于宫颈癌的基因靶点与分子机制,为宫颈癌治疗药物的研发提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞株与裸鼠人宫颈癌Hela细胞株,货号CL-0101,购自武汉普诺赛生命科技有限公司,稳定传代至7~8代。10只4周龄雌性无胸腺裸鼠(BALB/C-nu)购自辽宁长生生物技术股份有限公司,实验动物质量合格证编号为210726230100560743。本研究所涉及实验均符合湖北医药学院伦理委员要求,伦理审查批准号:湖北医药学院动(福)第2022-实097号。
1.1.2 药物与试剂18β-甘草次酸(上海阿达玛斯试剂有限公司,纯度98%,批号P1623951);胎牛血清(浙江天杭生物科技股份有限公司,批号21080702);杜氏改良Eagle培养基(美国Gibco公司,批号2478988);胰蛋白酶1∶250(德国Biofroxx公司,批号1004GR025);磷酸盐缓冲溶液(PBS)、四甲基偶氮唑盐(MTT)比色法试剂盒、DAPI试剂(武汉赛维尔生物科技有限公司,批号分别为G0002、G4101、G1012);青霉素-链霉素溶液、二甲亚砜(DMSO)、β-Tubulin抗体、4%多聚甲醛固定液、Triton X-100(上海碧云天生物技术有限公司,批号分别为C0222、ST038、AF1216、P0099、P0096);瑞氏-吉姆萨染色液(广州捷倍斯生物科技有限公司,批号G4486);PIM1(ST0513)抗体(美国Novus Biologicals公司,批号HN1102);白细胞介素-6(IL-6)抗体、PCNA抗体和BCL-2抗体(武汉伊莱瑞特生物科技股份有限公司,批号分别为DK9816、BL3820、EC5205);STAT3抗体、Phospho-STAT3(Tyr705)抗体、Beclin-1抗体(美国Cell Signaling公司,批号4904、9145、3495);Lipofectamine 3000(美国Invitrogen公司,批号为2232162);山羊抗兔HRP免疫球蛋白G(IgG)抗体、Alexa Fluor 594标记驴抗兔IgG抗体(武汉安特捷生物技术有限公司,批号1559761021、1599271192);RIPA裂解缓冲液(北京普利莱基因技术有限公司,批号C1053);PIM1 siRNA序列(正义链5'-GCCCUGAGACCAUCA-GAUA-3'、反义链5'-UAUCUGAUGGUCUCAGGGC-3')、阴性对照siRNA(NC siRNA)和riboFECTTM CP转染试剂(广州市锐博生物科技有限公司,批号分别为stB0004651A、siN0000001-1-5、V0623);pcDNATM3.1(+)哺乳动物表达载体(美国Thermo Fisher Scientific公司;批号2206962)。
1.1.3 主要仪器331型二氧化碳培养箱、1384 A2型生物安全柜(美国Thermo Fisher Scientific公司),CKX31型倒置显微镜、CX41型荧光倒置相差显微镜(日本Olympus公司),Centrifuge 5424 R型低温高速离心机(德国Eppendorf公司),Epoch多体积分光光度计(美国Biotek公司),Mini-PROTEAN Tetra电泳槽、Mini Trans-Blot电泳转印槽、PowerPac Basic电源、Gel DocTM XR+凝胶成像分析系统(美国Bio-Rad公司)。
1.2 方法 1.2.1 瑞氏-吉姆萨染色及免疫荧光染色将10%胎牛血清、1%双抗与DMEM培养基中对数生长的Hela细胞,胰酶消化接种于6孔板与24孔板,贴壁生长后,设置空白组、18β-GA浓度梯度(50、100、150 μmol/L)实验组培养24 h,弃培养基,4 %多聚甲醛固定20 min,PBS洗涤,0.5% Triton X-100通透10 min。6孔板滴加瑞氏-吉姆萨染色液染色1 min,再加2~3倍的磷酸盐缓冲液(pH 6.8)充分混合,染色10 min。24孔板用5% 牛血清白蛋白(BSA)封闭30 min,吸去BSA加入PIM1抗体孵育1 h,PBS清洗,用荧光二抗孵育30 min,洗去二抗,DAPI染色1 min,以荧光倒置相差显微镜拍摄。
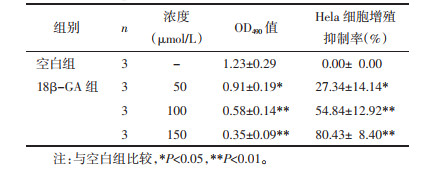
1.2.2 MTT法检测细胞增殖抑制率胰酶消化对数生长的Hela细胞稀释为每孔1×104个接种于96孔板。100 μL培养基培养贴壁后吸去培养基,设置空白组(加入等量药物溶剂DMSO)、18β-GA浓度梯度(50、100、150 μmol/L)实验组,加入不同浓度培养基100 μL。培养24 h后弃旧培养基,每孔加20 μL MTT溶液再培养4 h。吸去上清液,每孔加入100 μL DMSO溶解孔内的甲臜沉积物37 ℃孵育15 min,充分溶解摇匀,以多体积分光光度计检测每孔490 nm波长处吸光度值,计算增值抑制率。
1.2.3 分子对接与相关性分析运用AutoDock Vina软件(https://autodock.scripps.edu/)[21]将18β-GA和PIM1进行分子对接。
1.2.4 转染siRNA胰酶消化对数期生长的细胞接种于6孔板,细胞贴壁密度为60%时分为NC siRNA组、NC siRNA+18β-GA(100 μmol/L)组、PIM1 siRNA组、PIM1 siRNA+18β-GA(100 μmol/L)组,按比例加入培养基、siRNA与转染试剂,培养24 h后在NC siRNA+18β-GA组与si-PIM1+18β-GA加入100 μmol/L 18β-GA,继续培养24 h用MTT检测细胞增殖抑制率,蛋白印迹法检测蛋白表达量。
1.2.5 过表达PIM1胰酶消化对数期生长的细胞接种于96孔板与6孔板,细胞贴壁密度为60%时分为空载体组、空载体加18β-GA(100 μmol/L)组、PIM1过表达组、PIM1过表达加18β-GA(100 μmol/L)组,将pcDNATM3.1(+)过表达质粒通过Lipofectamine 3000转染入Hela细胞中,48 h后在空载体加18β-GA组与PIM1过表达加18β-GA组加入100 μmol/L 18β-GA,继续培养24 h收集细胞以96孔板MTT法检测细胞增殖抑制率,免疫印迹检测6孔板转染效率及蛋白表达量。
1.2.6 构建裸鼠宫颈癌移植瘤模型及组织染色胰酶消化对数期生长,密度为80%~90%同一批次传代的10个平皿Hela细胞,用PBS轻轻吹打混匀离心弃上清液洗3遍,吸去PBS加入DMEM混匀,在细胞计数板计数调整悬液细胞浓度为5×106个/mL,在每只4周龄雌性无胸腺裸鼠皮下注射0.1 mL细胞悬液,待肿瘤体积生长至100 mm3左右时将10只裸鼠随机分为对照组和18β-GA组,每组5只。18β-GA组每天灌胃0.2 mL 100 mg/kg配比为2% DMSO+30% PEG300+5% Tween-80+63%生理盐水[22]的18β-GA溶液,对照组用相同配比未加18β-GA的溶液灌胃。每天观察裸鼠的生存状况,实验结束时将裸鼠麻醉安乐死。实验结束时使用游标卡尺测量肿瘤大小,分析天平称裸鼠移植瘤质量。将裸鼠移植瘤在PBS中清洗,置于4 ℃的10%福尔马林中,乙醇脱水处理后将组织浸入石蜡包埋、切片。将石蜡切片置于60 ℃温箱中30 min,浸入二甲苯再依次放入梯度浓度乙醇,分别进行HE染色与免疫荧光染色。加入柠檬酸盐缓冲液高压修复抗原,以3% H2O2阻断过氧化物酶,5% BSA 37 ℃温箱封闭30 min,弃封闭液加1∶100稀释一抗37 ℃孵育1 h,洗去一抗用1∶200稀释荧光二抗37 ℃孵育30 min,洗去二抗,DAPI染色1 min,使用抗荧光淬灭剂封片,以荧光倒置相差显微镜观察瘤组织形态差异。
1.2.7 蛋白免疫印迹法检测以RIPA缓冲液裂解液氮研磨后的裸鼠肿瘤组织与弃去上清的6孔板中Hela细胞,将提取的蛋白加入SDS-PAGE凝胶电泳后转印至PVDF膜上,冲洗并封闭以防止非特异性结合。加入1∶1 000稀释一抗,4 ℃摇床孵育24 h,TBST洗涤3次后加入HRP IgG二抗孵育1 h,再洗涤3次用凝胶成像分析系统扫描并分析条带。
1.2.8 统计分析运用Image J软件(https://imagej.net/software/imagej/)、GraphPad Prism 8软件(https://www.graphpad.com)对数据进行分析,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较使用单因素方差分析,组间两两比较LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 18β-GA对Hela细胞形态的影响空白组Hela细胞胞核清晰,细胞排列较为紧密。与空白组比较,随着18β-GA处理浓度的升高,细胞密度逐渐降低,细胞核变小;100 μmol/L组细胞排列松散,细胞质染色变淡,出现网状空泡;150 μmol/L组细胞核浓缩坏死,细胞质明显破损。见图 1。
|
| 注:A,空白组;B,50 μmol/L 18β-GA组;C,100 μmol/L 18β-GA组;D,150 μmol/L 18β-GA组。 图 1 18β-甘草次酸对Hela细胞形态的影响(瑞氏-吉姆萨染色,×200) Fig. 1 Effects of 18 β-glycyrrhetinic acid on Hela cell morphology(Wright-Giemsa Stain, ×200) |
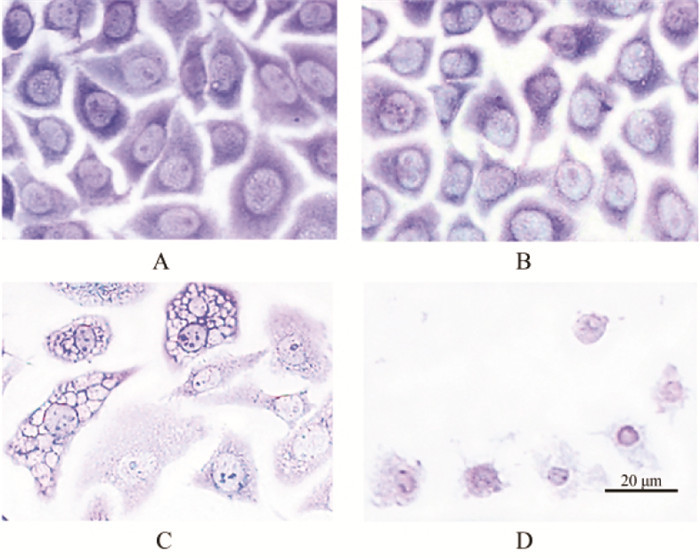
空白组PIM1染色的红色荧光主要定位于细胞核,DAPI染色可见细胞核呈圆形,发出均匀蓝色荧光。与空白组相比,随着18β-GA处理浓度的增加PIM1红色荧光强度明显减弱,凋亡细胞比例增加,100 μmol/L组细胞DAPI染色观察到染色质聚集(亮蓝色荧光)与凋亡小体,150 μmol/L组出现染色质凝集以及细胞核碎裂。见图 2。
|
| 注:A,空白组;B,50 μmol/L 18β-GA组;C,100 μmol/L 18β-GA组;D,150 μmol/L 18β-GA组。 图 2 18β-甘草次酸对Hela细胞凋亡和PIM1表达的影响(免疫荧光,×200) Fig. 2 Effects of 18 β-glycyrrhetinic acid on apoptosis and PIM1 expression of Hela cells(IF, ×200) |
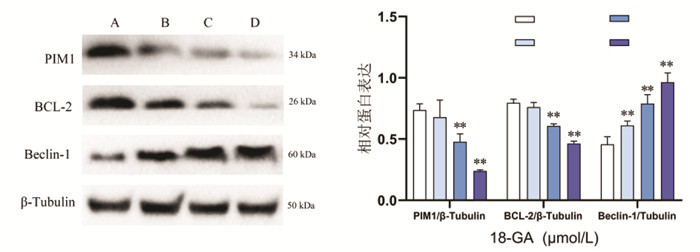
与空白组相比,实验组(50、100、150 μmol/L)Hela细胞OD490值降低,细胞增殖抑制率升高(P < 0.05或P < 0.01);随着18β-GA作用浓度的增加,PIM1蛋白、抗凋亡蛋白BCL-2表达水平降低,自噬相关蛋白Beclin-1表达升高,呈剂量依赖性,差异具有统计学意义(P < 0.01)。见表 1和图 3。
|
|
| 注:A,空白组;B,50 μmol/L 18β-GA组;C,100 μmol/L 18β-GA组;D,150 μmol/L 18β-GA组。与空白组比较,**P < 0.01,n=3。 图 3 18β-甘草次酸对Hela细胞蛋白表达的影响(x±s) Fig. 3 Effects of the 18β-glycyrrhetinic acid on protein expression of Hela cells(x±s) |
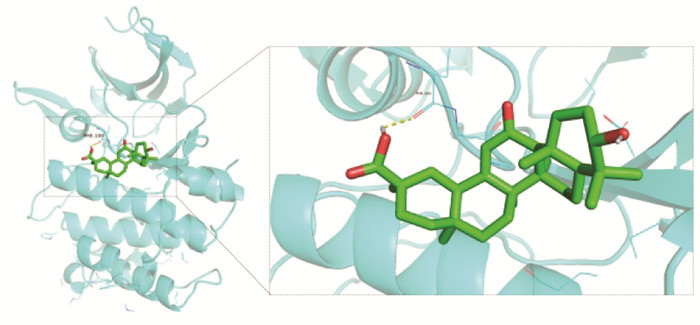
结果显示18β-GA可以与PIM1稳定结合,结合位点位于PHE-100,结合能为-7.3 kcal/mol,见图 4。
|
| 图 4 18β-甘草次酸与PIM1分子对接 Fig. 4 18β-glycyrrhetinic acid docking with PIM1 molecule |
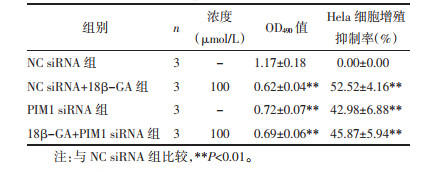
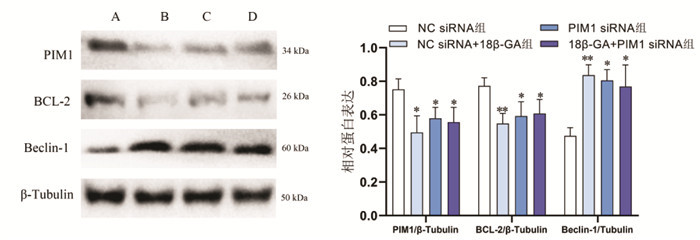
与NC siRNA组相比,NC siRNA+18β-GA组与PIM1 siRNA组OD490值降低,细胞增殖抑制率明显增高,PIM1与BCL-2蛋白表达水平均降低,Beclin-1蛋白表达水平增高,差异具有统计学意义(P < 0.05或P < 0.01)。与PIM1 siRNA组相比,18β-GA+PIM1 siRNA组细胞增殖抑制率、PIM1、Beclin-1与BCL-2蛋白表达水平无明显差异(P>0.05)。见表 2与图 5。
|
|
| 注:A,NC siRNA;B,NC siRNA+18β-GA组;C,PIM1 siRNA组;D,18β-GA+PIM1 siRNA组。与NC siRNA组比较,*P < 0.05,**P < 0.01,n=3。 图 5 敲低PIM1与18β-甘草次酸处理对Hela细胞蛋白表达的影响(x±s) Fig. 5 Effects of the knock down PIM1 and 18β-glycyrrhetinic acid on protein expression of Hela cells(x±s) |
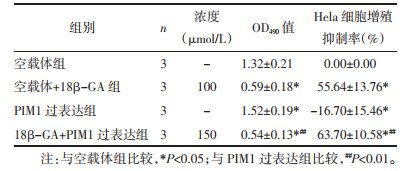
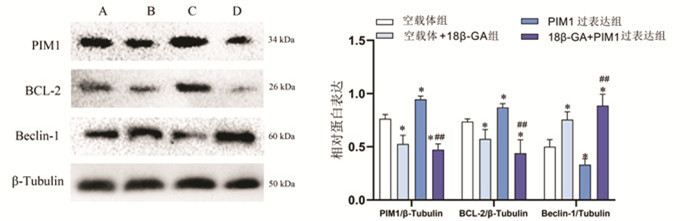
与空载体组相比,空载体+18β-GA组OD490值降低,细胞增殖率抑制率升高,PIM1与BCL-2蛋白表达水平下降,而Beclin-1蛋白表达水平升高,差异具有统计学意义(P < 0.05)。与空载体组相比,PIM1过表达组OD490值升高,细胞增殖抑制率降低,PIM1与BCL-2蛋白表达水平上升,而Beclin-1蛋白表达降低,差异具有统计学意义(P < 0.05)。与PIM1过表达组相比,18β-GA+PIM1过表达组OD490值降低,细胞增殖率抑制率增高;PIM1与BCL-2蛋白表达明显降低,Beclin-1蛋白表达升高,差异具有统计学意义(P < 0.01)。见表 3与图 6。
|
|
| 注:A,空载体组;B,空载体+18β-GA组;C,PIM1过表达组;D,18β-GA+PIM1过表达组;与空载体组比较,*P < 0.05;与PIM1过表达组比较,##P < 0.01。 图 6 过表达PIM1与18β-甘草次酸处理对Hela细胞蛋白表达的影响(x±s,n=3) Fig. 6 Effects of the overexpression of PIM1 and 18β-glycyrrhetinic acid on protein expression of Hela cells(x±s, n=3) |
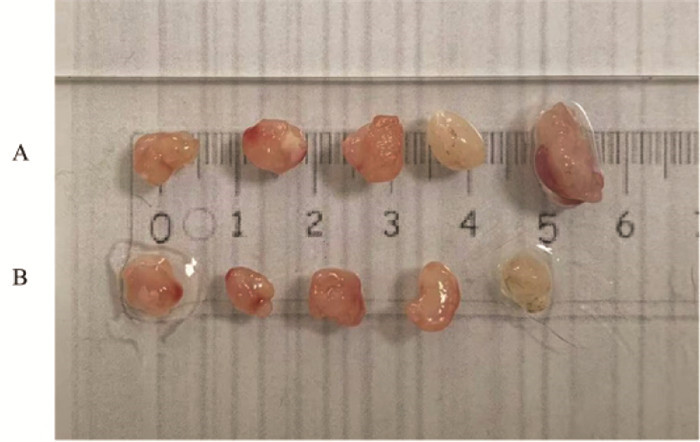
与裸鼠对照组比较,18β-GA实验组裸鼠移植瘤体积与质量明显较小,差异具有统计学意义(P<0.01),见表 4、图 7。
|
|
| 注:A,裸鼠对照组;B,裸鼠18β-GA实验组。 图 7 18β-甘草次酸对裸鼠移植瘤体积的影响 Fig. 7 Effects of the 18β-glycyrrhetinic acid on the volume of transplanted tumor in nude mice |
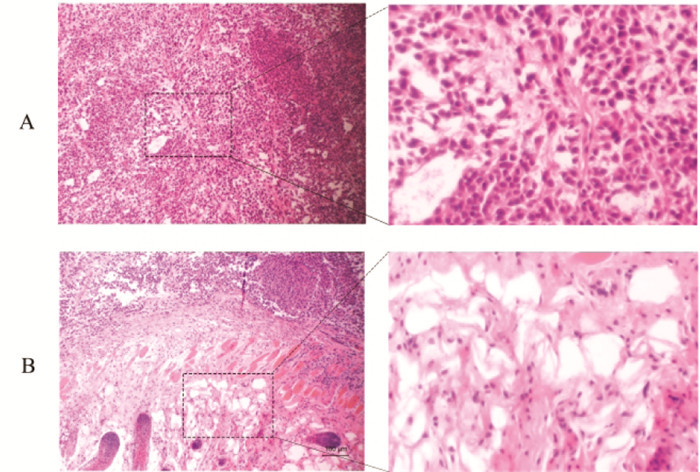
HE染色可见,裸鼠对照组肿瘤组织Hela细胞排列紧密,胞核深染,与对照组相比,18β-GA实验组肿瘤细胞体积明显变小,细胞核染色较浅,出现明显的较为密集肿瘤组织与疏松空泡状组织的分界线,肿瘤凋亡核心面积增大,肿瘤细胞密度更低,能观察到实验组组织中Hela细胞被分别包裹为条索状或球囊状进而发生组织疏松空泡化,见图 8。
|
| 注:A,裸鼠对照组;B,裸鼠18β-GA实验组。 图 8 18β-甘草次酸对裸鼠移植瘤病理形态的影响(HE,×100) Fig. 8 Effects of the 18β-glycyrrhetinic acid on the pathological morphology of transplanted tumor in nude mice(HE, ×100) |
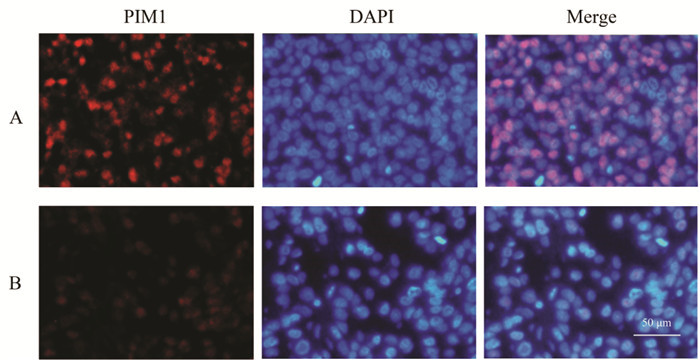
免疫组织荧光染色可见,与裸鼠对照组相比,18β-GA实验组肿瘤组织PIM1标记的红色荧光强度较低,DAPI染色可见实验组肿瘤组织细胞密度较为疏松,染色质聚集的亮蓝色荧光细胞核比例更高。见图 9。
|
| 注:A,裸鼠对照组;B,裸鼠18β-GA实验组。 图 9 18β-甘草次酸对裸鼠移植瘤PIM1表达的影响(免疫荧光,×200) Fig. 9 Effects of the 18β-glycyrrhetinic acid on PIM1 expression in the transplanted tumor of nude mice(IF, ×200) |
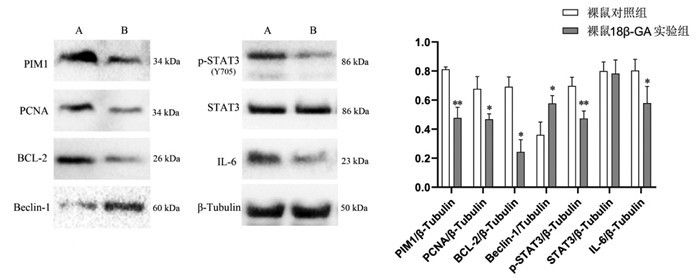
与裸鼠对照组比较,18β-GA裸鼠组增殖相关蛋白PCNA与抗凋亡蛋白BCL-2表达明显降低,自噬相关蛋白Beclin-1表达升高,差异具有统计学意义(P<0.05)。与对照组相比,PIM1、p-STAT3、IL-6蛋白表达降低(P<0.05或P<0.01),而STAT3蛋白表达无显著差异(P>0.05)。见图 10。
|
| 注:A,裸鼠对照组;B,裸鼠18β-GA实验组。与裸鼠对照组比较,*P < 0.05,**P < 0.01,n=5。 图 10 18β-甘草次酸对裸鼠移植瘤蛋白表达的影响(x±s) Fig. 10 Effects of the 18β-glycyrrhetinic acid on the protein expression of transplanted tumor in nude mice(x±s) |
目前宫颈癌发病率和病死率居生殖道恶性肿瘤的首位,患病人数逐年增加,患者年龄逐渐减小[23]。由于宫颈癌肿瘤细胞增殖快、侵袭性高,晚期宫颈癌患者容易形成局部浸润和远处转移而导致复发率高、预后差[24],易产生化疗耐药性[25],因此迫切需要开发新的辅助治疗药物。PIM1属于3种原癌蛋白(PIM1、PIM 2和PIM 3)组成的丝氨酸/苏氨酸激酶的PIM家族,通过激活生长因子和细胞因子信号通路,在细胞周期进程、细胞存活、细胞凋亡、耐药和转录激活等方面具有重要作用,参与癌细胞的增殖、迁移、凋亡与肿瘤生长[8]。PIM1在宫颈癌[9]、乳腺癌[26]、前列腺癌[27]、结直肠癌[28]、肺癌[29]等多类型的肿瘤细胞中过表达,并且其过表达与肿瘤发生和进展相关。研究发现宫颈癌患者中PIM1表达增加可能表明患者肿瘤大小和转移风险增加,PIM1在一系列癌症中的作用使其成为一个有潜力的新药靶点。本研究细胞实验结果显示,与对照组相比,随着18β-GA作用浓度的增加,PIM1蛋白表达降低,细胞增殖抑制率与凋亡明显增加。动物实验免疫荧光与蛋白印迹也显示18β-GA组PIM1表达明显低于对照组,HE染色显示移植瘤凋亡核心扩大,表明18β-GA能抑制PIM1蛋白表达促进Hela细胞与裸鼠移植瘤凋亡。
促炎细胞因子IL-6是由HPV癌蛋白E5、E6和E7通过上调环氧合酶-2与前列腺素E2激活免疫系统与细胞产生,与宫颈癌与HPV病毒感染引发的炎症密切相关[30]。既往研究使用过表达和si RNA敲低后进行细胞功能分析表明,PIM1过表达能诱导STAT3激活,在Tyr705位点磷酸化增加[31],能促进乳腺癌细胞的恶性表型,敲除PIM1可显著抑制宫颈癌Hela细胞增殖,促进其凋亡,减弱IL-6诱导的乳腺癌细胞上皮间质转化[9, 26]。抗凋亡蛋白BCL-2处于STAT3下游,BCL-2过表达与STAT3的高磷酸化显著相关[32]。敲低PIM1后抗凋亡蛋白BCL-2及其调节的靶标SOCS3的表达随之降低[10],SOCS3通过阻断STAT3的激活来抑制IL6信号传导[28],表明PIM1能通过抑制STAT3进而抑制BCL-2与IL-6。本研究动物组织蛋白印迹结果显示18β-GA可抑制PIM1降低STAT3的磷酸化,降低抗凋亡蛋白BCL-2与IL-6表达,与既往研究结果一致。IL-6降低显示18β-GA可能通过下调PIM1抑制STAT3/IL-6信号轴,有助于改善HPV癌蛋白引发的炎症。STAT3可通过结合p21启动子下调p21表达,p21能通过多种机制导致细胞周期阻滞,直接作用于PCNA,抑制DNA合成[33]。本研究动物实验PCNA的降低表明18β-GA可能通过下调PIM1抑制STAT3促进下游p21产生并作用于PCNA,进而抑制Hela细胞周期进程与DNA复制。
Beclin-1是自噬的中枢调控因子,研究发现Beclin-1介导的自噬激活与BCL-2下调相关,BCL-2可通过结合Beclin-1的BH3唯一结构域抑制Beclin-1[34]。本研究细胞与动物实验显示18β-GA处理能抑制BCL-2的表达,而Beclin-1表达增加。18β-GA处理、敲低PIM1与敲低PIM1后加18β-GA处理Beclin-1与BCL-2变化趋势一致,而过表达PIM1后BCL-2表达增加而Beclin-1降低,表明PIM1可能通过减少STAT3的磷酸化抑制BCL-2表达进而上调Beclin-1表达,激活肿瘤细胞发生自噬。敲低PIM1与敲低PIM1后加18β-GA处理细胞增殖抑制率、PIM1、Beclin-1与BCL-2表达水平无明显差异,而过表达PIM1与过表达PIM1后加18β-GA上述结果有显著差异以及分子对接结果说明PIM1是18β-GA作用于Hela细胞的靶点。敲低PIM1作用靶点缺失导致18β-GA对Hela细胞作用效果降低,过表达PIM1作用靶点增多而使18β-GA对Hela细胞作用更明显,表明18β-GA可能对于PIM1表达低的正常宫颈细胞副作用小,更适用于PIM1表达水平高的宫颈癌肿瘤治疗。
综上所述,本研究基于动物实验、分子对接以及细胞实验,免疫荧光与蛋白印迹多角度阐明18β-GA可由PIM1/STAT3/IL-6信号轴诱导裸鼠宫颈癌移植瘤自噬与凋亡,通过PIM1/STAT3信号通路抑制肿瘤细胞增殖促进凋亡与自噬,同时降低IL-6表达起到抗炎作用,具有改善宫颈癌免疫浸润微环境的潜力。本研究结果为深入研究甘草抗宫颈癌提供了实验基础,为宫颈癌治疗药物的研发提供了新的思路。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
TEWARI K S, MONK B J, VERGOTE I, et al. Survival with cemiplimab in recurrent cervical cancer[J]. The New England Journal of Medicine, 2022, 386(6): 544-555. DOI:10.1056/NEJMoa2112187 |
| [3] |
WALLBILLICH J J, TRAN P M, BAI S, et al. Identification of a transcriptomic signature with excellent survival prediction for squamous cell carcinoma of the cervix[J]. American Journal of Cancer Research, 2020, 10(5): 1534-1547. |
| [4] |
DAMAST S, FIELDS E, KIDD E, et al. Reports from four international clinical trials for cancers of the cervix, uterus and vulva, and a new guideline for cervical cancer[J]. International Journal of Radiation Oncology, Biology, Physics, 2021, 111(2): 299-306. DOI:10.1016/j.ijrobp.2021.05.002 |
| [5] |
HU Z, MA D. The precision prevention and therapy of HPV-related cervical cancer: New concepts and clinical implications[J]. Cancer Medicine, 2018, 7(10): 5217-5236. DOI:10.1002/cam4.1501 |
| [6] |
MONK B J, ENOMOTO T, KAST W M, et al. Integration of immunotherapy into treatment of cervical cancer: Recent data and ongoing trials[J]. Cancer Treatment Reviews, 2022, 106(3): 102385. |
| [7] |
MAHATA S, SAHOO P K, PAL R, et al. PIM1/STAT3 axis: A potential co-targeted therapeutic approach in triple-negative breast cancer[J]. Medical Oncology, 2022, 39(5): 74. |
| [8] |
NAYSHOOL O, KOL N, JAVASKI E, et al. SurviveAI: Long term survival prediction of cancer patients based on somatic RNA-seq expression[J]. Cancer Informatics, 2022, 21(10): 11769351221127875. |
| [9] |
YANG H W, HE K, DONG W L, et al. PIM-1 may function as an oncogene in cervical cancer via activating the EGFR signaling[J]. The International Journal of Biological Markers, 2020, 35(3): 67-73. DOI:10.1177/1724600820936295 |
| [10] |
BELLON M, LU L, NICOT C. Constitutive activation of Pim1 kinase is a therapeutic target for adult T-cell leukemia[J]. Blood, 2016, 127(20): 2439-2450. DOI:10.1182/blood-2015-11-685032 |
| [11] |
吴海滨, 马志强, 李帅, 等. 基于SIRT1/SOX2信号通路探究西黄丸抗乳腺癌作用及机制[J]. 天津中医药, 2023, 40(6): 775-781. DOI:10.11656/j.issn.1672-1519.2023.06.16 |
| [12] |
国家药典委员会. 中华人民共和国药典: 2020年版一部[S]. 北京: 中国医药出版社, 2020: 88.
|
| [13] |
赵守训, 黄泰康, 丁志遵. 现代本草纲目(上下卷)[M]. 北京: 中国医药科技出版社, 2000: 662-668.
|
| [14] |
WU S Y, WANG W J, DOU J H, et al. Research progress on the protective effects of licorice-derived 18β-glycyrrhetinic acid against liver injury[J]. Acta Pharmacologica Sinica, 2021, 42(1): 18-26. DOI:10.1038/s41401-020-0383-9 |
| [15] |
WANG X Y, XIE F, ZHOU X F, et al. 18β-Glycyrrhetinic acid inhibits the apoptosis of cells infected with rotavirus SA11 via the Fas/FasL pathway[J]. Pharmaceutical Biology, 2021, 59(1): 1098-1105. |
| [16] |
FENG Y H, MEI L Y, WANG M J, et al. Anti-inflammatory and pro-apoptotic effects of 18beta-glycyrrhetinic acid in vitro and in vivo models of rheumatoid arthritis[J]. Frontiers in Pharmacology, 2021, 12(7): 681525. |
| [17] |
CHEN B D, ZHU D C, XIE C L, et al. 18β-Glycyrrhetinic acid inhibits IL-1β-induced inflammatory response in mouse chondrocytes and prevents osteoarthritic progression by activating Nrf2[J]. Food & Function, 2021, 12(18): 8399-8410. |
| [18] |
LUO Y H, WANG C, XU W T, et al. 18β-glycyrrhetinic acid has anti-cancer effects via inducing apoptosis and G2/M cell cycle arrest, and inhibiting migration of A549 lung cancer cells[J]. OncoTargets and Therapy, 2021, 14(10): 5131-5144. |
| [19] |
STECANELLA L A, BITENCOURT A P R, VAZ G R, et al. Glycyrrhizic acid and its hydrolyzed metabolite 18β-glycyrrhetinic acid as specific ligands for targeting nanosystems in the treatment of liver cancer[J]. Pharmaceutics, 2021, 13(11): 1792. DOI:10.3390/pharmaceutics13111792 |
| [20] |
DEUTCH M R, GRIMM D, WEHLAND M, et al. Bioactive candy: Effects of licorice on the cardiovascular system[J]. Foods, 2019, 8(10): 495. DOI:10.3390/foods8100495 |
| [21] |
EBERHARDT J, SANTOS-MARTINS D, TILLACK A F, et al. AutoDock vina 1.2.0:New docking methods, expanded force field, and python bindings[J]. Journal of Chemical Information and Modeling, 2021, 61(8): 3891-3898. DOI:10.1021/acs.jcim.1c00203 |
| [22] |
MARKOVICS A, TOTH D M, GLANT T T, et al. Regulation of autoimmune arthritis by the SHP-1 tyrosine phosphatase[J]. Arthritis Research & Therapy, 2020, 22(1): 160. |
| [23] |
SUN R, GUAN H W, LIU W, et al. Expression of BMP7 in cervical cancer and inhibition of epithelial-mesenchymal transition by BMP7 knockdown in HeLa cells[J]. International Journal of Molecular Medicine, 2020, 45(5): 1417-1424. |
| [24] |
LEI L, MOU Q W. Exosomal taurine up-regulated 1 promotes angiogenesis and endothelial cell proliferation in cervical cancer[J]. Cancer Biology & Therapy, 2020, 21(8): 717-725. |
| [25] |
XU H, SUN Y, ZENG L, et al. Inhibition of cytosolic phospholipase A2 alpha increases chemosensitivity in cervical carcinoma through suppressing β-catenin signaling[J]. Cancer Biology & Therapy, 2019, 20(6): 912-921. |
| [26] |
GAO X Q, LIU X P, LU Y Y, et al. PIM1 is responsible for IL-6-induced breast cancer cell EMT and stemness via c-myc activation[J]. Breast Cancer, 2019, 26(5): 663-671. DOI:10.1007/s12282-019-00966-3 |
| [27] |
LEDET R J, RUFF S E, WANG Y, et al. Identification of PIM1 substrates reveals a role for NDRG1 phosphorylation in prostate cancer cellular migration and invasion[J]. Communications Biology, 2021, 4(1): 36. DOI:10.1038/s42003-020-01528-6 |
| [28] |
YIN F X, ZHAO R, GORJA D R, et al. Novel dual inhibitor for targeting PIM1 and FGFR1 kinases inhibits colorectal cancer growth invitro and patient-derived xenografts in vivo[J]. Acta Pharmaceutica Sinica B, 2022, 12(11): 4122-4137. DOI:10.1016/j.apsb.2022.07.005 |
| [29] |
CHAUHAN S S, TOTH R K, JENSEN C C, et al. PIM kinases alter mitochondrial dynamics and chemosensitivity in lung cancer[J]. Oncogene, 2020, 39(12): 2597-2611. DOI:10.1038/s41388-020-1168-9 |
| [30] |
FRANCIOSI M L M, DO CARMO T I T, ZANINI D, et al. Inflammatory profile in cervical cancer: Influence of purinergic signaling and possible therapeutic targets[J]. Inflammation Research: Official Journal of the European Histamine Research Society, 2022, 71(5/6): 555-564. |
| [31] |
MOLOGNI L, MAGISTRONI V, CASUSCELLI F, et al. The novel PIM1 inhibitor NMS-P645 reverses PIM1-dependent effects on TMPRSS2/ERG positive prostate cancer cells and shows anti-proliferative activity in combination with PI3K inhibition[J]. Journal of Cancer, 2017, 8(1): 140-145. DOI:10.7150/jca.15838 |
| [32] |
WENZL K, MANSKE M K, SARANGI V, et al. Loss of TNFAIP3 enhances MYD88L265P-driven signaling in non-Hodgkin lymphoma[J]. Blood Cancer Journal, 2018, 8(10): 97. DOI:10.1038/s41408-018-0130-3 |
| [33] |
TICLI G, CAZZALINI O, STIVALA L A, et al. Revisiting the function of p21CDKN1A in DNA repair: The influence of protein interactions and stability[J]. International Journal of Molecular Sciences, 2022, 23(12): 7058. |
| [34] |
MENZIE-SUDERAM J M, MODI J, XU H, et al. Granulocyte-colony stimulating factor gene therapy as a novel therapeutics for stroke in a mouse model[J]. Journal of Biomedical Science, 2020, 27(1): 99. DOI:10.1186/s12929-020-00692-5 |
2. Suizhou Center for Disease Control and Prevention, Suizhou 441300, China
 2024, Vol. 41
2024, Vol. 41