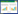文章信息
- 侯梦卉, 李莹, 张清钥, 等.
- HOU Menghui, LI Ying, ZHANG Qingyue, et al.
- 基于微生态失衡的子宫内膜异位症致病机制及中药干预治疗研究进展
- Research progress on the pathogenesis of endometriosis based on unbalance of microecology and traditional Chinese medicine therapy
- 天津中医药, 2024, 41(4): 537-544
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(4): 537-544
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.04.23
-
文章历史
- 收稿日期: 2024-01-02
子宫内膜异位症(EMs)是一种慢性炎症性、雌激素依赖性疾病,指具有活性及生长功能的子宫内膜组织(腺体和间质)在子宫腔外的部位出现、定植生长、浸润、反复出血;易发于青春期和育龄妇女,主要临床症状为慢性盆腔痛、不孕、痛经、盆腔肿块等。EMs是一种复杂的多因素和全身性临床综合征,伴有全身性炎症[1]。世界卫生组织报告显示全球约有2亿妇女患有EMs,约占育龄妇女的10%以上[2-3],严重影响其生殖健康。研究发现约90%的EMs患者伴有痛经,76%的患者出现性生活困难,77%的患者患有慢性盆腔痛[4],约50%的EMs患者出现不孕[5]。EMs是对妇女生活质量和生殖健康具有重大影响的公共卫生问题,给中国经济社会发展和人口安全也会带来很大影响[6]。近年研究发现,EMs患者病患局部微生态发生明显改变,其局部微生态失衡可能与EMs的发生发展密切相关,系统研究微生态失衡与EMs疾病发生发展的关联性,对临床治疗具有重要的指导意义。
1 EMs疾病概括EMs作为一种慢性、炎症性、激素性、免疫性、全身性和异质性疾病,病因复杂,病变广泛,可累及多个器官系统。根据组织浸润的位置和深度EMs主要分为3种表型:腹膜型、卵巢型和深层浸润型(DIE)[7]。无论哪种表型,目前均普遍存在诊断滞后问题,严重影响疾病的治疗及预后,因此临床诊断对于EMs的早期干预和治疗意义重大,除采集患者病史外,还可通过妇科检查了解盆腔情况,影像学检查辅助诊断,但其敏感性因病灶部位不同而有差异,糖类抗原125(CA125)水平升高在早期也不具有特异性,目前尚缺乏可靠的非侵入性诊断方法,临床上腹腔镜联合病理诊断被视为明确诊断EMs的“金标准”。见图 1。
|
| 图 1 EMs临床症状、分型及诊断 Fig. 1 Clinical symptoms, classification, and diagnosis of EMs |
传统医学中并无EMs病名,根据其临床症状可将其归属为中医学“痛经”“不孕”“月经不调”“血瘕”等范畴。《诸病源候论·卷三十九·八癥候》谓:“血瘕病……为血瘕之聚。令人腰痛,不可以俯仰,横骨下有积气,牢如石,小腹里急苦痛,背膂疼,深达腰腹下挛此病令人无子。”所述症状与EMs相似。中医认为其病位在冲任、胞宫胞脉,与肝、肾、脾三脏密切相关。也有学者在不断深入研究其致病特点后提出“伏邪”理论[8]。中医认为一切不正之气如风、寒、暑、湿、燥、火、痰、瘀、浊、毒等致病因素都可为邪,伏藏于体内因势而发,《素问·刺法论》曰:“正气存内,邪不可干,邪之所凑,其气必虚”,正气亏虚为EMs发病的根本条件;加之外感六淫之邪,引动体内伏邪伺机而动[9]。正气与伏邪相搏,机体失衡致病[10]。女子因生活及工作等方面的压力因素,日渐耗伤正气,邪气伺机伏藏于人体、不断积聚引发伏邪。《子宫内膜异位症中西医结合诊治指南》中将异位内膜随月经周期的反复出血明确称为离经之血[11]。唐容川《血证论》言:“既然是离经之血,虽清血、鲜血,亦是瘀血。”血瘀是贯穿EMs发生发展过程中的中心环节,也是EMs基本的病理基础。瘀血阻滞气血致运行不畅,不通则痛引发痛经,离经之血留滞日久则成癥瘕,阻滞冲任胞宫则不能摄精成孕,见图 2。EMs具有病位深、病程长、反复发作、难以治愈等特点[12];且EMs患者早期无明显临床表现大多因慢性盆腔痛或婚久不孕就诊,发病过程具有渐进性、积聚性、侵袭性等特点,与伏邪致病的疾病特点和发病过程类似[13]。

|
| 图 2 中医对EMs的病机认识 Fig. 2 Traditional Chinese medicine's understanding of the pathogenesis of EMs |
在人类进化史中,微生物是人类密不可分的“伙伴”,它们与人体共同构成了一个“超生物体”[14]。人体微生态是存在于体内外的包括共生微生物和病原微生物的共生生态群落[15],是一个复杂多样的有机整体,即人体为其提供适宜的生存环境,微生物及其代谢产物也直接或间接地影响宿主一系列生命活动,微生物群落与宿主之间可进行能量、物质以及遗传信息的交换[16],形成了相互协调又相互制约的统一,即微生态的动态平衡。人体微生物失调、机体与外环境的平衡失调都可能导致疾病的发生发展[17]。人体微生态平衡对维护人类健康具有重要意义。人体微生物与宿主共生,其产生的生物活性分子能够调节机体代谢、免疫功能等,维持人体正常的生理机能,在维持人体稳态中发挥重要作用[18],当微生态失衡时,微生物异位并产生有害代谢物可引发免疫反应等导致疾病的发生发展。随着基因组学和高通量测序技术的发展和成熟,人体微生态环境与女性生殖健康的关联性备受关注,特别是微生态失衡与EMs之间的关系成为当前研究热点[19],微生态失衡在EMs疾病发生发展的过程中扮演重要角色。
4 微生态失衡在EMs发生发展中的作用EMs疾病形成机制的揭示是其疾病治疗的关键,也备受临床专家学者关注。Sampson的经血逆流种植理论是目前被广泛接受的假说[20],间接植入理论(血管及淋巴转移学说)、原位转化理论(腔肠化生和胚胎遗传理论)、干细胞理论也是比较流行的假说[21-23]。但目前所提出的单一理论均无法有效解释EMs不同临床表现和病理特征,其发病过程还可能与炎症因素、类固醇激素变化、遗传因素及表观遗传因素、血管生成、氧化应激等因素相关[24]。近年来,随着微生态研究的兴起,越来越多的研究人员开始关注微生态失衡与EMs发生发展的关联性[25]。
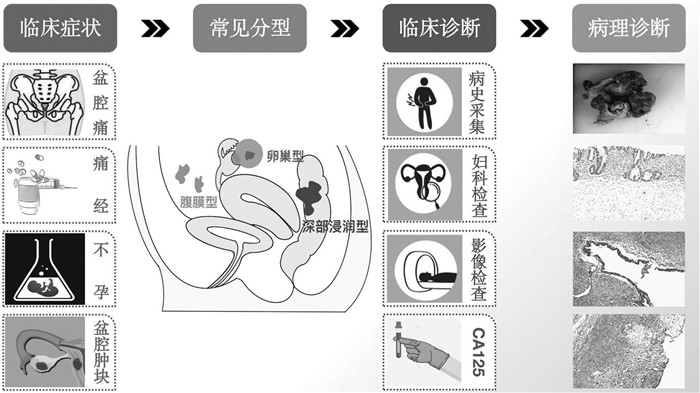
4.1 EMs患者存在明显的微生态失衡许多因素影响器官系统和个体之间的微生物组成。人体微生物组受到年龄、遗传、种族、饮食、运动、病史、吸烟、压力、环境因素等高度影响,微生物组反过来会影响宿主的整体健康。越来越多的研究证实EMs和微生态变化之间存在相关性[26]。人类已经认识到人体微生态失衡的危害性与微生态重建的重要性。EMs患者微生态失调(肠道、腹腔液和生殖道微生物群改变)是EMs发生发展的重要诱因[27]。
4.1.1 肠道微生物群肠道微生物群是EMs研究中重点关注的微生物组。肠道微生物组以细菌为主,包括拟杆菌门、厚壁菌门等,厚壁菌/拟杆菌的比值是用于评价肠道微生物是否正常的重要指标。与正常对照组相比,EMs患者的厚壁菌/拟杆菌比值更高[28]。EMs患者的肠道微生物群α多样性降低,放线菌门、蓝藻门、单糖菌门、梭杆菌门和酸杆菌门丰度显著升高,软壁菌门丰度显著降低,属水平分析显示,链球菌丰度升高[29]。另一项研究也表明[30]:与对照组相比,EMs肠道菌群中放线菌、厚壁菌、变形菌和疣状微生物在EMs肠道中丰度显著升高,乳酸杆菌科丰度显著减少。EMs患者肠道菌群中显著升高的微生物主要以革兰氏阴性菌为主。上述研究发现均显示肠道菌群的改变与EMs发病存在着密切的相关性。
4.1.2 生殖道微生物群生殖道菌群也与EMs发生发展密切相关,生殖道菌群主要包括阴道、子宫颈、子宫内膜、输卵管和卵巢等部位的菌群。研究发现EMs患者宫颈微生物群中加德纳菌属、链球菌属、埃希氏菌属、志贺氏菌属和解脲支原体属等潜在致病微生物丰度增加[31-33],EMs患者子宫内膜中肠球菌、副球菌、志贺氏菌、解脲支原体和瘤球菌科等微生物丰度显著增加,在门水平上,放线菌、厚壁菌、蛋白菌明显增加,乳酸杆菌显著减少[34]。EMs患者宫颈微生物组的丰富度和多样性显著降低[35]。这些变化提示生殖道菌群参与了EMs的发生发展。
4.1.3 腹腔微生物群EMs患者腹腔液中的微生物丰度发生明显改变[36]。EMs患者腹腔液中不动杆菌、假单胞菌、链球菌和水杆菌的丰度显著增加,而丙酸杆菌、放线菌和罗氏菌的丰度显著降低[37]。Hernandes等[32]在研究EMs深部病变腹腔液的微生物群发现,Alishewanella、肠球菌和假单胞菌明显增加。EMs患者腹腔液中酸多菌、德沃斯氏菌属、甲基杆菌、考拉杆菌和链球菌等也发生明显变化[36]。腹腔菌群的变化失调促进了子宫内膜异位病灶的形成。
4.2 微生态失衡在EMs发生发展中的作用越来越多研究表明:微生态失调介导炎症反应和免疫反应影响EMs的发生和发展[38]。微生物群可以通过促进炎症和雌激素变化、细胞增殖/凋亡、新陈代谢、氧化应激和增加血管生成等来驱动EMs的发生发展[39]。
4.2.1 菌群介导炎症反应参与EMs的发生发展“细菌污染”理论指出:EMs妇女经血极易受到污染,逆行子宫导致宫内环境的细菌污染,介导免疫反应引发EMs[40]。肠道微生态失调导致革兰氏阴性菌增多[41],内毒素的水平升高,导致肠壁通透性增加,以脂多糖(LPS)为代表的细菌内毒素大量入血引起原发性炎症,LPS作为炎症介质可能是最初的触发因素,LPS和免疫细胞上存在的Toll样受体4(TLR4)结合显著增加了腹膜腔免疫细胞特别是巨噬细胞的浓度,促进腹膜腔中继发性炎症介质的释放[42],如核因子-κB(NF-κB)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介素-17(IL-17)及肿瘤坏死因子α(TNF-α)、血管内皮生长因子(VEGF)等,促进子宫内膜异位性腹膜结节的形成、炎症浸润、增殖和新生血管生成从而导致炎性环境驱动病变生长。炎症反应是EMs发展的核心过程,在EMs中,微生态失调介导的肠道炎症有助于增强疾病中观察到的免疫应答失调,最终形成免疫抑制环境,使逃逸的异位子宫内膜细胞能够在子宫外扩散和生长,引起疼痛、组织重塑、纤维化、粘连黏附和不孕等。革兰氏阴性菌分泌并存在于巨噬细胞溶酶体中的β-葡萄糖醛酸苷酶可激活巨噬细胞促进其极化及细胞因子的释放[43]。细胞因子促进EMs盆腔炎性免疫反应及异位病灶生长,刺激增强子宫内膜基质细胞的增殖、黏附和侵袭,导致免疫失衡促进EMs发展。
4.2.2 菌群微生态通过调节免疫应答参与EMs的发生发展此外,既往研究表明EMs患者存在子宫内膜微环境的免疫缺陷、侵袭等改变。微生态失调导致异位内皮细胞免疫清除功能受损,程序性细胞死亡受体1(PD-1)是一种重要的免疫抑制分子,主要在激活的免疫细胞表面表达,是免疫系统的一种正常的平衡机制。而增多的LPS不断激活PD-1通路,引起PD-1和程序性死亡配体1(PD-L1)过表达及免疫T细胞耗竭,出现免疫耐受,机体的免疫力下降,促进异位病灶浸润、粘连和子宫内膜血管生成从而促进EMs的进展[44]。
4.2.3 菌群微生态通过调节循环雌激素水平参与EMs的发生发展微生物在雌激素代谢中起着重要作用,能够调节循环雌激素水平。微生物分泌的β-葡萄糖醛酸酶和β-葡萄糖苷酶,可以将雌激素从其结合形式代谢为去结合形式。通过细菌酶促作用可促进结合型雌激素的分解,解偶联成具有活性的游离雌激素,再被循环系统吸收并作用于体内的雌激素受体,增加游离型雌激素的再吸收,导致体内雌激素呈现过多状态,循环雌激素水平与菌群之间的平衡被破坏,直接刺激异位内皮的侵袭性生长和周期性出血,加速子宫内膜异位病灶的增殖,促进EMs的进展[45]。
4.2.4 菌群微生态通过调节代谢产物参与EMs的发生发展研究发现,多不饱和脂肪酸可通过调节肠道菌群的组成,并可改变菌群的代谢活性,减少前列腺素和细胞因子等的释放,以抑制异位病灶的增殖[46]。研究表明菌群的代谢产物如短链脂肪酸、氧化三甲胺等参与多条宿主的代谢通路,丁酸盐是肠道代谢组中的重要短链脂肪酸,是肠细胞的能量来源,以维持肠道屏障功能。微生态失调会减少短链脂肪酸生成,增加肠上皮炎症,导致通透性增加,肠道屏障功能弱化,从而导致细菌浸润及局部炎症。还可通过环磷酸腺苷(cAMP)信号通路调节颗粒细胞中孕酮和雌二醇合成,形成高雌激素环境,进一步刺激病变部位,促进EMs的发展[47-48],见图 3。
|
| 图 3 微生态失衡在EMs中的作用机制 Fig. 3 The mechanism of microecological imbalance in EMs |
基于目前研究发现的微生态与EMs间联系,微生态可能作为EMs患者的潜在诊断和治疗靶点[49]。有研究报道称肠道中瘤胃球菌的消耗可能是EMs潜在的生物标志物[50]。确定疾病特异性微生物组的组成将有助于开发非侵入性诊断方法,当疾病处于更晚期阶段时,可以帮助减少延迟诊断的发生率。特定的微生物变化特征可能是未来非侵入性诊断的重要研究方向。
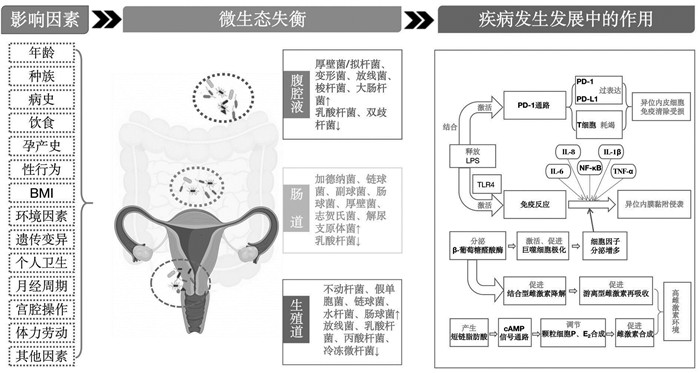
目前,EMs治疗的主要目标是清除病灶,减轻和消除疼痛,改善和促进生育,减少和避免复发,应基于临床诊断尽早开展药物治疗,实现长期有效管理,最大化发挥药物的治疗作用[51]。治疗方法包括药物治疗、手术治疗、介入治疗及辅助治疗,如辅助生殖技术体外授精—胚胎移植(IVF-ET)助孕治疗等。目前治疗药物主要包括非甾体类抗炎药、孕激素类、复方口服避孕药、促性腺激素释放激素激动剂及中药,治疗方式的选择主要根据患者病情评估和生育诉求[52],参考指南可选择适合的治疗方式,见图 4。虽然,药物及手术治疗是EMs患者治疗中的重要手段,但微生态干预正逐步受到广泛关注,可作为药物及手术治疗的补充。
|
| 图 4 EMs的临床治疗 Fig. 4 The clinical treatment of EMs |
Itoh等[53]研究发现,Gasseri乳杆菌OLL2809通过激活自然杀伤细胞抑制腹膜腔内异位内膜细胞的发育。服用Gasseri乳杆菌OLL2809 3个月后可显著降低视觉模拟评分法(VAS)评估的疼痛强度和口头评分法(VRS)评估的痛经程度[54]。益生菌还可以改善肠道微生物群中神经递质合成和信号传导;通过调节神经递质水平,可能会影响EMs患者的疼痛通路并减轻疼痛感知,从而影响VAS评分,主要归因于对白细胞介素-12(IL-12)和NK细胞的免疫反应的调节[55]。另1项研究发现[56]通过外源性补充菌群代谢物不饱和脂肪酸α-亚麻酸能改善EMs小鼠的肠道菌群结构、优势菌丰度和肠壁屏障,调节腹腔内LPS含量和炎症环境改善EMs。综上所述,在益生菌等干预下,通过促进有益菌的生长、抑制有害菌生长,恢复微生态平衡可能是防治EMs的1种方法。
5.2 中药多靶点调节微生态失衡抑制EMs发生发展中药在EMs疾病治疗中发挥了重要的治疗作用,中药复方活性成分通过多环节、多靶点调节恢复微生态平衡,延缓EMs进展,减轻症状。小檗碱[57]通过改善菌群丰度、影响参与能量稳态的代谢物(如葡萄糖、谷氨酰胺和乳酸)浓度来抑制EMs的复发。甘草甜素[58]不仅能够参与免疫调节、抗炎,还能恢复菌群稳态,显著降低LPS诱导的TNF-α、白细胞介素-1β(IL-1β)、一氧化氮(NO)和前列腺素2(PGE2)水平,从而抑制炎症反应,抑制子宫内膜异位病灶的增殖和侵袭。白藜芦醇[59]被称为天然抗炎剂,具有调节肠道菌群结构的作用,增加乳酸杆菌和双歧杆菌丰度,降低厚壁菌和肠球菌的丰度,还能抑制前列腺素合成,发挥抗炎及抗增殖作用,从而有助于防治EMs。通过调节微生物群抑制炎症反应可成为药物治疗的主要靶标。
研究发现[60]化瘀解毒方能改善微生态环境,调节肠道菌群和肠道代谢产物,降低EMs小鼠外周血和腹腔液中LPS水平,并显著降低腹腔液中炎症水平、减轻病灶组织的纤维化程度,从而有效改善EMs。少腹逐瘀汤[61]治疗EMs大鼠4周后肠道微生物群逐步恢复正常,其中厚壁菌/拟杆菌比值降低、瘤胃球菌科丰度增加,肠道屏障功能恢复,异位病灶和内环境中的炎症反应降低,从而在EMs中发挥治疗作用。由此可见,中药不仅能够降低致病菌,调节菌群结构,增加益生菌的丰度,还可以通过调节代谢产物改善宿主的代谢和炎症反应,有望成为未来防治EMs的重要手段。
6 小结及展望综上所述,EMs作为一种严重影响患者生活质量及生育水平的疾病,其表型不同、临床表现多样,目前其发病机理尚未系统阐明,缺乏非侵入性诊断方法及更有效的综合治疗方案,因此寻找诊疗新策略至关重要。中医虽无EMs病名,但对本病早有认识,血瘀是历来医家公认的中医病机,贯穿EMs发生、发展的各个环节。中医对EMs证型描述更多的也是基于血瘀基础上讨论的。但对于其发病也有不同的理论提出,有学者在不断深入研究其致病特点后提出“伏邪”理论,《王氏医存》中云:“伏匿诸病,六淫、诸郁、饮食、淤血、结痰、积气、蓄水,诸虫皆有之……凡肢体酸痛、麻木,及梦魇、梦遗、痞块、癥瘕、疝气、肿瘤、耳聋、目翳、鼻痔,一切对证药不效,皆别有伏邪。”指出瘀血可为伏邪停留日久迁延不愈发为癥瘕,EMs疾病发生发展过程与伏邪的致病特点有异曲同工之处,如EMs早期临床症状不明显、病变范围较广且复杂难治及大多患者伴随卵巢巧克力囊肿的特点,均与伏邪致病的隐匿性、潜伏性、侵袭性及积聚性相一致,可见伏邪与EMs发病密切相关。也有学者在此基础上提出“伏瘀”“伏毒”“伏寒”等理论,虽然目前具体发病原因亦不甚明确,但EMs内环境可以用“伏邪”的理论来准确描述,将致病理论与现代医学的EMs发病机制高度吻合,但目前的病机总结尚缺乏规范、公认的辨证指导,未来应采集更多病史信息,进行EMs疾病分阶段论治的病机思考,形成中医更完善精准的辨证论治体系以指导临床诊疗。
微生态失衡是EMs患者疾病发生发展的重要诱因,与疾病发展程度及临床症状有着密切关系,中药复方及其有效成分可通过多种环节、靶点以调节菌群结构、恢复菌群稳态方式进一步抑制炎症反应、调控免疫功能等方面,较好地调控EMs病情的发展,研究中医药在微生态失衡中发挥的作用将为EMs疾病提供新的干预靶点。但因存在菌群种类丰富、作用机制复杂、中药成分作用靶点缺乏系统梳理等问题,还需更多研究支持论证。随着高通量测序、代谢组学等科研技术的不断应用,研究也将更趋向于精准化、多元化。未来可对不同分型的EMs患者病灶部位微生态特征和代谢产物特征开展深入挖掘研究,以中药调节微生态环境作为切入点,深入明晰中医药作用的具体环节靶点机制,旨在将生态失调状态转化为有利均衡的微环境,以期进一步提高EMs疾病的防治水平,为中医药防治EMs的科学内涵提供新依据。
| [1] |
TAYLOR H S, KOTLYAR A M, FLORES V A. Endometriosis is a chronic systemic disease: Clinical challenges and novel innovations[J]. The Lancet, 2021, 397(10276): 839-852. DOI:10.1016/S0140-6736(21)00389-5 |
| [2] |
LAMCEVA J, ULJANOVS R, STRUMFA I. The main theories on the pathogenesis of endometriosis[J]. International Journal of Molecular Sciences, 2023, 24(5): 4254. DOI:10.3390/ijms24054254 |
| [3] |
TERZIC M, AIMAGAMBETOVA G, KUNZ J, et al. Molecular basis of endometriosis and endometrial cancer: Current knowledge and future perspectives[J]. International Journal of Molecular Sciences, 2021, 22(17): 9274. DOI:10.3390/ijms22179274 |
| [4] |
COHEN BEN-MEIR L, SORIANO D, ZAJICEK M, et al. The association between gastrointestinal symptoms andTransvaginal ultrasound findings in women referred forEndometriosis evaluation: A prospective pilot study[J]. Ultraschall in Der Medizin, 2022, 43(5): e81-e89. DOI:10.1055/a-1300-1887 |
| [5] |
COCCIA M E, NARDONE L, RIZZELLO F. Endometriosis and infertility: A long-life approach to preserve reproductive integrity[J]. International Journal of Environmental Research and Public Health, 2022, 19(10): 6162. DOI:10.3390/ijerph19106162 |
| [6] |
SAUNDERS P T K, HORNE A W. Endometriosis: Etiology, pathobiology, and therapeutic prospects[J]. Cell, 2021, 184(11): 2807-2824. DOI:10.1016/j.cell.2021.04.041 |
| [7] |
CHAPRON C, MARCELLIN L, BORGHESE B, et al. Rethinking mechanisms, diagnosis and management of endometriosis[J]. Nature Reviews Endocrinology, 2019, 15(11): 666-682. DOI:10.1038/s41574-019-0245-z |
| [8] |
马遇春, 孟庆刚, 李佩玲, 等. 基于"伏邪""络病"理论探讨子宫内膜异位症中医病机通路构建[J]. 湖北中医药大学学报, 2017, 19(6): 58-60. DOI:10.3969/j.issn.1008-987x.2017.06.14 |
| [9] |
朱小琳, 韩亚光, 王雪莲, 等. 龙江韩氏妇科基于"伏邪学说"探析子宫内膜异位症辨治思路[J]. 环球中医药, 2018, 11(7): 1060-1062. |
| [10] |
马遇春, 丛慧芳, 王素, 等. 从伏邪理论探讨子宫内膜异位症的发病特点[J]. 辽宁中医杂志, 2015, 42(3): 496-498. |
| [11] |
中国中西医结合学会妇产科专业委员会. 子宫内膜异位症中西医结合诊治指南[J]. 中国中西医结合杂志, 2019, 39(10): 1169-1176. |
| [12] |
马荣. 基于伏邪理论的透邪法治疗感染后咳嗽的临床研究和机理探讨[D]. 北京: 中国中医科学院, 2017.
|
| [13] |
齐盈颊, 肖新春, 崔晓萍, 等. 基于伏邪、络病理论探讨子宫内膜异位症病因病机及治疗[J]. 江苏中医药, 2020, 52(9): 4-7. |
| [14] |
李兰娟. 中国近30年微生态学发展现状及未来[J]. 中国微生态学杂志, 2019, 31(10): 1151-1154, 1157. |
| [15] |
严人, 江慧勇, 李兰娟. 人体微生态与健康和疾病[J]. 微生物学报, 2017, 57(6): 793-805. |
| [16] |
骆文青, 李志宇, 段巧, 等. 从微生态失衡角度阐释"无湿不成痹"理论: 以类风湿关节炎为例[J]. 浙江中医药大学学报, 2020, 44(2): 125-128, 158. |
| [17] |
张发明. 微生态医学作为临床医学学科的探讨[J]. 南京医科大学学报(社会科学版), 2023, 23(1): 82-86. |
| [18] |
CANI P D. Human gut microbiome: Hopes, threats and promises[J]. Gut, 2018, 67(9): 1716-1725. DOI:10.1136/gutjnl-2018-316723 |
| [19] |
CHEN C, SONG X L, WEI W X, et al. The microbiota continuum along the female reproductive tract and its relation to uterine-related diseases[J]. Nature Communications, 2017, 8(1): 875. DOI:10.1038/s41467-017-00901-0 |
| [20] |
KUAN K K W, GIBSON D A, WHITAKER L H R, et al. Menstruation dysregulation and endometriosis development[J]. Frontiers in Reproductive Health, 2021, 3(11): 756704. |
| [21] |
WANG P H, YANG S T, CHANG W H, et al. Endometriosis: Part I. Basic concept[J]. Taiwan Journal of Obstetrics & Gynecology, 2022, 61(6): 927-934. |
| [22] |
AMRO B, RAMIREZ ARISTONDO M E, ALSUWAIDI S, et al. New understanding of diagnosis, treatment and prevention of endometriosis[J]. International Journal of Environmental Research and Public Health, 2022, 19(11): 6725. DOI:10.3390/ijerph19116725 |
| [23] |
SIGNORILE P G, VICECONTE R, BALDI A. New insights in pathogenesis of endometriosis[J]. Frontiers in Medicine, 2022, 9(4): 879015. |
| [24] |
FRANÇA P R C, LONTRA A C P, FERNANDES P D. Endometriosis: A disease with few direct treatment options[J]. Molecules, 2022, 27(13): 4034. DOI:10.3390/molecules27134034 |
| [25] |
KITAYA K, YASUO T. Commonalities and disparities between endometriosis and chronic endometritis: Therapeutic potential of novel antibiotic treatment strategy against ectopic endometrium[J]. International Journal of Molecular Sciences, 2023, 24(3): 2059. DOI:10.3390/ijms24032059 |
| [26] |
SER H L, AU YONG S J, SHAFIEE M N, et al. Current updates on the role of microbiome in endometriosis: A narrative review[J]. Microorganisms, 2023, 11(2): 360. DOI:10.3390/microorganisms11020360 |
| [27] |
JIANG I, YONG P J, ALLAIRE C, et al. Intricate connections between the microbiota and endometriosis[J]. International Journal of Molecular Sciences, 2021, 22(11): 5644. DOI:10.3390/ijms22115644 |
| [28] |
LE N, CREGGER M, BROWN V, et al. Association of microbial dynamics with urinary estrogens and estrogen metabolites in patients with endometriosis[J]. PLoS One, 2021, 16(12): e0261362. DOI:10.1371/journal.pone.0261362 |
| [29] |
SHAN J, NI Z X, CHENG W, et al. Gut microbiota imbalance and its correlations with hormone and inflammatory factors in patients with stage 3/4 endometriosis[J]. Archives of Gynecology and Obstetrics, 2021, 304(5): 1363-1373. DOI:10.1007/s00404-021-06057-z |
| [30] |
LEONARDI M, HICKS C, EL-ASSAAD F, et al. Endometriosis and the microbiome: A systematic review[J]. BJOG: an International Journal of Obstetrics and Gynaecology, 2020, 127(2): 239-249. DOI:10.1111/1471-0528.15916 |
| [31] |
ATA B, YILDIZ S, TURKGELDI E, et al. The endobiota study: Comparison of vaginal, cervical and gut microbiota between women with stage 3/4 endometriosis and healthy controls[J]. Scientific Reports, 2019, 9(1): 2204. DOI:10.1038/s41598-019-39700-6 |
| [32] |
HERNANDES C, SILVEIRA P, RODRIGUES SEREIA A F, et al. Microbiome profile of deep endometriosis patients: Comparison of vaginal fluid, endometrium and lesion[J]. Diagnostics, 2020, 10(3): 163. DOI:10.3390/diagnostics10030163 |
| [33] |
KHAN K N, FUJISHITA A, KITAJIMA M, et al. Intra-uterine microbial colonization and occurrence of endometritis in women with endometriosis[J]. Human Reproduction, 2014, 29(11): 2446-2456. DOI:10.1093/humrep/deu222 |
| [34] |
王红燕, 颜贝, 裴承斌, 等. 经血来源间充质干细胞对大鼠薄型子宫内膜的治疗效果[J]. 中国医学前沿杂志(电子版), 2019, 11(11): 41-45. |
| [35] |
CHANG C Y, CHIANG A J, LAI M T, et al. A more diverse cervical microbiome associates with better clinical outcomes in patients with endometriosis: A pilot study[J]. Biomedicines, 2022, 10(1): 174. DOI:10.3390/biomedicines10010174 |
| [36] |
YUAN W, WU Y H, CHAI X S, et al. The colonized microbiota composition in the peritoneal fluid in women with endometriosis[J]. Archives of Gynecology and Obstetrics, 2022, 305(6): 1573-1580. DOI:10.1007/s00404-021-06338-7 |
| [37] |
LEE S R, LEE J C, KIM S H, et al. Altered composition of microbiota in women with ovarian endometrioma: Microbiome analyses of extracellular vesicles in the peritoneal fluid[J]. International Journal of Molecular Sciences, 2021, 22(9): 4608. DOI:10.3390/ijms22094608 |
| [38] |
WEI W X, ZHANG X W, TANG H R, et al. Microbiota composition and distribution along the female reproductive tract of women with endometriosis[J]. Annals of Clinical Microbiology and Antimicrobials, 2020, 19(1): 15. DOI:10.1186/s12941-020-00356-0 |
| [39] |
SOBSTYL A, CHAŁUPNIK A, MERTOWSKA P, et al. How do microorganisms influence the development of endometriosis? participation of genital, intestinal and oral microbiota in metabolic regulation and immunopathogenesis of endometriosis[J]. International Journal of Molecular Sciences, 2023, 24(13): 10920. DOI:10.3390/ijms241310920 |
| [40] |
KHAN K N, KITAJIMA M, HIRAKI K, et al. Escherichia coli contamination of menstrual blood and effect of bacterial endotoxin on endometriosis[J]. Fertility and Sterility, 2010, 94(7): 2860-2863.e1-3. DOI:10.1016/j.fertnstert.2010.04.053 |
| [41] |
韦雅婧, 梁炎春, 杨如玉, 等. 健康女性与子宫内膜异位症患者肠道菌群微生物组学研究[J]. 实用医学杂志, 2021, 37(10): 1279-1283. |
| [42] |
KHAN K N, FUJISHITA A, HIRAKI K, et al. Bacterial contamination hypothesis: A new concept in endometriosis[J]. Reproductive Medicine and Biology, 2018, 17(2): 125-133. DOI:10.1002/rmb2.12083 |
| [43] |
WEI Y J, TAN H, YANG R Y, et al. Gut dysbiosis-derived β-glucuronidase promotes the development of endometriosis[J]. Fertility and Sterility, 2023, 120(3 Pt 2): 682-694. |
| [44] |
FENG D, WANG X N, HUANG Y H, et al. Warming menstruation and analgesic soup inhibits PD-1/PD-L1 pathway in rats with endometriosis[J]. Alternative Therapies in Health and Medicine, 2023, 29(4): 152-157. |
| [45] |
BAKER J M, AL-NAKKASH L, HERBST-KRALOVETZ M M. Estrogen-gut microbiome axis: Physiological and clinical implications[J]. Maturitas, 2017, 103(9): 45-53. |
| [46] |
HELBIG M, VESPER A S, BEYER I, et al. Does nutrition affect endometriosis?[J]. Geburtshilfe Und Frauenheilkunde, 2021, 81(2): 191-199. DOI:10.1055/a-1207-0557 |
| [47] |
LASCHKE M W, MENGER M D. The gut microbiota: A puppet master in the pathogenesis of endometriosis?[J]. American Journal of Obstetrics and Gynecology, 2016, 215(1): 68e1-68e4. DOI:10.1016/j.ajog.2016.02.036 |
| [48] |
LU N S, LI M J, LEI H L, et al. Butyric acid regulates progesterone and estradiol secretion via cAMP signaling pathway in porcine granulosa cells[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2017, 172(9): 89-97. |
| [49] |
MOLINA N M, SOLA-LEYVA A, SAEZ-LARA M J, et al. New opportunities for endometrial health by modifying uterine microbial composition: Present or future?[J]. Biomolecules, 2020, 10(4): 593. DOI:10.3390/biom10040593 |
| [50] |
HUANG L J, LIU B D, LIU Z H, et al. Gut microbiota exceeds cervical microbiota for early diagnosis of endometriosis[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11(12): 788836. |
| [51] |
中国医师协会妇产科医师分会, 中华医学会妇产科学分会子宫内膜异位症协作组. 子宫内膜异位症诊治指南(第三版)[J]. 中华妇产科杂志, 2021, 56(12): 812-824. |
| [52] |
曹改静, 吕小慧, 汪梦馨, 等. 子宫内膜异位症临床分期研究进展[J]. 中国实用妇科与产科杂志, 2023, 39(7): 762-765. |
| [53] |
ITOH H, SASHIHARA T, HOSONO A, et al. Lactobacillus gasseri OLL2809 inhibits development of ectopic endometrial cell in peritoneal cavity via activation of NK cells in a murine endometriosis model[J]. Cytotechnology, 2011, 63(2): 205-210. DOI:10.1007/s10616-011-9343-z |
| [54] |
ITOH H, UCHIDA M, SASHIHARA T, et al. Lactobacillus gasseri OLL2809 is effective especially on the menstrual pain and dysmenorrhea in endometriosis patients: Randomized, double-blind, placebo-controlled study[J]. Cytotechnology, 2011, 63(2): 153-161. DOI:10.1007/s10616-010-9326-5 |
| [55] |
KHODAVERDI S, MOHAMMADBEIGI R, KHALEDI M, et al. Beneficial effects of oral Lactobacillus on pain severity in women suffering from endometriosis: A pilot placebo-controlled randomized clinical trial[J]. International Journal of Fertility & Sterility, 2019, 13(3): 178-183. |
| [56] |
NI Z X, DING J, ZHAO Q Q, et al. Alpha-linolenic acid regulates the gut microbiota and the inflammatory environment in a mouse model of endometriosis[J]. American Journal of Reproductive Immunology, 2021, 86(4): e13471. DOI:10.1111/aji.13471 |
| [57] |
WAROWICKA A, QASEM B, DERA-SZYMANOWSKA A, et al. Effect of protoberberine-rich fraction of Chelidonium majus L. on endometriosis regression[J]. Pharmaceutics, 2021, 13(7): 931. DOI:10.3390/pharmaceutics13070931 |
| [58] |
WANG X R, HAO H G, CHU L. Glycyrrhizin inhibits LPS-induced inflammatory mediator production in endometrial epithelial cells[J]. Microbial Pathogenesis, 2017, 109(8): 110-113. |
| [59] |
DULL A M, MOGA M A, DIMIENESCU O G, et al. Therapeutic approaches of resveratrol on endometriosis via anti-inflammatory and anti-angiogenic pathways[J]. Molecules, 2019, 24(4): 667. DOI:10.3390/molecules24040667 |
| [60] |
赵倩倩, 倪喆鑫, 毕艳丽, 等. 化瘀解毒方改善子宫内膜异位症小鼠肠道菌群及粪便代谢组[J]. 中国实验方剂学杂志, 2021, 27(9): 202-214. |
| [61] |
LIU M, YAN J, WU Y K, et al. The impact of herbal medicine in regulating intestinal flora on female reproductive disorders[J]. Frontiers in Pharmacology, 2022, 13(10): 1026141. |
 2024, Vol. 41
2024, Vol. 41