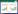文章信息
- 张辉, 吕树泉, 潘保朝.
- ZHANG Hui, LYU Shuquan, PAN Baochao.
- 基于IRE1/GPR78信号通路研究三黄益肾胶囊抑制DKD大鼠肾组织细胞凋亡的作用机制
- Study on the mechanism of Sanhuang Yishen Capsule in inhibiting apoptosis of renal tissue cells in DKD rats based on IRE1/GPR78 signaling pathway
- 天津中医药, 2024, 41(5): 642-648
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(5): 642-648
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.05.17
-
文章历史
- 收稿日期: 2024-01-22
由于人口的老龄化程度逐渐加深,全球2型糖尿病的患病率在过去30年中迅速增加,这表明其微血管并发症糖尿病肾病(DKD)的发病率也在迅速提高[1]。DKD作为终末期肾病的主要病因,给家庭、社会和国家造成了巨大的经济压力。然而,DKD的发病机制尚不明确,目前尚无特异性治疗方法。西医治疗DKD的主要手段是通过药物控制血压、血脂和葡萄糖水平[2],一些新的药物,例如钠-葡萄糖协同转运蛋白2抑制剂,能在一定程度上减少蛋白尿改善肾功能进而延缓DKD的进展,但是也会产生胃肠道不良事件、低血糖、胰腺炎等不良反应[3]。中医药因其多靶点、多组分、多环节、低毒副作用的优势,已经成为改善DKD患者肾功能,阻止疾病进展的重要治疗手段。
研究表明[4-5]内质网应激(ERS)及其诱导的细胞凋亡与DKD的发生与发展密切相关。G蛋白偶联受体78(GRP78)能够在ERS期间被诱导表达,在1项临床实验[6]中证实,GRP78的表达量与DKD患者的蛋白尿、肌酐、尿素氮等水平呈正相关。另1项实验研究证明,通过抑制GRP78的表达能够有效减轻内质网应激,进而减少细胞凋亡改善肾功能。肌醇酶1(IRE1)是内质网应激激活的主要信号通路之一,在ERS期间,GRP78通过促进IRE1α的激活进而诱导肾组织细胞凋亡[7-8],从而导致肾功能的降低。三黄益肾胶囊作为本院制剂,由黄芪、西洋参、山药、山茱萸、金樱子等药物组成,具有益气活血,补脾益肾的功效,在既往的临床和基础实验中均证实了其疗效确切[9-11],但作用机制尚未明确。本研究首先通过高脂饲料联合链脲佐菌素(STZ)注射,建立DKD大鼠模型,明确三黄益肾胶囊对DKD大鼠的治疗作用。其次通过检测三黄益肾胶囊干预后模型大鼠肾脏内质网应激标志性因子GRP78、IRE1的蛋白表达水平以及肾组织中BcL2关联X蛋白(Bax)、BcL2、半胱氨酸蛋白酶-3(Caspase-3)、半胱氨酸蛋白酶-9(Caspase-9)凋亡相关蛋白的表达水平,探究三黄益肾胶囊治疗DKD的作用机制。
1 材料 1.1 实验动物SPF级雄性SD大鼠30只,6~8周龄,体质量(200±20)g,购自北京华阜康生物科技股份有限公司[动物许可证号:SCXK(京)2021-0031]饲养环境保持在(25±2)℃,相对湿度为50%±15%,明暗周期12 h的环境下,自由饮水和进食。该研究已被河北省沧州中西医结合医院伦理委员会批准(伦理批号:CZX2022-KY-023)。
1.2 药品与主要试剂三黄益肾胶囊(每粒装0.45 g,批号Z20050795),厄贝沙坦(0.15 g/片,国药准字H20000516)。高糖高脂饲料(10%猪油、20%蔗糖、2.5%胆固醇、67.5%常规饲料)购自北京斯贝福生物科技有限公司。STZ购自北京索莱宝科技有限公司。血清肌酐(Cr,批号:C011-2-1)、尿素氮(BUN,批号:C013-2-1)、尿蛋白(批号:C035-2-1)、超氧化物歧化酶(SOD,批号:A001-3-2)、丙二醛(MDA,批号:003-1-2)和谷胱甘肽过氧化酶(GSH-Px,批号:A005-1-2)检测试剂盒均购自南京建成生物工程研究所。大鼠白细胞介素-6(IL-6,批号:EK306HS)、白细胞介素-1β(IL-1β,批号:EK301B)、大鼠肿瘤坏死因子-α(TNF-α,批号:EK382HS)酶联免疫吸附(ELISA)试剂盒均购自联科生物科技有限公司。BCA蛋白测定试剂盒(批号:PC0020)、Tunel凋亡检测试剂盒(批号:T2130)购自Solarbio生物技术有限公司。抗大鼠GRP78(批号:ab21685)、IRE1(批号:ab37073)、Bax(批号:ab32503),Bcl2(批号:ab182858),Caspase-3(批号:ab13847),Caspase-9(批号:ab202068)购自美国Abcam公司。
2 方法 2.1 实验动物分组与给药将大鼠适应性喂养1周,随机选取6只为正常组,予以常规清洁级饲料,其余24只给予高糖高脂饲料(10%猪油、20%蔗糖、2.5%胆固醇、67.5%常规饲料)。特殊饲料喂养7周后于第7周末进行腹腔注射STZ 30 mg/kg[溶于0.1 mol/L枸橼酸缓冲液,pH=4.5],注射前12 h禁食不禁水。72 h后尾静脉采血检测随机血糖≥16.7 mmol/L,即可认为糖尿病大鼠造模成功。糖尿病大鼠继续喂养1周,1周后开始用代谢笼收集大鼠24 h尿,检测24 h UTP。以血糖水平≥16.7 mmol/L、尿白蛋白≥30 mg/24 h,作为DKD动物模型建立标准[12]。
按照随机数字表法,将造模成功的24只大鼠随机分为模型组、阳性药组、三黄益肾胶囊低剂量组和三黄益肾胶囊高剂量组,每组各6只。正常组、DKD组予以灌胃等剂量生理盐水,三黄益肾低、高剂量组灌胃剂量分别为0.81、1.62 g/kg,阳性药组予厄贝沙坦11.51 mg/kg进行灌胃,各组连续给药8周。给药期间,每周检测大鼠空腹血糖及体质量。
2.2 生化指标检测三黄益肾干预8周后,使用代谢笼收集各组大鼠24 h尿液,收集质量达4 000×g后进行离心,时间为10 min,按照试剂盒说明书进行操作。麻醉处死大鼠,腹主动脉取血,收集血清,检测Cr、BUN水平。
2.3 肾组织病理学染色各组大鼠肾脏组织经10%福尔马林溶液固定24 h,水洗20 min后梯度乙醇脱水,二甲苯透明后石蜡包埋,切片5 μm,进行苏木精-伊红(HE)染色,然后在显微镜下观察各组大鼠肾组织的基本病理改变情况。
2.4 肾脏组织氧化应激相关指标检测取肾脏组织,用磷酸缓冲盐溶液(PBS)冲洗,并在冰上匀浆,4 ℃、3 000 r/min,离心10 min(离心半径10 cm)。按照酶联免疫吸附剂测定(ELISA)试剂盒说明书检测氧化应激相关指标SOD、GSH-Px活性以及MDA水平。
2.5 肾脏组织炎性因子相关指标检测按照ELISA试剂盒说明书检测肾脏组织IL-1β、IL-6、TNF-α水平。将100 μL的IL-6、IL-1β及TNF-α捕获抗体加入ELISA板中室温孵育过夜,洗板后封闭1 h,洗板后加入大鼠肾组织匀浆100 μL,每个样品做3个复孔,同时分别加入试剂盒提供的标准品以绘制标准曲线,室温孵育3 h后洗板,加入相应酶标二抗室温孵育30 min后洗板,加入显色液后酶标仪在波长405 nm读取吸光度,计算IL-6、IL-1β及TNF-α浓度。
2.6 肾脏细胞凋亡情况检测将大鼠肾组织进行石蜡包埋后切片,进行Tunel染色,按试剂盒说明书进行操作,显微镜下观察肾组织细胞凋亡情况。
2.7 蛋白免疫印迹(Western blot)法检测取各组大鼠肾组织加入RIPA裂解缓冲液中,使用BCA蛋白测定试剂盒测定总蛋白浓度,并将样品蛋白浓度进行均一化。蛋白样品经电泳后,转移至聚偏二氟乙烯(PVDF)膜,封闭后分别加入Bax、Bcl2、Caspase-3、Caspase-9、IRE1、GRP78抗体,用5%脱脂奶粉4 ℃封闭过夜,次日取出后,分别加入不同的兔抗大鼠一抗(1∶1 000),室温孵育2 h,洗膜后加入二抗(稀释比例1∶5 000),室温孵育2 h,加入显影液显色,用ECL化学发光仪显影。采用Image J软件分析蛋白条带灰度值。
2.8 统计学方法采用SPSS Statistics 26.0统计软件进行数据统计,计量资料符合正态分布的采用t检验,用均数±标准差(x±s)表示,两组组间资料比较采用t检验,P<0.05为差异具有统计学意义。
3 结果 3.1 三黄益肾胶囊对DN大鼠的治疗作用 3.1.1 造模给药后各组大鼠体质量、血糖、肾功能指标变化给药结束后,与正常组相比,模型组大鼠体质量明显下降(P<0.01),与模型组相比,阳性药组、三黄益肾胶囊低剂量组、三黄益肾胶囊高剂量组体质量增加,差异具有统计学意义(P<0.01)。见表 1。
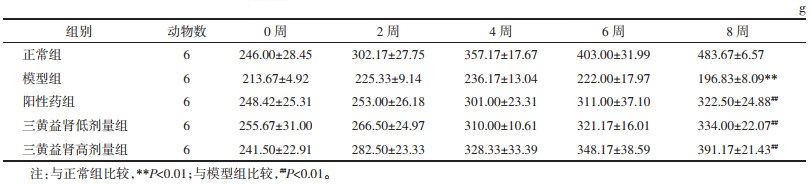
大鼠注射STZ 72 h后空腹血糖均≥16.7 mmol/L,三黄益肾胶囊干预4周后,与模型组相比三黄益肾胶囊低、高剂量组大鼠空腹血糖降低(P<0.01)。见表 2。
肾功能检测结果显示,与正常组相比,模型组大鼠血清中Cr、BUN水平以及24 h尿蛋白定量显著升高(均P<0.01);与模型组相比,阳性药组及低、高剂量三黄益肾胶囊干预可降低DKD大鼠血清Cr、BUN水平及24 h尿蛋白定量,差异有统计学意义(P<0.01)。见表 3。
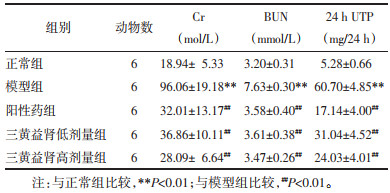
|
肾脏HE染色结果显示,正常组肾小球、肾小管结构均为生理状态;模型组出现肾小管局灶变性、萎缩,肾小球基底膜略增厚、系膜增生,且出现脂肪变性。与模型组对照,各给药组肾脏病理变化改善明显,以阳性药组、三黄益肾高剂量组改善更加明显。见图 1。
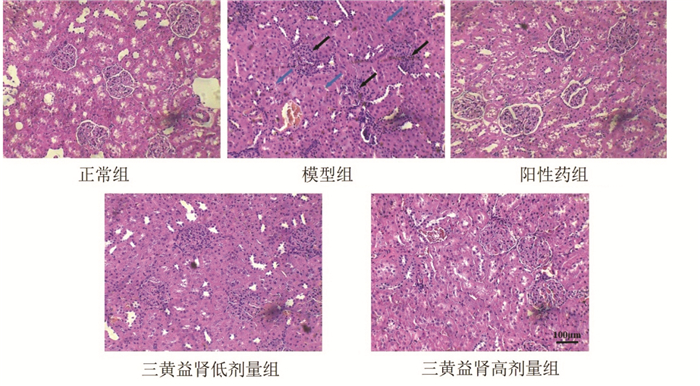
|
| 注:黑色箭头表示肾小球典型病变标识,蓝色箭头表示肾小管典型病变标识。 图 1 大鼠肾组织HE染色 Fig. 1 HE staining of renal tissue in rats |
与正常组相比,模型组大鼠肾组织匀浆中SOD及GSH-Px活性降低,MDA水平增高(P<0.01);与模型组相比,阳性药组、三黄益肾胶囊低、高剂量组SOD及GSH-Px活性升高,MDA水平降低,差异有统计学意义(P<0.01)。见表 4。
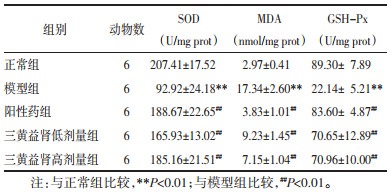
|
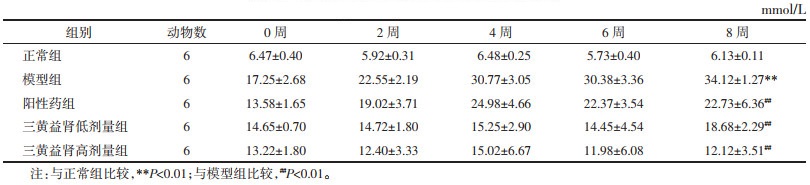
与正常组相比,模型组大鼠血清中促炎因子IL-6、IL-1β及TNF-α水平显著升高(P<0.01);与模型组相比,阳性药组及三黄益肾低、高剂量干预可降低DKD大鼠血清中IL-6、IL-1β及TNF-α水平,差异有统计学意义(P<0.01)。见表 5。
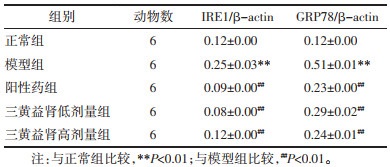
Western blot结果表明,与正常组相比,模型组IRE1、GPR78蛋白表达均显著升高(P<0.01);与模型组相比,阳性药组、三黄益肾胶囊低、高剂量组IRE1、GPR78蛋白表达显著降低,差异有统计学意义(P<0.01)。见图 2。
|
| 图 2 大鼠肾组织中IRE1、GPR78 Western blot结果 Fig. 2 Western blot results of IRE1 and GPR78 in rat kidney tissue |
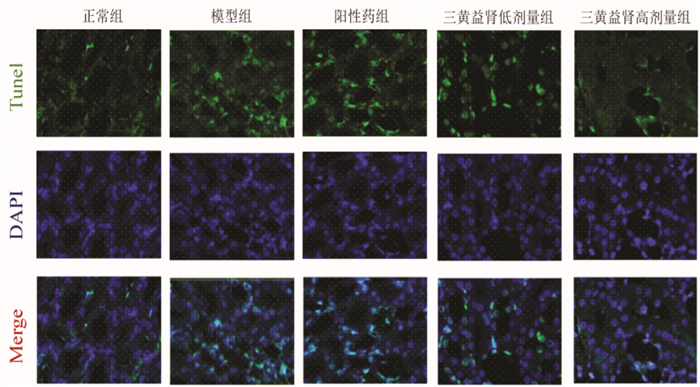
肾组织TUNEL染色结果显示,正常组可见极少数阳性细胞;模型组与正常组比较,可见大量阳性细胞,细胞凋亡较多;与模型组比较,各给药组阳性细胞数目明显低于模型组,凋亡细胞减少,以阳性药组、三黄益肾高剂量组改善更加明显。见图 3。
|
| 图 3 大鼠肾组织Tunel染色 Fig. 3 Tunel staining of rat kidney tissue |
|
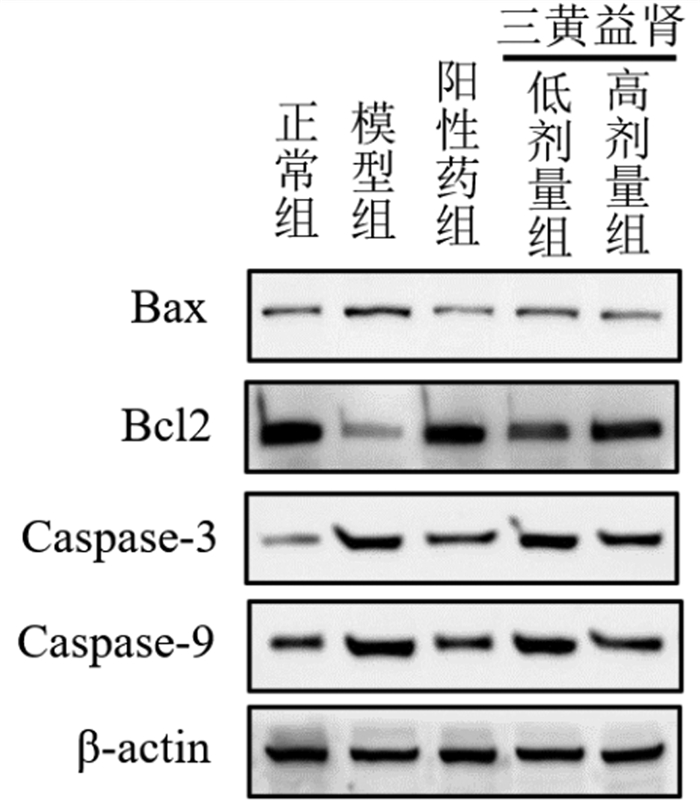
| 图 4 大鼠肾组织中Bax、Caspase-3、Caspase-9、BcL2 Western blot结果 Fig. 4 Western blot results of Bax, Caspase-3, Caspase-9 and BcL2 in rat kidney tissue |
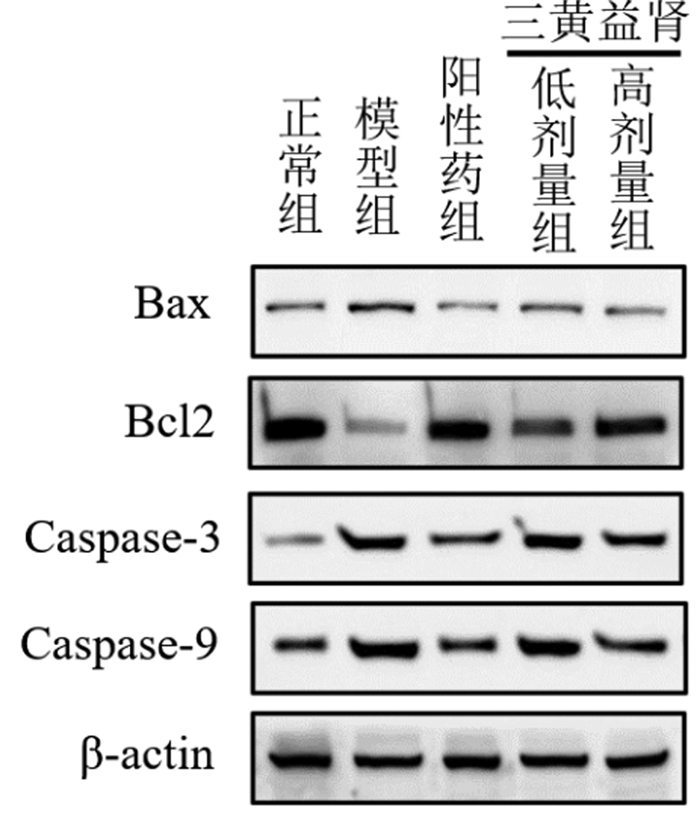
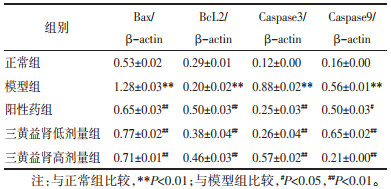
Western blot结果表明,与正常组相比,模型组Bax、Caspase-3、Caspase-9蛋白表达均显著升高(P<0.01),BcL2蛋白表达显著降低(P<0.01);与模型组相比,阳性药组Bax、Caspase-3、Caspase-9蛋白表达显著降低(P<0.01),BcL2蛋白表达显著升高(P<0.01),三黄益肾胶囊低、高剂量组Bax、Caspase-3、Caspase-9蛋白表达显著降低(P<0.01),BcL2蛋白表达显著升高(P<0.01)。见表 7。
|
|
DKD是指由糖尿病所致的慢性肾脏结构和功能障碍的疾病,其病变可累及全肾。如果不及时进行治疗,将会导致严重后果,最终发展为终末期肾衰竭[13]。DKD临床表现多为尿蛋白漏出和肾功能异常。中医将其归属为“水肿”“尿浊”,病位在肾,与脾关系密切。中医在治疗DKD上历史悠久,应用广泛,通过辨证论治和整体治疗等方法,在治疗DKD上有多靶点、多通路的优势。三黄益肾胶囊作为本院临床使用的中药复方制剂,疗效显著。纵观全方,三黄益肾胶囊共奏益气养阴、健脾补肾、活血化瘀之功。其中重用黄芪、黄精、生地黄以“三黄”为君,补脾气,滋肾阴;西洋参、山茱萸、枸杞子、山药为臣,益气兼养肝肾之阴;芡实、金樱子、益母草、当归为佐以涩精消浊,化瘀利水。
本研究使用高脂饲料联合STZ注射建立DKD大鼠模型。研究结果显示,模型组大鼠血清中的肌酐、尿素氮以及尿液中的蛋白质水平显著上升。肾脏的HE染色显示DKD模型大鼠的肾组织细胞过度增殖和排列紊乱,这与其他关于DKD的动物研究一致[14],造模成功。给药三黄益肾胶囊治疗后,模型大鼠血清中Cr、BUN水平及24 h UTP水平均降低,同时,肾组织病理学变化得到明显改善。实验结果充分证实了三黄益肾胶囊对DKD的治疗作用。
研究表明,IL-6、IL-1β和TNF-α在内的促炎细胞因子在DKD的发生和发展中起重要作用[15]。同时,氧化应激也是DKD肾脏损伤的重要因素。本研究结果证实三黄益肾胶囊可显著上调肾组织SOD与GSH-Px活性,下调MDA水平,显著降低DKD大鼠肾组织IL-6、TNF-α及IL-1β水平。实验结果提示,三黄益肾胶囊能够通过减轻炎症反应及氧化应激改善DKD肾损伤。
长期的高血糖状态会诱导持续性的内质网应激,进而导致肾组织细胞的凋亡,从而发生DKD[16-17]。ERS可导致蛋白质折叠紊乱并促使未折叠和错误折叠蛋白质的积累。为了恢复内质网稳态,多种细胞信号通路被激活以维持细胞存活。然而,当诱导ERS的刺激持续存在时,ERS反应最终以细胞凋亡告终[18]。GRP78是热休克蛋白70(HSP70)家族的成员,是ER稳态的关键调节剂[19]。在细胞稳态的标准条件下,GRP78以非活性形式与激活转录因子6(ATF6)、蛋白激酶RNA样内质网激酶(PERK)和肌醇需要酶1(IRE1)3个UPR传感器结合。然而当细胞暴露于内质网中积累的未折叠蛋白质时,GRP78会从UPR传感器中释放,同时增加的GRP78能够防止错误折叠的蛋白质的聚集,帮助它们正确易位,并启动UPR途径[20-21]。然而GRP78大量产生之后会使得内质网出现持续性应激进而激活相关凋亡信号途径从而介导细胞凋亡。IRE1信号介导通路在ERS反应中发挥着核心作用[22]。当ERS发生时,ER稳态被ER中超载蛋白质的折叠破坏,功能失调的ERS可导致UPR,同时持续的刺激激活了作为ERS传感器的IRE1依赖性信号通路。激活的IRE1通过与下游通路(JNK、XBP1、CHOP)的结合,进而下调抗凋亡基因BCL-2、上调促凋亡基因Bax等凋亡反应蛋白,从而促使细胞凋亡[23]。多项研究也已证实IRE1信号通路在诱导细胞凋亡中的关键作用[24-25]。肾组织TUNEL染色结果显示,三黄益肾胶囊可显著改善模型组大鼠细胞,以高剂量组更为显著。Western blot结果表明三黄益肾胶囊显著降低了肾组织中GRP78、IRE1蛋白表达水平,并同时下调了Bax、Caspase-3、Caspase-9的表达,提高了BCL2的表达。实验证实,三黄益肾胶囊通过抑制IRE1/GPR78信号通路的表达,在一定程度上改善了内质网应激的影响,缓解了肾组织中的细胞凋亡,进而起到了保护肾功能的作用。
综上所述,研究证实了三黄益肾胶囊对DKD的多种改善作用,包括改善肾功能,缓解高血糖、病理改变、氧化应激和炎症反应,明确了三黄益肾胶囊能够通过抑制IRE1/GPR78信号通路的激活,降低内质网应激反应,进而减少肾组织细胞的过度凋亡,减轻DKD大鼠肾脏损伤。
| [1] |
SAWAF H, THOMAS G, TALIERCIO J J, et al. Therapeutic advances in diabetic nephropathy[J]. Journal of Clinical Medicine, 2022, 11(2): 378. DOI:10.3390/jcm11020378 |
| [2] |
《中国老年型糖尿病防治临床指南》编写组. 中国老年2型糖尿病防治临床指南(2022年版)[J]. 中国糖尿病杂志, 2022, 30(1): 2-51. |
| [3] |
TRUJILLO J. Safety and tolerability of once-weekly GLP-1 receptor agonists in type 2 diabetes[J]. Journal of Clinical Pharmacy and Therapeutics, 2020, 45(Suppl 1): 43-60. |
| [4] |
HAN J R, PANG X X, SHI X J, et al. Ginkgo biloba extract EGB761 ameliorates the extracellular matrix accumulation and mesenchymal transformation of renal tubules in diabetic kidney disease by inhibiting endoplasmic reticulum stress[J]. BioMed Research International, 2021, 2021: 6657206. |
| [5] |
CAO Y P, HAO Y M, LI H, et al. Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose[J]. International Journal of Molecular Medicine, 2014, 33(4): 809-816. DOI:10.3892/ijmm.2014.1642 |
| [6] |
MA N, XU N, YIN D, et al. Levels of circulating GRP78 and CHOP in endoplasmic reticulum stress pathways in Chinese type 2 diabetic kidney disease patients[J]. Medicine, 2021, 100(33): e26879. DOI:10.1097/MD.0000000000026879 |
| [7] |
SIWECKA N, ROZPȨDEK-KAMIŃSKA W, WAWRZYNKIEWICZ A, et al. The structure, activation and signaling of IRE1 and its role in determining cell fate[J]. Biomedicines, 2021, 9(2): 156. DOI:10.3390/biomedicines9020156 |
| [8] |
PIHÁN P, CARRERAS-SUREDA A, HETZ C. BCL-2 family: integrating stress responses at the ER to control cell demise[J]. Cell Death and Differentiation, 2017, 24(9): 1478-1487. DOI:10.1038/cdd.2017.82 |
| [9] |
王媛媛. 三黄益肾胶囊联合达格列净片对气阴两虚夹瘀型糖尿病肾脏病患者尿蛋白的影响[D]. 唐山: 华北理工大学, 2022.
|
| [10] |
路菲菲, 王元松, 吕树泉, 等. 三黄益肾胶囊对糖尿病肾病大鼠肾组织IGF-1表达的影响[J]. 中国中医基础医学杂志, 2019, 25(9): 1218-1221, 1240. |
| [11] |
宋慧丽, 吕树泉, 韩中千, 等. 三黄益肾组方对早期糖尿病肾病患者肾功能及肾脏纤维化指标的影响[J]. 现代中西医结合杂志, 2018, 27(23): 2551-2553. |
| [12] |
XUE L Y, FENG X Q, WANG C H, et al. Benazepril hydrochloride improves diabetic nephropathy and decreases proteinuria by decreasing ANGPTL-4 expression[J]. BMC Nephrology, 2017, 18(1): 307. DOI:10.1186/s12882-017-0724-1 |
| [13] |
SAMSU N. Diabetic nephropathy: challenges in pathogenesis, diagnosis, and treatment[J]. BioMed Research International, 2021, 2021: 1497449. |
| [14] |
YAN L, XU X X, FAN Y B, et al. Tangshen decoction enhances podocytes autophagy to relieve diabetic nephropathy through modulation of p-AMPK/p-ULK1 signaling[J]. Evidence-Based Complementary and Alternative Medicine, 2022, 2022: 3110854. |
| [15] |
RAYEGO-MATEOS S, MORGADO-PASCUAL J L, OPAZO-RÍOS L, et al. Pathogenic pathways and therapeutic approaches targeting inflammation in diabetic nephropathy[J]. International Journal of Molecular Sciences, 2020, 21(11): 3798. DOI:10.3390/ijms21113798 |
| [16] |
YASUDA M, TANAKA Y, KUME S, et al. Fatty acids are novel nutrient factors to regulate mTORC1 lysosomal localization and apoptosis in podocytes[J]. Biochimica et Biophysica Acta, 2014, 1842(7): 1097-1108. DOI:10.1016/j.bbadis.2014.04.001 |
| [17] |
KIM H, MOON S Y, KIM J S, et al. Activation of AMP-activated protein kinase inhibits ER stress and renal fibrosis[J]. American Journal of Physiology Renal Physiology, 2015, 308(3): F226-F236. DOI:10.1152/ajprenal.00495.2014 |
| [18] |
XIE Y F, JING E, CAI H, et al. Reticulon-1A mediates diabetic kidney disease progression through endoplasmic reticulum-mitochondrial contacts in tubular epithelial cells[J]. Kidney International, 2022, 102(2): 293-306. DOI:10.1016/j.kint.2022.02.038 |
| [19] |
QI W, MU J, LUO Z F, et al. Attenuation of diabetic nephropathy in diabetes rats induced by streptozotocin by regulating the endoplasmic reticulum stress inflammatory response[J]. Metabolism: Clinical and Experimental, 2011, 60(5): 594-603. DOI:10.1016/j.metabol.2010.07.021 |
| [20] |
KORENNYKH A, WALTER P. Structural basis of the unfolded protein response[J]. Annual Review of Cell and Developmental Biology, 2012, 28: 251-277. DOI:10.1146/annurev-cellbio-101011-155826 |
| [21] |
PFAFFENBACH K T, LEE A S. The critical role of GRP78 in physiologic and pathologic stress[J]. Current Opinion in Cell Biology, 2011, 23(2): 150-156. DOI:10.1016/j.ceb.2010.09.007 |
| [22] |
SEPULVEDA D, ROJAS-RIVERA D, RODRÍGUEZ D A, et al. Interactome screening identifies the ER luminal chaperone Hsp47 as a regulator of the unfolded protein response transducer IRE1α[J]. Molecular Cell, 2018, 69(2): 238-252. DOI:10.1016/j.molcel.2017.12.028 |
| [23] |
URANO F, WANG X, BERTOLOTTI A, et al. Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1[J]. Science, 2000, 287(5453): 664-666. DOI:10.1126/science.287.5453.664 |
| [24] |
YUE L L, DU X. Thrombospondin 1 promotes endoplasmic reticulum stress and apoptosis in HK-2 cells by upregulating ATF6-CHOP[J]. Current Medical Science, 2022, 42(2): 341-347. DOI:10.1007/s11596-022-2513-8 |
| [25] |
XU Y W, CHEN J, CHEN J G, et al. EI24 promotes cell adaption to ER stress by coordinating IRE1 signaling and calcium homeostasis[J]. EMBO Reports, 2022, 23(3): e51679. DOI:10.15252/embr.202051679 |
 2024, Vol. 41
2024, Vol. 41