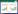文章信息
- 张晓晓, 战秀俊, 李晓格, 等.
- ZHANG Xiaoxiao, ZHAN Xiujun, LI Xiaoge, et al.
- 基于专利数据挖掘与网络药理学探讨大血藤抗高脂血症的作用机制
- Mechanism of sargentodoxa cuneate in treatment of hyperlipidemia based on patent data mining and network pharmacology
- 天津中医药, 2024, 41(5): 649-658
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(5): 649-658
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.05.18
-
文章历史
- 收稿日期: 2024-01-10
2. 现代中医药海河实验室,天津 301617;
3. 组分中药国家重点实验室,天津 301617
中药大血藤为木通科植物大血藤Sargentodoxa cuneata(Oliv.)Rehd. et Wils.的干燥藤茎。味苦,性平,归大肠、肝经,有清热解毒,活血,祛风止痛的功效。大血藤中有多种化学成分,尤其富含多酚类。近几年多酚在预防高脂血症方面得到了广泛的研究。而笔者未见大血藤提取物具有抗高脂血症功效的报道。但是在现代药理研究中,大血藤总酚酸可以抑制心肌缺血小鼠的细胞凋亡和氧化应激[1],可以改善脑缺血再灌注损伤大鼠脑组织的氧化应激水平[2],还能降低炎症因子在大脑组织的表达[3];大血藤活性成分3,4-dihydroxyphenylethyl alcohol glycoside和liriodendrin均可以减轻炎症反应,阻止活性氧(ROS)的产生,对结肠炎和急性肺损伤均有保护作用[4-6]。这些研究表明大血藤具有减轻炎症效应和氧化应激损伤的作用,并对心血管疾病具有保护作用。众所周知,炎症和氧化应激是高脂血症、动脉粥硬化和非酒精性脂肪肝等疾病发展中的关键危险因素[7-9]。除了多酚,大血藤中还含有其他已被证明具备降血脂活性的化合物,比如,蒽醌类成分大黄素能够增强斑马鱼对低密度脂蛋白摄取,逆转胆固醇转运,抑制胆固醇合成,从而对脂质代谢紊乱有明显的缓解作用[10];因此,从全面的、整体的角度进一步阐明大血藤的降血脂机制是十分重要的。在中医理论中,高脂血症与“血瘀”和“痰浊”有关[11],在治疗过程中一方面强调对肝、脾、肾3脏的调理,另一方面着重采用化痰祛瘀的方法来保障气血津液在人体中能够运行畅通,而大血藤单味药或与其他药物配伍具有活血化瘀和祛风止痛的传统功效。根据大血藤现代药理研究与中医理论提示其或许有抗高脂血症作用,故本研究利用专利数据挖掘来分析大血藤与中药配伍使用对高脂血症的治疗,再通过网络药理学筛选高脂血症疾病靶点,构建“成分-靶点-疾病”网络,探讨大血藤治疗高脂血症可能的作用机制,为后期新的处方配伍与进一步研究提供科学的理论基础。
1 专利数据挖掘的资料收集及研究方法 1.1 资料收集与筛选以“大血藤”“红藤”和“大活血”为关键词在中国知网(CNKI)的专利数据总库进行检索相关中药组合物、药酒或制剂等,以主权项中明确包含大血藤为纳入标准,排除中西药物混合应用的专利和单味中药专利,筛选出符合上述要求的专利共658项。
1.2 数据清洗与中药标准化参照2020版《中国药典》《中华本草》和“十三五”规划教材《中药学》(人民卫生出版社)对专利中涉及中药名称进行规范,具体包括:中药别名或俗称,如“元参”规范为“玄参”,“灵仙”规范为“威灵仙”;将不同炮制方法但中药功用大致类似的中药合并处理,如“生白术”和“炒白术”合并为“白术”;将不同炮制品和药物功效发生变化的归为不同药物,如将“甘草”和“炙甘草”划分为不同药物。利用华柄数据智能中医药大数据服务平台(http://www.huabeing.com/)对《中国药典》中未纳入的中药进行性味归经和药效的检索和归纳,将一些药用部位不明确、基原分类模糊及检索不到的中药材删除。
1.3 统计学方法 1.3.1 频数分析不同人员采用Excel 2019软件将规范后的中药进行再次检验核对,确保后续数据挖掘的准确性。使用Origin Pro 2021软件对涉及中药的功效类别、药物种类和性味归经等进行频数分析。
1.3.2 关联规则分析利用SPSS Modeler 18.0软件的Apriori算法进行关联规则分析,步骤如下:源(数据导入)、字段选项(类型)、图形(网络)、建模(关联Apriori)。本实验采用支持度和置信度两个重要指标进行衡量,设置参数如下:最小规则置信度(minimum rule confidence)为80%;最小支持度(minimum antecedent support)大于10%;最大前项数为2;提升度(lift)>1。并对高频(前30)中药间的关联性进行可视化分析,绘制关联规则网络。
1.3.3 聚类分析采用SPSS Statistics 26软件系统聚类法(hierarchical clustering method)对高频(前30)中药进行聚类分析,并对中药字段进行二质量化处理。聚类分析说明了几种药物之间的共性,即同一个簇中的对象有很大的相似性,而不同簇间的对象有很大的相异性。本实验设置参数如下:聚类最小值和最大值分别为2和5;聚类方法选择组间联接;度量标准选择Pearson相关性。从高频药物的聚类分析结果中尝试能否探索出新的组方规律。
2 网络药理学数据来源及研究方法 2.1 大血藤化学成分的收集及其靶点预测 2.1.1 候选活性化合物获取在PubMed和CNKI中,检索“大血藤化学成分”或“红藤成分”,对其已报道的化合物名称进行核对和归纳,一共得到153个化合物。将得到的化合物在PubChem中查找其Canonical SMILES格式并保存,下载Sdf格式文件。再利用Swiss ADME平台来预测候选化合物的吸收度和类药性的相关参数。将化合物的Sdf格式上传到该平台,设定两个参数:1)肠胃吸收(GI absortion)为“High”,意味着该化合物具有较好口服生物利用度。2)5种类药性预测(Lipinski、Ghose、Veber、Egan、Muegge)中有2个及2个以上为“Yes”的化合物,即可作为活性化合物。
2.1.2 活性化合物靶点的获取将筛选到的活性成分的SMILES格式文件导入Swiss Target Prediction平台,物种属性设定为“Homo sapiens”来收集预测到的所有靶点,并进行去重,之后利用UniPort数据库进行核对。
2.1.3 高脂血症疾病潜在靶点的搜集以“hyperlipidemia”“dyslipidemia”“hypercholesterolemia”和“hypertriglyceridemia”为关键词检索Genegards、Drug Bank Database、疗效药靶(TTD)、在线人类孟德尔遗传数据库(OMIM)数据库中高脂血症的潜在靶点。其中Genegards数据库筛选得到的靶点需设定Score值大于中位数的条件进行再次筛选,之后与3个疾病数据库中所筛选到的靶点进行合并,删除重复值,并利用UniPort数据库进行核对,获得高脂血症的相关靶点。
2.2 构建共同靶蛋白质互作(PPI)网络将活性成分的靶点和高脂血症的相关靶点取交集,得到共同靶标基因,并绘制Venny图。在String 11.5数据库的Multiple proteins模块中导入共同靶点,生物种类限定为“Homo sapiens”,设置最低相互作用阈值为“highest confidence(0.900)”,隐藏边缘游离蛋白,保证研究数据的准确性。将得到的结果在线输送到Cytoscape 3.8.0内置工具(String和String Enrichment)来进行网络可视化并筛选核心靶点基因。
2.3 共同靶点的基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析将得到的共同靶点基因数据集导入DAVID 6.8数据库进行分析。
2.4 大血藤有效成分-靶点-通路网络图的构建将获得的排名靠前的生物过程和通路,结合对应的化学成分和靶点在Cytoscape 3.8.0软件构建“成分-靶点-通路”互作网络并进行可视化分析。
3 结果与分析 3.1 用药频次统计对本次研究所纳入的中药进行频次统计,结果显示:658个专利涉及的中药除了主权项大血藤,共计1 802种,使用频次共计10 549次。除了大血藤之外使用频次>65的中药共有20个,包括当归、甘草、川芎、牛膝、红花、黄芪、丹参等。见表 1。

|
采用将同一味中药的不同性味归经全部统计入内的方法进行中药药性味归经的统计,比如当归味甘、辛,性温,归肝、心、脾经,则将这3种性味、3种归经全部统计在内;将中药药性为微寒、大寒者全部统计为寒。统计结果显示:药性频数共计10 086次,药味频数共计15 255次,归经频数共计22 416次。在药性统计中,频数较高的是温(3 574次,35.44%)和寒(3 044次,30.18%);在药味统计中,频数较高的是苦(5 494次,36.01%)和辛(4 104次,26.90%);在归经统计中,频数较高的是肝经(5 689次,25.38%)和脾经(3 115次,13.90%)。
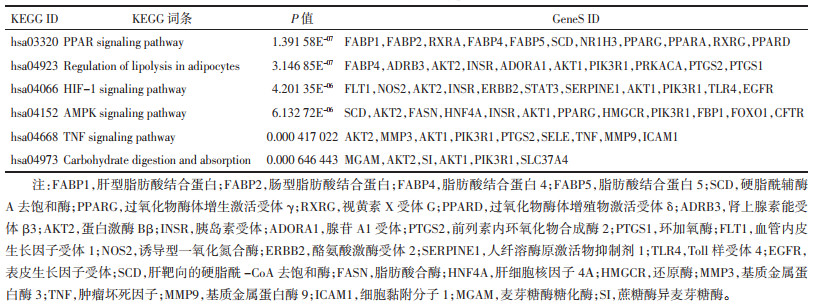
3.3 用药功效类别统计将658个专利中涉及的1 802种中药进行功效类别统计,发现共涉及20种功效,累计出现总频数为8 219次。其中清热药出现的频次最高,出现频次共计1 516次,所占比例为18.45%;活血化瘀药次之,出现频次共计1 500次,所占比例为18.25%;补虚药出现频率共计1 292次,所占比例为15.72%。见图 1。
|
| 图 1 中药功效频次统计图 Fig. 1 Statistics of efficacy frequency of traditional Chinese medicine |
本研究一共获得关联规则20组,并按照置信度高低进行排序,同时还对30味高频药物的关联性进行网络可视化,将两种中药同时出现在同一个专利中的频次用两药之间的链接表示,强链接线条较粗,弱连接线条较细,并按照链接大小连续变化展示,形成关联规则网络图,见图 2。图中关联性越强说明两种中药之间的线条颜色越深,由图可知大血藤、当归、甘草、红花、川芎、牛膝等关系密切。
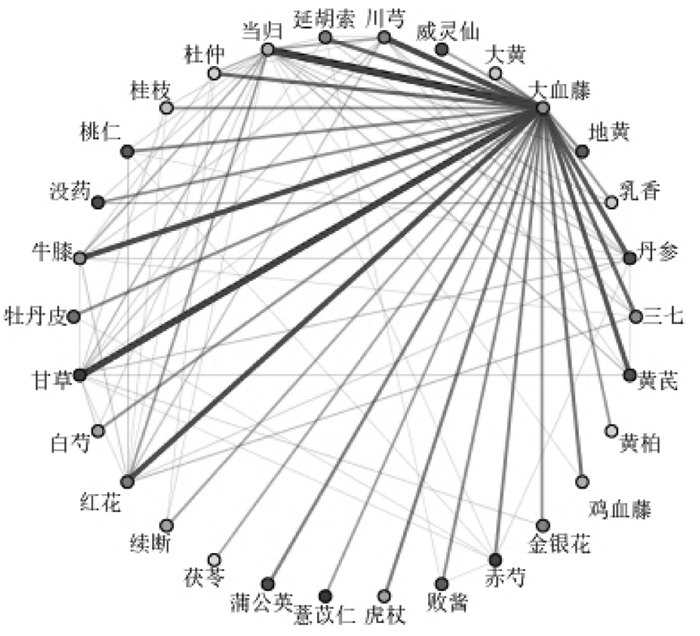
|
| 图 2 前30味高频药物关联强度网络图 Fig. 2 Association strength network diagram of 30 highfrequency traditional Chinese medicine |
利用SPSS Statistics 25软件对30味高频中药进行聚类分析,以组间距离22为界,可以将高频药物分为5组。C1类是没药、乳香、红花、三七、当归、川芎、杜仲、断续、牛膝、威灵仙、鸡血藤;C2类是甘草、桂枝、地黄、白芍、黄芪;C3类是虎杖、黄柏;C4类是薏苡仁、茯苓、蒲公英、败酱、延胡索、金银花、赤芍、牡丹皮、桃仁、大黄、丹参;C5类大血藤。
3.5 大血藤有效成分和潜在靶点的获得大血藤中富含多种化合物,本研究通过筛选后共获得49个符合要求的有效成分。2020年版《中国药典》规定的指标成分为红景天苷和绿原酸,在已报道的各成分含量测定中绿原酸含量极高[12-13],且研究表明绿原酸的生物活性显著,在治疗代谢性疾病方面疗效较好[14],因此将绿原酸也作为有效成分。将上述50个活性成分通过Swiss Target Prediction数据库进行筛选、和UniPort数据库进行核对、删除重复后一共得到592个潜在的基因靶点。值得注意的是,对羟基酪醇、1-(3',4'-dihydroxycinnamoyl)-cyclopentane-2,3-diol、表儿茶素、儿茶素和芦荟大黄素在Swiss Target Prediction中预测不到靶点。但动物实验证实表儿茶素可以通过调控Insig-1-SREBP-SCAP通路来降低血脂,减轻大鼠肝脏脂肪变性[15];对羟基酪醇能够通过抑制p38信号通路来发挥调节脂质代谢的作用[16];儿茶素在治疗高脂血症、动脉粥硬化等心血管疾病方面具有很好的药效[17]。虽然这5个化合物预测不到靶点,但不能说其在治疗高脂血症方面没有药效。最终一共得到了43个活性成分,并进行了编号M1—M43。
3.6 高脂血症靶点的收集基于Genegards、TTD、OMIM、Drugbank数据库筛选疾病靶点,去除重复靶点共收集到与高脂血症的相关靶点890个。利用在线Venn计算大血藤有效成分的靶点(592个)与高脂血症的相关靶点(890个)的交集,共得到133个交集靶点,将这些靶点作为大血藤抗高脂血症的潜在作用靶点。将133个共同靶点及其对应的化学成分导入Cytoscape 3.8.0中作拓扑分析,构建中药-化学成分-靶点-疾病网络图。见图 3。
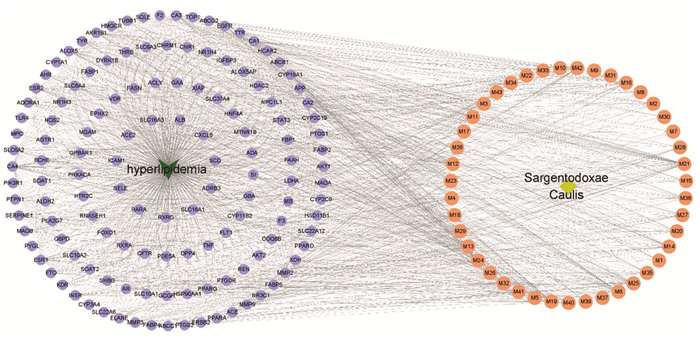
|
| 图 3 大血藤成分-靶点-高脂血症互作网络图 Fig. 3 Interaction network of compounds of sargentodoxae caulis-targets-hyperlipidemia targets |
在图 3中共有178个节点(Number of nodes)和1 415条连线(Number of edges)。经计算可得,该网络连接度平均为16.953 5,介度平均为0.006 6,紧密度平均为0.389 4。有14种活性成分连接度、介度、紧密度大于或等于其平均值,拓扑参数见表 2。网络图中PPARA分别和编号为M13、M25、M41、M42的化合物相联系;编号为M16的化合物作用于EGFR、AKR1B1和PTPN1等靶点;编号为M27的化合物作用于TNF、THRB和INSR等靶点。这从一定的程度说明大血藤中不同活性成分可作用于相同或不同的靶点。
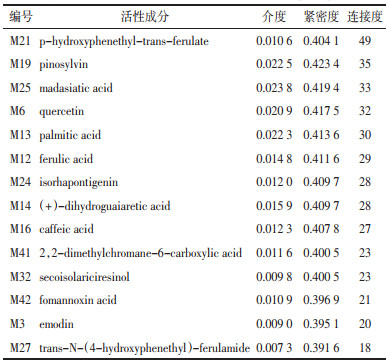
|
将133个交集靶点导入到STRING中设置最低相互作用阈值为“highest confidence(0.900)”,并隐藏边缘游离蛋白,最终得到PPI网络图。见图 4。包含133个节点(number of nodes),207条关系线条(number of edges),平均节点数(average node degree)为3.11,聚类系数(local clustering coefficient)为0.403,预期边缘(expected number of edges)58个,PPI富集值P值(PPI enrichment P-value)<1.0e-16。将STRING得到的PPI网络图在线输送到Cytoscape 3.8.0内置工具(String和String Enrichment)进行拓扑分析,并根据Degree值≥5绘制基因互作关系barplot图。见图 5。经计算,该网络连接度平均为3.112 8,介度平均为0.025 4,紧密度平均为0.259 6,选择连接度、介度、紧密度均大于等于平均值的节点作为候选靶点,得到大血藤治疗高脂血症的关键靶点26个,主要是类视黄酸受体α(RXRA)、信号转导及转录激活蛋白3(STAT3)、90kDa热休克蛋白αA1(HSP90AA1)、蛋白激酶Bα(AKT1)、磷酸肌醇3-激酶调节亚基1(PIK3R1)、雌激素受体1(ESR1)、过氧化物酶体增殖物激活受体α(PPAR)A、核受体亚家族3C组成员1(NR3C1)等。

|
| 图 4 大血藤-高脂血症-核心靶点交集基因PPI网络 Fig. 4 PPI network of sargentodoxae caulis-hyperlipidemia-keygenes |
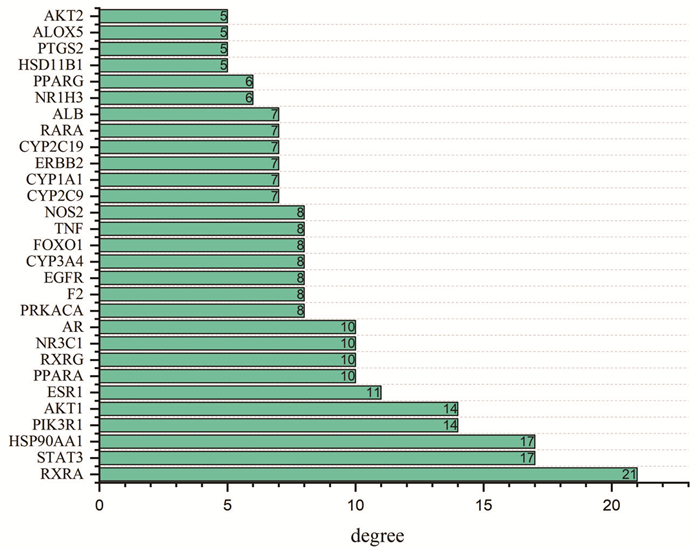
|
| 图 5 基因互作关系barplot图 Fig. 5 Barplot of gene interactions |
通过DAVID数据库对133个共同靶点进行GO富集分析。共得到437个GO条目,其中293个生物过程(BP)条目,35个细胞组成(CC)条目,109个分子功能(MF)条目。根据P<0.01,并各取排名前20位的富集条目。见图 6。可推测大血藤可能通过调节糖脂代谢、类固醇代谢、耐缺氧和氧化应激等过程发挥降血脂作用。
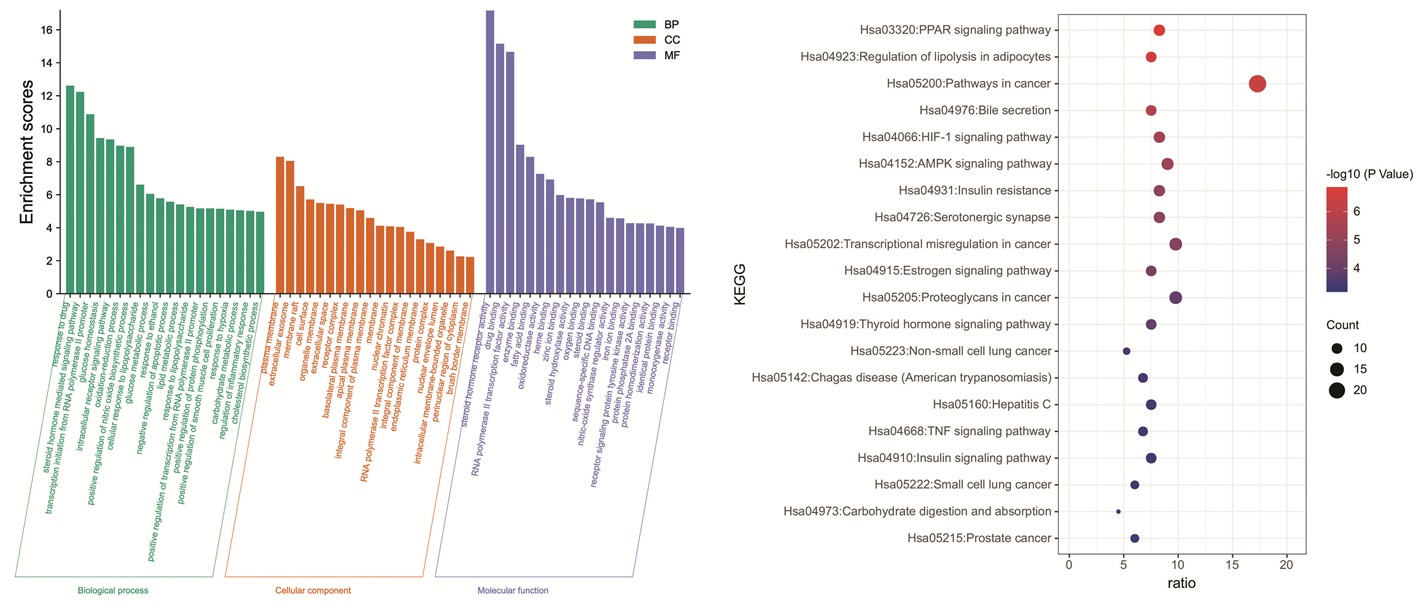
|
| 图 6 大血藤治疗高脂血症的交集靶点GO和KEGG分析图 Fig. 6 Go and KEGG analysis of the intersection targets of sargentodoxae caulis in the treatment of hyperlipidemia |
KEGG通路富集分析结果显示,潜在靶点共涉及到76条相关信号通路,其中P<0.05的一共有57条,以P值为筛选条件,绘制了前20条通路的富集气泡图。见图 6。图中圆形气泡形状大小与所在通路富集的基因数量多少成正比,气泡颜色的深浅与靶基因在此通路上富集的程度的高低成正比,可以直观地观察富集信息。并且参考有关研究[17-21]发现了6条信号通路与高脂血症密切相关,具体信息见表 3。运用了Cytoscape 3.8.0构建大血藤抗高脂血症潜在活性成分-作用靶点-通路网络。见图 7,蓝色圆形节点代表大血藤的活性成分,正方形代表靶点,倒三角代表通路。此外,PPAR信号通路是目前研究高脂血症的非常经典信号通路,也是大血藤抗高脂血症的KEGG富集通路中的P值最小的通路。过氧化物酶体增殖物激活受体(PPARs)有3种亚型,分别是PPAR-α、PPAR-β/δ和PPAR-γ。其中PPAR-α通过调节参与肝脏和骨骼肌脂质代谢基因的表达,在清除循环或细胞脂质中发挥关键作用[22-23],PPAR-β/δ参与脂质氧化和细胞增殖,PPAR-γ能促进脂肪细胞分化和产脂酶的表达以增强血糖摄取[24-25]。PPARs通过参与胆固醇的合成与分解、脂肪酸氧化等多种生物学过程,从而维持体内脂质代谢的动态平衡。因此,本实验选择了P值最小的两条通路,即PPAR信号通路和脂肪细胞内脂解的调节,绘制成分-靶点-前两条通路网络图。见图 7。可直观地看到它们之间相互对应的关系。
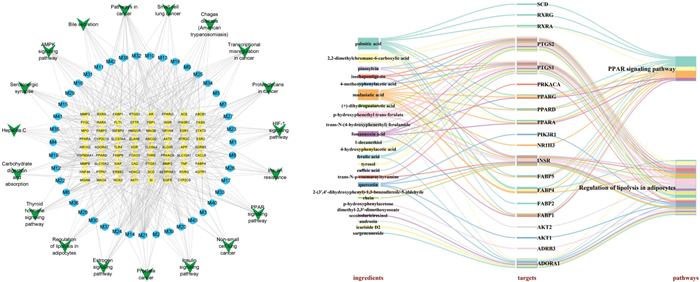
|
| 图 7 大血藤抗高脂血症的成分-靶点-通路网络和成分-靶点-前两条通路网络 Fig. 7 Components-targets-pathways network of sargentodoxae caulis against hyperlipidemia and components-targets-the first two pathways network |
中医中没有高脂血症这个病名,但却有着相应的记载,比如《黄帝内经》中已有“脂者”“油脂”“脂膜”等记载;《景岳全书》中写道“痰涎本皆气血,水谷津液化得其正则为津血,化失其正,则为痰浊”;其在传统中医古籍中属于“痰湿”“痰瘀”“肥胖”“血浊”和“血瘀”等范畴,常用“膏”“脂”“瘀”“浊”等概括高脂血症的病理状态,且中医通过辨证论治,发现大多数高脂血症患者属本虚标实,病机是以肝脾肾3脏之虚为本,痰浊瘀血为标,在治疗上多采用标本兼顾、补虚泻实的方法[26-27]。血瘀证是高脂血症的病理产物和致病因素,活血化瘀药具有抗脂质过氧化、改善微循环、降低血液黏稠度等作用,在治疗高脂血症中被广泛应用[28]。比如,张清源等[29]基于VOSviewer的可视化分析来探讨活血化瘀类复方防治高脂血症的研究现状与发展方向;胡山岗等[30]利用数据挖掘综合分析中药治疗高脂血症的用药配伍规律,发现高频次中药以温性、寒性和甘味、苦味为主,多归于肝经、脾经和胃经;赵冉等[31]通过检索国家专利数据库揭示了缓解高脂血症的中药多以补虚药、活血药和清热药为主。本研究通过AI+Excel对数据进行整理,频次分析,发现核对规范后的1 803种中药以温性、寒性和苦味、辛味为主;在归经方面主要是肝经、脾经占比最高;药用类别上以清热药、活血化瘀药为主,其次为补虚药;结合关联规则分析和高频药物关联强度网络图可以看出大血藤和当归、甘草、红花、川芎、牛膝等活血、补虚药关系密切;基于高频药物的聚类分析可得到药物组合5个,为后期新的处方配伍的挖掘提供了参考。
本研究从CNKI的专利数据库发掘大血藤的用药规律和上述报道的中药治疗高脂血症的用药规律几乎一致,表明大血藤及其中药联合使用对高脂血症有一定的治疗作用,这为后期新的处方配伍的挖掘提供了参考。随后从网络药理学角度探究大血藤治疗高脂血症的作用机制,利用Swiss ADME和Swiss Target Prediction数据库获取到了50个活性成分和592个潜在靶点;通过OMIM、Drug Bank、TTD、Gene Card数据库一共筛选高脂血症靶点890个;利用Venn分析软件获得了RXRA、STAT3、HSP90AA1、AKT1、PIK3R1、ESR1、PPARA等133个交集靶点以及靶点对应的绿原酸、红景天苷、酪醇、草夹竹桃苷等43个化学成分;最后经可视化分析和GO和KEGG富集分析发现大血藤可以通过脂质生物合成、炎症反应调控和氧化应激等过程发挥治疗高脂血症的作用。文章通过全面分析发现大血藤的发挥作用的关键靶点为RXRA、STAT3、HSP90AA1、AKT1、PIK3R1、ESR1、PPARA等。有研究总结了与关键脂质相关联的靶点有AKT1、PIK3R1、ESR1、PPARA等[32],这与本研究相一致。
根据成分-靶点网络,关键靶点对应的成分有阿魏酸、咖啡酸、酪醇、N-反式对香豆酰酪胺、N-反式(4-羟基苯乙基)阿魏酸酰胺、绿原酸、红景天苷和草夹竹桃苷等,而绿原酸和红景天苷还是大血藤的质量测定的指标成分。绿原酸是由奎尼酸咖啡酰基酯组成的一种具有抗菌性能的强酚类抗氧化剂,具有许多促进健康的作用。其中大部分与治疗代谢综合征有关,包括抗氧化、抗炎、降血脂、抗糖尿病和抗高血压作用,这些特性使绿原酸成为膳食补充剂和功能食品配方的极好候选化合物之一[33]。Bhandarkar等[34]证实在高碳水化合物、高脂肪饮食喂养的大鼠模型中,摄入绿原酸能够降低肥胖大鼠的肝脏炎症和脂肪沉积,并增加肠道菌群的多样性。阿魏酸是蔬菜和谷类中含量最丰富的酚类化合物,体外和动物实验研究都表明了阿魏酸具有抗高血脂、抗氧化和抗炎作用。而红景天苷是一种苯乙醇苷,具有降血脂、降血糖、抗炎等多种活性。在治疗非酒精性脂肪肝[35]、动脉粥硬化[36]、代谢综合征[37]、心肌缺氧损伤[38]等方面疗效显著,已经开发成为了非常受欢迎的膳食功能补充剂。KEGG分析结果表明大血藤治疗高脂血症的关键靶点富集在脂质代谢、氧化应激和炎症反应等代谢途径上,提示大血藤提取物在抗高脂血症及调节脂代谢方面机制的多样性。且根据文献报道找出了和高脂血症密切相关的6条通路。特别是P值最小的PPAR信号通路,PPAR包括PPARα、PPARβ/δ和PPARγ的3种亚型,具有不同的组织分布和生理功能。研究[39]证实PPAR可调控肝脏内的脂肪酸氧化代谢,降低三酰甘油,有助于维持脂质稳态,提示大血藤作用靶器官可能为肝脏,这与中医理论大血藤归经方面和本研究专利数据挖掘结果一致,为后期进一步的动物实验研究提供了思路。
综上可得,大血藤可以通过多层面参与调控血脂代谢和高脂血症的发生发展过程。但网络药理学存在一定的局限性,其结果缺乏实验验证,且本研究虽纳入大血藤中的众多活性成分,但β-谷甾醇(不符合胃肠吸收条件)、表儿茶素(预测不到靶点)、儿茶素(预测不到靶点)等重要成分尚未纳入本次研究中。大血藤治疗高脂血症的药效也需要相关实验验证以及临床数据的支撑。故在本研究后期,会在此基础进行动物实验加以验证,来进一步明确大血藤是否具有抗高脂血症的药效及其相关机制。
| [1] |
于梦, 宋欣丽, 孙丽, 等. 大血藤总酚酸调控微小RNA-155对缺氧复氧心肌细胞的细胞活性凋亡及氧化应激的影响[J]. 安徽医药, 2021, 25(12): 2355-2359. |
| [2] |
苗明三, 彭孟凡, 方晓艳, 等. 大血藤总酚酸对局灶性脑缺血再灌注大鼠脑组织氧化应激水平和能量代谢的影响[J]. 神经药理学报, 2019, 9(1): 1-5. |
| [3] |
BAI M, LIU B S, PENG M F, et al. Effect of sargentodoxa cuneata total phenolic acids on focal cerebral ischemia reperfusion injury rats model[J]. Saudi Journal of Biological Sciences, 2019, 26(3): 569-576. DOI:10.1016/j.sjbs.2018.11.019 |
| [4] |
ZHUO Y Z, LI D H, CUI L H, et al. Treatment with 3,4-dihydroxyphenylethyl alcohol glycoside ameliorates sepsis-induced ALI in mice by reducing inflammation and regulating M1 polarization[J]. Biomedicine & Pharmacotherapy, 2019, 116: 109012. |
| [5] |
YANG L, LI D H, ZHUO Y Z, et al. Protective role of liriodendrin in sepsis-induced acute lung injury[J]. Inflammation, 2016, 39(5): 1805-1813. DOI:10.1007/s10753-016-0416-1 |
| [6] |
LI D H, ZHUO Y Z, ZHANG Q, et al. Purification of 3, 4-dihydroxyphenylethyl alcohol glycoside from sargentodoxa cuneata (Oliv.) Rehd. et Wils. and its protective effects against DSS-induced colitis[J]. Scientific Reports, 2019, 9(1): 3222. DOI:10.1038/s41598-019-38926-8 |
| [7] |
FARZANEGI P, DANA A, EBRAHIMPOOR Z, et al. Mechanisms of beneficial effects of exercise training on non-alcoholic fatty liver disease(NAFLD): roles of oxidative stress and inflammation[J]. European Journal of Sport Science, 2019, 19(7): 994-1003. DOI:10.1080/17461391.2019.1571114 |
| [8] |
YUAN T, YANG T, CHEN H, et al. New insights into oxidative stress and inflammation during diabetes mellitus-accelerated atherosclerosis[J]. Redox Biology, 2019, 20: 247-260. DOI:10.1016/j.redox.2018.09.025 |
| [9] |
CHEON S Y, CHUNG K S, LEE K J, et al. HVC1 ameliorates hyperlipidemia and inflammation in LDLR-/- mice[J]. BMC Complementary and Alternative Medicine, 2017, 17(1): 222. DOI:10.1186/s12906-017-1734-z |
| [10] |
HE L F, WANG C, ZHANG Y F, et al. Effect of emodin on hyperlipidemia and hepatic lipid metabolism in zebrafish larvae fed a high-cholesterol diet[J]. Chemistry & Biodiversity, 2022, 19(2): e202100675. |
| [11] |
柏帆, 唐露霖, 尚文斌. 高脂血症的中医分类治疗探讨[J]. 中医药学报, 2022, 50(2): 10-13. |
| [12] |
陈兆榕, 叶丽宏, 华怡静, 等. UPLC同时测定大血藤中6种成分含量[J]. 药学研究, 2020, 39(8): 443-448, 453. |
| [13] |
刘晓涵, 祁龙凯. UPLC法同时测定大血藤中4种成分的含量[J]. 中药新药与临床药理, 2016, 27(5): 689-692. |
| [14] |
王庆华, 杜婷婷, 张智慧, 等. 绿原酸的药理作用及机制研究进展[J]. 药学学报, 2020, 55(10): 2273-2280. |
| [15] |
CHENG H, XU N, ZHAO W X, et al. (-)-Epicatechin regulates blood lipids and attenuates hepatic steatosis in rats fed high-fat diet[J]. Molecular Nutrition & Food Research, 2017, 61(11). |
| [16] |
ZHANG X X, QIN Y T, WAN X N, et al. Hydroxytyrosol plays antiatherosclerotic effects through regulating lipid metabolism via inhibiting the p38 signal pathway[J]. BioMed Research International, 2020, 2020: 5036572. |
| [17] |
颜俊杰, 黄静雯, 金陆飞, 等. 儿茶素应用于心血管疾病的研究进展[J]. 四川生理科学杂志, 2018, 40(4): 316-318. |
| [18] |
裴帅, 曹宁宁, 李晓璇, 等. 中药干预高脂血症相关信号通路的研究进展[J]. 药物评价研究, 2022, 45(1): 177-185. |
| [19] |
李虹仪, 习欠云, 张永亮. TNF-α在脂肪中的研究进展[J]. 畜牧与兽医, 2012, 44(S1): 75-77. |
| [20] |
李芸, 柳弥, 吴碧华, 等. 高脂饮食对大鼠脑微血管内皮细胞HIF-1α及Claudin-5表达的影响[J]. 中华临床医师杂志(电子版), 2014, 8(5): 909-913. |
| [21] |
XIAO P T, LIU S Y, KUANG Y J, et al. Network pharmacology analysis and experimental validation to explore the mechanism of sea buckthorn flavonoids on hyperlipidemia[J]. Journal of Ethnopharmacology, 2021, 264: 113380. |
| [22] |
FERRÉ P. The biology of peroxisome proliferator-activated receptors: relationship with lipid metabolism and insulin sensitivity[J]. Diabetes, 2004, 53(Suppl 1): S43-S50. |
| [23] |
LARSEN P J, JENSEN P B, SØRENSEN R V, et al. Differential influences of peroxisome proliferator-activated receptors gamma and-alpha on food intake and energy homeostasis[J]. Diabetes, 2003, 52(9): 2249-2259. |
| [24] |
BLANCHARD P G, TURCOTTE V, CÔTÉ M, et al. Peroxisome proliferator-activated receptor γ activation favours selective subcutaneous lipid deposition by coordinately regulating lipoprotein lipase modulators, fatty acid transporters and lipogenic enzymes[J]. Acta Physiologica, 2016, 217(3): 227-239. |
| [25] |
QUAN H Y, BAEK N I, CHUNG S H. Licochalcone a prevents adipocyte differentiation and lipogenesis via suppression of peroxisome proliferator-activated receptor γ and sterol regulatory element-binding protein pathways[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5112-5120. |
| [26] |
安冬青, 吴宗贵, 梁春, 等. 血脂异常中西医结合诊疗专家共识[J]. 中国全科医学, 2017, 20(3): 262-269. |
| [27] |
安娜, 曹昌霞. 中医治疗高脂血症临床研究进展[J]. 世界最新医学信息文摘, 2019, 19(85): 30-32. |
| [28] |
孙媛, 纪笑艳. 高脂血症与血瘀证关系辨析[J]. 辽宁中医杂志, 2012, 39(6): 1048-1049. |
| [29] |
张清源, 张敬文, 吴千言, 等. 活血化瘀类复方防治高脂血症的临床研究热点与趋势: 基于VOSviewer的可视化分析[J]. 中草药, 2022, 53(1): 196-205. |
| [30] |
胡山岗, 胡仕祥, 孙乾. 中药复方专利治疗高脂血症的用药规律分析[J]. 河南医学高等专科学校学报, 2021, 33(6): 714-718. |
| [31] |
赵冉, 于宗良, 刘龙涛, 等. 基于国家专利数据库探讨中药复方治疗高脂血症的用药规律[J]. 海南医学院学报, 2022, 28(15): 1177-1183. |
| [32] |
RAI S, BHATNAGAR S. Hyperlipidemia, disease associations, and top 10 potential drug targets: a network view[J]. Omics: a Journal of Integrative Biology, 2016, 20(3): 152-168. |
| [33] |
SANTANA-GÁLVEZ J, CISNEROS-ZEVALLOS L, JACOBO-VELÁ-ZQUEZ D A. Chlorogenic acid: Recent advances on its dual role as a food additive and a nutraceutical against metabolic syndrome[J]. Molecules, 2017, 22(3): 358. |
| [34] |
BHANDARKAR N S, BROWN L, PANCHAL S K. Chlorogenic acid attenuates high-carbohydrate, high-fat diet-induced cardiovascular, liver, and metabolic changes in rats[J]. Nutrition Research, 2019, 62: 78-88. |
| [35] |
SONG T X, WANG P L, LI C Y, et al. Salidroside simultaneously reduces de novo lipogenesis and cholesterol biosynthesis to attenuate atherosclerosis in mice[J]. Biomedicine & Pharmacotherapy, 2021, 134: 111137. |
| [36] |
ZHAO D M, SUN X Y, LV S J, et al. Salidroside attenuates oxidized low-density lipoprotein-induced endothelial cell injury via promotion of the AMPK/SIRT1 pathway[J]. International Journal of Molecular Medicine, 2019, 43(6): 2279-2290. |
| [37] |
BAI X L, DENG X L, WU G J, et al. Rhodiola and salidroside in the treatment of metabolic disorders[J]. Mini Reviews in Medicinal Chemistry, 2019, 19(19): 1611-1626. |
| [38] |
LIAO W T, LIU J, WANG S M, et al. Metabolic profiling reveals that salidroside antagonizes hypoxic injury via modulating energy and lipid metabolism in cardiomyocytes[J]. Biomedicine & Pharmacotherapy, 2020, 122: 109700. |
| [39] |
BERGER J, MOLLER D E. The mechanisms of action of PPARs[J]. Annual Review of Medicine, 2002, 53: 409-435. |
2. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China;
3. State Key Laboratory of Component-Based Chinese Medicine, Tianjin 301617, China
 2024, Vol. 41
2024, Vol. 41