文章信息
- 逯文敏, 王曦, 王向涛.
- LU Wenmin, WANG Xi, WANG Xiangtao.
- 三七总皂苷生物利用度提升制剂新技术研究进展
- Research progress on new technologies to improve bioavailability of Panax notoginseng saponins
- 天津中医药, 2024, 41(5): 672-680
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(5): 672-680
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.05.21
-
文章历史
- 收稿日期: 2024-02-05
2. 中国医学科学院北京协和医学院药用植物研究所, 北京 100193
三七是中国应用广泛且具代表性的传统中药材,主要分布于云南、四川、广西等地,传统的入药部位主要是其根和根茎[1]。三七为典型的人参属药用植物,在中国整个成药市场销量中占据首位,含三七的中药制剂和中成药已达300多种,以三七单味药材研制的中成药,其市场规模已超过100亿元[2]。三七一直以来都是心脑血管领域的研究热点,在临床上已被开发成多种用于治疗心脑血管疾病的中药制剂,如血塞通注射液、血栓通注射液、血塞通片等[3]。三七在制药业的广泛应用以及作为功能性食品的消费不断增加,使三七成为中国消费最多的中草药。目前,已确定了三七中的多种生物活性成分包括皂苷类、黄酮类、多糖和挥发油等[4],具有抗炎、止血、降血脂、抗肿瘤等作用[5-6],在保护和治疗心脑血管疾病等领域具有显著疗效[7]。
三七总皂苷(PNS)被认为是三七发挥广泛药理作用的主要活性成分,其在抗动脉粥样硬化、调节血脂血糖、治疗急性肺损伤、抗肿瘤以及治疗心脑血管疾病等方面具有显著优势[8]。临床应用上,除疾病急性期的注射给药外,口服的三七总皂苷制剂更多,且口服给药通常被认为是最普遍且安全性较高的给药方法。注射制剂在临床用药中以PNS原型成分入血发挥疗效,说明其原型皂苷成分对疾病的治疗至关重要。然而,由于PNS自身的理化性质(分子量大、亲水性强)、胃肠道的生理条件、肠道菌群以及吸收屏障的存在,这些因素共同影响了PNS在胃肠道的稳定性,最终导致其肠道吸收差、生物利用度低(总口服生物利用度仅为1.2%)[9-16],显著影响PNS的有效性和安全性。
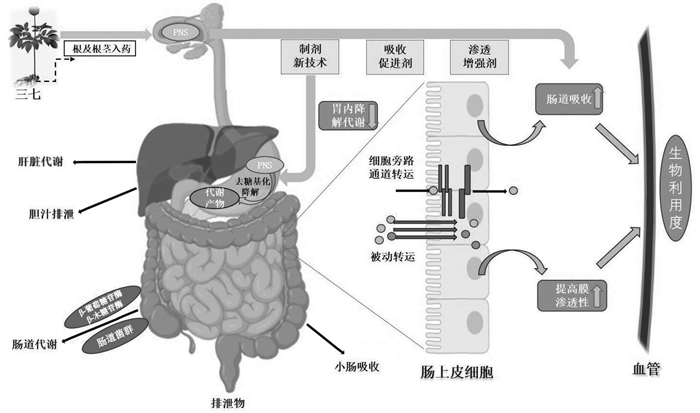
从药代动力学上看,药物穿过肠膜的通透性是影响肠道吸收的关键因素之一,约90%的药物吸收发生在小肠中,肠上皮作为药物吸收的主要部位,其表面黏液层和上皮细胞膜流动性会对药物通透性产生影响,进而影响药物吸收[17],尤其对于PNS这类高亲水性、高分子量药物来说,这些挑战更甚。此外,由于PNS可在肠道菌群中广泛代谢以及在胃液酸性环境下不稳定,易失去糖基转化成次级苷[18],PNS母体皂苷成分或其代谢物可能对其生物活性以及胃肠道吸收产生直接影响,进而影响其生物利用度[19]。为了提升PNS疗效,需提高其体内生物利用度以实现PNS广泛的药用价值,以便更好地在临床上得到开发和应用。本文从生物利用度的角度出发,综述了影响三七总皂苷生物利用度的理化因素以及胃肠道的水解代谢过程;并对目前改善PNS生物利用度的新型制剂技术、剂型等进行总结。示意图见图 1。
|
| 图 1 三七总皂苷药代动力学过程及提高其生物利用度的策略 Fig. 1 Pharmacokinetic process of PNS and strategies to improve their bioavailability |
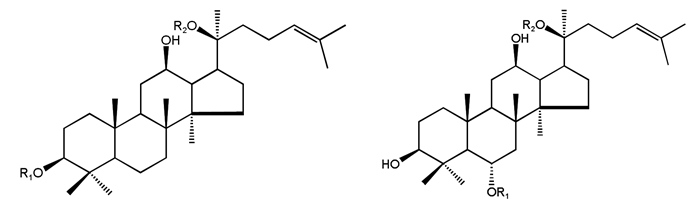
目前已发现的三七中皂苷类化合物有200多种[20],三七总皂苷作为口服和静脉注射等制剂主要原料,其代表性单体皂苷有人参皂苷Rb1、Rg1、Re、Rd和三七皂苷R1[2, 21]。见表 1。其中,人参皂苷Rb1和Rg1是含量最高的两个皂苷成分,分别占三七总皂苷的30%和20%,而三七皂苷R1(NG-R1)是PNS的特征皂苷,含量为2.5%[22]。大多数PNS可分为两大类,包括糖基连接在C-3上(含或不含C-20)的原人参二醇型皂苷(PPD)和糖基连接在C-6上(含或不含C-20)的原人参三醇型皂苷(PPT)。人参皂苷Rb1、Rd属于PPD型,人参皂苷Re、Rg1和三七皂苷R1属于PPT型[4, 23]。见图 2。
|
| 图 2 20(S)-原人参二醇型(A)和20(S)-原人参三醇型(B)皂苷 Fig. 2 20(S)-PPD(A)and 20(S)-PPT(B) |
药物的口服生物利用度是影响其体内发挥作用的首要因素。PNS中,人参皂苷Rg1的口服生物利用度仅为2.58%,存在严重的胃肠道吸收障碍[24];人参皂苷Rb1作为原人参二醇型的代表,胃吸收较差,其生物利用度仅约0.78%[18];三七皂苷R1具有较差的膜透性,在大鼠体内的绝对生物利用度为9.29%,在小肠上段吸收,以被动转运为主,其吸收速率随着浓度和极性的增加而逐渐减小[25];人参皂苷Re在胃肠道中较其他皂苷成分吸收快,绝对生物利用度为7.06%[26]。三七皂苷类成分的理化性质、结构、胃肠道水解代谢等因素决定了其生物利用度。
2.1 三七皂苷类成分的结构特点PNS的成分结构被视为影响生物利用度的重要因素。众所周知,口服药物经肠上皮细胞的转运吸收发挥疗效,脂溶性小分子化合物在上皮细胞的渗透性好,生物利用度高。而PNS中的单体皂苷组分大多为大分子水溶性成分,口服后主要通过细胞旁路被动转运吸收,而亲脂性的肠上皮细胞膜也会阻碍亲水性药物通过跨细胞途径被吸收[27],其中,除人参皂苷Rg1含2个葡萄糖基外,其余4种皂苷均含3~4个糖基,分子量较大,极性强,膜黏膜渗透性差,导致生物利用度不高。Liu等[28]采用Caco-2单层细胞模型研究三七中三萜皂苷、皂苷元的吸收机制,发现多数皂苷的表观渗透系数(Papp)<3×10-7 cm/s,且从培养板顶端到基底外侧(AP→BL)与从基底外侧到顶端(BL→AP)的Papp基本相同,表明三七中多数皂苷的膜透性较差,其吸收属于被动扩散机制。也有实验证明,减少糖基部分的数量,降低氢键容量、分子柔韧性和分子质量,能显著降低药物的溶解度[28-29],这在一定程度上改善了其生物利用度。
2.2 胃肠道的水解和代谢大多数PNS及其主要皂苷成分很难被人体血液吸收,很少分布在人体组织中以达到其功效,胃酸介导的水解或水化、肠道菌群分泌的酶(主要是β-葡萄糖苷酶和β-木糖苷酶)介导的去糖基化或肝脏代谢[30-31],影响了口服生物利用度。
三七皂苷类成分在胃液中的转化是口服后的第一道屏障,其胃稳定性差,易被胃肠道细菌所产生的酶降解。有文献报道,PNS在人工胃液中主要通过去糖基化途径降解,在其进入肠道前就在胃液中进行了广泛的代谢,研究人员将30 mg PNS加入到20 mL 0.1N HCl中,在(37±0.5)℃下,摇速100 r孵育,PNS在人工胃液中发生转化,形成的主要代谢物为去糖基化产物Rg3、Rh2、Rg2和Rh1,且代谢产物的产量在2 h达到峰值,表明PNS在胃液中会快速降解[32]。不仅如此,PNS中的主要单体皂苷成分在胃液的稳定性也不佳,研究者对Rb1胃肠道稳定性进行考察,将质量浓度为0.1 mg/mL的Rb1在人工胃液37 ℃孵育2 h,测得有90%以上被降解;同样酸水解条件下,质量浓度为0.1mg/mL Rg1有80%以上被破坏[33];刘梅等[34]将0.2 mg/mL的Rg1对照品溶液(1 mL)注射到大鼠胃内,2 h时测得胃匀浆中Rg1为26.8%,降解了73.2%,这说明不同给药剂量的Rg1在胃液酸性环境中的水解程度可能不同。除了给药剂量的影响,胃的酸性环境和蛋白酶破坏了皂苷中的糖苷键,并且皂苷的降解速率与糖苷键的位置也有一定关系。与C3位置相比,C6位置的糖苷键更容易断裂,因此NGR1、GRg1和GRe的降解速度更快[35]。
肠道菌群可以影响PNS口服后的代谢,包括改变PNS的药代动力学性质和改变其药理活性[36]。PNS在血浆中的4种主要代谢物分别为人参皂苷CK、人参皂苷F1、人参皂苷Rh2和PPT[37]。Rb1在大肠内容物中易被降解[38],其水解产物的量高于原型药物,血液中有大量的人参皂苷CK和F2[33, 39];Rg1主要的代谢产物是Rh1、F1及PPT,口服后,Rg1在胆汁的排泄回收率为6.88%[40],且其代谢产物的量超过原形药,代谢产物的吸收和消除速率相对缓慢[41];NG-R1在肠道细菌作用下,以NGR1→Rg1→F1→PPT→脱氢PPT这一过程逐步水解[42],2 h内排泄到胆汁中被消除,12 h内仍可被检测到,这表明NGR1在大鼠体内代谢的时间过程较长[43];Re口服后,在胃肠道内主要被肠道菌群代谢为Rh1和G-F1,然后吸收进入血液。PNS及主要皂苷成分在肠道菌群的影响下,均被广泛代谢,影响其生物利用度。
3 提高三七总皂苷生物利用度的策略为提高三七总皂苷的生物利用度,人们采用了各种新的策略,例如利用吸收/渗透增强剂改善肠道吸收,靶向输送到预定的生理部位以及运用纳米递送系统和制剂新技术增加其渗透性或者防止胃肠道的降解或代谢等,不同程度上提高了其生物利用度。
3.1 利用肠道吸收/渗透促进剂根据生物制药分类系统(BCS),三七总皂苷为生物药剂学分类系统的BCS Ⅲ类药物(高溶、低渗),提高渗透性是改善其生物利用度的主要解决方向。
使用肠道吸收促进剂是一种提高低渗透性药物口服生物利用度的方法[44],可提高细胞膜流动性、降低黏液黏度、延长药物在吸收部位的作用时间,进而改善药物在胃肠道中的通透性,来提高制剂的口服生物利用度[45]。PNS常用的肠道吸收/渗透促进剂有生物黏附材料、冰片等,并结合药剂学手段,制备的纳米粒或混悬液,具有一定的缓释作用,一定程度上避免了PNS在胃液中的降解;延长在人体组织或吸收部位的作用时间,增加对肠上皮细胞的渗透,提高其生物利用度[46]。
3.1.1 生物黏附材料卡波姆作为常用生物黏附材料之一,口服后毒性低,生物相容性好,联用卡波姆可将三七总皂苷在小肠中的生物利用度提高2.02~3.14倍[47];张运等[48]发现卡波姆934P、卡波姆941P均能显著促进PNS中R1、Rg1、Rb1在十二指肠段的吸收(与原药比较P<0.05)。曹飒丽[49]利用卡波姆940将人参皂苷Rd制备成微乳凝胶,经鼻给药后,血浆绝对生物利用度为55.49%,显著高于溶液组的8.29%;脑组织中绝对生物利用度为97.83%,显著高于溶液组的8.8%。
壳聚糖能延长PNS在吸收部位的滞留时间,使药物更易通过细胞间隙,药物在胃肠道中的稳定性也显著提高[18]。使用壳聚糖制备的PNS生物黏性片剂,与普通片相比,其主要成分R1、Rg1、Rb1的相对生物利用度分别提高至204.53%、152.73%、150.50%[50]。研究人员制备的PNS三甲基壳聚糖包被的纳米颗粒,吸收速率常数和表观吸收系数均高于PNS溶液[51-52],PNS在各肠段的Papp由均<1.8×10-4 cm/min提高到>1.2×10-3 cm/min,从难吸收转变成易吸收[27],壳聚糖的加入进一步提高了PNS的生物利用度。
羟丙基甲基纤维素(HPMC)是一种亲水性凝胶材料,当HPMC置于水介质中时,由于水化作用和形成较厚的凝胶屏障,阻断了PNS在胃中的释放,避免了PNS在胃中的降解。Li等[46]制备了含HPMC的生物黏附微丸,根据体外释放实验和体内药动学研究表明,含HPMC的微丸具有较好的缓释效果,与普通微丸相比,PNS生物胶黏剂微丸的口服生物利用度提高1.45~3.20倍,Cmax增加,平均滞留时间延长,口服生物利用度提高。
3.1.2 冰片冰片可以通过破坏亲水基团之间的氢键来松动脂质双层,导致细胞之间形成瞬时水通道,从而增加亲水化合物的扩散系数,起到吸收增强剂的作用[53-54]。研究人员在体外人工膜透性实验和体内药代动力学结果中发现,冰片在一定摩尔比下显著提高了三七皂苷类活性成分的通透性(P<0.05),与不含冰片的处方相比,含冰片与Rb1和Rg3的处方(摩尔比1∶27)的口服吸收明显增强,总口服吸收程度约为对照品的3倍[55],说明冰片增加了PNS的口服吸收,并进一步改善其口服生物利用度。
3.2 制剂技术与新剂型利用制剂技术,特别是纳米给药递送系统,主要目的是能增加PNS口服制剂在胃肠道内的稳定性,有效增加其表面积,提高药物溶出速率,增加药物穿过肠上皮的吸收和转运[56]。除PNS口服制剂之外,另外一个重要的研究方向是开发PNS其他给药剂型和给药途径,靶向病灶部位,提高PNS的生物利用度,最大限度地发挥其多功能治疗潜力。
3.2.1 口服纳米制剂 3.2.1.1 纳米粒Fu等[57]制备了PNS-卵磷脂-玉米醇溶蛋白(zein)的脂蛋白激发杂交纳米粒(PLZ-NPs),该纳米粒子具有核壳结构,以zein取代动物源性蛋白,其较强的抗酶解能力能避免PNS在胃液的降解,同时,以卵磷脂为脂类成分,也提高了PNS的口服吸收,载药能力增强。研究表明,PLZ-NPs在结肠细胞的通透性是游离PNS的1.5倍。PLZ-NPs在回肠和空肠的吸收参数分别比游离PNS提高1.75和1.80倍,体内药代动力学表明,PLZ-NPs在大鼠中的相对生物利用度是游离PNS的1.71倍,PNS纳米粒子在肠道的渗透、吸收和生物利用度均有一定程度的提高。
3.2.1.2 纳米乳纳米乳是两种不混溶液体的双相分散体:油包水(W/O)或由两亲性表面活性剂稳定的水包油(O/W)液滴,当口服给药时,纳米乳液可以提高溶解度、增强渗透性及其保护药物免受恶劣环境因素[氧化、酸碱度(pH)、水解]的影响,提高药物全身生物利用度[58]。对于PNS这类吸收差的亲水性大成分,W/O型纳米乳更为适用,可能是因为表面活性剂能改善膜流动性,增强了透膜吸收程度。Liu等[59]通过高压均质成功制备了三七总皂苷油包水纳米乳(PNS-N),平均粒径为(28.17±0.39)nm,PDI为(0.116±0.032),制备结果符合要求,且纳米乳能持续释放,稳定性良好。在大鼠肠道中PNS-N吸收动力学的研究中,PNS-N的3种主要成分的Papp比大鼠肠道中的PNS溶液(PNS-SOL)增加了5倍,SD大鼠的药代动力学研究表明,与PNS-SOL相比,口服生物利用度增加了2.58倍。
3.2.1.3 脂质体脂质体是由磷脂和胆固醇组成的封闭囊泡,作为药物载体,具有一定的靶向和缓释能力。它可以延长血液循环,减轻药物毒性,增强药物稳定性[60-61]。将PNS制成脂质体,可提高PNS的生物利用度,延长其在体内的作用时间。吕竟夷等[62]采用薄膜分散法制备PNS口服胆盐脂质体,其粒径为(163.0±5.28)nm,PDI为(0.25±0.06),包封率为80.6%±2.14%,且大鼠体内药动学实验表明,相比于血栓通胶囊,PNS脂质体的Tmax为2.6 h,口服脂质体的AUC大于血栓通胶囊,其相对生物利用度为166.72%,显著提高了PNS的口服生物利用度。
3.2.2 磷脂复合物磷脂复合物既能改善药物亲水性,又能改善亲脂性,延长药物在体内作用时间,提高生物利用度[63]。Xiong等[64]基于磷脂复合物,将PNS -磷脂复合物溶解在中链及长链脂肪酸甘油酯中,制备出了含PNS磷脂复合物的疏水性制剂来抑制胶束形成。以PNS中Rg1、Rb1为研究对象,根据其在PNS胶束溶液的释放结果表明,在6 h内,Rg1的释放量小于30%,Rb1的释放量约为5%,说明该疏水性制剂有效减缓了分子向水相的扩散,抑制了胶束的形成,增加其吸收。同时,通过大鼠十二指肠内生物利用度实验表明,Rg1和Rb1水溶液的AUC0-∞分别为(7.87±2.85)(148.58±36.730)μg/(mL·h),其疏水制剂的AUC0-∞分别为(207.52±53.95)(1 961.72±686.6)μg/(mL·h),生物利用度显著提高。他的另一项研究也证明了PNS溶解在中链脂肪酸甘油酯(3∶1)的吸收程度略大于其他脂肪甘油酯,且口服生物利用度显著提高[65]。
3.2.3 口服肠溶制剂PNS及其主要皂苷成分大多对酸不稳定,易在胃液中降解、代谢,为了最大程度发挥PNS的药理活性,应尽可能避免PNS在胃酸中降解代谢,提高其口服生物利用度。在口服制剂研发中可利用肠溶技术将PNS开发成肠溶制剂,例如肠溶胶囊、微囊、微丸、微孔渗透泵片[66-67]等各种PNS制剂以实现规定时间内在胃中极少甚至是不释放药物,而在肠的某部位能大部分或全部释放药物,增加了药物稳定性,延缓药物肠道吸收时间,提高生物利用度[68]。
3.2.3.1 自乳化给药系统自乳化给药系统是在胃肠道内通过水相适度搅拌和稀释后生产微乳液或水包油(O/W)乳液的药物递送体系[69-70]。基于自乳化系统制成的肠溶胶囊,可以避免胃肠道消化酶对内水相亲水性成分的破坏,保护其不被胃液降解,并缓慢释放,直到其释放到肠道中,使小肠吸收的药物浓度最大化[71]。
Wang等[19]在双乳化给药系统(SDEDDS)的基础上,选择肠溶胶囊对PNS-SDEDDS进行包被,制备出三七皂苷肠溶胶囊(PNS-SDE-ECC)。PNS-SDEDDS油相有吐温80、大豆卵磷脂、油酸,自乳化的小油滴可以快速穿过肠道黏液与肠上皮细胞接触,同时,油滴中的油酸可以暂时破坏细胞膜磷脂双分子层的流动性,提高了膜渗透性。选择5%吐温80的PNS-SDEDDS水化成的W/O/W乳液粒径小,载药量大,包封率高80.34%±10.24%。将PNS-SDEDDS装入肠溶性胶囊制成PNS-SDE-ECC,显著促进了PNS在肠道的吸收,与PNS胃胶囊相比,该肠溶胶囊中NGR1、Rg1、Re、GRb1和Rd的相对生物利用度分别提高了4.83倍、10.78倍、9.25倍、3.58倍和4.63倍。Zheng等[72]选择异丙基肉豆蔻酸为油相,吐温80和Cremophor RH40为表面活性剂,PEG400为辅助表面活性剂,一定比例下混合均匀,逐渐加水制成PNS自微乳,并采用甲醛浸渍法制备了PNS肠溶软明胶胶囊。对比格犬进行体内药代动力学研究,与市面上的常规胶囊相比,PNS自乳化肠溶胶囊中,Rb1的相对生物利用度为196.2%;Rg1相对生物利用度为77.2%;NGR1的相对生物利用度为117.7%,其体内相对生物利用度高于市场常规胶囊。
3.2.3.2 口服缓释微囊、微丸微囊、微丸作为口服缓控释制剂,具有释药吸收速率均匀、稳定性高、靶向性好、减少在胃肠道中的不良反应、生物利用度高等优点[73]。赖玲[74]采用溶剂-非溶剂法,在聚丙烯酸树脂Ⅱ号乙醇溶液中加入一定量的PNS、冰片和液体石蜡等,制备了PNS肠溶微囊,其包封率和载药量分别为88.69%和25.32%。并根据药动学初步研究发现,PNS肠溶胶囊与普通制剂相比,延长了PNS的体内滞留时间,促进了其在肠道的吸收,生物利用度提高了1.08~5.71倍。赖玲等[75]采用空白丸芯上药法,选择羟丙基甲基纤维素为黏合剂,低取代羟丙基纤维素为崩解剂,进行肠溶包衣,制备了PNS肠溶微丸。以R1、Rb1、Rg1作为比格犬的药代动力学考察指标,结果表明,自制肠溶微丸各成分在体内的平均滞留时间均有不同程度的延长,避免了胃酸对PNS的破坏,也促进了肠道吸收,且与普通胶囊相比,自制肠溶微丸的相对生物利用度提高了2.52~5.21倍。
3.2.4 非胃肠道给药系统因三七总皂苷水溶性好、在胃肠道易降解、口服存在肝首过效应等药物性质,随着新型给药方式的发展,为了提高其生物利用度,开发出多种非胃肠黏膜给药方法,如鼻腔给药、肺部吸入给药、经皮给药等,这些给药方式均有利于PNS的吸收,发挥其药效。
3.2.4.1 鼻腔给药鼻腔给药是将药物输送到大脑中可避免血脑屏障、胃肠道降解和肝脏首过效应的直接途径,并且具有治疗脑部疾病的高生物利用度的特征,在PNS治疗脑血管疾病中应用最为广泛,研究人员发现鼻内给药PNS表现出良好的脑靶向[76]。
许清芳等[77]选择了羟丙基纤维素(HPC)作为黏附材料将PNS制成凝胶剂鼻腔给药,发现该制剂中Rg1和Rb1的AUC0~48 h分别为38.83(mg·h)/L和204.52(mg·h)/L,绝对生物利用度分别为83.74%和93.72%,均可达到较高的生物利用度。Li等[78]通过鼻内和胃内两种途径研究脑清微乳在大鼠体内的药代动力学,结果表明,鼻内给药后Rg1、Rb1在血液及其他组织中的AUC值均高于胃内给药,Rb1尤其明显;鼻内给药时Rg1在大脑中的AUC0-∞、分布半衰期(t1/2α)和消除半衰期(t1/2β)分别是胃内给药时的5.83、0.26和7.10倍。表明Rg1与Rb1经鼻内给药时具有更快的吸收和更高的生物利用度。
3.2.4.2 肺部给药近年来,吸入疗法已成为一种普遍采用的将药物直接输送到肺部的方法,提高了肺部疾病的治疗靶向性,同时,也会降低药物被肝脏或肠道代谢的风险。王华美[79]采用喷雾干燥方法制备了肺部吸入“三七总皂苷-丹参酮ⅡA”复合粒子,给大鼠肺部给药后,较口服给药,人参皂苷Rg1、Rb1生物利用度得到很大提升,为口服吸收差的PNS中的水溶性成分到达全身循环提供了可行性。
3.2.4.3 经皮给药与口服给药途径相比,经皮给药具有多种优点。例如当肝脏有明显的首过效应时,可以过早地代谢药物;避免药物在酸性介质中的水解和降解;减少药物波动和胃肠道刺激[80-81]。皮肤外用制剂包括三七总皂苷脂质体喷雾剂、脂质凝胶经皮给药制剂、三七总皂苷与细胞穿透肽Tat联合经皮给药制剂等均为PNS安全且有效的外用制剂[82-84],在一定程度上提高了PNS的生物利用度。
综上所述,以上总结的三七总皂苷制剂技术均能不同程度地提高三七总皂苷及其主要成分的渗透性,改善肠道吸收,减少胃肠道对PNS的降解,靶向病理部位,提高了PNS的生物利用度,为多领域多功能PNS临床制剂的开发提供理论基础。然而鲜少有人将PNS制备成固体分散体和包合物这些常用剂型,可能是由于这两种制剂技术主要是通过提高难溶性药物的溶解度、溶出速率,继而改善其生物利用度。故而,对于亲水性强的PNS来说,无需采用这类制剂技术来提高其溶解性,这也说明了PNS制剂技术和新剂型是有针对性地解决其低生物利用度的问题,为PNS成药性提供了有效策略。
4 展望三七总皂苷作为一种极具开发价值的皂苷类化合物,在医疗保健等领域广泛应用,然而由于其理化性质和物质结构的限制,以及受到肠道菌群、代谢酶等因素的影响,PNS易在胃肠道降解代谢,胃肠道吸收差,导致其生物利用度极低(<2%),口服吸收仍存在问题。随着纳米化技术和新剂型可提高生物利用度的概念被制药行业和监管部门广泛接受,越来越多的多功能纳米药物递送系统被用于提高药物溶解度、渗透性,防止胃肠道水解代谢,也可通过促进跨血脑屏障来提高药物吸收。然而,这些制剂技术也存在不足之处,比如载药量低、稳定性较差可能导致药物较难被包封,若想达到体内药理学活性的浓度,则需要较多的载体,可能会导致毒性或不良反应,在临床应用上仍有一定的局限性。
因此,根据PNS的药理应用,迫切需要引入更好、更安全的载体材料,并结合PNS的药动学特点,对PNS新剂型策略、给药途径和吸收机制进行深入分析,不断探索新型药物递送系统,以期获得更高的载药量、包封率和生物利用度,为PNS的临床应用和新药开发提供理论依据。
| [1] |
黄朝蓉, 杨兆祥. 三七茎叶中皂苷成分及药理作用研究进展[J]. 中国民族民间医药, 2022, 31(23): 51-58, 82. |
| [2] |
XU C C, WANG W W, WANG B, et al. Analytical methods and biological activities of panax notoginseng saponins: recent trends[J]. Journal of Ethnopharmacology, 2019, 236: 443-465. DOI:10.1016/j.jep.2019.02.035 |
| [3] |
LI Q, YUAN M R, LI X H, et al. New dammarane-type triterpenoid saponins from Panax notoginseng saponins[J]. Journal of Ginseng Research, 2020, 44(5): 673-679. DOI:10.1016/j.jgr.2018.12.001 |
| [4] |
石礼平, 张国壮, 刘丛盛, 等. 三七化学成分和药理作用研究概况及质量标志物的预测[J]. 中国中药杂志, 2023, 48(8): 2059-2067. |
| [5] |
WANG T, GUO R X, ZHOU G H, et al. Traditional uses, botany, phytochemistry, pharmacology and toxicology of Panax notoginseng (Burk.) F.H. Chen: a review[J]. Journal of Ethnopharmacology, 2016, 188: 234-258. DOI:10.1016/j.jep.2016.05.005 |
| [6] |
公为亮, 庄海涛. 三七总皂苷抗肿瘤作用的研究进展[J]. 药学研究, 2022, 41(3): 183-186. |
| [7] |
LIU H B, LU X Y, HU Y, et al. Chemical constituents of panax ginseng and panax notoginseng explain why they differ in therapeutic efficacy[J]. Pharmacological Research, 2020, 161: 105263. DOI:10.1016/j.phrs.2020.105263 |
| [8] |
梁晓莲, 刘纤纤, 李文莉, 等. 三七总皂苷药理作用及临床应用研究进展[J]. 湖北农业科学, 2021, 60(6): 15-19. |
| [9] |
范未伟. 胰岛素新型口服纳米载体的设计及其体内高效递送机制的研究[D]. 上海: 中国科学院大学(中国科学院上海药物研究所), 2019.
|
| [10] |
PADHYE T, MARAVAJJALA K S, SWETHA K L, et al. A comprehensive review of the strategies to improve oral drug absorption with special emphasis on the cellular and molecular mechanisms[J]. Journal of Drug Delivery Science and Technology, 2021, 61: 102178. DOI:10.1016/j.jddst.2020.102178 |
| [11] |
FINE-SHAMIR N, BEIG A, MILLER J M, et al. The solubility, permeability and the dose as key factors in formulation development for oral lipophilic drugs: maximizing the bioavailability of carbamazepine with a cosolvent-based formulation[J]. International Journal of Pharmaceutics, 2020, 582: 119307. DOI:10.1016/j.ijpharm.2020.119307 |
| [12] |
WANG Y C, MIAO X Q, SUN L, et al. Effects of nanosuspension formulations on transport, pharmacokinetics, in vivo targeting and efficacy for poorly water-soluble drugs[J]. Current Pharmaceutical Design, 2014, 20(3): 454-473. DOI:10.2174/13816128113199990403 |
| [13] |
周晶. 调控肠道代谢提高药物口服生物利用度的制剂技术研究[D]. 北京: 北京协和医学院, 2015.
|
| [14] |
SUZUKI K, TANIYAMA K, AOYAMA T, et al. Evaluation of the role of P-glycoprotein(P-gp)-mediated efflux in the intestinal absorption of common substrates with elacridar, a P-gp inhibitor, in rats[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2020, 45(3): 385-392. DOI:10.1007/s13318-019-00602-7 |
| [15] |
曹姗, 夏云, 曲虹, 等. 纳米技术提高难溶性药物口服给药生物利用度[J]. 吉林医学, 2020, 41(1): 206-208. |
| [16] |
FU X Z, CHEN K, LI Z, et al. Pharmacokinetics and oral bioavailability of panax notoginseng saponins administered to rats using a validated UPLC-MS/MS method[J]. Journal of Agricultural and Food Chemistry, 2023, 71(1): 469-479. DOI:10.1021/acs.jafc.2c06312 |
| [17] |
MASAOKA Y, TANAKA Y, KATAOKA M, et al. Site of drug absorption after oral administration: assessment of membrane permeability and luminal concentration of drugs in each segment of gastrointestinal tract[J]. European Journal of Pharmaceutical Sciences, 2006, 29(3/4): 240-250. |
| [18] |
CHEN X N, LI D Q, ZHAO M D, et al. Pharmacokinetics of panax notoginseng saponins in adhesive and normal preparation of Fufang Danshen[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2018, 43(2): 215-225. DOI:10.1007/s13318-017-0433-y |
| [19] |
WANG Y R, SHANG Y X, TANG F Y, et al. Self-double-emulsifying drug delivery system enteric-coated capsules: a novel approach to improve oral bioavailability and anti-inflammatory activity of Panax notoginseng saponins[J]. AAPS PharmSciTech, 2023, 24(4): 90. DOI:10.1208/s12249-023-02549-0 |
| [20] |
黄依丹, 成嘉欣, 石颖, 等. 近五年三七化学成分、色谱分析、三七提取物和药理活性的研究进展[J]. 中国中药杂志, 2022, 47(10): 2584-2596. |
| [21] |
刘迎. 稀有人参皂苷的制备方法及其抗过敏活性研究[D]. 长春: 吉林大学, 2018.
|
| [22] |
王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展[J]. 中草药, 2015, 46(9): 1381-1392. |
| [23] |
王秋颖, 吴冬雪, 赵幻希, 等. 人参中达玛烷型皂苷的化学转化产物结构和转化途径研究[J]. 分析测试学报, 2020, 39(1): 99-107. |
| [24] |
谭珍媛, 熊万娜, 黄兴振, 等. 人参皂苷Rg1大鼠体内药代动力学及生物利用度研究[J]. 中药材, 2013, 36(7): 1121-1123. |
| [25] |
苏元元, 付宇, 李楠楠, 等. 3种达玛烷型皂苷的生物药剂学分类及吸收机制研究[J]. 中国现代中药, 2018, 20(9): 1150-1156. |
| [26] |
PENG D C, WANG H S, QU C L, et al. Ginsenoside Re: its chemistry, metabolism and pharmacokinetics[J]. Chinese Medicine, 2012, 7: 2. DOI:10.1186/1749-8546-7-2 |
| [27] |
徐鹏飞, 张锐, 关志宇, 等. 三七总皂苷壳聚糖纳米粒的制备与肠吸收特性研究[J]. 中国中药杂志, 2022, 47(1): 95-102. |
| [28] |
LIU H F, YANG J L, DU F F, et al. Absorption and disposition of ginsenosides after oral administration of panax notoginseng extract to rats[J]. Drug Metabolism and Disposition: the Biological Fate of Chemicals, 2009, 37(12): 2290-2298. DOI:10.1124/dmd.109.029819 |
| [29] |
NAEEM A, YANG M, HU P Y, et al. The fate of flavonoids after oral administration: a comprehensive overview of its bioavailability[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(22): 6169-6186. DOI:10.1080/10408398.2021.1898333 |
| [30] |
李晶, 戴雨霖, 郑飞, 等. 人参皂苷的口服吸收及体内转化[J]. 中国生物制品学杂志, 2014, 27(12): 1633-1636. |
| [31] |
KANG A, ZHANG S J, ZHU D, et al. Gut microbiota in the pharmacokinetics and colonic deglycosylation metabolism of ginsenoside Rb1 in rats: contrary effects of antimicrobials treatment and restraint stress[J]. Chemico-Biological Interactions, 2016, 258: 187-196. DOI:10.1016/j.cbi.2016.09.005 |
| [32] |
WANG J R, YAU L F, ZHANG R, et al. Transformation of ginsenosides from notoginseng by artificial gastric juice can increase cytotoxicity toward cancer cells[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2558-2573. DOI:10.1021/jf405482s |
| [33] |
韩旻, 韩丽妹, 王青松, 等. 三七皂苷的口服吸收机制[J]. 药学学报, 2006, 41(6): 498-505. |
| [34] |
刘梅, 王莉, 胡凯莉, 等. 人参皂苷Rg1PEG修饰及其稳定性实验研究[J]. 中国中药杂志, 2012, 37(10): 1378-1382. |
| [35] |
KARIKURA M, MIYASE T, TANIZAWA H, et al. Studies on absorption, distribution, excretion and metabolism of ginseng saponins. Ⅶ. Comparison of the decomposition modes of ginsenoside-Rb1 and-Rb2 in the digestive tract of rats[J]. Chemical & Pharmaceutical Bulletin, 1991, 39(9): 2357-2361. |
| [36] |
KIM D H. Gut microbiota-mediated pharmacokinetics of ginseng saponins[J]. Journal of Ginseng Research, 2018, 42(3): 255-263. DOI:10.1016/j.jgr.2017.04.011 |
| [37] |
GUO Y P, SHAO L, CHEN M Y, et al. In vivo metabolic profiles of panax notoginseng saponins mediated by gut microbiota in rats[J]. Journal of Agricultural and Food Chemistry, 2020, 68(25): 6835-6844. DOI:10.1021/acs.jafc.0c01857 |
| [38] |
HAN M, HAN L M, WANG Q S, et al. Mechanism of oral absorption of panaxnotoginseng saponins[J]. Yao Xue Xue Bao, 2006, 41(6): 498-505. |
| [39] |
NIU T, SMITH D L, YANG Z, et al. Bioactivity and bioavailability of ginsenosides are dependent on the glycosidase activities of the A/J mouse intestinal microbiome defined by pyrosequencing[J]. Pharmaceutical Research, 2013, 30(3): 836-846. DOI:10.1007/s11095-012-0925-z |
| [40] |
HE C Y, FENG R, SUN Y P, et al. Simultaneous quantification of ginsenoside Rg1 and its metabolites by HPLC-MS/MS: Rg1 excretion in rat bile, urine and feces[J]. Acta Pharmaceutica Sinica B, 2016, 6(6): 593-599. DOI:10.1016/j.apsb.2016.05.001 |
| [41] |
冯亮, 胡昌江, 余凌英. 人参皂苷Rgl及其代谢产物的药代动力学研究[J]. 药学学报, 2010, 45(5): 636-640. |
| [42] |
LIU H, YANG J Q, YANG W Q, et al. Focus on notoginsenoside R1 in metabolism and prevention against human diseases[J]. Drug Design, Development and Therapy, 2020, 14: 551-565. DOI:10.2147/DDDT.S240511 |
| [43] |
陈广通, 杨敏. 三七皂苷R1在大鼠体内的代谢产物分析[J]. 时珍国医国药, 2010, 21(2): 485-487. |
| [44] |
DAHLGREN D, CANO-CEBRIÁN M J, OLANDER T, et al. Regional intestinal drug permeability and effects of permeation enhancers in rat[J]. Pharmaceutics, 2020, 12(3): 242. DOI:10.3390/pharmaceutics12030242 |
| [45] |
MAHER S, BRAYDEN D J, CASETTARI L, et al. Application of permeation enhancers in oral delivery of macromolecules: an update[J]. Pharmaceutics, 2019, 11(1): 41. DOI:10.3390/pharmaceutics11010041 |
| [46] |
LI Y, ZHANG Y, ZHU C Y. Pharmacokinetics and correlation between in vitro release and in vivo absorption of bio-adhesive pellets of panax notoginseng saponins[J]. Chinese Journal of Natural Medicines, 2017, 15(2): 142-151. DOI:10.1016/S1875-5364(17)30029-8 |
| [47] |
赖玲, 刘华钢, 陆仕华, 等. 三七总皂苷肠溶微囊的药代动力学及体内外相关性[J]. 中国新药杂志, 2012, 21(6): 693-696. |
| [48] |
张运, 朱春燕. 生物黏附材料对三七总皂苷肠吸收的影响[J]. 中国药学杂志, 2015, 50(14): 1215-1220. |
| [49] |
曹飒丽. 人参皂苷Rd微乳及微乳凝胶的制备与评价研究[D]. 北京: 北京中医药大学, 2016.
|
| [50] |
FENG H Z, CHEN W, ZHU C Y. Pharmacokinetics study of bio-adhesive tablet of panax notoginseng saponins[J]. International Archives of Medicine, 2011, 4(1): 18. |
| [51] |
CHEN H, ZHAO Y, LI R, et al. Preparation and in vitro and in vivo evaluation of panax notoginseng saponins-loaded nanoparticles coated with trimethyl chitosan derivatives[J]. Journal of Pharmaceutical Sciences, 2022, 111(6): 1659-1666. |
| [52] |
ZHAO Y, LIN S Y, FANG R Y, et al. Mechanism of enhanced oral absorption of a nano-drug delivery system loaded with trimethyl chitosan derivatives[J]. International Journal of Nanomedicine, 2022, 17: 3313-3324. |
| [53] |
DAI X X, WANG R, WU Z M, et al. Permeation-enhancing effects and mechanisms of borneol and menthol on ligustrazine: a multiscale study using in vitro and coarse-grained molecular dynamics simulation methods[J]. Chemical Biology & Drug Design, 2018, 92(5): 1830-1837. |
| [54] |
YU B, RUAN M, DONG X P, et al. The mechanism of the opening of the blood-brain barrier by borneol: a pharmacodynamics and pharmacokinetics combination study[J]. Journal of Ethnopharmacology, 2013, 150(3): 1096-1108. |
| [55] |
KIM S, KIM J H, SEOK S H, et al. Enhanced permeability and oral absorption of panax notoginseng saponins by borneol[J]. Journal of Drug Delivery Science and Technology, 2021, 66: 102819. |
| [56] |
EJAZI S A, LOUISTHELMY R, MAISEL K. Mechanisms of nanoparticle transport across intestinal tissue: an oral delivery perspective[J]. ACS Nano, 2023, 17(14): 13044-13061. |
| [57] |
FU W, LIANG Y P, XIE Z H, et al. Preparation and evaluation of lecithin/zein hybrid nanoparticles for the oral delivery of panax notoginseng saponins[J]. European Journal of Pharmaceutical Sciences, 2021, 164: 105882. |
| [58] |
SINGH Y, MEHER J G, RAVAL K, et al. Nanoemulsion: concepts, development and applications in drug delivery[J]. Journal of Controlled Release, 2017, 252: 28-49. |
| [59] |
LIU Z D, ZHANG Q, DING L L, et al. Preparation procedure and pharmacokinetic study of water-in-oil nanoemulsion of panax notoginseng saponins for improving the oral bioavailability[J]. Current Drug Delivery, 2016, 13(4): 600-610. |
| [60] |
FAN Y C, MARIOLI M, ZHANG K. Analytical characterization of liposomes and other lipid nanoparticles for drug delivery[J]. Journal of Pharmaceutical and Biomedical Analysis, 2021, 192: 113642. |
| [61] |
LARGE D E, ABDELMESSIH R G, FINK E A, et al. Liposome composition in drug delivery design, synthesis, characterization, and clinical application[J]. Advanced Drug Delivery Reviews, 2021, 176: 113851. |
| [62] |
吕竟夷, 梁丽玲. 三七总皂苷口服脂质体的制备及大鼠体内药动学研究[J]. 中南药学, 2017, 15(7): 902-907. |
| [63] |
管雅文, 姚秋娥, 赵语, 等. 磷脂复合物技术在药物研究中的应用[J]. 转化医学电子杂志, 2017, 4(11): 12-17. |
| [64] |
XIONG J, GUO J X, HUANG L S, et al. Self-micelle formation and the incorporation of lipid in the formulation affect the intestinal absorption of panax notoginseng[J]. International Journal of Pharmaceutics, 2008, 360(1/2): 191-196. |
| [65] |
XIONG J, GUO J X, HUANG L S, et al. The use of lipid-based formulations to increase the oral bioavailability of panax notoginseng saponins following a single oral gavage to rats[J]. Drug Development and Industrial Pharmacy, 2008, 34(1): 65-72. |
| [66] |
陈青阳, 胡鹏翼, 王文苹, 等. 三七总皂苷微孔型渗透泵片体外释药数学模型的研究[J]. 中成药, 2009, 31(4): 538-540. |
| [67] |
许小红, 廖丽云, 蒋婷. 三七总皂苷微孔渗透泵片释药机制[J]. 中国实验方剂学杂志, 2012, 18(8): 12-14. |
| [68] |
尹进朝, 李进, 高永良. 中药肠溶制剂研究进展[J]. 中成药, 2011, 33(2): 315-318. |
| [69] |
SALAWI A. Self-emulsifying drug delivery systems: a novel approach to deliver drugs[J]. Drug Delivery, 2022, 29(1): 1811-1823. |
| [70] |
GURSOY R N, BENITA S. Self-emulsifying drug delivery systems (SEDDS) for improved oral delivery of lipophilic drugs[J]. Biomedicine & Pharmacotherapy=Biomedecine & Pharmacotherapie, 2004, 58(3): 173-182. |
| [71] |
WANG X N, JIANG S F, WANG X Y, et al. Preparation and evaluation of nattokinase-loaded self-double-emulsifying drug delivery system[J]. Asian Journal of Pharmaceutical Sciences, 2015, 10(5): 386-395. |
| [72] |
ZHENG Y, BAI J, LI X, et al. Biosynthesis and pharmacokinetics of panax notoginseng enteric-coated soft capsules[J]. Annals of Translational Medicine, 2023, 11(2): 51. |
| [73] |
陈雅慧, 傅春升, 孙爱萍, 等. 三七总皂苷制剂研究进展[J]. 中南药学, 2018, 16(6): 812-816. |
| [74] |
赖玲. 三七总皂苷口服肠溶制剂的研究[D]. 南宁: 广西医科大学, 2011.
|
| [75] |
赖玲, 刘华钢, 文丽, 等. 三七总皂苷肠溶微丸的体内外相关性[J]. 中国实验方剂学杂志, 2011, 17(24): 97-100. |
| [76] |
ZHAO J Y, LU Y, DU S Y, et al. Comparative pharmacokinetic studies of borneol in mouse plasma and brain by different administrations[J]. Journal of Zhejiang University Science B, 2012, 13(12): 990-996. |
| [77] |
许清芳, 方晓玲, 陈道峰, 等. 三七总皂苷鼻腔用制剂的研究[J]. 药学学报, 2003, 38(11): 859-862. |
| [78] |
LI T, SHU Y J, CHENG J Y, et al. Pharmacokinetics and efficiency of brain targeting of ginsenosides Rg1 and Rb1 given as Nao-Qing microemulsion[J]. Drug Development and Industrial Pharmacy, 2015, 41(2): 224-231. |
| [79] |
王华美. "三七总皂苷—丹参酮ⅡA"复合粒子的优化设计及其肺部给药吸收、分布特性研究[D]. 南京: 南京中医药大学, 2013.
|
| [80] |
PRAUSNITZ M R, LANGER R. Transdermal drug delivery[J]. Nature Biotechnology, 2008, 26: 1261-1268. |
| [81] |
AL HANBALI O A, KHAN H M S, SARFRAZ M, et al. Transdermal patches: design and current approaches to painless drug delivery[J]. Acta Pharmaceutica, 2019, 69(2): 197-215. |
| [82] |
蒋擎, 陈晓超, 田康勇, 等. 三七总皂苷结合细胞穿透肽Tat经皮给药促进骨折愈合的研究[J]. 医学理论与实践, 2022, 35(10): 1621-1623, 1627. |
| [83] |
徐白. 复方三七总皂苷脂质体凝胶皮肤给药剂型的研究[D]. 沈阳: 沈阳药科大学, 2007.
|
| [84] |
陈思思, 王俊, 郑杭生. 超高效液相色谱法测定三七总皂苷喷雾给药大鼠皮肤中皂苷成分的含量[J]. 医药导报, 2023, 42(2): 155-159. |
2. Institute of Medicinal Plant, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
 2024, Vol. 41
2024, Vol. 41