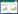文章信息
- 刘蓓蓓, 李斐, 彭卫卫, 等.
- LIU Beibei, LI Fei, PENG Weiwei, et al.
- 清肺排毒汤联合甲泼尼龙治疗免疫检查点抑制剂相关性肺炎患者临床观察
- Clinical observation of Qingfei Paidu Decoction combined with methylprednisolone in treating immune checkpoint inhibitor related pneumonia
- 天津中医药, 2024, 41(6): 697-701
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(6): 697-701
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.06.04
-
文章历史
- 收稿日期: 2024-02-22
2. 赣南卫生健康职业学院, 赣州 341000;
3. 赣州市人民医院, 赣州 341000
近年来,免疫检查点抑制剂(ICIs)的问世给恶性肿瘤患者带来了福音,这种免疫治疗大大提高了肿瘤患者的生存及预后[1]。ICIs药物带来疗效的同时却诱发了免疫相关不良事件,包括肺炎、垂体炎、糖尿病、结肠炎、甲状腺炎等[2-4]。虽然免疫相关不良事件发生率为0.5%~18.0%,多数程度较轻,但严重时可致患者死亡[5]。本研究中涉及的免疫检查点抑制剂相关性肺炎(CIP)临床发生率仅有3%~5%,但它是最常见的致命性免疫相关不良事件,占抗程序性细胞死亡蛋白1(PD-1)及其配体(PD-L1)相关死亡的35%[6]。根据国内外指南的建议CIP实施分级管理,治疗的首选药物为糖皮质激素[7-9]。提高CIP患者的疗效,减轻激素治疗造成的不良反应,是临床医师面临的难题。清肺排毒汤作为中医临床防治新型冠状病毒肺炎的首选方剂,引发了广泛关注。本研究把清肺排毒汤引入CIP患者的常规治疗中,探究中西医结合治疗CIP的有效性和安全性。
1 临床资料 1.1 样本量计算本研究比较清肺排毒汤联合甲泼尼龙治疗恶性实体瘤患者的CIP症状,根据样本量计算公式[10],以中医证候积分为主要观察的结局指标,预计联合组可降低2分,两组方差相似约1.80;假设α为0.05,β=0.2,两组样本量比值1∶1,采用PASS 15软件计算,计算得到每组最小样本量为13例,考虑本研究最大脱落率为10%,最终确定每组样本量为15例。选取于2021年1月—2022年12月在赣州市人民医院肿瘤科住院及门诊接受ICIs治疗并明确诊断为CIP的恶性实体瘤患者30例。
1.2 纳排标准 1.2.1 纳入标准1)经手术病理确诊为恶性实体瘤,使用ICIs。2)年龄≥18周岁且≤75周岁,预计生存期≥3个月。3)接受治疗后出现CIP,且CIP分级为2~4级(参照美国国立癌症研究所发布的不良事件通用术语标准5.0进行分级)。4)卡式功能状态(KPS)评分在30~80分。5)凝血功能:国际标准化比值(INR)或凝血酶原时间(PT)≤1.5倍的正常上限值(ULN);若患者正接受抗凝治疗,需要PT在抗凝药物拟定的范围内。6)入组前1个月内,育龄期女性须确认妊娠试验为阴性并同意在本研究治疗期间及最后1次治疗后6个月内采用有效的避孕措施;男性患者的配偶如为育龄期,也应遵循以上避孕要求。7)患者应自愿加入本研究,签署相关知情同意书,且遵守本研究规定的随访及相关流程。
1.2.2 排除标准1)同时参与其他的干预性临床研究。2)已知对中药过敏者。3)首次治疗前2周内接受过具有抗肿瘤适应证的中成药或免疫调节药物(如胸腺肽、干扰素、白介素等)。4)首次治疗前1个月内接受过重大外科手术或预计在研究治疗期间需要接受外科手术。5)在首次治疗前1个月内或计划在研究治疗期间接受疫苗接种。6)接受过脏器或骨髓移植。7)活动性、已知或可疑的自身免疫性疾病相关病史。8)首次接受治疗前,已服用激素且因激素使用出现不良反应。9)已知的原发性免疫缺陷、活动性结核、艾滋病或人类免疫缺陷病毒(HIV)感染病史。
1.2.3 剔除标准1)出现严重不良事件。2)研究过程中患者出现严重的合并疾病。3)患者依从性差,未按医嘱进行治疗,或中途使用其他药物或非药物治疗,无法判断疗效。4)患者自行退出研究。符合以上任意1条者,将从研究中予以剔除。
将30例患者按随机数字表法随机分为联合组和对照组,各15例,收集基线资料包括性别、年龄、肿瘤类型、ICIs使用情况、影像学评估[机化性肺炎(OP)、非特异性间质性肺炎(NSIP)、过敏性肺炎(HP)、弥漫性肺泡损伤(DAD)]及CIP分级等。本研究已获患者或其家属知情同意,并通过医院伦理委员会审核,伦理审核批号为TY-ZKY2023-046-01。
1.3 研究方法在恶性实体瘤患者确诊CIP,筛选入组后,立即停止使用ICIs。同时,对照组给予甲泼尼龙2 mg/(kg·d)口服或静脉滴注,每周减量4 mg,用药总疗程4周;视病情辅以抗感染、化痰平喘、氧气吸入等对症治疗。
联合组在对照组治疗基础上采用清肺排毒汤,随证加减部分药物并改变用量。清肺排毒汤由生石膏(先煎)30 g,小柴胡16 g,茯苓15 g,山药12 g,麻黄、苦杏仁、姜半夏、桂枝、猪苓、生姜、紫菀、泽泻、款冬花、射干、藿香、炙甘草各9 g,黄芩、细辛、枳实、陈皮各6 g组成,水煎服,每日1剂,早晚各1次(饭后30 min)温服,治疗4周。所有中药由赣州市人民医院中药房代煎,真空包装。药物由专人负责发放,要求发药同时回收中药真空包装袋及剩余药品,并询问患者服药情况,记录不良事件发生情况。
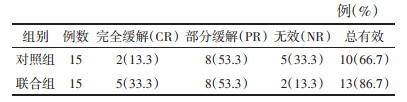
1.4 疗效评价 1.4.1 临床-影像-生理(CRP)评分根据Watters[11]提出的CRP综合评分法对CIP疗效进行量化评估,首先根据呼吸困难程度、咳嗽咳痰、胸闷胸痛、呼吸频率、口唇紫绀、杵状指等临床症状及体征计算临床评分(最高分50分);其次通过胸部计算机断层扫描(CT)平扫或增强观察肺实质浸润范围和程度、蜂窝肺表现及有无肺动脉高压的影像学表现(最高分20分);最后采用肺功能仪测定肺总量、弥散等指标(最高分30分)。
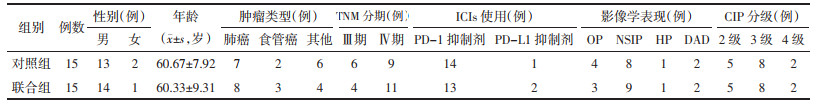
1.4.2 影像学疗效评价胸部CT表现:1)完全缓解(CR):病灶基本消失,并稳定1周以上。2)部分缓解(PR):病灶大部分消失,并稳定1周以上。3)无效(NR):病灶无变化或较前加重。有效率=(完全缓解+部分缓解)/入组例数×100%。
1.4.3 生活质量评分采用KPS评分标准评估CIP患者治疗前后的生活质量改善情况,总分为100分,得分越高表示生活质量越高。
1.4.4 中医证候积分根据《中医病症诊断疗效标准》,本研究对患者的中医证候进行评分,其中9项指标分别为:咳嗽、咳痰、痰血、发热、气促、胸痛、食欲不振、神疲乏力和心烦失眠。中医证候积分方法参考《中药新药临床研究指导原则》,采用4级评分标准(0~3分)。
1.5 统计分析本研究采用SPSS 22.0统计软件进行分析,采用GraphPad Prism软件作图进行可视化。计量资料采用均数±标准差(x±s)表示,组内前后比较采用配对t检验,组间比较采用独立样本t检验,计数资料采用例数(率)表示,组间比较采用卡方检验或Fisher确切概率计算法,等级资料组间比较采用Mann-Whitney U检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 两组基线资料比较两组患者性别、年龄、肿瘤类型、ICIs使用情况、影像学评估及CIP分级等比较,差异均无统计学意义(P>0.05),具有可比性。见表 1。
治疗前,两组临床得分(C)、影像得分(R)、生理得分(P)比较,差异均无统计学意义(P > 0.05)。治疗后,两组CRP评分较治疗前均有明显下降,且联合组较对照组CRP评分明显降低,差异均有统计学意义(P < 0.05)。见表 2。胸部CT影像显示肺窗下片状高密度或斑片状的磨玻璃影密度下降、范围减少,咳嗽、气促、呼吸困难、乏力等呼吸体征/症状明显改善,说明清肺排毒汤联合甲泼尼龙可明显缓解CIP患者的肺部症状,改善肺功能。
|
通过对比治疗前后的胸部CT影像,发现磨玻璃影、网状影、肺实变、纤维化及胸腔积液等影像学表现在两组治疗后均有不同程度改善,且清肺排毒汤联合甲泼尼龙治疗后上述表现改善更为明显。联合组治疗前后的肺窗下胸部CT影像变化见图 1。经Fisher精确概率检验发现清肺排毒汤干预后,联合组CT影像完全缓解率及总有效率均高于对照组,但无统计学差异(P > 0.05)。见表 3。
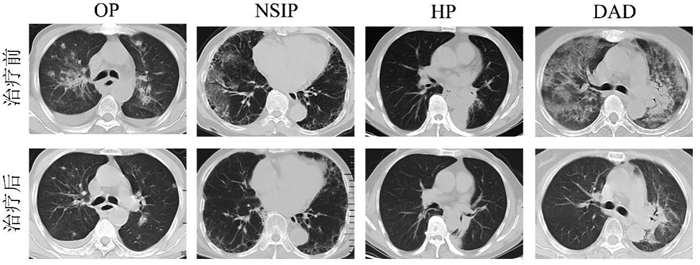
|
| 注:在清肺排毒汤联合甲泼尼龙治疗后,第1列显示OP患者双肺磨玻璃影、结节病灶及胸腔积液较治疗前明显缩小、吸收;第2列显示NSIP患者双侧中下叶磨玻璃影及网状影较治疗前明显缩小,支气管扩张及小叶间隔增厚同前相仿;第3列显示HP患者弥漫性、细微的磨玻璃影及左下叶阻塞较治疗前减轻;第4列显示DAD患者双肺弥漫性磨玻璃影、肺实变、纤维化程度较前明显缩小、改善。 图 1 联合组CIP患者治疗前后的胸部CT影像(肺窗) Fig. 1 Chest CT images (lung window) of CIP patients before and after treatment in combination group |
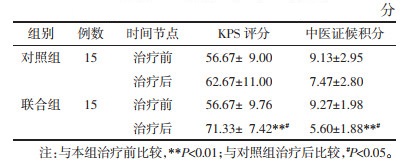
治疗前,两组KPS评分比较,差异无统计学意义(P > 0.05)。治疗后,对照组的KPS评分为80分2例、70分5例、60分3例、50分5例,平均分(62.67±11.00)分,与治疗前比较,差异无统计学意义(P > 0.05);联合组的KPS评分为80分5例、70分7例、60分3例,平均分(71.33±7.42)分,与治疗前比较,差异有统计学意义(P < 0.01);联合组KPS评分较对照组有明显升高(P < 0.05),表明清肺排毒汤联合甲泼尼龙可改善CIP患者的生活质量。见表 4。
|
治疗前,对照组中医证候积分为(9.13±2.95)分,联合组积分为(9.27±1.98)分,两组比较,差异无统计学意义(P > 0.05)。治疗后,对照组中医证候积分为(7.47±2.80)分,与治疗前比较,差异无统计学意义(P > 0.05);联合组中医证候积分为(5.60±1.88)分,与治疗前比较,差异有统计学意义(P < 0.01);联合组中医证候积分较对照组明显减少(P < 0.05)。见表 4。
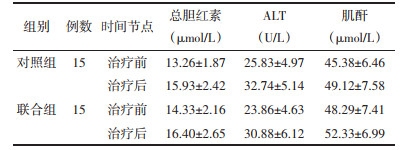
2.6 两组安全性及不良反应结果治疗前,两组的血清总胆红素、丙氨酸氨基转移酶(ALT)、肌酐水平比较,差异均无统计学意义(P > 0.05)。治疗后,两组的血清总胆红素、ALT、肌酐水平均无明显升高或降低,两组比较无统计学差异(P > 0.05)。结果表明在CIP治疗过程中清肺排毒汤联合甲泼尼龙治疗对肝肾功能无明显影响,且未发现明显的过敏、胃肠道不适等不良事件发生,证实了清肺排毒汤安全性良好,无明显毒副作用。见表 5。
|
CIP最初见于一项纳武利尤单抗治疗晚期恶性肿瘤患者的Ⅰ期临床试验中,有2%的患者死于重度免疫性肺炎[12]。Wang等[13]系统评价了125项免疫治疗的临床研究,发现CIP的发生率为2.79%;另一项纳入了23项临床研究的Meta分析指出CIP的发生率为5.17%[14]。本研究在2年内通过筛选958例接受ICIs的恶性实体瘤患者,最终仅有31例确诊为CIP,1例1级CIP未纳入研究,本研究中CIP发病率为3.24%,与上述文献报道基本一致。
中医认为应用ICIs虽能消散痰瘀毒结,改善肿瘤微环境,但其药性极易伤及肺气肺阴,致络脉不通,又易蕴生痰湿瘀毒等病理产物,故易致肺部弥漫病变。因此有观点认为CIP的中医病机以肺气阴两虚,或肺肾两虚为主,兼痰湿瘀毒阻络滞脉[15]。观点还指出CIP患者的早期临床表现以咳嗽、咳痰为主,中、后期病程以喘证为主,故CIP可归属于中医学“咳嗽”“喘证”“肺痹”等病证范畴。本研究中30例CIP患者主要症状为咳嗽、咳痰、呼吸困难、胸痛和喘息,因而可归于上述病症。1级CIP患者因无临床症状,只有影像学表现,不归属于上述病症,不纳入研究范畴。5级CIP患者病情危重,呼吸衰竭,不归属于上述病症,也不纳入研究范畴。
中医认为肺失宣降且表证不显、寒热不著者,可予宣肺降气,常用二陈汤、三子养亲汤加减。痰热蕴肺常见于喘证严重者,临床表现为呼吸困难伴咳痰,动则尤甚,痰多易咳出,可予清热泻肺、化痰止咳,常用麻杏石甘汤加减。饮邪困肺,肺失宣降发而为喘,以喘咳、不欲饮、头晕、心悸、脉浮紧为常见临床表现,常用小青龙汤或五苓散加减。若除具有喘息、咳嗽症状外,还伴有烦躁易怒、腹胀腹痛、嗳气叹息等,治宜疏肝理气,以小柴胡汤加减应用。以上证候可出现在CIP患者病变的不同时期。因清肺排毒汤包含了张仲景创制的4首经典古方:麻杏石甘汤、小柴胡汤、五苓散及射干麻黄汤,故能治疗CIP患者的咳嗽、咳痰、气促、喘息等主要症状。因此,治疗后联合组的中医证候积分和KPS评分均明显优于对照组。
国家中医药管理局推荐在中西医结合救治中使用清肺排毒汤,归功于该复方在中医药治疗新型冠状病毒肺炎中发挥的积极作用。清肺排毒汤及其包含的经典汤剂在既往临床研究中均有报道。有研究发现清肺排毒汤可改善博来霉素诱导的小鼠炎症和胶原沉积,减轻小鼠肺纤维化病变[16];可下调白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等促炎因子的表达水平,从而减轻脂多糖(LPS)引起的小鼠急性肺损伤[17]。还有研究指出小柴胡汤可明显降低肺癌CIP患者的CD4+/CD8+ T细胞亚群水平,有助于调节免疫抑制状态,增强免疫功能,提高患者的生活质量,疗效明显优于泼尼松治疗[18]。麻杏石甘汤联合甲泼尼龙治疗恶性黑色素瘤、非小细胞肺癌、肾细胞癌患者免疫性肺炎的疗效优于单用甲泼尼龙,可发挥增效减毒作用。并且麻杏石甘汤治疗社区获得性细菌性肺炎患儿的临床疗效显著,不良事件发生率低,安全性高[19]。本研究结果与上述文献报道结果一致:清肺排毒汤可以减轻肺部病变,提高患者的生活质量,安全性良好。
综上所述,清肺排毒汤联合甲泼尼龙治疗CIP患者的疗效优于甲泼尼龙,且安全可靠。但本研究仍存在一些不足之处:病例样本数有限且为单中心,会造成一定程度上的偏倚风险;观察时间不够充足(仅1个月);入组患者大多为1个区域患者,样本具有地区局限性;清肺排毒汤治疗CIP的物质基础和作用机制仍不明确。今后应扩大样本量,采用多中心进行研究,进行大量动物实验且进一步完善临床试验,以提高试验结果的真实性和准确性。
| [1] |
PALIARD X, RIXE O. Precision oncology for cancer immunotherapies in early-phase clinical trials[J]. Targeted Oncology, 2019, 14(6): 631-637. DOI:10.1007/s11523-019-00678-w |
| [2] |
NARANJO M B, ROSENTHAL D S, KUMAR S C, et al. SAT-674 anti PD1 induced type 1 diabetes[J]. Journal of the Endocrine Society, 2020, 4(Supplement_1): SAT-674. |
| [3] |
SAMSON K. In the clinic: risks reported for neurologic adverse events with two cancer immunotherapies[J]. Neurology Today, 2017, 17(20): 7-8. DOI:10.1097/01.NT.0000526680.83571.06 |
| [4] |
KHUNGER M, JAIN P, RAKSHIT S, et al. Safety and efficacy of PD-1/PD-L1 inhibitors in treatment-naive and chemotherapy-refractory patients with non-small-cell lung cancer: a systematic review and Meta-analysis[J]. Clinical Lung Cancer, 2018, 19(3): 335-348. DOI:10.1016/j.cllc.2018.01.002 |
| [5] |
WANG D Y, SALEM J E, COHEN J V, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and Meta-analysis[J]. JAMA Oncology, 2018, 4(12): 1721-1728. DOI:10.1001/jamaoncol.2018.3923 |
| [6] |
ONO K, ONO H, TOI Y, et al. Association of immune-related pneumonitis with clinical benefit of anti-programmed cell death-1 monotherapy in advanced non-small cell lung cancer[J]. Cancer Medi-cine, 2021, 10(14): 4796-4804. DOI:10.1002/cam4.4045 |
| [7] |
赵静, 苏春霞. 《CSCO免疫检查点抑制剂相关的毒性管理指南》解读: 对比NCCN免疫治疗相关毒性管理指南[J]. 实用肿瘤杂志, 2020, 35(1): 11-15. |
| [8] |
BRAHMER J R, LACCHETTI C, THOMPSON J A. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American society of clinical oncology clinical practice guideline summary[J]. Journal of Oncology Practice, 2018, 14(4): 247-249. DOI:10.1200/JOP.18.00005 |
| [9] |
OGURA T, TAKIGAWA N, TOMII K, et al. Summary of the Japanese Respiratory Society statement for the treatment of lung cancer with comorbid interstitial pneumonia[J]. Respiratory Investigation, 2019, 57(6): 512-533. DOI:10.1016/j.resinv.2019.06.001 |
| [10] |
PI-SUNYER X, ASTRUP A, FUJIOKA K, et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management[J]. The New England Journal of Medicine, 2015, 373(1): 11-22. DOI:10.1056/NEJMoa1411892 |
| [11] |
KEIR M E, BUTTE M J, FREEMAN G J, et al. PD-1 and its ligands in tolerance and immunity[J]. Annual Review of Immunology, 2008, 26: 677-704. DOI:10.1146/annurev.immunol.26.021607.090331 |
| [12] |
TOPALIAN S L, HODI F S, BRAHMER J R, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. The New England Journal of Medicine, 2012, 366(26): 2443-2454. DOI:10.1056/NEJMoa1200690 |
| [13] |
WANG Y C, ZHOU S H, YANG F, et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitors in clinical trials: a systematic review and Meta-analysis[J]. JAMA Oncology, 2019, 5(7): 1008-1019. DOI:10.1001/jamaoncol.2019.0393 |
| [14] |
SU Q, ZHU E C, WU J B, et al. Risk of pneumonitis and pneumonia associated with immune checkpoint inhibitors for solid tumors: a systematic review and Meta-analysis[J]. Frontiers in Immunology, 2019, 10(2): 108. |
| [15] |
陈晨, 贾立群, 娄彦妮, 等. 免疫检查点抑制剂相关性肺炎发病及治疗的中医思考[J]. 中国中医急症, 2022, 31(3): 425-428, 432. |
| [16] |
WU Y, XU L L, CAO G, et al. Effect and mechanism of Qingfei Paidu Decoction in the management of pulmonary fibrosis and COVID-19[J]. The American Journal of Chinese Medicine, 2022, 50(1): 33-51. DOI:10.1142/S0192415X22500021 |
| [17] |
邱爱珠, 徐晔青, 欧阳翌国, 等. 清肺排毒汤对脂多糖诱导急性肺损伤小鼠的作用机制研究[J]. 湖南中医杂志, 2022, 38(12): 142-146. |
| [18] |
宗嘉宝, 韩磊, 卢元丽, 等. 小柴胡汤联合泼尼松对肺癌患者免疫性肺炎及T淋巴细胞的影响[J]. 肿瘤药学, 2021, 11(5): 607-611. |
| [19] |
WEI L N, GUO Y N, FEI Y T, et al. A randomized, double-blind, placebo-controlled, multicenter clinical trial for efficacy and safety of traditional Chinese medicine combined with antibiotics in the treatment of bacterial pneumonia in children[J]. Medicine, 2020, 99(50): 23217. |
2. Gannan Health Vocational College, Ganzhou 341000, China;
3. Ganzhou People's Hospital, Ganzhou 341000, China
 2024, Vol. 41
2024, Vol. 41