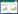文章信息
- 张婧, 马雷雷, 杨思齐, 等.
- ZHANG Jing, MA Leilei, YANG Siqi, et al.
- 肾炎防衰液对硫酸苯酯诱导小鼠肾足细胞损伤及自噬作用机制研究
- Study on the mechanism of Shenyan Fangshuai Formula on induction mouse kidney podocytes injury and autophagy by phenyl sulfate
- 天津中医药, 2024, 41(6): 766-772
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(6): 766-772
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.06.16
-
文章历史
- 收稿日期: 2024-01-11
2. 国家中医针灸临床医学研究中心,天津 300381;
3. 天津市中医药研究院附属医院,天津 300120
糖尿病肾脏疾病(DKD)是由糖尿病发展而来,临床常出现水肿、蛋白尿、肾功能异常等症状和体征,其归属于中医消渴病继发的水肿、虚劳、关格等范畴。DKD是全球慢性肾脏病和终末期肾脏病(ESRD)的主要原因,占所有ESRD患者近50%[1]。DKD发病机制较为复杂,目前普遍认为糖脂代谢紊乱、炎症、氧化应激、细胞自噬、细胞凋亡等是其主要发病机制[2-3]。近年来研究发现DKD发生发展过程中与足细胞损伤密切相关[4]。自噬对维持细胞结构稳定和功能的平衡至关重要,正常足细胞能适应环境的改变而保持自身稳定,但在高糖刺激下,足细胞足突融合消失,足细胞数量减少,出现持续蛋白尿,肾功能逐渐减退[5-6]。大量研究表明,高糖环境造成线粒体损伤,细胞自噬减弱,导致足细胞损伤,因此改善或提高足细胞自噬能力可能是防治DKD的重要切入点[7]。2019年Nature Communication[8]杂志发表的一篇文章,基于非靶向代谢组学研究发现肠道微生物代谢产物——硫酸苯酯(PS)水平随着DKD病情进展而增加,证实PS诱导足细胞损伤,还发现降低DKD患者血浆PS水平可能会进一步防止蛋白尿进展,且可以预测早期DKD,因此PS不仅是早期诊断的生物标志物,还可能是DKD治疗的潜在靶点。
西医主要以降糖药、血管紧张素Ⅱ受体拮抗剂(ARB)/血管紧张素转换酶抑制剂(ACEI)、免疫抑制剂等治疗为主,而中医药在针对DKD危险因素治疗的基础上,在降低DKD患者蛋白尿,改善肾脏损伤,推迟进入ESRD等方面临床疗效确切,因此开展中医药延缓DKD进展的深入研究,具有重要的临床价值和现实意义。本课题组基于DKD“肾络癥瘕”和虚、痰、浊、瘀夹杂的病机特点,拟定肾炎防衰液,该方由生黄芪、当归、鳖甲、三七、海藻、生牡蛎、熟大黄组成,全方具有活血化瘀、消癥散结之功。前期研究表明[9-11]肾炎防衰液可以显著降低DKD患者24 h尿蛋白定量,改善DKD患者肾功能及临床症状,可以通过抑制SphK1/S1P信号通路,下调肿瘤坏死因子(TNF-α)、核因子-κB(NF-κB)p65表达,减轻肾脏炎症反应,从而延缓DKD进展。因此,PS诱导足细胞损伤是否通过调控自噬水平,且肾炎防衰液是否可以调节自噬减轻PS对足细胞损伤这一机制尚不清楚,本研究拟观察肾炎防衰液对PS诱导小鼠肾脏足细胞损伤和自噬的影响,探讨其治疗DKD的作用机制。
1 材料 1.1 主要仪器及设备倒置相差显微镜(厦门Motic医疗诊断系统有限公司)、实时荧光定量PCR仪(瑞士Roche公司)、蛋白电泳仪(美国BIO-RAD公司)、多功能成像系统(德国Analytik Jena公司)。
1.2 主要药物与试剂肾炎防衰液组方:生黄芪30 g,当归15 g,鳖甲15 g,三七9 g,海藻30 g,生牡蛎30 g,熟大黄9 g,均购自天津中医药大学第一附属医院国药堂,符合2020年版《中华人民共和国药典》标准。缬沙坦片规格:80 mg×14片,浙江华海药业,批号H20183126。硫酸苯酯(CAS937-34-8)购自郑州杰克斯化工产品有限公司;细胞活力检测(CCK-8,货号:BS350B)、增强型化学发光试剂(ECL)化学发光底物试剂盒(货号:BL520A)、蛋白定量(BCA)测定试剂盒(货号:BL521A)购自兰杰柯科技有限公司;TRIzon总核糖核酸(RNA)提取试剂(货号:CW0580)、SuperStar Universal SYBR Master Mix(货号:CW3360)、HiFiScript cDNA Synthesis Kit(货号:CW2569)购自抗康为世纪生物科技股份有限公司;CD2AP兔抗(货号:DF2298)、SQSTM1/P62兔抗(货号:AF5384)、LC3兔抗(货号:AF5402)均购自江苏Affinity Biosciences公司,Podocin兔抗(货号:BS60405)购自南京Bioworld公司,BNIP3鼠抗(货号:68091-1-Ig)、GAPDH兔抗(货号:10494-1-AP)购自武汉Proteintech公司,HRP标记羊抗兔二抗(货号:BA1056)购自BOSTER公司。
1.3 动物选用体质量(200±20)g的SPF级SD雄性大鼠20只,购自北京华阜康生物科技股份有限公司,动物生产使用许可证号SYXK(津)2021-003,所有实验操作符合动物伦理要求,动物伦理审核批号为:YSY-DWLL-2021011。
1.4 细胞小鼠肾足细胞(MPC5)由北京中医药大学东直门医院刘伟敬教授课题组惠赠。
2 方法 2.1 含药血清制备将20只体质量(200±20)g的健康雄性SPF级SD大鼠随机分为空白对照组、缬沙坦组、肾炎防衰液低、中、高组,每组各4只。肾炎防衰液低、中、高剂量分别按成人(体质量70 kg)临床剂量0.5、1、2倍等效剂量,按照成人临床日用量(138 g/d)及体表面积折算系数(6.3)计算肾炎防衰液中剂量浓度为1.242 g/mL,低、高剂量浓度分别为0.621、2.484 g/mL,缬沙坦给药浓度为0.72 g/mL,空白对照组以等量生理盐水灌胃,所有大鼠以2 mL/d连续灌胃7 d,各组分别于末次灌胃2 h后,麻醉后腹主动脉取血,4 ℃下静置2 h,3 500 r/min,离心半径10 cm,离心10 min,吸取上清液,56 ℃水浴30 min,用0.45 μm滤器过滤除菌,分装后置于-80 ℃冰箱保存备用。
2.2 细胞培养及分组足细胞置于33 ℃、5%二氧化碳(CO2)培养箱中增殖,用含10 U/L γ-干扰素、10%胎牛血清的1640培养基培养,在37 ℃、5% CO2培养箱中,用含10 %胎牛血清的1640培养基培养分化成熟,当细胞融合达到80 %,接种于细胞培养板中,将细胞分为空白对照组(Con)、硫酸苯酯组(PS)、缬沙坦组(XST)、肾炎防衰液低、中、高组(SYFS-L、SYFS-M、SYFS-H),除Con组外其余各组以PS处理24 h后,分别加入10 %体积的空白血清、缬沙坦含药血清、肾炎防衰液低、中、高浓度含药血清,处理24 h。
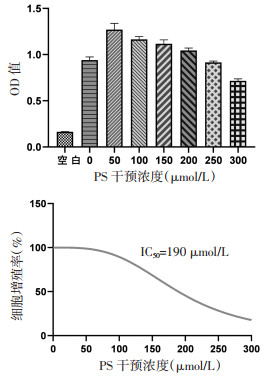
2.3 CCK-8法确定造模条件及干预条件细胞分化成熟后,按照不同浓度的PS分别设置(全培组不含细胞)、0、50、100、150、200、250、300 μmol/L共8组,每组6个副孔,分别在0、4、6、12、24、48 h观察细胞状态,干预时间结束后避光加入CCK-8染液,每孔10 μL,之后放入37 ℃细胞培养箱中根据孵育效果孵育30 min至4 h。在酶标仪中设定波长为450 nm处测定各孔光吸收值,记录结果,根据细胞增殖率计算IC50,确定PS干预的最佳条件。
2.4 实时荧光定量逆转录聚合酶链式反应(qRT-PCR)法检测足细胞损伤及自噬相关基因mRNA表达将1×105个MPC5细胞接种于24孔板,分组及处理同“2.2”项方法。收集细胞,提取细胞总RNA,测定RNA浓度及A260/A280值,A260/A280在1.9~2.0之间表明RNA纯度较高,可以进行后续实验。以1 μg总RNA按照HiFiScript cDNA Synthesis Kit试剂盒说明书反转录cDNA,使用UltraSYBR Mixture试剂盒进行qRT-PCR检测目的基因mRNA表达,引物见表 1。参照Roche LightCycler 96软件推荐条件进行扩增反应,采用2-ΔΔCT法计算目的基因与内参基因GAPDH的相对表达水平。
将2×105个MPC5细胞接种于12孔板,分组及处理同“2.2”项方法。收集细胞,提取蛋白,按照标准曲线计算加入SDS上样缓冲液及磷酸盐缓冲液(PBS),使蛋白终浓度为3 μg/μL,100 ℃煮沸5 min使蛋白变性,获得蛋白样品,置于-20 ℃冰箱保存。配置10 %聚丙烯酰胺凝胶,每组蛋白上样30 μg进行电泳,400 mA转膜0.5 h将蛋白转印至聚偏二氟乙烯膜(PVDF);5 %脱脂奶粉封闭2 h;分别加入一抗CD2AP(1∶1 000)、Podocin(1∶1 000)、BNIP3(1∶1 000)、P62(1∶1 000)、LC3(1∶1 000)、GAPDH(1∶5 000),4 ℃摇床孵育过夜,TBST漂洗5 min×5次;分别加入HRP标记的羊抗兔二抗(1∶10 000)和羊抗大鼠二抗(1∶10 000),室温摇床孵育1 h,TBST漂洗5 min×5次;ECL化学发光试剂显色并用成像分析系统拍照,使用Image J对结果进行灰度分析,蛋白相对表达量=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
2.6 统计学分析处理本实验数据使用GraphPadPrism 9.0软件进行作图,使用统计软件SPSS 22.0进行统计学分析,数据以均数±标准差(x ± s)表示,各组数据先进行正态性及方差齐性检验。符合正态分布的数据,两组数据比较采用独立样本t检验,多组数据比较采用单因素方差分析,若满足方差齐,采取LSD检验;若不满足方差齐,采取Dunnett’s T3检验。以P < 0.05表示差异具有统计学意义。
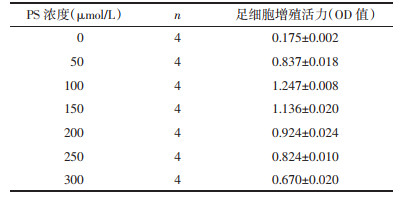
3 结果 3.1 PS诱导足细胞损伤的干预条件采用CCK-8法检测不同浓度的PS对足细胞增殖活性的影响以确定造模条件。PS浓度分别为0、50、100、150、200、250、300 μmol/L,分别在0、4、6、12、24、48 h观察细胞状态,结果提示在干预24 h时细胞状态最好,此时计算IC50为190 μmol/L,确定用浓度为190 μmol/L的PS干预足细胞24 h可以诱导足细胞损伤。见图 1,表 2。
|
| 图 1 不同浓度PS对足细胞增殖活力的影响 Fig. 1 Effect of different concentrations of PS on proliferative viability of podocytes |
|
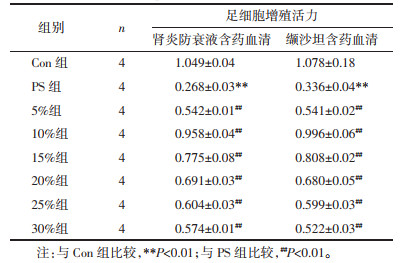
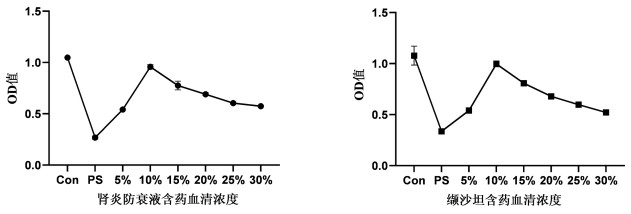
与空白对照组比较,PS处理后足细胞增殖率显著降低(P<0.01),与PS组比较,肾炎防衰液及缬沙坦含药血清在5%~30%均能促进足细胞增殖(P<0.01),但在10%含药血清干预后对足细胞增殖作用最好。见表 3、图 2。
|
|
| 图 2 不同浓度含药血清对足细胞的增殖活力的影响 Fig. 2 Effects of different concentrations of drug-containing serum on the proliferative activity of podocytes |
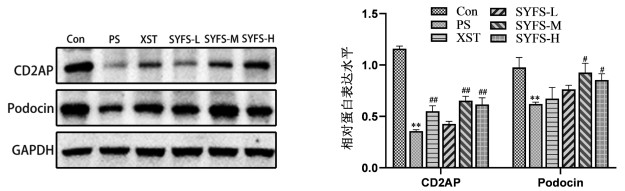
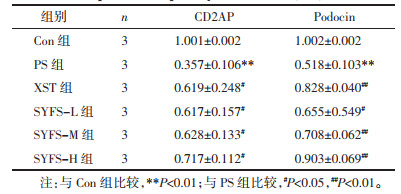
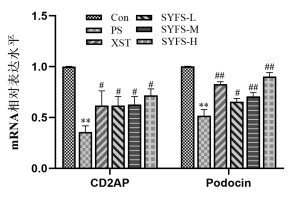
与Con组比较,PS处理后足细胞CD2AP、Podocin蛋白及mRNA表达水平显著降低(P<0.01);与PS组比较,SYFS-M、SYFS-H组及XST组显著升高CD2AP蛋白表达水平(P<0.01),SYFS-M和SYFS-H组的Podocin蛋白表达升高(P<0.05);肾炎防衰液给药组及缬沙坦组CD2AP、Podocin的mRNA表达水平升高。见图 3,表 4,图 4。
|
| 注:与Con组比较,**P<0.01;与PS组比较,#P<0.05,##P<0.01。 图 3 Western Blot检测足细胞蛋白CD2AP、Podocin的表达 Fig. 3 Western Blot detection of the podocyte proteins expression of CD2AP and Podocin |
|
|
| 图 4 qRT-PCR检测CD2AP、Podocin mRNA表达 Fig. 4 qRT-PCR detection of the mRNA expression of CD2AP and Podocin |
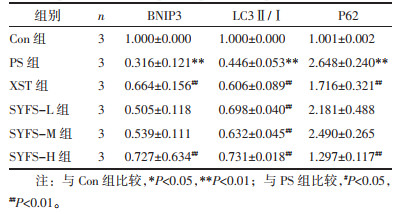
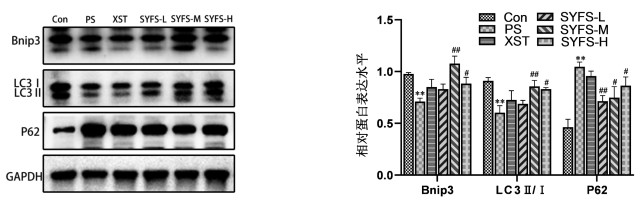
与Con组比较,PS处理足细胞后BNIP3、LC3Ⅱ/Ⅰ蛋白及mRNA表达水平显著降低(P<0.01),p62蛋白及mRNA表达水平显著升高(P<0.01);与PS组比较,SYFS-M组BNIP3、LC3Ⅱ/Ⅰ蛋白表达水平显著升高(P<0.01),SYFS-H组升高(P<0.05),且SYFS-M和SYFS-H组p62蛋白表达水平升高(P<0.05),而SYFS-L组显著升高(P<0.01);同PS组比较,SYFS-H组和XST组的BNIP3 mRNA表达水平显著升高(P<0.01),同时p62 mRNA表达水平显著降低(P<0.01),肾炎防衰液给药3组及缬沙坦组的LC3Ⅱ/Ⅰ mRNA表达水平均显著升高(P<0.01)。见图 5,表 5,图 6。
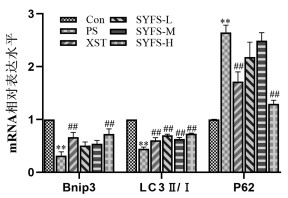
|
| 图 5 qRT-PCR检测BNIP3、LC3Ⅱ/Ⅰ、p62 mRNA表达 Fig. 5 qRT-PCR detection of the mRNA expression of BNIP3、LC3Ⅱ/Ⅰ and P62 |
|
|
| 注:与Con组比较:*P<0.05,**P<0.01;与PS组比较:#P<0.05,##P<0.01。 图 6 Western Blot检测自噬蛋白BNIP3、LC3Ⅱ/Ⅰ、p62的表达 Fig. 6 Western Blot detection of the autophagy proteins expression of BNIP3、LC3Ⅱ/Ⅰ and p62 |
DKD是典型的微血管疾病,中医认为本病基础病机为虚实夹杂,痰浊、热毒等病理产物停聚于肾络,导致气血两虚,血液运行不畅,络脉瘀滞,肾之络脉瘀结肿胀,形成微型癥瘕积聚,损伤肾脏,同时瘀血阻滞贯穿DKD始终。肾炎防衰液中黄芪、当归补气补血,充盈脉管,鳖甲、三七、海藻、生牡蛎、熟大黄以活血化瘀、消癥散结,全方具有攻补兼施,虚实标本兼治的功效。前期研究已证实肾炎防衰液可以减轻DKD大鼠肾脏组织损伤,改善肾间质纤维化,减少炎症细胞浸润[9–10]。缬沙坦能够拮抗血管紧张素受体以扩张血管,降低血压,有效保护肾功能,延缓肾脏纤维化,且缬沙坦较少经过肾脏代谢,降低药物对肾脏的毒性作用,可以有效地改善肾脏功能[12-13],因此本研究采用缬沙坦作为对照药物。
足细胞是一种不具有再生能力的、终末分化的细胞,是肾小球滤过屏障的结构成分,在高糖、高脂、氧化应激等多种病理刺激,足细胞足突融合,出现微量白蛋白尿,若病情进展,足细胞数量减少,肾功能逐渐减退[14],因此,足细胞损伤和缺失是肾脏疾病早期预测及病情进展的重要指标,探讨足细胞损伤发生机制不仅为DKD患者早期干预提供新方案,还可以为中医药治疗该病提供新靶点。Koichi等[8, 15]研究发现小鼠灌胃PS后蛋白尿显著增加,电镜显示小鼠肾脏足细胞足突消失增加,肾小球基底膜增厚,同时足细胞内线粒体功能受到明显损害,而且高浓度的PS会引起更严重的肾小球损伤,首次证实肠道菌群代谢产物PS能引起足细胞及其线粒体损伤。本研究结果显示PS干预足细胞在浓度达到100 μmol/L时出现细胞增殖抑制作用,在190 μmol/L时达到半数抑制作用,且干预时间24、36、48 h时细胞增殖曲线大体一致,但在干预24 h时细胞状态最好,并且PS干预后CD2AP、Podocin蛋白表达水平明显降低,提示足细胞损伤模型造模成功,故本研究选用190 μmol/L浓度的PS作为造模方式。
CD2AP、Podocin都属于足细胞裂孔隔膜蛋白,CD2AP可作为桥接蛋白与细胞骨架蛋白发生联系,保持足突处于正常状态,Podocin具有信号传导功能,CD2AP与Podocin相互作用形成功能复合体,维持裂孔膜蛋白结构和功能的完整性[16–19]。本研究结果提示肾炎防衰液中、高剂量组含药血清干预后可上调CD2AP及Podocin蛋白及mRNA的表达,表明肾炎防衰液可以通过上调足细胞裂孔膜蛋白CD2AP和Podocin表达来修复PS对足细胞的损伤。
自噬是通过溶酶体途径破坏细胞器以降解和再循环,从而维持细胞内稳态。该过程在正常和疾病状态中都起着重要作用。研究表明DKD大鼠存在足细胞自噬不足,同时伴足细胞缺失和大量蛋白尿,这表明自噬在维持足细胞溶酶体稳态中起关键作用[20-21]。LC3是一种重要的自噬调节因子,广泛分布于细胞核中,是细胞核和细胞质之间循环自噬的关键启动子,可作为检测自噬活性的标志物。自噬发生时LC3-Ⅰ经泛素化修饰形成LC3-Ⅱ,从而启动自噬[22-23]。P62/SQSTM1是一种重要的选择性自噬衔接蛋白,P62-LC3参与自噬-溶酶体系统性降解,P62还可以通过直接激活mTORC复合物来抑制自噬,其表达水平与自噬呈负相关[21, 24]。本研究结果显示,PS诱导足细胞后P62蛋白表达升高,LC3Ⅱ/Ⅰ比值降低,经肾炎防衰液含药血清干预后,P62蛋白表达降低,LC3Ⅱ/Ⅰ比值升高,这表明PS诱导后小鼠肾足细胞自噬-溶酶体系统受阻,而肾炎防衰液干预后能逆转足细胞自噬水平,从而保护足细胞维持内环境稳态。当细胞需要清除受损细胞器,需启动选择性自噬,线粒体自噬是其重要组成部分[7],可及时清除功能失调或受损的线粒体,防止活性氧过量产生,BNIP3途径是线粒体自噬重要的启动机制,其可以与LC3相互作用,募集自噬体到线粒体进行线粒体自噬。相关研究表明[25],BNIP3介导的线粒体自噬与DKD病程进展密切相关,通过调节BNIP3水平提高线粒体自噬,恢复异常线粒体的正常功能,可以有效逆转DKD病情进展。本研究结果显示PS组BNIP3表达降低,肾炎防衰液含药血清干预后可升高BNIP3水平,表明PS可损伤足细胞线粒体自噬功能,而肾炎防衰液干预后可促进线粒体自噬功能恢复,保护足细胞。
综上所述,肠道代谢产物硫酸苯酯可能通过抑制细胞和线粒体自噬造成肾小球足细胞损伤,而肾炎防衰液能够改善足细胞自噬水平,可能与增强LC3-p62调控的自噬-溶酶体系统及BNIP3介绍的线粒体自噬有关,从而达到保护足细胞、维持肾小球滤过屏障完整性的作用。
| [1] |
BARRERA-CHIMAL J, JAISSER F. Pathophysiologic mechanisms in diabetic kidney disease: a focus on current and future therapeutic targets[J]. Diabetes, Obesity and Metabolism, 2020, 22: 16-31. |
| [2] |
刘芳, 付平. 糖尿病肾病的发生发展机制研究进展[J]. 中华肾病研究电子杂志, 2013, 2(4): 197-200. |
| [3] |
李嘉欣, 马婷婷, 南一, 等. 糖尿病肾病发病机制研究进展[J]. 临床肾脏病杂志, 2019, 19(11): 860-864. DOI:10.3969/j.issn.1671-2390.2019.11.015 |
| [4] |
WANG T, GAO Y B, WANG X L, et al. Calpain-10 drives podocyte apoptosis and renal injury in diabetic nephropathy[J]. Diabetes, Meta-bolic Syndrome and Obesity: Targets and Therapy, 2019, 12(9): 1811-1820. |
| [5] |
HARADA K, KOTANI T, KIRISAKO H, et al. Two distinct mechanisms target the autophagy-related E3 complex to the pre-autophagosomal structure[J]. eLife, 2019, 8(2): e43088. |
| [6] |
LIANG R B, REN J Q, ZHANG Y, et al. Structural conservation of the two phosphoinositide-binding sites in WIPI proteins[J]. Journal of Molecular Biology, 2019, 431(7): 1494-1505. DOI:10.1016/j.jmb.2019.02.019 |
| [7] |
CASALENA G A, YU L P, GIL R, et al. The diabetic microenvironment causes mitochondrial oxidative stress in glomerular endothelial cells and pathological crosstalk with podocytes[J]. Cell Communication and Signaling: CCS, 2020, 18(1): 105. DOI:10.1186/s12964-020-00605-x |
| [8] |
KIKUCHI K, SAIGUSA D, KANEMITSU Y, et al. Gut microbiome-derived phenyl sulfate contributes to albuminuria in diabetic kidney disease[J]. Nature Communications, 2019, 10(1): 1835. DOI:10.1038/s41467-019-09735-4 |
| [9] |
孙鲁英, 孙卫卫, 金化男, 等. 肾炎防衰液对糖尿病肾病大鼠的防治作用及对于MCP-1表达的影响[J]. 中国中西医结合肾病杂志, 2015, 16(6): 482-485, 566. |
| [10] |
吕杰, 马雷雷, 孙卫卫, 等. 肾炎防衰液通过SPHK1/S1P信号通路对糖尿病肾病大鼠肾脏炎症的干预作用[J]. 中国中西医结合肾病杂志, 2017, 18(10): 856-859. DOI:10.3969/j.issn.1009-587X.2017.10.005 |
| [11] |
LV J, WANG Z, WANG Y, et al. Renoprotective effect of the Shen-Yan-Fang-Shuai formula by inhibiting TNF-α/NF-κB signaling pathway in diabetic rats[J]. Journal of Diabetes Research, 2017, 2017: 4319057. |
| [12] |
陈效, 袁峰, 何志红, 等. 碳酸钙联合缬沙坦对老年糖尿病肾病患者炎症和免疫功能的影响[J]. 中国老年学杂志, 2022, 42(21): 5280-5283. |
| [13] |
马家晴, 杜雪峰, 郑立明. 缬沙坦联合CXCL16对高糖诱导的小鼠足细胞损伤的机制研究[J]. 中国中西医结合肾病杂志, 2022, 23(10): 881-884, 943. DOI:10.3969/j.issn.1009-587X.2022.10.010 |
| [14] |
BONNER R, ALBAJRAMI O, HUDSPETH J, et al. Diabetic kidney disease[J]. Primary Care, 2020, 47(4): 645-659. DOI:10.1016/j.pop.2020.08.004 |
| [15] |
KOBAYASHI T, MATSUMURA Y, OZAWA T, et al. Exploration of novel predictive markers in rat plasma of the early stages of chronic renal failure[J]. Analytical and Bioanalytical Chemistry, 2014, 406(5): 1365-1376. DOI:10.1007/s00216-013-7472-2 |
| [16] |
KWON S H, OH S, NACKE M, et al. Adaptor protein CD2AP and L-type lectin LMAN2 regulate exosome cargo protein trafficking through the Golgi complex[J]. The Journal of Biological Chemistry, 2017, 292(40): 16523. DOI:10.1074/jbc.A116.729202 |
| [17] |
SHONO A, TSUKAGUCHI H, YAOITA E, et al. Podocin participates in the assembly of tight junctions between foot processes in nephrotic podocytes[J]. Journal of the American Society of Nephrology, 2007, 18(9): 2525-2533. DOI:10.1681/ASN.2006101084 |
| [18] |
SAURUS P, TOLVANEN T A, LINDFORS S, et al. Inhibition of SHIP2 in CD2AP-deficient podocytes ameliorates reactive oxygen species generation but aggravates apoptosis[J]. Scientific Reports, 2017, 7(1): 10731. DOI:10.1038/s41598-017-10512-w |
| [19] |
尹江宁, 卢国元. 二至丸提取物对糖尿病肾病大鼠足细胞损伤的保护作用研究[J]. 南京中医药大学学报, 2018, 34(4): 386-390. |
| [20] |
KARUNASAGARA S, HONG G L, PARK S R, et al. Korean red ginseng attenuates hyperglycemia-induced renal inflammation and fibrosis via accelerated autophagy and protects against diabetic kidney disease[J]. Journal of Ethnopharmacology, 2020, 254(2): 112693. |
| [21] |
WANG X X, SU W, MA M Z, et al. The KLF4-p62 axis prevents vascular endothelial cell injury via the mTOR/S6K pathway and autophagy in diabetic kidney disease[J]. Endokrynologia Polska, 2022, 73(5): 837-845. DOI:10.5603/EP.a2022.0072 |
| [22] |
HUANG R, XU Y F, WAN W, et al. Deacetylation of nuclear LC3 drives autophagy initiation under starvation[J]. Molecular Cell, 2015, 57(3): 456-466. DOI:10.1016/j.molcel.2014.12.013 |
| [23] |
YOU Z Y, XU Y F, WAN W, et al. TP53INP2 contributes to autophagosome formation by promoting LC3-ATG7 interaction[J]. Autophagy, 2019, 15(8): 1309-1321. |
| [24] |
MIZUSHIMA N, YOSHIMORI T. How to interpret LC3 immunoblotting[J]. Autophagy, 2007, 3(6): 542-545. |
| [25] |
黄景珠, 成秋宸, 李福建, 等. BNIP3介导线粒体自噬研究进展[J]. 海南医学院学报, 2024, 30(1): 60-66. |
2. National Clinical Medical Research Center of Acupuncture and Moxibustion, Tianjin 300381, China;
3. The Affiliated Hospital of Tianjin Research Institute of Traditional Chinese Medicine, Tianjin 300120, China
 2024, Vol. 41
2024, Vol. 41