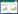文章信息
- 吴琰, 圣炜, 王立顺, 等.
- WU Yan, SHENG Wei, WANG Lishun, et al.
- 清肝活血方调控Caspase-4/Caspase-3/GSDME介导的细胞焦亡改善酒精性肝损伤
- Qinggan Huoxue Recipe regulates the cell pyroptosis mediated by Caspase-4/Caspase-3/GSDME to improve alcoholic liver injury
- 天津中医药, 2024, 41(6): 773-780
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(6): 773-780
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.06.17
-
文章历史
- 收稿日期: 2024-01-11
2. 上海市闵行区中心医院,上海 201199;
3. 上海中医药大学附属龙华医院脾胃病研究所,上海 200032
酒精性肝病(ALD)是全球最常见的肝病之一,临床上可表现为酒精性脂肪肝、酒精性肝炎(AH)、酒精性肝纤维化及酒精性肝硬化[1]。2017年的1项流行病学调查显示,全球每年大约有81万人因慢性肝病而死亡,其中大约30%与酗酒有关[2]。然而,ALD的发病机制仍不明确,目前尚未有相应的药物治疗ALD。细胞焦亡是近年来发现并被证实的一种新型程序性细胞死亡方式,伴有大量的促炎症因子释放[3],细胞内炎症小体以及Gasdermin蛋白家族成员GSDMD、GSDME在此过程中发挥了重要作用[4]。细胞焦亡引起的炎症是多种慢性肝脏疾病的共同基础,经典焦亡途径上游的NOD样受体蛋白3(NLRP3)是活化Caspase-1的关键蛋白,在肝脏疾病发生发展过程中至关重要[5-6]。最近有研究表明,线粒体膜通透性转换(MPT)可促使凋亡酶激活因子(Apaf-1)与半胱天冬酶(Caspase)-4结合形成1种新的蛋白复合体——“焦亡小体复合物”,这种复合物可以激活剪切Caspase-3,并切割GSDME以触发细胞焦亡[7-8]。而Caspase-3抑制剂可以有效阻断GSDME的激活,并改善肝细胞和巨噬细胞的凋亡和焦亡,从而减轻胆汁淤积小鼠的肝损伤[8]。这提示通过调控Caspase-4/Caspase-3/GSDME介导的细胞焦亡,减少炎症因子的释放,可能是治疗酒精性肝病的有效策略。
本课题组基于中药经方小柴胡汤,拟定的清肝活血方(QGHXR)已被证明可以有效治疗ALD[9]。全方由柴胡、黄芩、丹参、鳖甲和葛根组成,清热利湿、活血化瘀并用,切中酒精性肝病“湿热瘀血为患”的病机特点。既往研究[10]表明清肝活血方可以通过调节肝X受体α(LXRα)和溶血卵磷脂酰基转移酶3(LPCAT3)的表达水平改善内质网应激,进而在体内减轻乙醇引起的肝脂肪变性和肝损伤,在体外减轻乙醇对肝细胞的损伤。临床研究[11]发现,清肝活血方用于治疗酒精性肝硬化湿热瘀结证患者可缓解患者临床症状,并改善酒精性肝硬化患者的肝功能和预后。但是,目前尚不清楚清肝活血方能否通过调控Caspase-4/GSDME信号通路发挥抗炎作用,从而减轻乙醇诱导的肝损伤。因此,本研究拟采用Lieber-DeCarli乙醇液体饮食诱导建立ALD小鼠模型,观察清肝活血方对ALD肝损伤的疗效,并进一步探讨其对Caspase-4/Caspase-3/GSDME信号通路的调控机制,以期为临床用药提供科学依据和指导。
1 材料 1.1 实验动物C57BL/6小鼠18只,雄性,SPF级,8~9周龄,体质量(20±2)g,由上海灵畅生物科技有限公司提供,许可证号:SCXK(沪)2018-0003,饲养于吾创生物科技(上海)有限公司,温度为(24±2)℃,湿度为(55±10)%,光照/黑暗时间为12 h/12 h。实验遵循《实验动物护理和使用指南》,获复旦大学附属闵行医院动物实验伦理委员会批准,批准编号:(2022)审第(38)号。实验过程中对动物的处置符合动物伦理学标准。
1.2 主要药物试剂及耗材Lieber-DeCarli乙醇液体鼠粮、Lieber-DeCarli对照液体鼠粮(戴茨生物科技有限公司,货号分别为Lieber、Lieber-C);麦芽糖糊精(麦克林,货号M830178),4%多聚甲醛固定液(碧云天生物技术有限公司);丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、三酰甘油(TG)生化检测试剂盒,南京建成生物有限公司(批号分别为C009-2-1、C010-2-1、A111-1-1、A110-1-1);RIPA裂解液(碧云天生物技术有限公司);蛋白酶、磷酸酶抑制剂(美国Sigma公司);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司,批号:P009);Loading buffer(碧云天生物技术有限公司);雅酶PAGE凝胶快速制备试剂盒(上海雅酶生物医药科技有限公司);Glycine、Trizma base、SDS、Tris-HCl(美国Sigma公司);GSDME-N-terminal抗体、Caspase-4抗体(美国Abcam公司,货号分别为ab215191、ab25898);Caspase-3抗体、Cleaved-caspase-3抗体(美国CST公司,货号分别为#9662、#9664);兔二抗(美国Cell Signaling Technology公司,批号:7074S);荧光兔二抗(美国Invitrogen公司,货号:A11012、A11034)。
1.3 主要仪器液体鼠粮喂食器套装(戴茨生物科技有限公司,货号:902003);蛋白免疫印迹(Western Blot)快转仪(金斯瑞生物科技有限公司,型号:L00686);功能酶标仪(美国BioTek公司,型号:SynergyH4);低温高速离心机(德国Eppendorf公司,型号:5804R);切片机、脱水机、包埋机(德国Leica公司,型号分别为RM2235、RM2235、EG1150H+C);高速低温组织研磨仪(武汉塞维尔生物科技有限公司,型号:KZ-Ⅲ-FP);实时荧光定量逆转录聚合酶链反应(qRT-PCR)仪(美国ABI公司,型号:7500 StepOne PLUS);化学发光成像仪(上海天能科技有限公司,型号:Tanon5200);全自动生化分析仪(日本Toshiba株式会社,型号:TBA-40FR);激光共聚焦显微镜(德国ZEISS,型号:LSM 800)。
2 方法 2.1 动物分组、造模及干预方法将18只小鼠适应性喂养1周后按照随机数字表法随机分为空白对照组、模型组、QGHXR组,每组6只。参考文献[12]造模方法构建ALD小鼠模型,每组给予Lieber-DeCarli对照液体鼠粮5 d,然后模型组和QGHXR组预先适应乙醇浓度,从1%浓度到4%浓度分别喂养1 d后,用含5%浓度乙醇的Lieber-DeCarli乙醇液体鼠粮喂养52 d,空白对照组给予等体积的对照液体鼠粮。QGHXR由柴胡、黄芩、丹参、鳖甲、葛根组成(北京康仁堂药业有限公司,批号:23010401、22049941、21044741、21044751);按参考文献[13]制备,QGHXR组于第34~61天灌胃给药,将QGHXR浓缩并使用蒸馏水溶解至7.41 g/kg(在前期研究中,剂量已经通过实验进行了探索和验证[10, 13]),每日1次,其他组小鼠灌胃等体积的生理盐水。根据NIAAA模型,将6.6 mL 95%乙醇与13.4 mL水混合制备31.5%(vol/vol)乙醇溶液(0.25 g/mL乙醇),并将9 g麦芽糖糊精溶解在最终体积为20 mL的水中,制备45%(wt/vol)麦芽糖糊精溶液。在第62天早上7点至9点,空白对照组以9 g/kg的剂量给予45%浓度的麦芽糖糊精,而模型组和QGHXR组以5 g/kg的剂量给予31.5%浓度的乙醇(对于相同质量的小鼠,这两个剂量提供相同的热量)。9 h后,在小鼠腹腔注射1%戊巴比妥(50 mg/kg)。造模流程图见图 1。
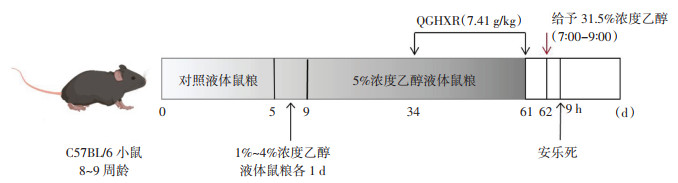
|
| 图 1 动物造模流程图 Fig. 1 Flow chart of animal modeling |
小鼠腹腔内注射1%戊巴比妥,并通过眼眶静脉丛取血以及心脏采血方法来收集血液,取血清备用;取血后立即用化学致死法(吸入一氧化碳)处死小鼠,留取肝左叶相同部位肝组织,一半组织放于4%多聚甲醛固定,一半组织保存于-80 ℃超低温冰箱备用。
2.3 血清生化指标检测采用全自动生化分析仪检测各组小鼠血清ALT、AST、总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)水平,ELISA试剂盒检测血清肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、IL-6水平。
2.4 肝组织病理常规苏木精-伊红(HE)染色,油红O染色,观察肝组织病理变化及脂质分布。
2.5 试剂盒检测肝组织TC、TG水平取适量肝组织,乙醇匀浆后取上清液,试剂盒检测肝组织TC、TG水平。
2.6 Western Blot法检测肝组织相关蛋白表达取适量肝组织在RIPA裂解液中匀浆,低温离心(12 000 r/min,4 ℃,15 min,离心半径8 cm)后收集上清液。蛋白定量(BCA)法测定蛋白浓度。用10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转聚偏二氟乙烯膜(PVDF),室温封闭30 min,与稀释的一抗[Gsdme-N、Caspase-4、Caspase-3、裂解半胱天冬酶(C-Caspase)-3]和β-actin稀释比均为1∶1 000)4 ℃孵育过夜,二抗(稀释比为1∶3 000)在室温下孵育60 min。膜表面滴加增强型化学发光试剂(ECL),置于化学发光成像系统显色。采用Image J软件分析蛋白条带灰度值,计算相关蛋白相对于内参蛋白(β-actin)的表达量。
2.7 qRT-PCR法检测肝组织相关基因表达取约20 mg肝组织置于研磨管内,加入1 mL TRIZOL提取总RNA,加入逆转录试剂进行逆转录制备cDNA。以β-actin为内参,进行荧光定量PCR扩增以检测各组肝脏组织中相关基因的表达水平。反应条件:95 ℃预变性15 min,95 ℃变性5 s,60 ℃退火30 s,40个循环。扩增引物由上海闪晶分子生物科技有限公司合成。引物序列见表 1。
石蜡切片在60 ℃烘箱中放置2 h后脱蜡,磷酸盐缓冲液(PBS)洗3遍后抗原修复,PBS洗3遍后用5% BSA封闭,室温孵育60 min,孵育后甩干,滴加一抗,4 ℃冰箱过夜;回收一抗,磷酸盐吐温缓冲液(PBST)洗3遍后滴加二抗,室温避光孵育60 min,PBST洗3遍后避光加入4’,6-二脒基-2-苯基吲哚(DAPI),染核20 min,避光PBST洗4遍后吸水纸吸去水渍,封片,激光共聚焦显微镜拍照。
2.9 统计学方法计量资料以均数±标准差(x ± s)表示,符合正态分布的数据使用单因素方差分析(ANOVA),两两比较采用t检验;不符合正态分布的数据采用非参数检验。数据使用SPSS 26.0进行分析,以P<0.05为差异有统计学意义。图表应用Graphpad Prism 8.0制作。
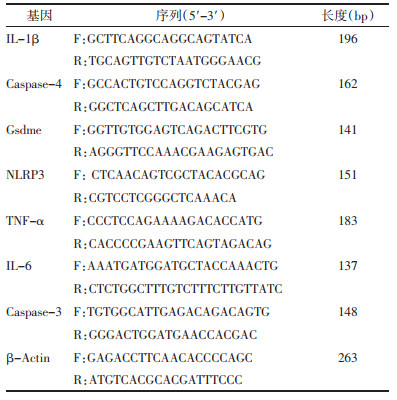
3 结果 3.1 动物一般情况空白对照组小鼠自由活动、摄食、饮水、精神状态正常;模型组小鼠造模后出现活动明显减少、拒食、萎靡等现象;QGHXR组小鼠活动能力、摄食、饮水、精神状态均较模型组有所改善。模型组小鼠肝质量和肝体比与空白对照组比较,差异均有统计学意义(P<0.05)。QGHXR组小鼠肝质量和肝体比与模型组比较,差异均有统计学意义(P < 0.05)。见表 2。
肝组织HE染色显示空白对照组小鼠肝组织细胞结构与边界清晰,组织结构正常,未见明显脂质累积。模型组出现脂肪变性伴大泡状脂滴和肝细胞坏死,肝窦可见炎性细胞浸润,而QGHXR组肝细胞脂肪变和炎症程度明显轻于模型组,肝细胞内脂滴减少,形态大致正常,肝细胞脂肪变和炎细胞浸润程度明显减轻。油红O染色显示,模型组小鼠肝脏中有大量脂滴,表明存在肝损伤;与模型组比较,QGHXR组的肝组织病理形态有明显的改善。见图 2。
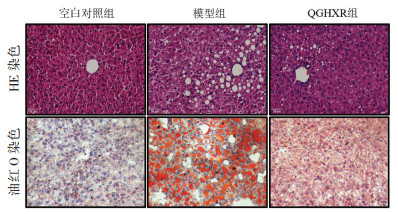
|
| 图 2 各组小鼠肝组织病理图(HE染色,×400;油红O染色,×400) Fig. 2 Liver histopathology of mice in each group(HE staining, ×400;Oil Red O staining, ×400) |
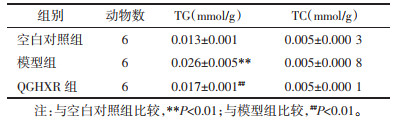
与空白对照组比较,模型组小鼠肝组织TG水平明显升高(P<0.05);与模型组比较,QGHXR组小鼠肝组织TG水平下降(P<0.05)。各组肝组织TC水平比较,差异无统计学意义(P>0.05)。见表 3。
|
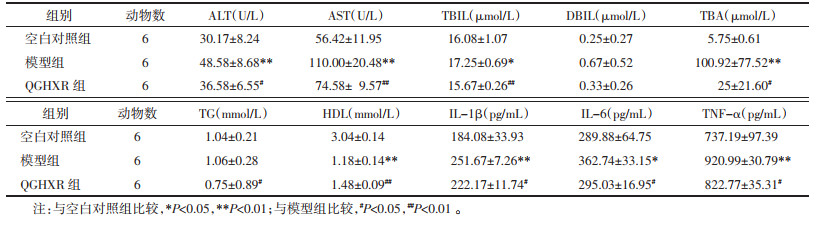
与空白对照组比较,模型组小鼠血清ALT、AST、TBIL、TBA水平升高(P<0.05);血清DBIL、TG水平升高,但差异无统计学意义(P>0.05);血清HDL水平降低(P<0.05);血清炎症指标IL-1β、IL-6、TNF-α水平升高(P<0.05)。与模型组比较,QGHXR组小鼠血清ALT、AST、TBIL、TBA水平降低(P<0.05);血清DBIL水平降低,但差异无统计学意义(P>0.05);血清TG水平明显降低(P<0.05);血清HDL水平升高(P<0.05);血清炎症指标IL-1β、IL-6、TNF-α水平降低(P<0.05)。见表 4。
|
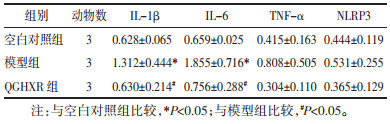
与空白对照组比较,模型组小鼠肝组织IL-1β、IL-6 mRNA表达水平升高(P<0.05);与模型组比较,QGHXR组小鼠肝组织IL-1β、IL-6 mRNA表达水平降低(P<0.05)。与空白对照组比较,模型组小鼠肝组织TNF-α、NLRP3 mRNA表达水平虽有升高,但差异无统计学意义(P>0.05);与模型组比较,QGHXR组小鼠肝组织TNF-α、NLRP3 mRNA表达水平虽有降低,但差异无统计学意义(P>0.05)。见表 5。
|
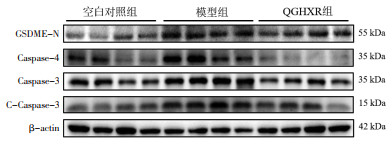
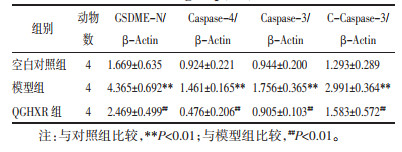
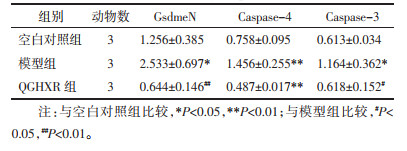
与空白对照组比较,模型组小鼠肝组织GSDME-N、Caspase-4、Caspase-3、C-Caspase-3蛋白水平升高(P<0.01);与模型组比较,QGHXR组小鼠肝组织GSDME-N、Caspase-4、Caspase-3、C-Caspase-3蛋白水平降低(P<0.01)。见图 3、表 6。
|
| 图 3 各组小鼠肝组织GSDME-N、Caspase-4、Caspase-3、C-Caspase-3蛋白表达电泳 Fig. 3 GSDME-N, Caspase-4, Caspase-3, C-Caspase-3 protein expression electrophoresis in liver tissue of mice in each group |
|
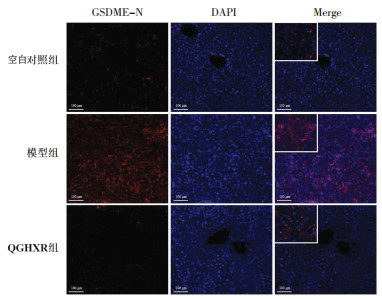
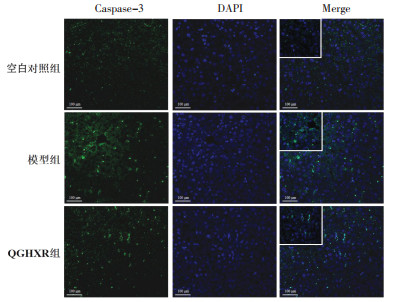
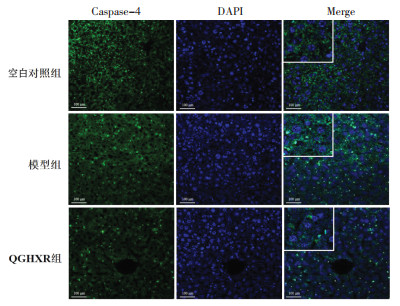
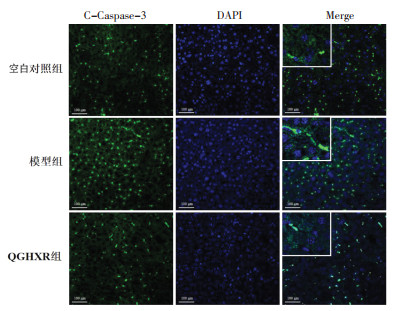
免疫荧光染色结果显示,与空白对照组比较,模型组小鼠肝脏GSDME-N、Caspase-3、Caspase-4、C-Caspase-3蛋白表达量升高;与模型组比较,QGHXR组小鼠肝组织中GSDME-N、Caspase-3、Caspase-4、C-caspase-3蛋白表达量显著减少。见图 4-图 7。
|
| 注:DAPI为细胞核染色图,Merge为目标分子染色与核染色的合成图。Merge图中左上角的小图为放大的典型区域。 图 4 各组小鼠肝组织GSDME-N蛋白表达量(免疫荧光检测,×200) Fig. 4 Protein expression of GSDME-N in liver tissue of mice in each group(immunofluorescence staining, ×200) |
|
| 图 5 各组小鼠肝组织Caspase-3蛋白表达量(免疫荧光检测,×200) Fig. 5 Protein expression of Caspase-3 in liver tissue of mice in each group(immunofluorescence staining, ×200) |
|
| 图 6 各组小鼠肝组织Caspase-4蛋白表达量(免疫荧光检测,×200) Fig. 6 Protein expression of Caspase-4 in liver tissue of mice in each group(immunofluorescence staining, ×200) |
|
| 图 7 各组小鼠肝组织C-Caspase-3蛋白表达量(免疫荧光检测,×200) Fig. 7 Protein expression of C-Caspase-3 in liver tissue of mice in each group(immunofluorescence staining, ×200) |
与对照组比较,模型组小鼠肝组织GSDME-N、Caspase-4、Caspase-3 mRNA表达水平升高(P<0.05);与模型组小鼠相比,QGHXR组小鼠肝组织GSDME-N、Caspase-4、Caspase-3 mRNA表达水平降低(P<0.05)。见表 7。
|
近年来,ALD相关的发病率和病死率逐年上升。乙醇相关肝病是世界上最常见的死亡原因之一,排名第30位,并且与饮酒量直接相关[14]。正常生理条件下,健康成人摄入乙醇后,约70%被胃吸收,而有25%左右被十二指肠吸收[15],由肠上皮细胞吸收的这部分乙醇会通过肝门静脉系统被转移到肝脏中[16]。随着乙醇摄入量的增加,身体的代谢能力发生改变,通过肝细胞、胃黏膜细胞和肠道菌群产生的乙醛增多进而导致进行性肝毒性[17]。目前,对于ALD的治疗主要以营养和保肝等对症治疗为主,因此采用多种手段加强对ALD的防治十分重要。中医药治疗ALD具有相当的优势,从中医药中寻找治疗ALD的有效方法并阐明其作用机制成为一种重要的选择。
清肝活血方全方由柴胡、黄芩、丹参、鳖甲和葛根组成,有清热利湿、活血化瘀之效。其中柴胡的主要活性成分柴胡皂苷D具有抗炎[18]和抗癌作用[19];黄芩提取物黄芩苷可抑制importinα5介导的核因子-κB(NF-κB)信号通路,保护肝脏免受乙醇诱导的损伤、炎症、氧化应激和肝细胞凋亡[20];丹参提取物丹参酸B对代谢稳态具有保护作用,可抑制NLRP3炎症小体的激活并降低肝脏炎症的严重程度[21];葛根的活性成分葛根素可通过提高E盒结合锌指蛋白2(ZEB2)的表达水平来阻止促炎因子的激活,并减少脂多糖(LPS)/D-半乳糖(D-galactose)诱导的肝损伤[22]。清肝活血方的主要黄酮化合物为黄芩苷和葛根素[23]。据报道,黄芩苷可通过抑制肝脏中LXRα的表达减轻胆结石模型小鼠的肝损伤[24]。课题组前期也发现清肝活血方可通过调节LXR-LPCAT3信号通路抑制内质网应激减轻乙醇所造成的肝损伤[10],这一改善作用可能依赖于黄芩苷。此外,黄芩苷还可通过下调细胞外调节蛋白激酶(ERK)信号通路及其下游炎症反应效应物,有效减轻对乙酰氨基酚诱导的肝损伤[25]。而葛根素可抑制肝脏中NF-κB信号通路的激活,发挥其对肝脏的保护作用[26]。这与笔者结果一致,表明清肝活血方抑制ERK、NF-κB信号通路激活可能依赖于葛根素及黄芩苷[27-28]。
细胞焦亡是近年来发现并被证实的一种新型程序性细胞死亡方式,焦亡的经典途径依赖于Caspase-1,活化的Caspase-1切割GSDMD并诱导质膜形成孔洞,使得细胞焦亡并释放大量炎性因子[3]。非经典的焦亡途径是由Caspase-4介导的,Caspase-4在Apaf-1中被激活,并继续裂解激活Caspase-3,从而切割GSDME,诱导非经典焦亡[29]。Caspase-1介导的经典途径已被证明在ALD的发病机制中起关键作用,GSDMD敲除后减少了小鼠体内IL-1β的释放并改善了ALD[30]。而Caspase-4/Caspase-3/GSDME在ALD中的进展尚不清楚,因此,本研究假设Caspase-4/Caspase-3/GSDME介导的肝细胞焦亡参与了ALD损伤的发展。
本研究通过Lieber-DeCarli乙醇液体饲料构建了ALD小鼠模型,并在造模后期给予小鼠清肝活血方治疗,通过组织病理染色观察发现,QHHXR可以降低肝脏脂质累积,改善肝脏形态变化。Western Blot和免疫荧光结果显示,ALD小鼠肝组织内GSDME-N、Caspase-3、Caspase-4和C-Caspase-3蛋白表达水平升高,QGHXR可以降低肝组织内GSDME-N、Caspase-3、Caspase-4和C-Caspase-3蛋白表达水平。肝组织和血清mRNA结果也显示,与模型组比较,QGHXR可减轻乙醇诱导的炎症反应。上述结果提示Caspase-4/Caspase-3/GSDME通路介导的细胞焦亡可能是ALD的发病机制,QGHXR可通过该机制发挥其治疗ALD的作用,为防治ALD提供了新思路,并为QGHXR的推广应用提供了理论依据。课题组未来将进一步分析QGHXR的活性成分或单体,探讨其功效和作用机制,以期通过更多的研究,开发出新的治疗ALD的方法。
| [1] |
中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 酒精性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34(5): 939-946. |
| [2] |
Global Burden of Disease Liver Cancer Collaboration, AKINYEMIJU T, ABERA S, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: results from the global burden of disease study 2015[J]. JAMA Oncology, 2017, 3(12): 1683-1691. DOI:10.1001/jamaoncol.2017.3055 |
| [3] |
SHI J J, GAO W Q, SHAO F. Pyroptosis: gasdermin-mediated programmed necrotic cell death[J]. Trends in Biochemical Sciences, 2017, 42(4): 245-254. DOI:10.1016/j.tibs.2016.10.004 |
| [4] |
XIA S Y, HOLLINGSWORTH L R 4th, WU H. Mechanism and regulation of gasdermin-mediated cell death[J]. Cold Spring Harbor Perspectives in Biology, 2020, 12(3): a036400. DOI:10.1101/cshperspect.a036400 |
| [5] |
WU X Q, DONG L, LIN X H, et al. Relevance of the NLRP3 inflammasome in the pathogenesis of chronic liver disease[J]. Frontiers in Immunology, 2017, 8(12): 1728. |
| [6] |
GUO H T, XIE M J, ZHOU C, et al. The relevance of pyroptosis in the pathogenesis of liver diseases[J]. Life Sciences, 2019, 223(4): 69-73. |
| [7] |
XU W F, CHE Y, ZHANG Q, et al. Apaf-1 pyroptosome senses mitochondrial permeability transition[J]. Cell Metabolism, 2021, 33(2): 424-436. DOI:10.1016/j.cmet.2020.11.018 |
| [8] |
XU W F, ZHANG Q, DING C J, et al. Gasdermin E-derived Caspase-3 inhibitors effectively protect mice from acute hepatic failure[J]. Acta Pharmacologica Sinica, 2021, 42(1): 68-76. DOI:10.1038/s41401-020-0434-2 |
| [9] |
季光, 王育群, 曹承楼, 等. 清肝活血方治疗酒精性肝病的临床研究[J]. 中国中西医结合杂志, 2004, 24(1): 13-16. |
| [10] |
LU Y F, SHAO M M, XIANG H J, et al. Qinggan Huoxue Recipe alleviates alcoholic liver injury by suppressing endoplasmic reticulum stress through LXR-LPCAT3[J]. Frontiers in Pharmacology, 2022, 13(3): 824185. |
| [11] |
潘洁露, 邢练军, 张济, 等. 清肝活血方治疗酒精性肝硬化湿热瘀结证的随机对照临床试验[J]. 海南医学院学报, 2022, 28(8): 579-584. |
| [12] |
BERTOLA A, MATHEWS S, KI S H, et al. Mouse model of chronic and binge ethanol feeding(the NIAAA model)[J]. Nature Protocols, 2013, 8(3): 627-637. DOI:10.1038/nprot.2013.032 |
| [13] |
WANG J M, LU Y F, ZHANG C Y, et al. Qinggan Huoxue Recipe attenuates Alcoholic Liver Disease by suppressing PI3K/AKT signaling pathway based on network pharmacology[J]. International Journal of Medical Sciences, 2023, 20(3): 346-358. DOI:10.7150/ijms.80329 |
| [14] |
ADDOLORATO G, ABENAVOLI L, DALLIO M, et al. Alcohol associated liver disease 2020:a clinical practice guideline by the Italian Association for the Study of the Liver(AISF)[J]. Digestive and Liver Disease, 2020, 52(4): 374-391. DOI:10.1016/j.dld.2019.12.008 |
| [15] |
CORTOT A, JOBIN G, DUCROT F, et al. Gastric emptying and gastrointestinal absorption of alcohol ingested with a meal[J]. Digestive Diseases and Sciences, 1986, 31(4): 343-348. DOI:10.1007/BF01311667 |
| [16] |
CEDERBAUM A I, LU Y K, WU D F. Role of oxidative stress in alcohol-induced liver injury[J]. Archives of Toxicology, 2009, 83(6): 519-548. DOI:10.1007/s00204-009-0432-0 |
| [17] |
KOURKOUMPETIS T, SOOD G. Pathogenesis of alcoholic liver disease: an update[J]. Clinics in Liver Disease, 2019, 23(1): 71-80. DOI:10.1016/j.cld.2018.09.006 |
| [18] |
MA Y, BAO Y R, WANG S, et al. Anti-inflammation effects and potential mechanism of saikosaponins by regulating nicotinate and nicotinamide metabolism and arachidonic acid metabolism[J]. Inflammation, 2016, 39(4): 1453-1461. DOI:10.1007/s10753-016-0377-4 |
| [19] |
LI C, XUE H G, FENG L J, et al. The effect of saikosaponin D on doxorubicin pharmacokinetics and its MDR reversal in MCF-7/adr cell xenografts[J]. European Review for Medical and Pharmacological Sciences, 2017, 21(19): 4437-4445. |
| [20] |
FANG L, WANG H F, CHEN Y M, et al. Baicalin confers hepatoprotective effect against alcohol-associated liver disease by upregulating microRNA-205[J]. International Immunopharmacology, 2022, 107(6): 108553. |
| [21] |
MENG L C, ZHENG J Y, QIU Y H, et al. Salvianolic acid B ameliorates non-alcoholic fatty liver disease by inhibiting hepatic lipid accumulation and NLRP3 inflammasome in ob/ob mice[J]. International Immunopharmacology, 2022, 111(8): 109099. |
| [22] |
YANG J F, WU M M, FANG H, et al. Puerarin prevents acute liver injury via inhibiting inflammatory responses and ZEB2 expression[J]. Frontiers in Pharmacology, 2021, 12(8): 727916. |
| [23] |
鲁艳柳, 王淼, 季光. HPLC测定清肝活血方中4种黄酮的含量[J]. 中国药学杂志, 2010, 45(4): 299-301. |
| [24] |
CHEN G, WU S D. Role of baicalin and liver X receptor alpha in the formation of cholesterol gallstones in mice[J]. Gastroenterology Research and Practice, 2020, 2020(4): 1343969. |
| [25] |
LIAO C C, DAY Y J, LEE H C, et al. ERK signaling pathway plays a key role in baicalin protection against acetaminophen-induced liver injury[J]. The American Journal of Chinese Medicine, 2017, 45(1): 105-121. DOI:10.1142/S0192415X17500082 |
| [26] |
张静文. 葛根素对小鼠酒精性脂肪肝保护作用的研究[D]. 十堰: 湖北医药学院, 2022.
|
| [27] |
季光, 王淼, 郑培永, 等. 清肝活血方及其拆方对库普弗细胞表达CD14、Toll样受体4及核因子-κB的影响[J]. 中西医结合学报, 2006, 4(5): 509-513. |
| [28] |
WU T, LIU T, ZHANG L, et al. Chinese medicinal formula, Qinggan Huoxue Recipe protects rats from alcoholic liver disease via the lipopolysaccharide-Kupffer cell signal conduction pathway[J]. Experimental and Therapeutic Medicine, 2014, 8(2): 363-370. DOI:10.3892/etm.2014.1740 |
| [29] |
LIANG H F, YANG X, LI H L, et al. Schisandrol B protects against cholestatic liver injury by inhibiting pyroptosis through pregnane X receptor[J]. Biochemical Pharmacology, 2022, 204(10): 115222. |
| [30] |
LUAN J Y, CHEN W, FAN J J, et al. GSDMD membrane pore is critical for IL-1β release and antagonizing IL-1β by hepatocyte-specific nanobiologics is a promising therapeutics for murine alcoholic steatohepatitis[J]. Biomaterials, 2020, 227(10): 119570. |
2. Central Hospital of Minhang District, Shanghai 201199, China;
3. Institute of Digestive Disease, Longhua Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
 2024, Vol. 41
2024, Vol. 41