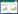文章信息
- 张起, 潘志铖, 古恩鹏, 等.
- ZHANG Qi, PAN Zhicheng, GU Enpeng, et al.
- 脊髓及神经根缺血再灌注损伤机制及中药防治作用的研究进展
- Research progress on mechanism of spinal cord and nerve root ischemia-reperfusion injury and prevention and treatment of traditional Chinese medicine
- 天津中医药, 2024, 41(6): 802-811
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(6): 802-811
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.06.21
-
文章历史
- 收稿日期: 2024-02-23
2. 天津中医药大学,天津 301617;
3. 天津中医药大学第一附属医院骨伤科,天津 300381;
4. 国家中医针灸临床医学研究中心,天津 300381
脊髓缺血再灌注损伤(SCII)通常发生于解除因脊髓型颈椎病、椎体骨折或肿瘤等各种因素压迫脊髓的脊柱减压手术后或胸腹主动脉手术钳夹和放松主动脉后[1],发病率为2%~40%[2-5]。它是指在去除引起脊髓缺血的因素或恢复脊髓血液供应后,其神经元功能不仅无法改善,反而加重损伤程度,甚至存在脊髓神经元不可逆的迟发性死亡的病理状态[6]。作为临床中非常严重的并发症之一,它往往会引起神经功能障碍、下肢瘫痪等不可预测的严重后果[5, 7]。其发生过程一般为脊髓受到压迫而缺血缺氧,减压手术解除脊髓压迫或恢复灌注,脊髓的血液灌注迅速增加。但是由于氧自由基、原发性缺血缺氧损伤和神经细胞内钙离子超载等损伤机制的推动[8-9],脊髓发生缺血再灌注损伤,严重者甚至导致患者“二次瘫痪”。
临床中,脊柱减压手术不仅可以解除脊髓的机械压迫,也是解除神经根压迫的直接方法。微创手术作为脊柱减压手术的常见术式,通常能在直视下看到神经根受压缺血表现,在短时间内解除因椎管狭窄、椎间盘突出、黄韧带肥厚、增生骨赘等对神经根的压迫后,可见神经根恢复灌注,术后大部分患者的神经损害症状迅速改善,但有约7.5%~18.1%的患者在术后出现该神经支配区域疼痛、麻木等症状再发的现象,甚至较术前症状加重[10-12]。术后影像学检查提示神经根水肿增粗,出现神经根继发性损伤。然而临床上并没有对此类现象的明确定义,大多将其归结为术后残留症状或神经根反应性水肿[13-14],并将原因归结为手术过程时对脊髓神经造成牵拉性损伤,或者髓核清理不彻底及术后血肿疤痕形成等[15]。但该症状发生率较高,且并非都是术后即刻出现,多在术后7~20日左右,因此,笔者认为手术减压解除神经根长期受压状态后,血液重新灌注的过程中也必然存在继发性损伤。从解剖结构上讲,脊神经根缺少神经束膜及神经外膜,导致其屏障保护功能较弱,对挤压、牵拉及化学刺激耐受性差[16],因此,在受到机械压迫后,缺血缺氧反应明显。而手术解除神经根压迫后,灌注恢复,可能存在类似SCII所引起的氧化应激反应、炎性反应、细胞凋亡和离子超载等理化过程,导致神经根出现继发性损伤而水肿。从发生机制上看,脊髓与神经根虽分属中枢神经与周围神经,但在受到机械压迫时,均会产生明确的缺血缺氧表现,解除压迫后,二次损伤随即出现[17-20]。从功能影响上看,脊髓与神经根经过缺血后再灌注状态,其传递、处理感觉信息和运动指令的功能下降,因而出现感觉平面或神经支配区域的感觉、运动异常甚至丧失[3]。两者发生过程相似,症状相类。基于此,笔者将这种神经根继发性损伤首次定义为神经根缺血再灌注损伤(NRII),其发生机制可能为,在神经根缺血的情况下,神经细胞会出现能量代谢障碍、炎症反应、自由基损伤和细胞内钙离子超载等变化。当血流重新恢复时,这些病理过程进一步加剧,导致神经细胞凋亡。
目前,许多治疗措施可以减轻SCII后脊髓神经功能的损害,但包括高压氧[21]、脊髓缺血预处理[9, 22]等在内的防治手段均无法从根本上阻断脊髓神经继发性损伤的发生、发展。因此良好的防治SCII策略仍是目前脊髓损伤研究的热点与难点。
传统中药被广泛用于防治缺血再灌注损伤,具有成本低、安全性高、不良反应少、患者依从性高等特性。大量现代药理学研究表明,中药及其提取物能够在氧化应激、炎症反应、细胞凋亡、离子过载等生理病理过程中发挥作用[23-26]。例如,黄芪甲苷Ⅳ能够通过抑制死亡受体途径和线粒体途径中的关键因子,如半胱天冬酶(Caspase)-3、细胞色素C和Bax/Bcl-2等的激活,来减轻缺血再灌注诱导的细胞凋亡过程[27]。而红景天苷被证实可以减少活性氧(ROS)产生、减少线粒体损伤诱导的神经元凋亡,通过抑制过度的氧化应激和细胞凋亡来保护脊髓免受缺血再灌注损伤[25]。但目前并无关于中药防治NRII的基础研究,使得临床治疗NRII缺乏理论依据。
笔者通过总结SCII、NRII的发生发展机制,梳理补气活血类中药如何有效治疗SCII、NRII及其作用机制,为探索中药对缺血再灌注损伤的保护作用提供实验依据,以期拓展脊髓及神经根缺血再灌注损伤研究的深度与广度,为其临床治疗提供新思路。
1 缺血再灌注损伤的生理病理机制缺血再灌注损伤的具体发生机制目前尚不明确,笔者结合缺血再灌注损伤的发生发展阶段对其生理病理机制进行梳理。
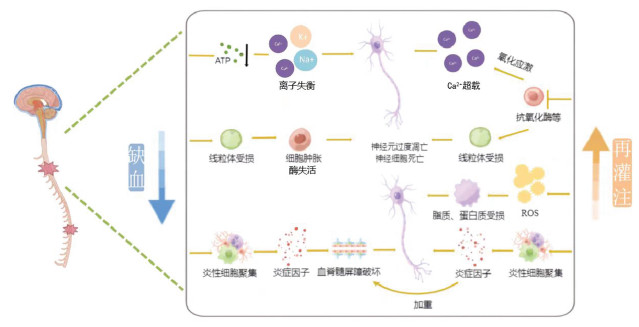
该过程主要经历以下阶段:一是缺血阶段,首先,缺血性损伤最初可引起缺氧和营养不良。缺氧和缺血使线粒体内的电子传递链功能和厌氧代谢失调[28-29],导致线粒体受损。同时,神经细胞三磷酸腺苷(ATP)生成继发性减少,使得离子交换通道功能受损[30],导致Na/K泵失效、细胞水肿和细胞质钙浓度升高,钠、钾、镁和钙离子失衡,出现细胞损伤。长时间缺血最终导致细胞内酶活性受损和细胞肿胀,最终出现神经元凋亡、坏死[31-32]。同时,缺血也会诱发局部炎症反应发生,并随着白介素-1α(IL-1α)、白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等炎症因子的释放,进一步加重损伤[33],导致血脊髓屏障破坏,神经细胞凋亡和坏死。二是再灌注状态下,活性自由基的产生增加[34],并且体内抗氧化酶类及抗氧化剂合成减少、活性减弱,在NADPH氧化酶系统、一氧化氮合酶系统和黄嘌呤氧化酶系统共同影响的氧化应激损伤会诱导线粒体嵴扩张、线粒体外膜破裂和细胞色素C释放,出现线粒体损伤和离子失衡[29, 35-36],最终导致细胞凋亡。同时,再灌注血液供应恢复后,会发生中性粒细胞介导的炎症反应,局部炎症产生进一步增加[37],随着炎症细胞因子的分泌,引发全面炎症级联反应,进一步破坏血脊髓屏障,最终导致细胞凋亡,并抑制轴突再生[23, 38]。最后,ROS滞留诱导细胞脂质和蛋白质损伤,诱导线粒体自噬、坏死和凋亡等导致细胞死亡,见图 1。虽然详细的缺血-再灌注损伤的相关机制仍有待充分阐明,但对病理生理学的理解有可能为探索新的缺血再灌注的治疗途径提供依据。
|
| 图 1 脊髓及神经根缺血再灌注损伤的主要生理病理机制 Fig. 1 Main physiological and pathological mechanism of SCII and NRII |
中医古籍并无对SCII、NRII的明确记载。《难经·二十九难》曰“督之为病,脊强而厥”,《素问·骨空论》曰“督脉为病,脊强反折”,指出“脊强”与“厥”是督脉之病的临床表现,这与脊髓和神经发生病变后的典型症状吻合。因此,现代中医认为,脊髓及神经根缺血再灌注后一系列病理改变多由督脉受损,瘀血留著,三阳经气血逆乱所致。而“血瘀”贯穿于全过程,是基本病机。脊柱减压手术治疗也必然造成督脉损伤,导致瘀血停留,且手术耗气伤血,气虚不足以行血,则血瘀更甚。另外老年患者大多素体肝肾不足,手术损伤伐正更致正气虚弱,瘀血阻滞,常为虚实夹杂,气虚血瘀之证。因此,临床上针对该病因病机,中医治疗多以补气活血为治法。
针对缺血再灌注过程中的ROS过度产生、炎症反应、神经细胞凋亡等,笔者将从中药改善过度氧化应激、抑制炎症反应、调节神经细胞过度凋亡及干预离子过载防治缺血再灌注损伤进行总结与阐述。
2.1 中药可通过影响过度氧化应激治疗脊髓、神经根缺血再灌注损伤在缺血再灌注损伤时,体内抗氧化酶类及抗氧化剂合成减少、活性减弱,同时被增加的氧自由基大量消耗,使自由基的清除不足,最终造成自由基增多[34]。同时,在受伤的大脑或脊髓中,活性自由基的产生增加又会对细胞脂质和蛋白质造成氧化应激损伤,导致微血管和脑实质的功能损害,并可能导致细胞死亡[39]。线粒体氧化应激和由此引起的功能障碍在SCII后细胞死亡过程中也起着特别关键的作用[25, 40]。这些研究表明,氧化应激反应在SCII后的神经元损伤中起着关键作用,可能是SCII的一个重要机制。因此,增加机体抗氧化能力可能是保护SCII的潜在机制。
生理情况下,自由基的产生与清除维持动态平衡。当体内自由基生成增多时,导致核因子-E2相关因子2(Nrf2)与kelch样ECH关联蛋白1(Keap1)解偶联转入细胞核,与活化的PI3K/Akt通路下游靶点Akt结合,能促进超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH)等抗氧化物质表达,增加机体抗氧化能力[41-42],减轻SCII继发性损伤。SCII后恢复SOD活性和GSH水平可以有效减轻神经元损伤[43]。而补气活血类中药可以干预神经细胞微环境,通过增加机体抗氧化能力、减少过度氧化应激等治疗缺血再灌注损伤。
人参主要的有效成分为人参皂苷,具有抗氧化、抗凋亡等广泛的药理作用。Zhuang等[44-45]的研究表明人参皂苷Rg1与虾青素(AST)是强大的抗氧化剂和抗炎剂,具有多靶点神经保护作用,可通过激活PI3K/Akt通路[41],促使Nrf2转移到细胞核,增加机体抗氧化能力从而减轻SCII带来的损伤。除此之外,人参皂苷Rb1可通过螯合金属离子(Fe2+、Cu2+、Fe3+)及激活转录Cu/Zn超氧化物歧化酶基因发挥清除自由基作用,但具体机制有待进一步研究[41]。Sun等[43]对SCII小鼠的行为学和组织病理学进行评价发现,天然类黄酮黄芪甲素明显减轻了SCII后的运动障碍和组织病理学恶化,同时,黄芪甲素可以恢复SOD活性和GSH水平并减少丙二醛浓度,减少氧化应激和下游细胞坏死,为临床缺血再灌注损伤干预提供了一种有价值的药理学策略。红景天苷(Sal)是从肉苁蓉中提取的一种活性成分,具有抗氧化、抗凋亡和神经保护等多种生物特性。Gu等[25]通过一系列实验,发现红景天苷可以通过抗氧化应激减少ROS的产生,以减少线粒体损伤,还可以通过促进线粒体自噬,消除受损的线粒体,有利于缺血再灌注损伤后脊髓神经元的保护,其中红景天苷的抗氧化起着重要作用。
2.2 中药通过抑制炎症反应缓解脊髓、神经根缺血再灌注损伤过度的炎症反应会阻碍神经细胞的修复和再生,进一步导致组织损伤、细胞死亡、轴突脱髓鞘等。SCII后血脊髓屏障破坏,外周血白细胞进入中枢神经系统,小胶质细胞和星形胶质细胞活化,生成和释放白介素(IL)-1、IL-6、TNF-α等炎症因子[46-48],从而引发炎症级联反应,黏附分子在脊髓组织中浸润、聚集,进一步加重缺血损伤区的损伤。
SCII的继发性损害因素中,炎症反应是发病机制中的最重要环节,以灰质内大量炎性细胞聚集为特征。Toll样受体(TLR)介导核因子-κB(NF-κB)信号通路和TNF-α介导NF-κB信号通路等转导系统在损伤后因受到刺激被激活[49],固有免疫细胞(小胶质细胞和星形胶质细胞)和浸润性白细胞(巨噬细胞)激活,NLRP3炎症小体被激活,进而激活和募集Caspase-1,并升高细胞间黏附分子-1(ICAM-1)、IL-1β、TNF-α、IL-1、IL-6等炎症因子水平[50],继发全面炎症级联反应,导致血脊髓屏障的破坏,细胞水肿、死亡,抑制轴突再生和脊髓损伤后的功能恢复[51-53],是形成其余多种继发损伤的基础。而中药及中药制剂可以通过抑制局部炎症反应保护SCII。
陈向华、张俐等[54-55]利用兔脊髓缺血再灌注损伤模型观察丹参酮对炎性因子的影响发现,丹参酮通过抑制TNF-α和IL-1β,促进IL-1受体拮抗剂(IL-1RA)的分泌,降低SCII中脊髓的ICAM-1的表达,减少中性粒细胞的浸润,从而减轻SCII的免疫炎症反应。姜黄素在多项研究中被证实,可通过下调Notch信号通路抑制环氧酶(COX)、炎症细胞因子(IL-6、TNF-α、IL-1β、IL-10、SOX-9、TGF-β1、TGF-β2、TLR2、TLR4及NF-κB在内的转录因子)的表达,并可明显降低NF-κBp65亚基的DNA结合活性,减轻炎症反应,从而对损伤神经组织起保护作用[56-57]。孙建忠等[58]研究显示,人参皂苷Rg1能够下调IL-1β表达、上调IL-10表达,抑制IL-6及NF-κB的活性,从而抑制SCII后的炎症反应。张晨等[59]研究表明,藏花醛可以显著诱导下调IL-1β和TNF-α的表达、上调IL-10的表达,有助于保护SCII后受损的脊髓神经。此外,在一项随机对照试验中,都芳涛等[60]发现川芎嗪可使患者脑脊液中的TNF-α与IL-1β的mRNA表达降低,改善SCII后的炎症反应。曾欢欢[61]研究发现,大黄素可以抑制NF-κB的激活,减少TNF-α,IL-1β,IL-6表达,促进SCII后运动功能的恢复。甘草酸二铵[62]也可通过抑制ICAM-1、NF-κB、TNF-α的表达及NF-κB p65活化,减轻炎症反应,缓解SCII。林庆宾[63]研究显示活血通督汤可以通过抑制炎症反应有效改善神经修复环境从而缓解SCII。张俐等[64]通过随机对照研究发现活血通督汤能有效抑制NF-κB、血管细胞黏附分子-1(VCAM-1)的表达,从而减轻炎性反应,缓解SCII。
综上,中药可能通过调节炎症因子表达抑制局部炎症、减少炎性细胞浸润缓解SCII继发损伤。
2.3 中药可通过调节神经细胞过度凋亡保护脊髓、神经根缺血再灌注损伤神经细胞过度凋亡已被证明是SCII的关键表型。SCII发生后,神经细胞大量凋亡,加剧了脊髓损伤[65-66]。神经细胞凋亡的内在途径以线粒体为中心[67],因此,线粒体功能障碍被认为是脊髓缺血期间神经元损伤的关键步骤。一方面,线粒体功能的改变将导致ATP水平降低,Ca2+平衡失调和ROS应激损伤[68],另一方面,一系列促凋亡物质,如细胞色素C,将从受损线粒体释放到细胞质中,从而激活Caspase,最终导致神经细胞死亡[68-69]。Caspase家族蛋白在神经细胞凋亡通路中也发挥着重要作用,细胞色素C释放增加会激活Caspase-9,进而激活Caspase-3和Caspase-7,形成凋亡通路的网络式反应,最终导致细胞死亡[66, 70]。此外促凋亡蛋白Bax和p53,抗凋亡蛋白Bcl-2都与SCII密切相关[71-72]。p53信号通路可以激活促凋亡蛋白(如BCL2相关X蛋白、Bax、BH3相互作用结构域死亡激动剂等)和抑制抗凋亡蛋白(Bcl-2等),并在SCII应激过程中抑制抗凋亡蛋白(如B细胞淋巴瘤-2和Bcl-2)[73-74]。此外,p53作为Caspase 3的上游激活剂可以直接触发神经元的凋亡,加重SCII程度[75]。Li等[73]通过阻断p53信号通路的激活有效地提高了SCII损伤后的神经元存活率。
Kato[76]的体内和体外实验研究表明雷帕霉素受体蛋白(mTOR)可以通过选择性激活IRE1-JNK通路调节内质网应激(ERS)诱发的细胞凋亡,从而干预SCII。SCII后激活的ERS可导致线粒体损伤,进而激活Caspase-3,诱导神经细胞的凋亡[77-78]。持续的ERS使得mTOR的激活增加,通过触发Akt通路参与凋亡信号传导,同时又会抑制Bcl-2的表达,并上调Bax的表达诱导细胞凋亡[79]。罗兰等[78]的研究发现通过抑制mTOR-内质网应激途径可以明确减少细胞凋亡,对大鼠脊髓缺血再灌注损伤起保护作用。
Yin等[27]研究表明黄芪甲苷Ⅳ通过抑制死亡受体途径和线粒体途径中关键因子Caspase-3、细胞色素C、Bax/Bcl-2等的活化来缓解缺血再灌注诱导的细胞凋亡。此外,姜黄素显著降低了炎性细胞因子表达,减轻了氧化应激和脂质过氧化,抑制了Caspase-3水平,防止细胞凋亡,改善了组织病理学变化,有助于修复SCII[23, 80]。叶劲涛等[81-82]认为人参皂苷对SCII的神经保护作用的可能是通过促进人类凋亡抑制蛋白存活素survivin蛋白(内源性Caspase抑制物)的表达,抑制凋亡蛋白ASK1(细胞凋亡信号调节激酶1)和JNK(c-jun氨基末端激酶),降低胞质线粒体凋亡诱导因子的水平,从而减少神经细胞凋亡来实现的。郭晓辉等[83]的研究表明中药复方补阳还五汤可以通过调节Beclin 1(自噬相关蛋白)、LC3和P62蛋白的表达,促使细胞自噬发生,加快消化、降解受损、衰老、失能的细胞,给细胞的再生、重建提供原料,还能抑制细胞自噬过度发生,减少细胞凋亡程序,从而达到双向调节,保护神经细胞的目的。
2.4 中药通过干预离子过载防治脊髓、神经根缺血再灌注损伤脊髓缺血再灌注损伤部位常引起局部离子环境发生变化,导致钠、钾、镁、钙等离子失衡,从而加重脊髓继发性损伤,特别是钙离子参与的脊髓损伤途径是细胞死亡的必经通道。当脊髓发生缺血、缺氧时,细胞能量传输失衡,ATP生成减少,细胞膜上离子泵(Na+-K+泵及Ca2+泵)异常开放,Ca2+内流至胞质中。胞内高浓度Ca2+可激活多种与钙相关性蛋白激酶,并通过级联放大反应,产生拮抗自由基,诱发脂质过氧化反应的发生,最终导致细胞发生自溶与死亡[84-87]。研究表明:镁离子(Mg2+)是一种人体必需的矿物质,亦可参与SCII的发生、发展[88]。其作用机制可能是Mg2+能与Ca2+竞争结合位点,有效地抑制Ca2+内流及Ca2+超载有关[89]。综上,各种离子通道的共同作用导致大量Ca2+内流以及细胞内钙库动员增加,升高细胞内Ca2+浓度。
陈剑锋[90]利用急性脊髓损伤大鼠模型,发现红花注射液可有效抑制脊髓损伤后的Ca2+/Mg2+-ATP酶活性下降,阻止局部Ca2+集聚和Mg2+浓度下降,有效改善局部Ca2+超载以及能量代谢状态,从而延缓SCII后神经细胞继发性损伤的发生。而丹红注射液预处理显著抑制了细胞质和线粒体Ca2+超载,减少了过氧化氢(H2O2)诱导的细胞损伤[91],由此可见,预防性用药可能是防治SCII的可行方法。既往的研究显示,通过给予脊髓损伤大鼠注射川芎嗪后,脊髓组织内Ca2+浓度升高,进而印证川芎嗪可拮抗Ca2+内流,阻止细胞内钙超载所引起的一系列病理反应[92-93]。刘宇[94]发现活血养血汤可减轻兔SCII模型水肿,改善Ca2+超载,还可降低Cytc、Bax、Caspase-3的表达,升高Bcl-2的表达,减少细胞凋亡,从而改善SCII。
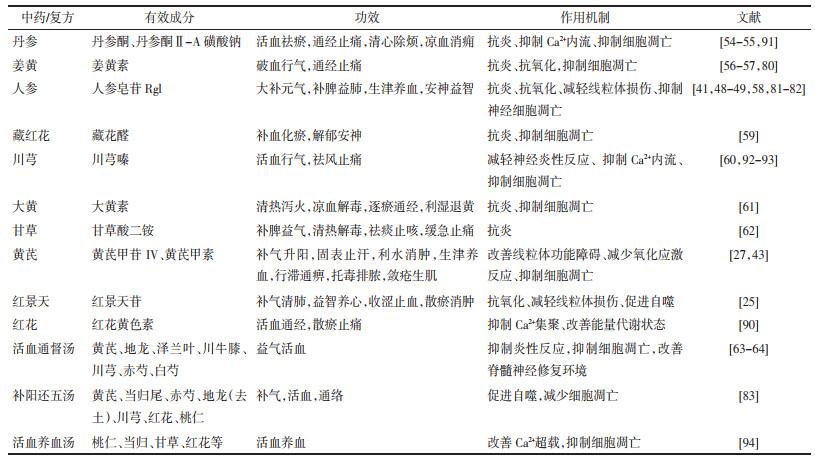
笔者系统总结了能有效防治SCII的中药单药及有效成分、复方组成,揭示了中药在过度氧化应激、抑制炎症反应、调节神经细胞过度凋亡及干预离子过载等方面防治SCII的作用机制,见表 1。但关于中药防治NRII的研究仍停留在临床观察层面,并未深入探讨其具体机制[95-109],见表 2。
近年来,中药防治心、脑缺血再灌注损伤的文献发表量呈现逐年上升趋势[110],而SCII同样作为脊柱减压和主动脉术后的严重并发症,其发生发展机制仍不明确,中药防治也是当前研究的热点,但目前仍缺少对这些研究的汇总梳理。笔者系统总结了近些年对于脊髓与神经根缺血再灌注损伤的基础和临床研究,系统梳理了中药治疗SCII的相关文献,发现补气活血类药物能有效发挥作用,这在一定程度上印证了中医治疗缺血再灌注损伤以“气虚血瘀”为病机的观点。而且,中药保护SCII并非通过单一途径发挥作用,有可能作用于多条信号通路上的关键分子,协同产生减少神经细胞凋亡的作用,具体的作用机制还需深入研究。同时,笔者类比SCII,首次定义了NRII,并提出了病理环节发展的可能机制,以期为临床治疗提供新思路和新理论。
目前的研究主要围绕中药单体防治SCII,关于中药复方干预SCII的研究较少,需要进一步选择多类型的中药复方结合动物模型深入研究体现中医辨证论治特色的治疗方法。其次,相关研究集中在基础实验领域,缺乏相关的高质量中药临床研究进行验证。再次,针对NRII的基础研究较少,但临床上该现象十分常见,目前大多将其归类为手术后残留症状或神经根继发性水肿,因此,建立适当的动物模型,参考SCII的发生发展机制进行NRII的拓展性基础研究工作仍需进一步深入。最后,补气活血类中药通过抑制氧化应激、抗炎、抗凋亡等途径发挥防治缺血再灌注损伤作用,但仍需要从药物剂量、安全性、用药时间等角度进行进一步深入研究,例如,部分应用预处理方式的研究结果表明“未病先防”的理念在缺血再灌注损伤行之有效[9, 91],中药的预防性使用能否获得更大收益仍待进一步研究。
针对脊髓或神经根缺血再灌注损伤,除了中药、复方方剂,也可结合艾灸、针刺等方法,充分发挥中西医结合治疗优势,发挥更大的疗效。
| [1] |
HU J, YU Q J, XIE L J, et al. Targeting the blood-spinal cord barrier: a therapeutic approach to spinal cord protection against ischemia-reperfusion injury[J]. Life Sciences, 2016, 158(6): 1-6. |
| [2] |
COSELLI J S, LEMAIRE S A, CONKLIN L D, et al. Morbidity and mortality after extent Ⅱ thoracoabdominal aortic aneurysm repair[J]. The Annals of Thoracic Surgery, 2002, 73(4): 1107-1116. DOI:10.1016/S0003-4975(02)03370-2 |
| [3] |
KARADIMAS S K, LALIBERTE A M, TETREAULT L, et al. Riluzole blocks perioperative ischemia-reperfusion injury and enhances postdecompression outcomes in cervical spondylotic myelopathy[J]. Science Translational Medicine, 2015, 7(316): 316ra194. |
| [4] |
HALVORSEN C M, LIED B, HARR M E, et al. Surgical mortality and complications leading to reoperation in 318 consecutive posterior decompressions for cervical spondylotic myelopathy[J]. Acta Neurologica Scandinavica, 2011, 123(5): 358-365. DOI:10.1111/j.1600-0404.2010.01405.x |
| [5] |
GREENBERG R K, LU Q S, ROSELLI E E, et al. Contemporary analysis of descending thoracic and thoracoabdominal aneurysm repair: a comparison of endovascular and open techniques[J]. Circulation, 2008, 118(8): 808-817. DOI:10.1161/CIRCULATIONAHA.108.769695 |
| [6] |
YU Q J, HUANG J X, HU J, et al. Advance in spinal cord ischemia reperfusion injury: blood-spinal cord barrier and remote ischemic preconditioning[J]. Life Sciences, 2016, 154(6): 34-38. |
| [7] |
LI X Q, LV H W, TAN W F, et al. Role of the TLR4 pathway in blood-spinal cord barrier dysfunction during the bimodal stage after ischemia/reperfusion injury in rats[J]. Journal of Neuroinflammation, 2014, 11(3): 62. |
| [8] |
GÖKCE E C, KAHVECI R, GÖKCE A, et al. Neuroprotective effects of thymoquinone against spinal cord ischemia-reperfusion injury by attenuation of inflammation, oxidative stress, and apoptosis[J]. Journal of Neurosurgery Spine, 2016, 24(6): 949-959. DOI:10.3171/2015.10.SPINE15612 |
| [9] |
GU C J, KONG F Q, ZENG J K, et al. Remote ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in mice by activating NMDAR/AMPK/PGC-1α/SIRT3 signaling[J]. Cell & Bioscience, 2023, 13(1): 57. |
| [10] |
SHIN E H, CHO K J, KIM Y T, et al. Risk factors for recurrent lumbar disc herniation after discectomy[J]. International Orthopaedics, 2019, 43(4): 963-967. DOI:10.1007/s00264-018-4201-7 |
| [11] |
LI Z H, YANG H, LIU M Z, et al. Clinical characteristics and risk factors of recurrent lumbar disk herniation: a retrospective analysis of three hundred twenty-one cases[J]. Spine, 2018, 43(21): 1463-1469. DOI:10.1097/BRS.0000000000002655 |
| [12] |
钱宇章, 王楠, 董煜祺, 等. 经皮椎间孔镜治疗腰椎间盘突出症术后复发相关因素的Meta分析[J]. 中国组织工程研究, 2020, 24(36): 5886-5896. DOI:10.3969/j.issn.2095-4344.2915 |
| [13] |
丁秀芳, 孙丽双, 王英华, 等. 电针治疗腰椎间盘突出症椎间孔镜术后残留症状[J]. 中国矫形外科杂志, 2020, 28(23): 2158-2161. |
| [14] |
丁浩, 金新蒙, 杭栋华, 等. 腰椎管狭窄症经关节突减压术后新发腰腿痛的原因[J]. 中国矫形外科杂志, 2021, 29(14): 1327-1329. |
| [15] |
王想福, 陈伟国, 石瑞芳, 等. 经皮脊柱内镜技术治疗腰椎管狭窄症的研究进展[J]. 中国骨与关节杂志, 2018, 7(2): 138-141. DOI:10.3969/j.issn.2095-252X.2018.02.011 |
| [16] |
BERTHELOT J M, LAREDO J D, DARRIEUTORT-LAFFITE C, et al. Stretching of roots contributes to the pathophysiology of radiculopathies[J]. Joint Bone Spine, 2018, 85(1): 41-45. DOI:10.1016/j.jbspin.2017.01.004 |
| [17] |
GUVEN M, GÖLGE U H, ASLAN E, et al. The effect of aloe vera on ischemia: reperfusion injury of sciatic nerve in rats[J]. Biomedecine & Pharmacotherapie, 2016, 79(3): 201-207. |
| [18] |
XU T, GAO P, HUANG Y F, et al. Git1-PGK1 interaction achieves self-protection against spinal cord ischemia-reperfusion injury by modulating Keap1/Nrf2 signaling[J]. Redox Biology, 2023, 62(6): 102682. |
| [19] |
SCHMELZER J D, ZOCHODNE D W, LOW P A. Ischemic and reperfusion injury of rat peripheral nerve[J]. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(5): 1639-1642. |
| [20] |
RONG Y L, FAN J, JI C Y, et al. USP11 regulates autophagy-dependent ferroptosis after spinal cord ischemia-reperfusion injury by deubiquitinating Beclin 1[J]. Cell Death and Differentiation, 2022, 29(6): 1164-1175. DOI:10.1038/s41418-021-00907-8 |
| [21] |
LI T, WANG Y R, FENG C Q, et al. Hyperbaric oxygen therapy for spinal cord injury: a protocol for systematic review and meta-analysis[J]. Medicine, 2020, 99(49): e23536. DOI:10.1097/MD.0000000000023536 |
| [22] |
MUKAI A, SUEHIRO K, KIMURA A, et al. Protective effects of remote ischemic preconditioning against spinal cord ischemia-reperfusion injury in rats[J]. The Journal of Thoracic and Cardiovascular Surgery, 2022, 163(2): e137-e156. DOI:10.1016/j.jtcvs.2020.03.094 |
| [23] |
GOKCE E C, KAHVECI R, GOKCE A, et al. Curcumin attenuates inflammation, oxidative stress, and ultrastructural damage induced by spinal cord ischemia-reperfusion injury in rats[J]. Journal of Stroke and Cerebrovascular Diseases, 2016, 25(5): 1196-1207. DOI:10.1016/j.jstrokecerebrovasdis.2016.01.008 |
| [24] |
ZHANG L, GAN W D, AN G Y. Influence of Tanshinone Ⅱa on heat shock protein 70, Bcl-2 and Bax expression in rats with spinal ischemia/reperfusion injury[J]. Neural Regeneration Research, 2012, 7(36): 2882-2888. |
| [25] |
GU C J, LI L W, HUANG Y F, et al. Salidroside ameliorates mitochondria-dependent neuronal apoptosis after spinal cord ischemia-reperfusion injury partially through inhibiting oxidative stress and promoting mitophagy[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 3549704. |
| [26] |
WU C Y, XU H, LI J F, et al. Baicalein attenuates pyroptosis and endoplasmic reticulum stress following spinal cord ischemia-reperfusion injury via autophagy enhancement[J]. Frontiers in Pharmacology, 2020, 11(7): 1076. |
| [27] |
YIN F, ZHOU H F, FANG Y C, et al. Astragaloside Ⅳ alleviates ischemia reperfusion-induced apoptosis by inhibiting the activation of key factors in death receptor pathway and mitochondrial pathway[J]. Journal of Ethnopharmacology, 2020, 248(6): 112319. |
| [28] |
SULKSHANE P, RAM J, THAKUR A, et al. Ubiquitination and receptor-mediated mitophagy converge to eliminate oxidation-damaged mitochondria during hypoxia[J]. Redox Biology, 2021, 45: 102047. DOI:10.1016/j.redox.2021.102047 |
| [29] |
DENG X, OUYANG P, XU W, et al. Research progress of nano selenium in the treatment of oxidative stress injury during hepatic ischemia-reperfusion injury[J]. Frontiers in Pharmacology, 2022, 13: 1103483. |
| [30] |
ATKINSON L, MILLIGAN C J, BUCKLEY N J, et al. An ATP-gated ion channel at the cell nucleus[J]. Nature, 2002, 420(6911): 42. |
| [31] |
WU X M, QIAN Z M, KE Y, et al. Ginkgolide B preconditioning protects neurons against ischaemia-induced apoptosis[J]. Journal of Cellular and Molecular Medicine, 2009, 13(11/12): 4474-4483. |
| [32] |
WIDGEROW A D. Ischemia-reperfusion injury: influencing the microcirculatory and cellular environment[J]. Annals of Plastic Surgery, 2014, 72(2): 253-260. |
| [33] |
DAVID S, ZARRUK J G, GHASEMLOU N. Inflammatory pathways in spinal cord injury[J]. International Review of Neurobiology, 2012, 106: 127-152. |
| [34] |
RADI E, FORMICHI P, BATTISTI C, et al. Apoptosis and oxidative stress in neurodegenerative diseases[J]. Journal of Alzheimer's Disease, 2014, 42(Suppl 3): S125-S152. |
| [35] |
HOLZEROVÁ E, PROKISCH H. Mitochondria: Much ado about nothing? How dangerous is reactive oxygen species production?[J]. The International Journal of Biochemistry & Cell Biology, 2015, 63(6): 16-20. |
| [36] |
YAO W F, HAN X, GE M, et al. N6-methyladenosine(m6A) methylation in ischemia-reperfusion injury[J]. Cell Death & Disease, 2020, 11(6): 478. |
| [37] |
JUN J H, SHIM J K, OH J E, et al. Protective effect of ethyl pyruvate against myocardial ischemia reperfusion injury through regulations of ROS-related NLRP3 inflammasome activation[J]. Oxidative Medi- cine and Cellular Longevity, 2019, 2019(1): 4264580. |
| [38] |
WANG L P, YAO Y, HE R, et al. Methane ameliorates spinal cord ischemia-reperfusion injury in rats: antioxidant, anti-inflammatory and anti-apoptotic activity mediated by Nrf2 activation[J]. Free Radical Biology & Medicine, 2017, 103(2): 69-86. |
| [39] |
HALL E D. Antioxidant therapies for acute spinal cord injury[J]. Neurotherapeutics, 2011, 8(2): 152-167. |
| [40] |
LIU B B, LIANG Y T, HUANG W H, et al. Dexmedetomidine attenuates spinal cord ischemia-reperfusion injury in rabbits by decreasing oxidation and apoptosis[J]. Current Molecular Medicine, 2023, 23(6): 569-577. |
| [41] |
高京, 刘飞祥, 张运克. 中药调控PI3K/Akt信号通路治疗脑缺血再灌注损伤的研究进展[J]. 中国实验方剂学杂志, 2024, 30(6): 253-261. |
| [42] |
RAQUEL G B, PANISELLO-ROSELLÓ A, SANCHEZ-NUNO S, et al. Nrf2 and oxidative stress in liver ischemia/reperfusion injury[J]. The FEBS Journal, 2022, 289(18): 5463-5479. |
| [43] |
SUN F, ZHANG H W, SHI J H, et al. Astragalin protects against spinal cord ischemia reperfusion injury through attenuating oxidative stress-induced necroptosis[J]. BioMed Research International, 2021, 2021(10): 7254708. |
| [44] |
ZHUANG C L, MAO X Y, LIU S, et al. Ginsenoside Rb1 improves postoperative fatigue syndrome by reducing skeletal muscle oxidative stress through activation of the PI3K/Akt/Nrf2 pathway in aged rats[J]. European Journal of Pharmacology, 2014, 740(6): 480-487. |
| [45] |
FU J, SUN H B, WEI H F, et al. Astaxanthin alleviates spinal cord ischemia-reperfusion injury via activation of PI3K/Akt/GSK-3β pathway in rats[J]. Journal of Orthopaedic Surgery and Research, 2020, 15(1): 275. |
| [46] |
POPOVICH P G, WEI P, STOKES B T. Cellular inflammatory response after spinal cord injury in sprague-dawley and lewis rats[J]. Journal of Comparative Neurology, 1997, 377(3): 443-464. |
| [47] |
JIN W, WANG J, ZHU T S, et al. Anti-inflammatory effects of curcumin in experimental spinal cord injury in rats[J]. Inflammation Research: official Journal of the European Histamine Research Society, 2014, 63(5): 381-387. |
| [48] |
BRAMBILLA R, HURTADO A, PERSAUD T, et al. Transgenic inhibition of astroglial NF-kappa B leads to increased axonal sparing and sprouting following spinal cord injury[J]. Journal of Neurochemistry, 2009, 110(2): 765-778. |
| [49] |
李雪焕, 陈向华. 脊髓缺血再灌注损伤相关信号通路研究进展[J]. 实用中医药杂志, 2015, 31(10): 982-984. |
| [50] |
CHEN S B, XIONG J Q, ZHAN Y P, et al. Wogonin inhibits LPS-induced inflammatory responses in rat dorsal root ganglion neurons via inhibiting TLR4-MyD88-TAK1-mediated NF-κB and MAPK signaling pathway[J]. Cellular and Molecular Neurobiology, 2015, 35(4): 523-531. |
| [51] |
BRACCHI-RICARD V, LAMBERTSEN K L, RICARD J, et al. Inhibition of astroglial NF-κB enhances oligodendrogenesis following spinal cord injury[J]. Journal of Neuroinflammation, 2013, 10(7): 92. |
| [52] |
MI J Y, YANG Y, YAO H, et al. Inhibition of heat shock protein family A member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte NF-κB/NLRP3 inflammasome pathway: HSPA8 inhibition protects spinal ischemia-reperfusion injury[J]. Journal of Neuroinflammation, 2021, 18(1): 170. |
| [53] |
高煜, 韩佳慧, 葛新. 脊髓缺血再灌注损伤后的免疫炎性微环境[J]. 中国组织工程研究, 2023, 27(8): 1300-1305. |
| [54] |
陈向华, 王和鸣, 张俐, 等. 丹参酮对脊髓缺血再灌注损伤细胞因子TNF-α、IL-1β、IL-1Ra的影响[J]. 中国中医骨伤科杂志, 2012, 20(4): 1-3. |
| [55] |
张俐, 林庆宾. 丹参及丹参酮ⅡA磺酸钠对脊髓缺血再灌注损伤IL-1β、ICAM-1及MPO表达的影响[J]. 中华中医药杂志, 2012, 27(8): 2042-2047. |
| [56] |
高枫, 赵琳, 杨彦玲. 姜黄素通过Notch信号通路对H2O2诱导的脊髓星形胶质细胞损伤的影响研究[J]. 中国免疫学杂志, 2019, 35(2): 165-170. |
| [57] |
TU X K, YANG W Z, CHEN J P, et al. Curcumin inhibits TLR2/4-NF-κB signaling pathway and attenuates brain damage in permanent focal cerebral ischemia in rats[J]. Inflammation, 2014, 37(5): 1544-1551. |
| [58] |
孙建忠, 马台, 丁任, 等. 人参皂苷Rg1对脊髓损伤SD大鼠血清MDA、SOD、IL-1β及IL-10水平的影响[J]. 现代中西医结合杂志, 2019, 28(1): 27-29, 33. |
| [59] |
张晨, 吕雷锋, 李苗, 等. 藏红花通过抗凋亡、抗炎和抗水肿机制发挥对大鼠脊髓损伤模型的神经保护作用[J]. 西安交通大学学报(医学版), 2017, 38(2): 280-289. |
| [60] |
都芳涛, 方继峰, 李兴晶, 等. 川芎嗪通过抗氧化及抗炎作用改善脊髓损伤[J]. 中医药学报, 2018, 46(6): 95-98. |
| [61] |
曾欢欢, 黄英如, 李子健, 等. 大黄素对大鼠急性脊髓损伤后氧化应激和炎症反应的影响研究[J]. 中国中药杂志, 2018, 43(9): 1886-1893. |
| [62] |
LIU B R, YIN G, DING L, et al. Research on the influence of diammonium glycyrrhizinate on the expression of NF-kappaB and neuron apoptosis after spinal cord ischemia-reperfusion injury in rats[J]. Chinese Journal of Reparative and Reconstructive Surgery, 2008, 22(12): 1466-1469. |
| [63] |
林庆宾. 活血通督汤促进兔脊髓缺血再灌注损伤修复的作用及机制[D]. 福州: 福建中医药大学, 2016.
|
| [64] |
张俐, 张纪浩, 陈凯, 等. 活血通督汤对脊髓缺血再灌注损伤NF-κB、VCAM-1表达的作用[J]. 中华中医药杂志, 2015, 30(4): 1020-1023. |
| [65] |
DONNELLY C R, GABRESKI N A, SUH E B, et al. Non-canonical Ret signaling augments p75-mediated cell death in developing sympathetic neurons[J]. The Journal of Cell Biology, 2018, 217(9): 3237-3253. |
| [66] |
YANG Y B, PANDURANGAN M, HWANG I. Targeted suppression of μ-calpain and caspase 9 expression and its effect on caspase 3 and caspase 7 in satellite cells of Korean Hanwoo cattle[J]. Cell Biology International, 2012, 36(9): 843-849. |
| [67] |
FRICKER M, TOLKOVSKY A M, BORUTAITE V, et al. Neuronal cell death[J]. Physiological Reviews, 2018, 98(2): 813-880. |
| [68] |
JANGHOLI E, SHARIFI Z N, HOSEINIAN M, et al. Verapamil inhibits mitochondria-induced reactive oxygen species and dependent apoptosis pathways in cerebral transient global ischemia/reperfusion[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020(10): 5872645. |
| [69] |
STETLER R A, LEAK R K, GAO Y Q, et al. The dynamics of the mitochondrial organelle as a potential therapeutic target[J]. Journal of Cerebral Blood Flow & Metabolism, 2013, 33(1): 22-32. |
| [70] |
ZHAO Q P, CHENG X L, WANG X B, et al. Neuroprotective effect and mechanism of Mu-Xiang-You-Fang on cerebral ischemia-reperfusion injury in rats[J]. Journal of Ethnopharmacology, 2016, 192: 140-147. |
| [71] |
ZHU P, ZHAO M Y, LI X H, et al. Effect of low temperatures on BAX and BCL2 proteins in rats with spinal cord ischemia reperfusion injury[J]. Genetics and Molecular Research, 2015, 14(3): 10490-10499. |
| [72] |
LI X Q, YU Q, TAN W F, et al. MicroRNA-125b mimic inhibits ischemia reperfusion-induced neuroinflammation and aberrant p53 apoptotic signalling activation through targeting TP53INP1[J]. Brain, Behavior, and Immunity, 2018, 74: 154-165. |
| [73] |
LI J Q, CHEN G, GAO X J, et al. p53 participates in the protective effects of ischemic post-conditioning against OGD-reperfusion injury in primary cultured spinal cord neurons[J]. Neuroscience Letters, 2017, 638: 129-134. |
| [74] |
WAN C H, MA X, SHI S S, et al. Pivotal roles of p53 transcription-dependent and-independent pathways in manganese-induced mitochondrial dysfunction and neuronal apoptosis[J]. Toxicology and Applied Pharmacology, 2014, 281(3): 294-302. |
| [75] |
ZHANG J L, CUI Z M, FENG G J, et al. RBM5 and p53 expression after rat spinal cord injury: implications for neuronal apoptosis[J]. The International Journal of Biochemistry & Cell Biology, 2015(60): 43-52. |
| [76] |
KATO H, NAKAJIMA S, SAITO Y, et al. mTORC1 serves ER stress-triggered apoptosis via selective activation of the IRE1-JNK pathway[J]. Cell Death and Differentiation, 2012, 19(2): 310-320. |
| [77] |
HUANG C A, ZHANG W Q, CHU F F, et al. Patchouli alcohol improves the integrity of the blood-spinal cord barrier by inhibiting endoplasmic reticulum stress through the akt/CHOP/caspase-3 pathway following spinal cord injury[J]. Frontiers in Cell and Developmental Biology, 2021(9): 693533. |
| [78] |
罗兰, 佟家祺, 李璐, 等. 氙气后处理对大鼠脊髓缺血再灌注损伤起保护作用: 基于下调mTOR通路和抑制内质网应激介导的神经元凋亡[J]. 南方医科大学学报, 2022, 42(8): 1256-1262. |
| [79] |
HUANG C Y, DENG J S, HUANG W C, et al. Attenuation of lipopolysaccharide-induced acute lung injury by hispolon in mice, through regulating the TLR4/PI3K/akt/mTOR and Keap1/Nrf2/HO-1 pathways, and suppressing oxidative stress-mediated ER stress-induced apoptosis and autophagy[J]. Nutrients, 2020, 12(6): 1742. |
| [80] |
AK AR, N CE, ARICI A, et al. The protective effect of curcumin on a spinal cord ischemia-reperfusion injury model[J]. Annals of Vascular Surgery, 42(2017): 285-292. |
| [81] |
叶劲涛, 宋焕瑾, 李锋涛, 等. 人参皂苷Rg1对大鼠脊髓缺血再灌注损伤中survivin蛋白表达及细胞凋亡的影响[J]. 西安交通大学学报(医学版), 2019, 40(4): 646-652. |
| [82] |
WANG B G, ZHU Q S, MAN X X, et al. Ginsenoside Rd inhibits apoptosis following spinal cord ischemia/reperfusion injury[J]. Neural Regeneration Research, 2014, 9(18): 1678-1687. |
| [83] |
郭晓辉, 卜保献, 李艳侠, 等. 补阳还五汤对脊髓缺血再灌注损伤后细胞自噬相关蛋白影响的研究[J]. 新中医, 2020, 52(7): 33-36. |
| [84] |
ZHU J, YANG L K, CHEN W L, et al. Activation of SK/KCa channel attenuates spinal cord ischemia-reperfusion injury via anti-oxidative activity and inhibition of mitochondrial dysfunction in rabbits[J]. Frontiers in Pharmacology, 2019(4): 10:325. |
| [85] |
YU Q J, ZHOU Q S, HUANG H B, et al. Protective effect of etomidate on spinal cord ischemia-reperfusion injury induced by aortic occlusion in rabbits[J]. Annals of Vascular Surgery, 2010, 24(2): 225-232. |
| [86] |
PHILIPS T, ROTHSTEIN J D. Oligodendroglia: metabolic supporters of neurons[J]. The Journal of Clinical Investigation, 2017, 127(9): 3271-3280. |
| [87] |
WARNOCK A, TOOMEY L M, WRIGHT A J, et al. Damage mechanisms to oligodendrocytes and white matter in central nervous system injury: the Australian context[J]. Journal of Neurotrauma, 2020, 37(5): 739-769. |
| [88] |
MEURER M, HÖCHERL K. Renal ischemia-reperfusion injury impairs renal calcium, magnesium, and phosphate handling in mice[J]. Pflugers Archiv-European Journal of Physiology, 2019, 471(6): 901-914. |
| [89] |
XIE J L, LI J Y, MA J J, et al. Magnesium oxide/poly(l-lactide-co-ε-caprolactone) scaffolds loaded with neural morphogens promote spinal cord repair through targeting the calcium influx and neuronal differentiation of neural stem cells[J]. Advanced Healthcare Materials, 2022, 11(15): 2200386. |
| [90] |
陈剑峰. 红花对大鼠急性脊髓损伤后保护机制的实验研究[D]. 苏州: 苏州大学, 2014.
|
| [91] |
DUAN Z Z, LI Y H, LI Y Y, et al. Danhong injection protects cardiomyocytes against hypoxia/reoxygenation- and H2O2-induced injury by inhibiting mitochondrial permeability transition pore opening[J]. Journal of Ethnopharmacology, 2015, 175: 617-625. |
| [92] |
蒋昇源, 邓博文, 徐林, 等. 川芎嗪修复脊髓损伤的作用及机制[J]. 中国组织工程研究, 2022, 26(11): 1799-1804. |
| [93] |
GUO M, LIU Y, SHI D Z. Cardiovascular actions and therapeutic potential of tetramethylpyrazine(active component isolated from rhizoma Chuanxiong): roles and mechanisms[J]. BioMed Research International, 2016(2016): 2430329. |
| [94] |
刘宇. 活血养血汤对兔脊髓缺血再灌注损伤Cytc-Caspase-3介导的细胞凋亡通路的影响[D]. 福州: 福建中医药大学, 2017.
|
| [95] |
龙厚任. 地龙散治疗腰椎间盘突出症椎间孔镜术后(气滞血瘀证)残余症状的临床疗效观察[D]. 长沙: 湖南中医药大学, 2023.
|
| [96] |
古振宏. 活血壮骨汤加减治疗LDH孔镜术后残余痛(气滞血瘀证)的疗效观察[D]. 长沙: 湖南中医药大学, 2023.
|
| [97] |
吴江川. 舒筋活血汤联合经皮椎间孔镜手术治疗气滞血瘀型腰椎间盘突出症的早期临床疗效观察[D]. 昆明: 云南中医药大学, 2023.
|
| [98] |
孙彤, 崔书国, 孙鹏飞, 等. 阴阳九针联合通督活血汤治疗腰椎间盘突出症椎间孔镜术后残余腰痛的疗效分析[J]. 河北中医药学报, 2023, 38(2): 30-33, 38. |
| [99] |
蒋顺琬, 陈大宇, 麦庆春. 通督活血汤治疗腰椎手术失败综合征临床研究[J]. 中华中医药学刊, 2018, 36(7): 1640-1642. |
| [100] |
邓小磊, 侯德才. 独活寄生汤加减治疗腰椎间盘突出症患者椎间孔镜髓核摘除术后残余痛的临床研究[J]. 河北中医, 2019, 41(8): 1213-1217, 1249. |
| [101] |
杨焕莹, 王想福, 赵道洲, 等. 口服独活寄生汤治疗经皮内窥镜下腰椎间盘切除术后残余症状的Meta分析[J]. 中医正骨, 2022, 34(7): 34-39. |
| [102] |
郭义, 林俊, 梁英. 血府逐瘀汤联合热敏灸治疗腰椎间盘突出症椎间孔镜术后下肢残余症状的临床观察[J]. 世界最新医学信息文摘, 2019, 19(46): 21-22, 25. |
| [103] |
胡朝鹏, 牟成林, 刘其赞, 等. 展筋活血方联合塞来昔布治疗腰椎间盘突出症椎间孔镜术后残余疼痛症状的临床研究[J]. 河北中医药学报, 2020, 35(6): 24-26, 61. |
| [104] |
邓亚典, 杨勇, 陈曦. 补阳还五汤口服联合浮针疗法治疗腰椎间盘突出症椎间孔镜术后残余神经症状[J]. 中医正骨, 2017, 29(10): 64-65, 68. |
| [105] |
康晟乾. 补阳还五汤配合药盐包治疗腰椎间盘突出症术后残余症状的疗效观察[D]. 北京: 北京中医药大学, 2021.
|
| [106] |
鲁嘉良, 牟天龙, 何健飞, 等. 补阳还五汤改善老年腰椎管狭窄症术后症状的临床疗效研究[J]. 世界中西医结合杂志, 2019, 14(2): 246-249. |
| [107] |
池红万. 电针联合黄芪桂枝五物汤治疗腰椎间盘突出症术后残留神经功能损害患者的疗效观察[J]. 实用中西医结合临床, 2021, 21(16): 33-34, 69. |
| [108] |
蒋彧轩. 复元活血汤治疗腰椎间盘突出症椎间孔镜术后残余症状的临床疗效观察[D]. 南宁: 广西中医药大学, 2021.
|
| [109] |
罗彬, 彭志才, 徐荣华. 身痛逐瘀汤治疗颈椎间盘突出伴颈椎椎管狭窄术后脊髓神经损伤残余症状的临床疗效[J]. 现代医药卫生, 2019, 35(8): 1204-1206. |
| [110] |
祁祥, 卢健棋, 王昱涵, 等. 中药防治心肌缺血再灌注损伤的文献计量学分析[J]. 中国药房, 2022, 33(21): 2590-2596. |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Orthopedics, First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China;
4. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
 2024, Vol. 41
2024, Vol. 41