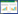文章信息
- 武文平, 张薇, 王剑, 等.
- WU Wenping, ZHANG Wei, WANG Jian, et al.
- 参芪扶正汤治疗桥本氏甲状腺炎合并甲状腺功能减退临床疗效及相关机制研究
- Effect and study on related mechanisms of Shenqi Fuzheng Decoction in treatment of hashimoto's thyroiditis combined with hypothyroidism
- 天津中医药, 2024, 41(7): 835-839
- Tianjin Journal of Traditional Chinese Medicine, 2024, 41(7): 835-839
- http://dx.doi.org/10.11656/j.issn.1672-1519.2024.07.05
-
文章历史
- 收稿日期: 2024-01-23
2. 秦皇岛市中医医院病理科, 秦皇岛 066000;
3. 秦皇岛市中医医院体检科, 秦皇岛 066000
桥本氏甲状腺炎(HT)是一种以甲状腺体积增大、实质内淋巴细胞浸润和甲状腺抗原特异性抗体升高为主要特点的甲状腺慢性炎症性疾病,也是临床常见的甲状腺自身免疫性疾病[1-2]。HT在中国的发病率高达1.6%,尤其好发于30~50岁女性,近年来随着饮食结构和工作、生活方式的改变,HT发病率呈现增加趋势[3-4]。HT常并发甲状腺功能减退、甲状腺结节,成为甲状腺癌发病的促进因素,严重威胁患者的生命和健康[5]。西医对于本病的治疗低碘饮食、补充硒元素[6]、手术治疗等,如合并甲状腺功能减退,则予以左甲状腺素片替代治疗[7]。但总体疗效并不确切,也尚未形成明确的治疗方案。近年来的研究发现中医药可有效改善HT患者临床症状,降低甲状腺抗体水平,中医药治疗HT逐渐成为研究的热点。中医学认为HT属“瘿病”范畴,脾肾阳虚是常见中医证候,本院在HT长期临床治疗中总结了中药参芪扶正汤复方,具有健脾益气、温阳固肾功效,契合脾肾亏虚之中医病机。研究表明,辅助性T淋巴细胞亚群17(Th17)和调节性T细胞(Treg)等淋巴细胞含量变化是促进HT发生和进展的重要因素[8],而长链非编码RNA人母系表达基因3(lncRNA MEG3)可作用于微小RNA-17(miR-17)受体和转录因子孤核受体,进而调节Th17/Treg平衡,其血液含量变化可导致Th17/Treg失衡,促进HT的发生[9]。本研究观察参芪扶正汤治疗HT合并甲状腺功能减退的临床疗效,并基于外周血Th17、Treg、lncRNA MEG3、miR-17含量变化初步分析其治疗机制。
1 资料与方法 1.1 一般资料选择本院2020年1月—2023年1月收治的HT患者110例,按照随机数字表法分为观察组和对照组,每组55例,其中观察组男7例,女48例,年龄26~59岁,平均(41.77±8.23)岁;病程8个月至13年,平均(4.38±1.57)年;甲状腺肿大49例,其中Ⅰ度肿大7例,Ⅱ度肿大41例,Ⅲ度肿大1例;合并甲状腺结节28例。对照组男5例,女50例,年龄25~59岁,平均(43.06±8.44)岁;病程7个月至14年,平均(4.17±1.49)年;甲状腺肿大47例,其中Ⅰ度肿大5例,Ⅱ度肿大42例,Ⅲ度肿大0例;合并甲状腺结节26例。两组年龄、性别、病程、甲状腺肿大情况、合并甲状腺结节情况差异无统计学意义(P > 0.05),具有可比性。本研究符合《赫尔辛基宣言》中相关伦理学原则,并获得医院伦理委员会批准(批号:202005B)。
纳入标准:1)符合HT西医诊断标准[10],合并甲状腺功能减退;2)符合瘿病脾肾阳虚证中医辨证标准[11];3)年龄25~60岁;4)自愿参与本研究,并签署协议书。
排除标准:1)合并甲状腺肿瘤;2)药物、手术等其他原因所致的甲状腺功能减退;3)合并其他自身免疫性疾病;4)合并严重内科疾病及恶性肿瘤、精神系统疾病等;5)入组前2个月内曾应用甲状腺素类药物;6)妊娠或哺乳期;7)过敏体质;8)同时应用其他药物。
1.2 方法两组均予以低碘饮食,规律作息,适当休息,并口服左甲状腺素钠片(生产企业:Merck KGaA;注册证号:H20140052;规格:50 μg/片),初始服用剂量50 μg/次,每日1次,7 d后随患者病情发展调整用量。在此基础上,对照组口服亚硒酸钠片(上海天赐福生物工程有限公司生产,国药准字:H31022699),每次100 μg,每日2次;观察组口服中药参芪扶正汤,药物组成:黄芪30 g,太子参10 g,白术、熟地黄、菟丝子、淮山药、肿节风各15 g,山茱萸、鬼箭羽、蜂房、僵蚕各10 g,制附子6 g。水煎服,每日1剂,早晚分2次温服,两组疗程均为12周。
1.3 观察指标 1.3.1 中医证候积分治疗前后对两组患者进行甲状腺超声检查,测量甲状腺左叶、右叶的长度、宽度、厚度和峡部的厚度,甲状腺叶体积=长度×宽度×厚度×0.52,计算两侧甲状腺体积之和。
1.3.3 实验室检查治疗前后两组均采取清晨空腹静脉血,以3000 r/min离心15 min,离心半径为8 cm,离心后分离血清,化学发光法测定血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素(TSH)、甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb),试剂盒购自罗氏Roche公司,采血前2周避免应用含碘量较高食品,规律作息。应用流式细胞术测定外周血Th17、Treg含量,仪器应用美国BD公司生产的FACSCalibur型流式细胞仪,计算Th17/Treg值。
荧光定量PCR法测定外周血lncRNA MEG3、miR-17相对表达量,首先应用TRIzol Universal总RNA提取试剂盒提取血浆总RNA,并逆转录为cDNA,以cDNA为模板,应用美国Bio-Rad公司生产的CFX96型qRT-PCR扩增仪对lncRNA MEG3、miR-17及内参GAPDH,反应条件:95 ℃预变性30 s,随后95 ℃ 5 s,60 ℃ 30 s,40个循环,引物序列由北京博尔迈生物技术有限公司合成,lncRNA MEG3上游引物(5'~3'):CTCCAGCTGGTAGTGATGTCAC,下游引物(5'~3'):AGTGTTGGAGCGTCGGCAAT;miR-17上游引物(5'~3'):GCTCTCCAGCTCATCGCTTGT,下游引物(5'~3'):CTGTGTGTCGTGCCGAGTC;GAPDH上游引物(5'~3'):CAGTCTGGGTAGCCTGCAT,下游引物(5'~3'):GTCTGAAGGCTTAGGCCTA。以2-△△Ct法计算lncRNA MEG3、miR-17mRNA相对表达量。
1.3.4 疗效评估显效,临床症状消失或明显缓解,甲状腺功能相关指标基本恢复正常或较前改善≥30%,中医证候评分减少≥70%;有效,临床症状缓解,甲状腺功能相关指标改善幅度≥10%,< 30%,中医证候评分减少≥30%,< 70%;无效,临床症状无缓解,甲状腺功能相关指标改善幅度 < 10%,中医证候评分减少 < 30%[12]。
1.4 统计学方法应用SPSS25.0软件分析统计数据,计量资料以均数±标准差(x±s)表示,中医证候评分、甲状腺体积和峡部厚度、FT3、FT4、TSH、TGAb、TPOAb、Th17、Treg、Th17/Treg、lncRNA MEG3、miR-17相对表达量组间比较应用独立样本t检验,治疗前后组内比较应用配对t检验,计数资料以例表示,组间治疗总有效率比较应用χ2检验,P < 0.05为差异有统计学意义。
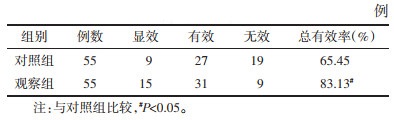
2 结果 2.1 两组中医证候评分比较治疗前两组中医证候评分差异无统计学意义(P > 0.05),治疗后两组各项中医证候评分均降低(P < 0.05),观察组均低于对照组(P < 0.05)。见表 2。
|
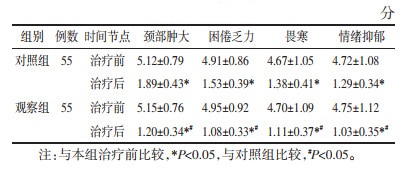
治疗后观察组甲状腺体积和峡部厚度均低于对照组(P < 0.05),见表 3。
|
治疗前两组血清FT3、FT4、TSH、TGAb、TPOAb水平差异无统计学意义(P > 0.05),治疗后两组血清FT3、FT4水平升高,TSH、TGAb、TPOAb水平降低(P < 0.05),观察组血清FT3、FT4水平高于对照组(P < 0.05),TSH、TGAb、TPOAb水平低于对照组(P < 0.05),见表 4。
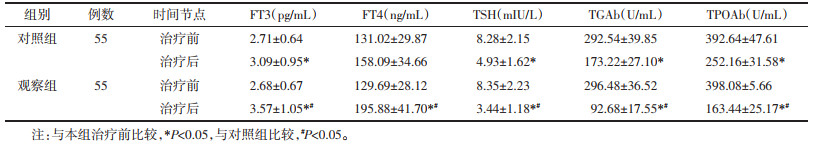
|
治疗前两组Th17、Treg、Th17/Treg、lncRNA MEG3、miR-17差异无统计学意义(P > 0.05),治疗后两组Th17、Th17/Treg、miR-17降低(P < 0.05),Treg、lncRNA MEG3升高(P < 0.05),观察组Th17、Th17/Treg、miR-17低于对照组(P < 0.05),Treg、lncRNA MEG3高于对照组(P < 0.05),见表 5。
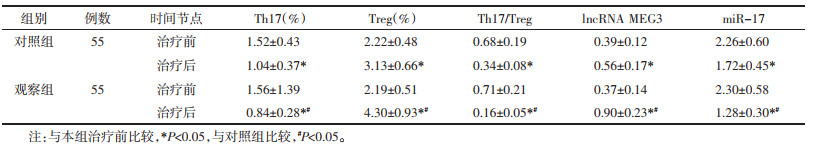
|
观察组治疗总有效率高于对照组(P < 0.05),见表 6。
甲状腺素替代疗法是HT合并甲状腺功能减退有效的治疗手段,虽然有一定的疗效,但治疗期间需根据患者的具体情况不断调整用药剂量[13],多数难以根治,不得不终身服药以维持甲状腺功能,躯体和心理健康均受到严重影响[14]。中医理论根据HT临床特点,将其纳入“瘿病”“瘿瘤”等范畴,脾肾阳虚是HT合并甲状腺功能减退常见的中医证候,患者素体亏虚,肾元不足,加之饮食失节,情志失调,损及脾脏,脾失健运,气血运行受阻,致水湿、痰浊、瘀血形成,结于颈前发为瘿病,肾为先天之本,主藏精,需脾气濡养,脾脏健运失司可影响肾脏气化和肾精充盈,致肾阳亏虚,脾阳根于肾阳,肾阳虚不能温煦脾阳,致脾肾阳虚[15]。参芪扶正汤是由太子参、黄芪、白术、熟地黄等12味中药组成,其中太子参可健脾益肾、扶助正气,既可补先天元气,亦可滋养后天之本;黄芪、白术、淮山药可健脾补气,熟地黄滋阴补肾,填髓益精,菟丝子、山茱萸可补肾固精,蜂房、僵蚕、鬼箭羽、肿节风可活血化痰通经,散结消瘿,制附子可温肾助阳,以鼓舞肾气。全方配伍可健脾补肾、生化阳气、活血祛痰、消肿散结兼顾,对脾肾阳虚型HT标本兼治。本研究发现治疗后观察组中医证候评分、血清甲状腺激素及甲状腺自身抗体含量改善情况均优于对照组,甲状腺体积和峡部厚度均低于对照组,治疗总有效率高于对照组,表明在左甲状腺素片治疗基础上应用参芪扶正汤可有效改善中医证候和甲状腺功能,调节甲状腺自身抗体,减小甲状腺体积,治疗脾肾阳虚型HT效果显著。
本研究还发现治疗后观察组外周血Th17含量、Th17/Treg、血清miR-17相对表达量低于对照组,外周血Treg含量、血清lncRNA MEG3相对表达量高于对照组。近年的研究发现长链非编码RNA表达异常与包括HT在内多种自身免疫性疾病的发生密切相关[16]。lncRNA MEG3是一种对肿瘤进展具有抑制作用的长链非编码RNA,参与甲状腺癌的发生和进展[17]。Th17、Treg是存在于人体内的两种细胞群,其含量相互制约,且保持相对平衡,调控着机体的免疫和炎症反应,lncRNA MEG3低表达可促进miR-17的高表达,导致Th17、Treg失衡,Th17生成增多,Th17及其相关因子作用于甲状腺组织,导致局部炎症因子合成增加,淋巴细胞大量聚集,引起或加重局部炎症反应,诱发HT和甲状腺功能减退[18]。王坤等[9]研究发现,HT患者血清lncRNA MEG3相对表达量降低,miR-17相对表达量升高,且与甲状腺素、自身甲状腺抗体血液含量及Th17/Treg存在相关性,经药物纠正甲状腺激素水平后,患者血清lncRNA MEG3相对表达量升高,miR-17相对表达量降低,并认为血清lncRNA MEG3、miR-17相对表达量可作为有效的观察指标,应用于指导HT的管理和治疗。
参芪扶正汤作为纯中药制剂,通过多靶点发挥作用,有效调节血清lncRNA MEG3、miR-17表达,使Th17/Treg趋于平衡,这可能是该方改善中医证候和甲状腺功能,治疗HT合并甲状腺功能减退的重要机制。
综上所述,参芪扶正汤可以改善中医证候和甲状腺功能,调节甲状腺自身抗体,减小甲状腺体积,治疗HT合并甲状腺功能减退效果显著,其机制可能与调节血清lncRNA MEG3、miR-17有关。但本研究纳入病例数较少,病例来源单一,参芪扶正汤治疗HT合并甲状腺功能减退的效果需扩大样本量、开展多中心临床观察进一步验证,其影响血清lncRNA MEG3、miR-17相对表达量的具体机制尚需深入探讨。
| [1] |
高天虹, 林燕, 赵程博文, 等. 桥本甲状腺炎临床检查指标与中医证型的相关性研究[J]. 中国临床医生杂志, 2023, 51(6): 677-681. DOI:10.3969/j.issn.2095-8552.2023.06.015 |
| [2] |
WEETMAN A P. An update on the pathogenesis of Hashimoto's thyroiditis[J]. Journal of Endocrinological Investigation, 2021, 44(5): 883-890. DOI:10.1007/s40618-020-01477-1 |
| [3] |
北京中西医结合学会甲状腺病专业委员会. 桥本氏甲状腺炎中西医结合质量控制指标体系北京专家共识(2021版)[J]. 中日友好医院学报, 2021, 35(6): 323-327. DOI:10.3969/j.issn.1001-0025.2021.06.001 |
| [4] |
LI Y Z, TENG D, BA J M, et al. Efficacy and safety of long-term universal salt iodization on thyroid disorders: epidemiological evidence from 31 provinces of China[J]. Thyroid, 2020, 30(4): 568-579. DOI:10.1089/thy.2019.0067 |
| [5] |
SILVA DE MORAIS N, STUART J, GUAN H X, et al. The impact of Hashimoto thyroiditis on thyroid nodule cytology and risk of thyroid cancer[J]. Journal of the Endocrine Society, 2019, 3(4): 791-800. DOI:10.1210/js.2018-00427 |
| [6] |
WU Q, WANG Y, CHEN P, et al. Increased incidence of Hashimoto thyroiditis in selenium deficiency: a prospective 6-year cohort study[J]. The Journal of Clinical Endocrinology and Metabolism, 2022, 107(9): e3603-e3611. DOI:10.1210/clinem/dgac410 |
| [7] |
王文礼, 刘冉. 中医药治疗桥本甲状腺炎临床研究进展[J]. 中医药临床杂志, 2023, 35(5): 1031-1035. |
| [8] |
CAO Y, JIN X, SUN Y, et al. Therapeutic effect of mesenchymal stem cell on Hashimoto's thyroiditis in a rat model by modulating Th17/Treg cell balance[J]. Autoimmunity, 2020, 53(1): 35-45. DOI:10.1080/08916934.2019.1697689 |
| [9] |
王坤, 曹成建, 沈俐萍. 桥本甲状腺炎患者外周血lncRNA MEG3和miR-17表达水平与Th17/Treg平衡的关系[J]. 热带医学杂志, 2023, 23(4): 493-497. |
| [10] |
中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写. 中国甲状腺疾病诊治指南: 甲状腺炎[J]. 中华内科杂志, 2008, 47(9): 784-788.
|
| [11] |
张伯礼, 吴勉华. 中医内科学[M]. 北京: 中国中医药出版社, 2017: 245-249.
|
| [12] |
郑筱萸. 中药新药临床研究指导原则: 试行[M]. 北京: 中国医药科技出版社, 2002: 230-233.
|
| [13] |
SOHRAB M, KASHI Z, BAHAR A. Hashimoto's thyroiditis presenting as a single toxic adenoma(A case report)[J]. Caspian Journal of Internal Medicine, 2020, 11(4): 450-453. |
| [14] |
ROSTAMI R, NOUROOZ-ZADEH S, MOHAMMADI A, et al. Serum selenium status and its interrelationship with serum biomarkers of thyroid function and antioxidant defense in Hashimoto's thyroiditis[J]. Antioxidants, 2020, 9(11): 1070. DOI:10.3390/antiox9111070 |
| [15] |
周丹妮, 洪勇良, 任海涛, 等. "三本"同调治疗桥本氏甲状腺炎[J]. 时珍国医国药, 2022, 33(8): 1956-1958. |
| [16] |
夏雯洁, 张雅婷, 涂琳琳, 等. 长链非编码RNA作为自身免疫病生物标志物的研究进展[J]. 现代免疫学, 2022, 42(1): 64-71. |
| [17] |
朱岱阳, 杜洋, 范培芝. lncRNAs在甲状腺癌中的研究进展[J]. 实用医学杂志, 2020, 36(8): 1116-1120. DOI:10.3969/j.issn.1006-5725.2020.08.026 |
| [18] |
WANG W, ZHANG B T, JIANG Q L, et al. Leptin receptor antagonist attenuates experimental autoimmune thyroiditis in mice by regulating Treg/Th17 cell differentiation[J]. Frontiers in Endocrinology, 2022, 13: 1042511. DOI:10.3389/fendo.2022.1042511 |
2. Department of Pathology, Qinhuangdao Traditional Chinese Medicine Hospital, Qinhuangdao 066000, China;
3. Department of Physical Examination, Qinhuangdao Traditional Chinese Medicine Hospital, Qinhuangdao 066000, China
 2024, Vol. 41
2024, Vol. 41